Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Высокая пропускная способность кристаллизации мембранных белков, используя метод липидный Bicelle
В этой статье
Резюме
Bicelles это липидные / амфифила смесей, которые поддерживают мембранных белков (депутатов) в пределах липидного бислоя, но имеют уникальное поведение фазы, что облегчает высокопроизводительного скрининга путем кристаллизации роботов. Эта методика успешно подготовила ряд с высоким разрешением структур с обеих прокариот и эукариот источников. Это видео описывает протоколы для создания липидной смеси bicelle, включая депутатов в смесь bicelle, создание кристаллизации испытаний (вручную, а также робота) и уборки кристаллов из среды.
Аннотация
Membrane proteins (MPs) play a critical role in many physiological processes such as pumping specific molecules across the otherwise impermeable membrane bilayer that surrounds all cells and organelles. Alterations in the function of MPs result in many human diseases and disorders; thus, an intricate understanding of their structures remains a critical objective for biological research. However, structure determination of MPs remains a significant challenge often stemming from their hydrophobicity.
MPs have substantial hydrophobic regions embedded within the bilayer. Detergents are frequently used to solubilize these proteins from the bilayer generating a protein-detergent micelle that can then be manipulated in a similar manner as soluble proteins. Traditionally, crystallization trials proceed using a protein-detergent mixture, but they often resist crystallization or produce crystals of poor quality. These problems arise due to the detergent′s inability to adequately mimic the bilayer resulting in poor stability and heterogeneity. In addition, the detergent shields the hydrophobic surface of the MP reducing the surface area available for crystal contacts. To circumvent these drawbacks MPs can be crystallized in lipidic media, which more closely simulates their endogenous environment, and has recently become a de novo technique for MP crystallization.
Lipidic cubic phase (LCP) is a three-dimensional lipid bilayer penetrated by an interconnected system of aqueous channels1. Although monoolein is the lipid of choice, related lipids such as monopalmitolein and monovaccenin have also been used to make LCP2. MPs are incorporated into the LCP where they diffuse in three dimensions and feed crystal nuclei. A great advantage of the LCP is that the protein remains in a more native environment, but the method has a number of technical disadvantages including high viscosity (requiring specialized apparatuses) and difficulties in crystal visualization and manipulation3,4. Because of these technical difficulties, we utilized another lipidic medium for crystallization-bicelles5,6 (Figure 1). Bicelles are lipid/amphiphile mixtures formed by blending a phosphatidylcholine lipid (DMPC) with an amphiphile (CHAPSO) or a short-chain lipid (DHPC). Within each bicelle disc, the lipid molecules generate a bilayer while the amphiphile molecules line the apolar edges providing beneficial properties of both bilayers and detergents. Importantly, below their transition temperature, protein-bicelle mixtures have a reduced viscosity and are manipulated in a similar manner as detergent-solubilized MPs, making bicelles compatible with crystallization robots.
Bicelles have been successfully used to crystallize several membrane proteins5,7-11 (Table 1). This growing collection of proteins demonstrates the versatility of bicelles for crystallizing both alpha helical and beta sheet MPs from prokaryotic and eukaryotic sources. Because of these successes and the simplicity of high-throughput implementation, bicelles should be part of every membrane protein crystallographer′s arsenal. In this video, we describe the bicelle methodology and provide a step-by-step protocol for setting up high-throughput crystallization trials of purified MPs using standard robotics.
протокол
Bicelle основан кристаллизации состоит из четырех основных этапов (рис. 2): я) подготовка bicelle формирования липидного: амфифила смеси; II) включение очищенного белка в среду bicelle; III) кристаллизации испытаний (вручную или робота) и IV) визуализации, добычи кристаллов и замораживания. Эти шаги подробно описаны ниже
1. Подготовка Bicelles
Bicelles могут формироваться в различных липидов: амфифила комбинации и в широком диапазоне концентраций. Таким образом, первоначальный состав, основанную на предыдущих успешных условиях, рекомендуется (табл. 1). Самых успешных смесь ДМФХ: CHAPSO bicelle формулировка, которая может либо быть приобретены коммерчески как предварительно смешивают готовые к использованию формулировки (см. таблицу реагентов ниже) или подготовленные в лаборатории, как описано. Для этого упражнения мы будем готовить 1 мл 35% ДМФХ: CHAPSO смеси при молярном соотношении 2,8:1.
- отвешивать 0,26 г ДМФХ (г-н 677,9 г / моль), 0,09 г CHAPSO (г-н 630,9 г / моль) и добавить деионизованной водой до конечного объема 1,0 мл.
- Bicelle процент может колебаться в пределах 10% -40% с ДМФХ: CHAPSO молярном соотношении от 2.6-3.0:1 (табл. 1).
- Обратите внимание: чем выше концентрация bicelle труднее распустить липидного приводит к более высокой вязкости раствора. Тем не менее, сосредоточены формулировка bicelle может быть выгодным, когда концентрация белка низка.
- Растворения липидной для получения гомогенного раствора требует значительных усилий, делая этот шаг, больше всего времени в методе bicelle. Цикл через следующие шаги, пока ДМФХ полностью смешанным:
- Теплая смесь до ~ 40 ° С с использованием водяной бане или инкубатора и вихрь в течение ~ 1 минуты.
- Примечание: Чем больше циклов проводится, нагревая смесь приведет к гелеобразной консогласованность что затрудняет вихря.
- Охладите смесь на лед и вихрь в течение нескольких минут. Охлаждение помогает жидкое решение облегчая вихря.
- Примечание: Чем больше циклов выполняются, смесь мутнеет при охлаждении.
- Повторите шаги, описанные выше (1.2.1 и 1.2.2), пока липидного полностью не растворится.
- Примечание: Этот процесс может занять несколько часов. Bicelle образование обозначается изменением фазового поведения ДМФХ: CHAPSO формулировке. После завершения, смесь будет прозрачный гель при температуре не выше комнатной температуры и вязкой жидкости на льду.
- Теплая смесь до ~ 40 ° С с использованием водяной бане или инкубатора и вихрь в течение ~ 1 минуты.
- Смесь bicelle готов к использованию и может храниться при температуре -20 ° С в течение длительного хранения (до 5 лет). Из-за риска гидролиза руководитель группы фосфолипидов, не рекомендуется хранить bicelles при комнатной температуре в течение длительного периода.
2. Включение белка в bicelles
Большинство МП структур, получаемых от bicelles кристаллизовались в ДМФХ: CHAPSO bicelle концентрации от 2 до 8% с помощью концентрации белка от 8 до 12 мг / мл (табл. 1). Если это возможно, начальные экраны должны использовать эти руководящие принципы и дополнительные концентрации могут быть показаны на стадии оптимизации. По сравнению с методом LCP, белковые включения с bicelles это простой процесс (рис. 3), что должно быть сделано в тот же день, как кристаллизация испытаний.
- Оттепель ДМФХ: CHAPSO bicelle смесь при комнатной температуре до фазы изменения в прозрачный гель.
- Примечание: Несколько стоп-тает не повлияет bicelle поведения.
- Поместите смесь на лед в сжиженном и кратко вихрь, чтобы восстановить однородной фазы bicelle. При помещении на льду смесь мутнеет.
- FrОМ этого момента, держите bicelle смеси и очищенного белка на льду. Это будет держать bicelle в жидкой фазе, что делает его поддаются пипетки.
- Добавить bicelle смесь очищенного моющего средства растворяются белка 1:4 (V / V) соотношение.
- Например: 100 мкл белка bicelle смесь получается путем смешивания 80 мкл белка с 20 мкл bicelle. Если концентрация белка составляет 15 мг / мл и bicelle концентрация составляет 35%, это даст bicelle-включен белковая смесь с концентрацией белка 12 мг / мл и bicelle концентрации 7%.
- Смешать, осторожно пипеткой содержимого вверх и вниз, пока раствор не становится ясным и однородной.
- Примечание: Если появятся пузырьки, быстро спина (30-60 секунд, 13000 оборотов в минуту, 4 ° С) с настольной центрифуге может помочь устранить их.
- Выдержите смесь на льду в течение по крайней мере 30 минут для содействия полной включение белка Intо bicelles. Белок-bicelle смесь готова к кристаллизации испытаний.
3. Настройка кристаллизации испытаний
Другие липидного кристаллизации таких методов, как LCP требует специального оборудования из-за высокой вязкости среды, но уникальное поведение фазы bicelles позволяет осуществлять практически в любом стандартном формате кристаллизации в том числе робототехнику (рис. 3). Кристаллизация испытания могут проводиться в любом повешение или сидя падение с использованием стандартных форматов коммерчески доступных экранов.
- Независимо от создания лотки вручную или с помощью кристаллизации робота, поддерживать белок-bicelle смеси на льду. Это позволит сохранить белка bicelle смесь холодной и убедитесь, что вязкость раствора минимален.
- Руководство Испытания Кристаллизация - Использование стандартной пипетки, белка-bicelle смесь может быть смешана с резервуаром решение таким же образом, как это обычно выполняютред для растворимых или моющим средством, растворяются белки мембраны.
- Примечание: Следует белка bicelle смеси на льду во время испытаний.
- Испытания робота Кристаллизация - У нас есть с учетом этих испытаний для Mosquito робот кристаллизации, но в принципе (по той же меры предосторожности) техника должна быть совместимой со всеми кристаллизации роботов. Следующие советы будет гарантировать, что белок-bicelle смесь остается холодной и точно пипеткой на робота:
- Предварительно охлаждать Пластина удержания белка bicelle смеси, разместив его на лед.
- Внесите белка bicelle смесь в тарелку и продолжать держать пластину на льду. Эта пластинка должна быть последним пунктом идти на роботу, прежде чем начать работать.
- Настройка лотка резервуара и кристаллизации крышки на платформе 3 и 5 соответственно, комаров робота.
- Место пластины, содержащей белок-bicelle смесь на платформе 4от комаров робота. Это гарантирует, белка-bicelle смесь в последнюю очередь подобрал роботом, и это немедленно освобожден.
- Для предотвращения нагрева и повышенной вязкостью, не следует смешивать резервуар с белком bicelle смеси.
- При выполнении нескольких экранах, немедленно вернуться bicelle-белковые пластину лед для охлаждения, как только работа будет завершена.
- Объем падения и отношения (белка: водохранилища) может быть выбрана, как для обычного испытания кристаллизации. Например, начальные испытания кристалл использования Mosquito робот может быть настроен с помощью 0,25 мкл белка: bicelle смесь плюс 0,25 мкл водохранилище.
- Инкубируйте кристалл испытаний в камере при температуре 20 ° C. Температура является хорошим отбора и оптимизации параметров, поскольку фазовое поведение bicelles зависит от температуры.
- Более высокие температуры вызывают ламеллярной фазы 12 (рис. 1), который имеет то преимущество, предварительно организациибелка в слоях. Температура ниже 20 ° C могут быть проверены, но вы не должны опускаться ниже 4 ° С, так как это может привести к липидов для осаждения в течение длительных периодов времени.
- Таким же образом, как традиционные испытания кристаллизации, bicelle испытаний должны быть проверены на регулярной основе для кристально появления и роста. Мы рекомендуем проверить лотки по 1-й и 3-й день после установки следуют еженедельные инспекции.
- Кристалл оптимизация может быть проведена с использованием методов обычно используются для моющих средств основано кристаллов, включая сетку скрининга, добавка скрининга, изменение температуры и т. д. Кроме того, bicelle процента и белка: bicelle соотношение может меняться. Кроме того, bicelles может быть, легированных специфические липиды, которые могут быть необходимы для стабильности белка или функции.
4. Визуализация, добыче хрусталя и замораживания
Так как кристалл испытания с белком bicelle смеси имеют вязкость похожи на белок-моющих средств капель, визуализации и добычи кристаллов является обычным и осуществляется как традиционный набор окон.
- Визуализация: В отличие от LCP СМИ, что часто требуется высококачественное освещение при нормальных и поляризованном свете для обнаружения кристаллов, визуализации не мешают bicelles. Цветные, а также бесцветные капли белковых кристаллов можно легко проанализировать с использованием стандартных микроскопов и никакого специального оборудования не требуется.
- Bicelles, как и другие липидные средства массовой информации, как правило, производят высокий процент ложных срабатываний. УФ микроскоп очень помогает в дифференциации белка из кристаллов соли (рис. 4).
- Добыча и замораживания: Crystal добычи и замораживания относительно проста и не требует роспуска окружающей среды bicelle. Кроме того, фаза bicelle сама предоставляет некоторые умеренные крио-защиту.
5. Представитель Результаты:
п "> Как правило, занимает 2-3 дня для кристаллов появляться и около недели или больше, пока они вырастут, чтобы их максимальный размер. Это был случай для бактериородопсина и мышь напряжение зависит от аниона канала 1 (mVDAC1) кристаллов 4,8 . Для других мембранных белков может потребоваться несколько недель для роста кристаллов, поэтому важно продолжать мониторинг кристалл испытаний далеко за пределами первой недели.Как и в других липидных СМИ, bicelles склонны к образованию форм, которые могут оказаться кристаллическими. Было также отмечено, что они приводят к более высокий процент соли и моющих средств кристаллов. УФ-микроскоп, который обнаруживает триптофан флуоресценции может значительно помочь устранить такие небелковые ложных срабатываний. Рисунок 4 показывает липидных форм, соль и белковых кристаллов, если смотреть в видимом и УФ-света, чтобы помочь отличить разные результаты, которые могут быть соблюдены.
83fig1.jpg "/>
Рисунок 1. Bicelle схемы. Bicelles состоят из двухслойной липидной формирования молекулы, такие как ДМФХ (синий) и амфифила таких как CHAPSO (зеленый), который защищает гидрофобные края бислоя. Когда температура повышается, дискообразных bicelles пройти этап превращения в перфорированной пластинчатые 12 листов.
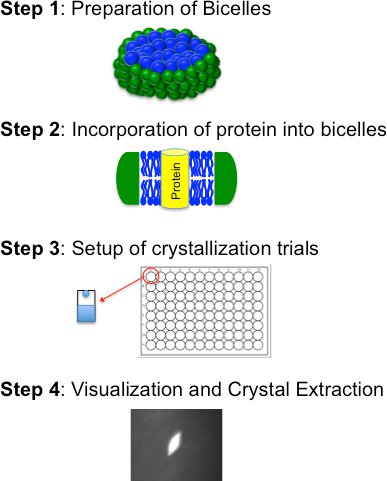
Рисунок 2. Блок-схема для bicelle методом кристаллизации изложением четырех основных шагов.

Рисунок 3. Кристалл испытаний настройки схемы. Очищенная моюще-солюбилизированного мембранных белков может быть непосредственно смешанные с bicelles на льду просто пипетки содержимое вместе. После инкубации белка / bicelle смеси на льду в течение ~ 30 минут, судебные процессы кристаллизацииможет быть настроено с помощью любого стандартного формата, включая робототехнику.

Рисунок 4. Визуализация кристаллической испытаний. Видимое изображение (верхняя панель) и УФ-изображения (нижняя панель) (А) игольчатые кристаллы наблюдаются в соль-единственное условие. Нет флуоресценции можно обнаружить по кристаллов, указание ложных срабатываний. (B) палочковидные кристалла, образованного в MPD состоянии. Кристалл fluoresced слабо, но оказалось небелковые с помощью рентгеновской дифракции. (C) Кристалл наблюдается примерно через четыре недели после установки испытаний. Сильная флуоресценция в УФ-свете подтверждает это белковых кристаллов.
| Нет. | Белок | Источник | Разработка Bicelle | Белки Concentratiна | Моющее средство 1 | Разрешение (Å) | Ссылка |
| 1 | Бактериородопсин 2 | Halobacterium salinarum | 8% ДМФХ: CHAPSO (2,8:1) | 8 мг / мл | 2,0 | Faham и Боуи, 2002 | |
| 8% DTPC: CHAPSO (3:1) | 8 мг / мл | 1,8 | Faham и соавт., 2005 | ||||
| 2 | β2-адренергических рецепторов / Fab комплекс | Человек разумный | 8,3% ДМФХ: CHAPSO (3:1) | 10 мг / мл | DDM | 3.4/3.7 | Расмуссен и соавт., 2007 |
| 3 | Напряжение зависит от аниона канала 1 | Муз мышцы | 7% ДМФХ: CHAPSO (2,8:1) | 12 мг / мл | LDAO | 2,3 | Ujwal и соавт., 2008 |
| 4 | Xanthorhodopsin | Salinibacter Ruber | 4,2% ДМФХ, 5% Н.М. | 4 мг / мл | DDM | 1,9 | Luecke и соавт., 2009 |
| 5 | Ромбовидной протеазы | Кишечная палочка | 2% ДМФХ: CHAPSO (2.6:1) | 9 мг / мл | Нонил глюкозид | 1,7 | Vinothkumar, 2011 |
1 Моющее средство для очистки мембранных белков
2 Родные липидов из пурпурных мембран может осуществляться наряду во время очистки
Таблица 1. Резюме условий кристаллизации для структур мембранных белков решена с помощью bicelles.
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Bicelles являются уникальными липидный средств массовой информации, которые предлагают родной бислой-среде в то время как себя так, будто растворяются на моющие средства. Это свойство дает bicelles явное преимущество перед другими на основе липидов методы кристаллизации, так как нет обучения...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Мы хотели бы поблагодарить д-ра. Джеймс Боуи и Салем Faham за предоставление технической экспертизы и рекомендации по методу bicelle и д-р Авив-Пас за полезные обсуждения. Мы признаем, Ле Дю для экспериментальной поддержки. Rachna Ujwal имеет финансовый интерес в MemX Biosciences LLC, которая, однако, не поддержал эту работу. Эта работа была частично поддержана грантами NIH (RO1 GM078844).
Access restricted. Please log in or start a trial to view this content.
Материалы

Ссылки
- Landau, E. M., Rosenbusch, J. P. Lipidic cubic phases: A novel concept for the crystallization of membrane proteins. Proceedings of the National Academy of Sciences. 93, 14532-14535 (1996).
- Caffrey, M., Lyons, J., Smyth, T., Hart, D. J. Chapter 4 Monoacylglycerols: The Workhorse Lipids for Crystallizing Membrane Proteins in Mesophases. Current Topics in Membranes. 63, 83-108 (2009).
- Nollert, P., Landau, E. M. Enzymic release of crystals from lipidic cubic phases. Biochem. Soc. Trans. 26, 709-713 (1998).
- Cheng, A., Hummel, B., Qiu, H., Caffrey, M. A simple mechanical mixer for small viscous lipid-containing samples. Chem. Phys. Lipids. 95, 11-21 (1998).
- Faham, S., Bowie, J. U. Bicelle crystallization: a new method for crystallizing membrane proteins yields a monomeric bacteriorhodopsin structure. J. Mol. Biol. 316, 1-6 (2002).
- Faham, S., Ujwal, R., Abramson, J., Bowie, J. U. Chapter 5 Practical Aspects of Membrane Proteins Crystallization in Bicelles. Current Topics in Membranes. 63, 109-125 (2009).
- Faham, S. Crystallization of bacteriorhodopsin from bicelle formulations at room temperature. Protein Science. 14, 836-840 (2005).
- Luecke, H. Crystallographic structure of xanthorhodopsin, the light-driven proton pump with a dual chromophore. Proceedings of the National Academy of Sciences. 105, 16561-16565 (2008).
- Ujwal, R. The crystal structure of mouse VDAC1 at 2.3 Å resolution reveals mechanistic insights into metabolite gating. Proceedings of the National Academy of Sciences. 105, 17742-17747 (2008).
- Vinothkumar, K. R. Structure of rhomboid protease in a lipid environment. J. Mol. Biol. 407, 232-247 (2011).
- Rasmussen, S. G. F. Crystal structure of the human [bgr]2 adrenergic G-protein-coupled receptor. Nature. 450, 383-387 (2007).
- Prosser, R. S., Hwang, J. S., Vold, R. R. Magnetically aligned phospholipid bilayers with positive ordering: a new model membrane system. Biophys. J. 74, 2405-2418 (1998).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены