Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Мышиной модели индуцированного хирургического Эндометриоз через Авто-трансплантации тканей матки
В этой статье
Резюме
Описание хирургической индукции эндометриоза у мышей и крыс авто-трансплантация ткани матки к артериальной каскад кишечного брыжейки.
Аннотация
Эндометриоз представляет собой хроническое, болезненное заболевание, этиология остается неизвестной. Кроме того, лечение эндометриоза может потребовать лапароскопической удаление поражений, и / или хронической фармацевтического менеджмента боли и бесплодие симптомов. Расходы, связанные с эндометриозом была оценена в 22 миллиардов долларов в год на 1 Соединенных Штатов. Для более глубокого понимания механизмов, лежащих этой загадочной болезни, животных моделях были использованы. Приматы спонтанно развиваться эндометриоз и, следовательно, приматов модели наиболее близко заболеваний у женщин. Грызун модели, однако, являются более экономически эффективным и легко доступны 2. Модель, которую мы описываем здесь включает в себя аутологичных передачи ткани матки к кишечным брыжейки (рис. 1) и была впервые разработана в крысу 3 и затем переведен в мыши 4. Цель аутологичных модели грызунов хирургически-индуцированной эндометриоз, чтобы имитироватьзаболеваний у женщин. Мы и другие, ранее показали, что изменило характер экспрессии генов наблюдается в эндометриоидных поражений от мышей и крыс зеркал, которые наблюдаются у женщин с болезнью 5,6. Одним из преимуществ проведения операции у мышей является то, что обилие трансгенных линий мышей доступны могут помочь исследователям в определении роли отдельных компонентов важно в создании и рост эндометриоза. Альтернативная модель, в которой вырезаны фрагменты эндометрия человека знакомятся с брюшины иммунитетом мышей также широко используется, но ограничена из-за отсутствия нормальной иммунной системой, которая считается важным при эндометриозе 2,7. Важно отметить, что модели мыши хирургически индуцированной эндометриоза является универсальной моделью, которая была использована для изучения того, как иммунная система 8, 9,10 гормоны и факторы окружающей среды влияют на 11,12 эндометриоз, а также последствия эндометриоза на Фертility 13 и более 14.
протокол
1. Планирование для живых животных хирургии
- Убедитесь, что соответствующее одобрение было получено для работы с лабораторными животными.
- Заказ мышей и позволяют по крайней мере одной недели акклиматизации в новых условиях.
- Женский мышей размещены в отсутствие воздействия на мужские феромоны могут остановить на велосипеде, явление называют эффектом Уиттен 15,16. Чтобы держать мышей езда на велосипеде передачи мочой пропитанную мужчин постельные принадлежности к женскому клетку каждые пять дней. Или же, если с открытым верхом клетки используются, место женщины клетке между двумя клетками самцов, чтобы держать женщин езда на велосипеде регулярно.
- Убедитесь, что мыши, на велосипеде, анализируя вагинального цитологического ежедневно в течение как минимум за неделю до операции (табл. 1) 17.
- Использование восковой карандаш, чтобы создать восемь разделов на предметное стекло так, что влагалищные мазки из нескольких мышей могут быть собраны.
- Флеш влагалище 0,2-0,25 мл физиологического раствора или дистиллированной воды с помощью пипетки. Будьте сЮр разместить пипетки только на влагалище, как рак шейки матки стимуляция может вызвать пипетку ложная беременность. Место промывание влагалища на предметное стекло для анализа типов клеток. Слайды можно прочитать свежие (мокрые), либо установленный ряд методов и изучены с помощью стандартной световой микроскоп 17.
- Сбор, очищать и стерилизовать все необходимое хирургическое оборудование для успешного асептической хирургии (см. материал раздела) 18.
- Подготовка бупренорфин решение для обезболивания в PBS с использованием стерильной техники для доставки 0,2 мг / кг окончательной дозы. Концентрация бупренорфина решение должно быть 0,0333 мг / мл, при условии, что средний взрослый C57BL / 6 мышь весит около 0,025 кг, а объем подкожного введения 0,15 мл на мышь. Бупренорфин может быть подготовлен заранее и хранится в виде порции. Обратите внимание, что бупренорфин Список III регулируемого вещества, требующие лицензии DEA и детальный журнал инвентаризации.
- Подготовка стерильной PBS с помощью пенициллина (100 ед / мл) и стрептомицин (100 мкг / мл).
- Синхронизация течки циклов передачи мочой пропитанную мужчин постельные принадлежности к женскому клетки за 72 часа до индукции 15.
2. Подготовка хирургического области для живой хирургии животных
- Подготовка хирургической области, как описано выше 18.
- Подготовка подготовкой области путем установления электрические ножницы, глазной мази, и хирургические скрабов.
- Подготовка хирургического области путем размещения рециркуляции горячей грелки воды на хирургическое области, чтобы поддерживать температуру тела всей операции. Место стерильные водонепроницаемые площадки по рециркуляции горячей грелки воды. Упорядочить хирургические инструменты, шовный, стерильные стеклянные чашки Петри, биопсия удар, стерильная марля, раны и раны клипы клип аппликатор на стерильные хирургические области.
- Подготовка области восстановления, помещая рециркуляции горячей воды, грелки на полпути ундэ пустую клетку, чтобы мышей отойти от тепла, если он того пожелает.
3. Обезболить и подготовить мышь для хирургии
- Запись вес мыши и определить стадию эструса, оценивая вагинальной цитологии.
- Для вводного наркоза, поместите курсор в пустой камере анестезии (пустая клетка с твердой крышкой содержащие портал ИФ). Включите изофлуран без возвратного дыхания система анестезии и установить испаритель до 4% изофлуран (с Скорость потока кислорода от 0,5 до 1 л / мин).
- При наведении курсора мыши под анестезией переключатель изофлуран поток конуса (30-60 мл шприц оболочка) и нос место мыши и рот в конусе по подготовке таблицы. Адекватная анестезия может быть обеспечена с более низкой концентрацией изофлуран протяжении оставшейся части операции (~ 2.5-3.5% ИФ). Адекватная глубина анестезии должны определяться отрицательный ответ до пят стимул крайнем случае.
- Применение глазной мази то избежание высыхания глаз во время операции.
- Использование небольших электрических ножницами, брить хирургии сайта.
- Лечить и подготовить операцию сайт с трех чередующихся пойло хлоргексидина скраб и 70% этанола.
- Пелерина животное с стерильные области.
4. Перевязка маточных
- Сделать мала (~ 1 см) разреза средней линии, используя либо маленькие ножницы или лезвие скальпеля окончание 0,5 - 1,0 см ростральнее влагалища.
- Вставить закрытые ножницы в отверстие так, чтобы лопасти между стенкой тела и брюшной стенки. Осторожно тупым рассекать пространство вокруг разреза медленным открытием и закрытием ножницами так, что брюшной стенки достаточно отделена от кожи. Оставшиеся видимые спайки между брюшной стенки и кожи вокруг разреза может быть тщательно пропущено. Неспособность адекватно тупым рассекать разреза сделает закрытия брюшной стенки более трудным.
- Использование малых еorceps, мягко найти левый рог матки. Матка спинной в кишечник, что и вы увидите при первом входе в разрез сайта. В некоторых случаях проще всего сначала найти яичников и связанных площадку яичников жира. Осторожно потяните вверх на рога матки и слайд открытых щипцов под ним в качестве втягивающего устройства. При желании отметить появление яичников и матки в это время для дополнительной информации относительно течки стадии индукции (табл. 1).
- Аккуратно вставьте два 6-8 см куски 5-0 черные шелковые плетеные шва (без иглы) под натянутой рога матки.
- Безопасное лигировать рога на маточно-tubual перехода (только каудально маточные трубы) и в маточно-цервикальный переход (только ростральнее шейки матки), используя квадратный узел на каждом месте. Оставьте концы шва на данный момент.
- Вырежьте часть рога матки между двумя перевязку и поместить ткань в стерильную стеклянную чашку Петри Контакining ~ 100 мкл PBS содержащих пенициллин (100 Ед / мл) и стрептомицин (100 мкг / мл). Отрежьте концы шелковых шва в последнюю очередь. Если шов идет свободно или есть кровотечение, найти пень и галстук другой узел.
5. Подготовка эндометриоидных имплантатов из вырезали матку
- Хотя вырезали матку манипулируют, крышка живота стерильной марли и поддерживать гидратации стерильной PBS содержащих пенициллин и стрептомицин по мере необходимости.
- Газа вырезали рога матки жира.
- При желании, весят вырезали рога матки.
- Открытое рога матки, вставляя одно лезвие ножниц малых (14 мм длиной лезвия) в просвет и мягко скользящие ножницы вниз рога матки, держа рог щипцами.
- В стеклянном блюде Петри, используйте 2 мм биопсии удар вырезать три равные по размеру имплантаты.
6. Наложение швов эндометриоидных имплантатов в брюшной полости
- Место стерильныеэлектронной марли сразу же выше места разреза и основательно мокрой стерильной PBS содержащих пенициллин и стрептомицин.
- При небольших, гладкая щипцы мягко найти слепой кишки и двигаться вдоль рострально тонком кишечнике. Вытяните небольшой (4-5 см) части кишечника, что, по крайней мере две артерии от слепой кишки и организовать его, как вентилятор на предварительно смоченный марлю так, чтобы артериальное каскад кишечного брыжейки четко виден. Не забудьте сохранить кишечника влажным стерильным физиологическим раствором. Примечание: не используйте крысу-зубчатые щипцы при работе кишечника.
- Используйте 6-0 черный шов ethilon с Р-1, 11 мм, 3 / 8 окружности, обратного режущие иглы, чтобы мягко шва один имплантат в артерии примерно в 0,5 см от кишечника.
- Примечание: кишечная брыжейки покрыта тонким слоем брюшины. Будьте осторожны, чтобы сделать чистым проходить через этот слой, наложение швов вокруг артерии. Потяните шва через медленно и осторожно, чтобы не рвать брюшины или разрывартерии.
- Полное двух узлов одного броска каждый, стараясь не затягивать шов очень трудно, так как это может привести к потере кровотока и последующего некроза кишки и смерти. Trim шва в пределах 2 мм имплантата. Влажные кишечника снова продолжать поддерживать гидратации, прежде чем перейти к следующему имплантата.
- Двигаясь в направлении ростральной, вытащить ближайшие 3-4 см кишечника и осторожно заменить раздел, уже содержащий имплантат. Пропустить одну или две артерии от предыдущего сайта имплантата и шовный следующий имплантата. Повторите эти действия для третьей имплантата.
- Замените все кишечника в брюшную полость.
7. Шам операций
- Шам Операции проводятся с использованием тех же шагов, как эндометриоз операций исключением того, что ткань пришита к кишечным брыжейки.
- Акцизный левого рога матки, как в шаге 4.
- Эндометриоидных имплантатов (шаг 5) не готовы в хирургии обман.вырезали рога матки может быть отброшен или использоваться для других целей, если это необходимо.
- Швы, но не ткани, располагаются вокруг трех артерий в артериальной каскад кишечного брыжейки, как в шаге 6.
8. Закрытие операционной раны
- Убедитесь, что все органы приблизительно обратно в их анатомическом положении.
- Используйте 5-0 покрытием Викрил шва без блокировки непрерывный шов, чтобы закрыть брюшной стенки.
- Использование клипов 9 мм, чтобы закрыть рану кожи.
9. Восстановление животных
- Администрирование 0,33 мг / мл бупренорфин на 0,15 ml/25 мыши г через подкожных инъекций для дозе 0,2 мг / кг. Бупренорфин назначается после операции, чтобы предотвратить дальнейшее сердечно-сосудистые / угнетение дыхания, что может удлинить процесс восстановления.
- Аккуратно сухой мышь с kimwipes или бумажные полотенца, если она была влажной во время операции.
- Место животных вентральной стороной вниз в клетке рartially вершине рециркуляции воды нагревается площадку, пока животное не выздоровел и восстановил грудины лежачее положение (в течение пяти минут, как ингаляционных анестетиков быстро стирается).
10. Послеоперационный уход
- Мыши должны наблюдаться каждые 15 минут, пока они не в состоянии поддерживать грудины лежачее положение, а затем ежечасно, пока они не восстановить их нормальное поведение после операции.
- Мыши должны появиться нормальное течение 24 часов после операции. Мыши необходимо ежедневное наблюдение в течение семи-десяти дней на признаки восстановления и хорошего здоровья.
- Признаки того, что животное находится в плохом здоровье, боль, или теснота включают снижение активности, членовредительство, ungroomed внешний вид, или сгорбленной осанке.
- Если животное, кажется, не иметь хорошее здоровье в течение 24 часов после операции, либо управлять бупренорфин (0,2 мг / кг) или усыпить животное. Если животное не улучшается в течение 8 часов дополнительного бупренорфин администрации животных Shoulг быть умерщвлены, как некроз кишечника, скорее всего.
- Удалить раны клипы 7-10 дней после индукции.
- Продолжайте следить за цикличности течки путем исследования выделений из влагалища цитологии в течение всего срока эксперимента. Синхронизация течки циклов за 72 часа до сбора мочи путем перечисления пропитанной мужской постельные принадлежности к женскому клетки, как описано в пункте 1.3.
11. Вскрытие и иссечение ткани
- Сроки вскрытия зависит от конкретного вопроса, исследований и более подробно рассматривается в репрезентативные результаты и обсуждения.
- Эвтаназии мыши углерода удушения газом.
- Забрать кровь пункции сердца использованием 23 иглу на шприц 1cc (по желанию).
- Сбор вагинального мазка цитология, как описано выше, чтобы определить течки этапе во время сбора 17.
- Отрежьте оставшиеся рога матки в маточно-трубное соединение и в шейке матки, удалить жир, взвесить, а процессжелаемое (см. 11,14 и 11.15).
- Найдите черные швы вокруг эндометриоидных поражений. Фотография нетронутыми эндометриоидных поражений при желании.
- Осторожно рассекают спайки окружающих эндометриоидных поражений с маленькие ножницы и щипцы, стараясь не копье поражений. Работают быстро и тщательно, чтобы предотвратить деградацию РНК.
- Измерьте и запишите длину и ширину эндометриоидных поражений использованием суппортами.
- Акцизный эндометриоидных поражений и положите на бумажное полотенце, смоченной PBS. Удалите все не-эндометриоидных ткани из поражений. Рассекает микроскоп или увеличительное стекло стенда могут быть использованы для оказания помощи в рассечение.
- Взвесьте три заполненных жидкостью эндометриоидных поражений до удаления шва.
- Аккуратно снимите шва от эндометриоидных поражений.
- Для гистологии, формалин фиксируем одну заполненных жидкостью эндометриоидных поражений в течение двух часов следуют три тридцать минут моет PBS и окончательного хранения ял 70% этанола. Дегидрировать и парафина вставлять.
- Лэнс два из эндометриоидных поражений. Взвесьте это снова. Так как циклические гормональные изменения могут изменять количество жидкости кисты, это дает меру ткани мокрого веса в дополнение к весу кисты плюс жидкость, измеряемой в 11.10.
- Для изоляции РНК и исследования экспрессии генов, сразу гомогенизации одной из внештатным эндометриоидных поражений (или ~ 20 мкг ткани матки) в лизис связывающего раствора и хранят при температуре -80 ° С для будущего выделения РНК с RNAqueous комплект (Амбион) или другим способом, как лучшего.
- Для будущих изоляции РНК, ДНК или белка, сразу оснастки заморозить второй внештатным эндометриоидных поражений (или ~ 20 мкг ткани матки) в жидком азоте и хранят при температуре -80 ° C.
Представитель Результаты
Эндометриоидных поражений в мышиной модели хирургически индуцированной эндометриоз морфологически и гистологически напоминают, которые наблюдались вженщин. Гистологический анализ эндометриоза у женщин, так и модель мыши указывает, что эндометриоидных поражений содержат желез эндометрия и стромы (рис. 2A). Эндометриоидных поражений у мышей также содержат гемосидерина нагруженные макрофаги, которые являются общим признаком эндометриоза у женщин (рис. 2В) 19.
Эндометриоидных поражений удалены от мышей через три дня после индукции появляются воспаленные и геморрагический (рис. 3А). После двух-четырех недель роста эндометриоидных поражений в мышиной модели являются цистоподобных, заполненных жидкостью и окруженные перитонеального спайки (рис. 3В и 3С). По сравнению с поражением вес при индукции, заполненных жидкостью поражения были 306% и 862% больше, на один-два месяца после индукции и внештатным поражения были 51% и 172% больше, соответственно (рис. 4А и 4В). Мы получили последовательное заполненных жидкостью и внештатным эндометриоидных поражений веса на один месяц после индукции в течение пяти различных экспериментах (рис. 5). В какой-то месяц после впроизводства заполненных жидкостью (7,44 ± 3,75 мг) и внештатным (2,92 ± 1,23 мг) эндометриоидных вес поражения были достоверно коррелирует (коэффициент корреляции Пирсона = 0,669, р <0,001).
Возраст мышь не влияет размер повреждения у мышей от трех до десяти месяцев. Ни одна из заполненных жидкостью или внештатным эндометриоидных вес поражение на один месяц после индукции было достоверно коррелирует с возрастом животного (г = -0,136, р = 0,380 и г = -0,063, р = 0,698 соответственно).
Мышь матки претерпевает изменения в размерах, задержка жидкости, пролиферации клеток и появление в связи с влиянием стероидных гормонов во время течки цикл. Мы сравнили вес эндометриоидных поражений от веса оставшихся нетронутыми рога матки от животных в разные течки этапов. Мы не нашли значимой корреляции между матки весом и заполненных жидкостью или внештатным эндометриоидных лesion вес на один месяц после индукции (г = -0,046, р = 0,765 и р = 0,232, р = 0,155 соответственно).
Картина экспрессии генов наблюдается в эндометриоидных поражений мышей тесно зеркала, которые сообщили у женщин с заболеваниями 5. Через три дня после индукции генов, регулирующих внеклеточной матрицы ремоделирования, адгезии клеток и ангиогенез очень upregulated и многие из этих генов остаются upregulated через один месяц роста.
Рисунки и таблицы

Рисунок 1. Хирургическая индукция эндометриоз матки по autologus передачи ткани мыши. Левый рог матки лигируют, вырезали, и открыл продольно подвергать эндометрия. Три 2 мм 2 биопсии готовятся и каждый из них пришита к артерии в артериальной каскад кишечного mesenteры. В один месяц после индукции эндометриоидных поражений заполненных жидкостью и окруженные спаек.
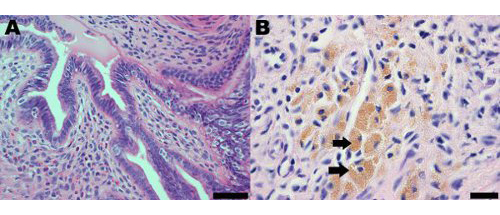
Рисунок 2 гематоксилин-эозином окрашенные части эндометрия поражения от мышиной модели эндометриоза через один месяц после индукции демонстрации () наличие желез эндометрия и стромы;. Шкала бар = 50 мкм и (Б) гемосидерина нагруженные макрофаги, некоторые из которых указаны стрелками; шкалы = 20 мкм.

Рисунок 3. Эндометриоидных поражений в мышиной модели следующих эвтаназии, либо через три дня после индукции () или один месяц после индукции (В и С).
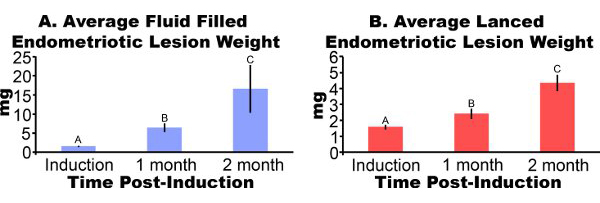
Рисунок 4. Эндометриоидных поражений от мышей хирургически индуцированной иметь анdometriosis вырезали и весил на один-два месяца после индукции. Данные среднем ± SEM. Данные были преобразованы и журналов разных букв указывают значения в каждой панели однофакторного дисперсионного анализа следует наименее значительное одностороннее Фишера Сравнения Mulitple Difference. (А) Киста, как, заполненных жидкостью эндометриоидных поражений (N = 10, 7 или 5 для индукции, через месяц или два месяца после индукции, соответственно). (B) вскрывать эндометриоидных поражений (N = 10, 8 или 7 для индукции, через месяц или два месяца после индукции соответственно).
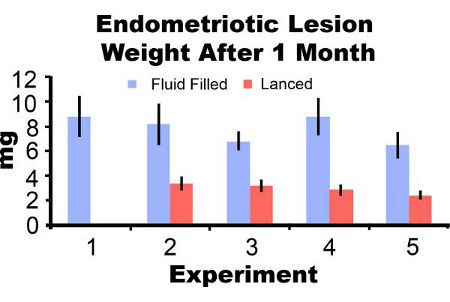
Рисунок 5. Эндометриоидных поражений сырого веса с жидкостью и внештатным через один месяц после индукции из пяти отдельных экспериментов. Данные среднем ± SEM. Мыши N = 10, 6, 8, 7 и 7 для заполненных жидкостью поражения и 0, 7, 10, 8 и 8 для внештатным поражения в эксперименте 1, 2, 3, 4 и 5, соответственно.
Таблица 1. Наблюдение Течка этап при вагинальном цитологии и внешний вид яичников и матки и индукции.
Внешний вид яичников и матки будет зависит от времени. Следующие основаны на жертву около 8:00 утра утро каждого цикла день. Кроме того, наблюдения носят субъективный характер и сравнение яичники и маточные рожки будет лучше оценка, чем рога матки только. Эти наблюдения предназначены для дополнения информации, полученной от ежедневных чтений вагинальной цитологии.

Таблица 2. Сравнение хирургии в мыши и крысы.
Обсуждение
Есть несколько важных параметров, которые следует отметить при выполнении хирургических индукции эндометриоза у мышей. Во-первых, эндометриоз является эстроген зависимых заболеваний и, таким образом эта операция должна быть выполнена в интактных животных или же в яичниках животных д...
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Особая благодарность Крису Kassotis и Одри Бэйли для критического обзора этой рукописи и д-р Скотт Корте, Джозеф Биман, Элисон Curfman, Пол Кимбалл, Бриджит Neibreggue, Иаков Редель, Эми Шредер, Майя Стейнберг, и Стейси Winkeler за помощь в оптимизации этой модели в нашей лаборатории. Финансирование было предоставлено Клиническая подготовка Biodetectives Грант (NIH T90) (KEP), Университет Миссури Науки о жизни Бакалавриат Исследовательские возможности программы, MU исследовательский совет, Совет по исследованиям MU грантов и NIH R21HD056441 (SCN).
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента / оборудование | Компания | Номер по каталогу | |
| Воск карандаш | Рыболов | NC9954135 | |
| Стекло | Рыболов | 12-550-433 | |
| Пипетка | Рыболов | S79383 | |
| Стандартный световой микроскоп для оценки влагалищных мазков цитологии | |||
| Бупренорфин HCL c3 (CARJET) 10X1ml | Батлер здоровья животных питания | 022891 | |
| Стерильные фосфатным буферным раствором (PBS) | Гибко | 14040-117 | |
| 10 000 ед / мл пенициллина, 10 000 мкг / мл стрептомицина в 0,85% NaCl | Hyclone | SV30010 | |
| Изофлюрана | AbbottЗдоровье животных | 05260-05 | |
| Изофлюрана без возвратного дыхания анестезии системы | |||
| Рециркуляции горячей грелки воды | |||
| 30 мл шприца оболочки | Рыболов | 14-823-16G | |
| Порошковая свободной стерильные перчатки | Fisherbrand | 19020558 | |
| Офтальмология мазь | Основные фармацевтика | 10033691 | |
| Малые электрические ножницы | Wahl | 9861-600 | |
| Хлоргексидин скраб | Рыболов | NC9863042 | |
| 70% этанола | |||
| Polylined стерильные поля | Буссе одноразового больницы | 696 | |
| Размер 3 скальпеля | Рыболов | 22-079-657 | |
| Номер 10 лезвий скальпеля | Рыболов | 22-079-681 | |
| Малые хирургические ножницы | Roboz | RS-5850 | |
| Малые зубчатые полу-изогнутые щипцы | Roboz | RS-5135 | |
| 5-0 черный шелковый плетеный шовный материал | Ethicon | K870H | |
| Стерилизованные стекла пирекс чашки Петри | Гранулирование | 70160-101 | |
| 2 мм биопсии удар | Miltex | 33-31 | |
| Стерильные марлевые | Кендалл | 1806 | |
| 6-0 черный мононить ethilon нейлона шва | Ethicon | 697G | |
| Иглы драйверов (опция) | Инструменты Всемирной Precision | 500023 | |
| 5-0 неокрашенного плетеные покрытием Vicryl шва | Ethicon | J490G | |
| 9мм Autoclip раны клипы | Becton Dickinson | 427631 | |
| Autoclip объекта применения и удаления | Becton Dickinson | 427630 | |
| 23G иглы | Becton Dickinson | 305193 | |
| 1cc шприц | Becton Диксон | 301025 | |
| 5X стоять лупу (опционально) | Рыболов | 14-648-23 | |
| 10% буферном растворе формалина | Рыболов | SF100-4 | |
| Кронциркуль | Roboz | RS-6466 | |
| Обработка / вложение кассеты | Рыболов | 15-197-700A | |
| Биопсия прокладки пены | Рыболов | 22-038-222 | |
| RNAqueous изоляции РНК комплект | Амбион | AM1912 | |
| Жидкий азот | |||
| Привязка шапка микроцентрифужных плоской верхней трубы | Рыболов | 02-681-240 | |
| Кетамин (опционально) | Simga | K4138 | |
| Domitor (medetomidine гидрохлорид) (опционально) | Tocris | 2023 | |
| Antisedan (атипамезола) (опционально) | Сигма | A9611 |
Ссылки
- Simoens, S., Hummelshoj, L., D'Hooghe, T. Endometriosis: cost estimates and methodological perspective. Hum. Reprod. Update. 13, 395-404 (2007).
- Grummer, R. Animal models in endometriosis research. Hum. Reprod. Update. 12, 641-649 (2006).
- Vernon, M. W., Wilson, E. A. Studies on the surgical induction of endometriosis in the rat. Fertil. Steril. 44, 684-694 (1985).
- Cummings, A. M., Metcalf, J. L. Induction of endometriosis in mice: a new model sensitive to estrogen. Reprod. Toxicol. 9, 233-238 (1995).
- Pelch, K. E. Aberrant gene expression profile in a mouse model of endometriosis mirrors that observed in women. Fertil. Steril. 93, 1615-1627 (2010).
- Flores, I. Molecular profiling of experimental endometriosis identified gene expression patterns in common with human disease. Fertil. Steril. 87, 1180-1199 (2007).
- Giudice, L. C., Kao, L. C. Endometriosis. Lancet. 364, 1789-1799 (2004).
- Lin, Y. J., Lai, L. e. i., Y, H., Wing, L. Y. Neutrophils and macrophages promote angiogenesis in the early stage of endometriosis in a mouse model. Endocrinology. 147, 1278-1286 (2006).
- Fang, Z. Intact progesterone receptors are essential to counteract the proliferative effect of estradiol in a genetically engineered mouse model of endometriosis. Fertil. Steril. 82, 673-678 (2004).
- Fang, Z. Genetic or enzymatic disruption of aromatase inhibits the growth of ectopic uterine tissue. J. Clin. Endocrinol. Metab. 87, 3460-3466 (2002).
- Cummings, A. M., Metcalf, J. L., Birnbaum, L. Promotion of endometriosis by 2,3,7,8-tetrachlorodibenzo-p-dioxin in rats and mice: time-dose dependence and species comparison. Toxicol. Appl. Pharmacol. 138, 131-139 (1996).
- Foster, W. G. Morphologic characteristics of endometriosis in the mouse model: application to toxicology. Can. J. Physiol. Pharmacol. 75, 1188-1196 (1997).
- Cummings, A. M., Metcalf, J. L. Effect of surgically induced endometriosis on pregnancy and effect of pregnancy and lactation on endometriosis in mice. Proc. Soc. Exp. Biol. Med. 212, 332-337 (1996).
- Lu, Y., Nie, J., Liu, X., Zheng, Y., Guo, S. W. Trichostatin A, a histone deacetylase inhibitor, reduces lesion growth and hyperalgesia in experimentally induced endometriosis in mice. Hum. Reprod. 25, 1014-1025 (2010).
- Whitten, W. K. Modification of the oestrous cycle of the mouse by external stimuli associated with the male. J. Endocrinol. 13, 399-404 (1956).
- Whitten, W. K., Bronson, F. H., Greenstein, J. A. Estrus-inducing pheromone of male mice: transport by movement of air. Science. 161, 584-585 (1968).
- Goldman, J. M., Murr, A. S., Cooper, R. L. The rodent estrous cycle: characterization of vaginal cytology and its utility in toxicological studies. Birth. Defects. Res. B. Dev. Reprod. Toxicol. 80, 84-97 (2007).
- Pritchett-Corning, K. R., Mulder, G. B., Luo, Y., White, W. J. Principles of Rodent Surgery for the New Surgeon. J. Vis. Exp. (47), e2586-e2586 (2011).
- Moen, M. H., Halvorsen, T. B. Histologic confirmation of endometriosis in different peritoneal lesions. Acta. Obstet. Gynecol. Scand. 71, 337-342 (1992).
- Cummings, A. M. Methoxychlor as a model for environmental estrogens. Crit. Rev. Toxicol. 27, 367-379 (1997).
- Fowler, R. E., Edwards, R. G. Induction of superovulation and pregnancy in mature mice by gonadotrophins. J. Endocrinol. 15, 374-384 (1957).
- Wilson, E. D., Zarrow, M. X. Comparison of superovulation in the immature mouse and rat. J. Reprod. Fertil. 3, 148-158 (1962).
- Lee, B., Du, H., Taylor, H. S. Experimental murine endometriosis induces DNA methylation and altered gene expression in eutopic endometrium. Biol. Reprod. 80, 79-85 (2009).
- Somigliana, E. Endometrial ability to implant in ectopic sites can be prevented by interleukin-12 in a murine model of endometriosis. Hum. Reprod. 14, 2944-2950 (1999).
- Hirata, T. Development of an experimental model of endometriosis using mice that ubiquitously express green fluorescent protein. Hum. Reprod. 20, 2092-2096 (2005).
- Story, L., Kennedy, S. Animal studies in endometriosis: a review. Ilar. J. 45, 132-138 (2004).
- Cummings, A. M., Hedge, J. M., Birnbaum, L. S. Effect of prenatal exposure to TCDD on the promotion of endometriotic lesion growth by TCDD in adult female rats and mice. Toxicol. Sci. 52, 45-49 (1999).
- Cummings, A. M., Metcalf, J. L. Effects of estrogen, progesterone, and methoxychlor on surgically induced endometriosis in rats. Fundam. Appl. Toxicol. 27, 287-290 (1995).
- Sharpe-Timms, K. L. Endometriotic lesions synthesize and secrete a haptoglobin-like protein. Biol. Reprod. 58, 988-994 (1998).
- Yavuz, E., Oktem, M., Esinler, I., Toru, S. A., Zeyneloglu, H. B. Genistein causes regression of endometriotic implants in the rat model. Fertil. Steril. 88, 1129-1134 (2007).
- Dmitrieva, N. Endocannabinoid involvement in endometriosis. Pain. 151, 703-710 (2010).
- Efstathiou, J. A. Nonsteroidal antiinflammatory drugs differentially suppress endometriosis in a murine model. Fertil. Steril. 83, 171-181 (2005).
- Becker, C. M. Endostatin inhibits the growth of endometriotic lesions but does not affect fertility. Fertil. Steril. 84, 1144-1155 (2005).
- Becker, C. M. Short synthetic endostatin peptides inhibit endothelial migration in vitro and endometriosis in a mouse model. Fertil. Steril. 85, 71-77 (2006).
- Sharpe-Timms, K. L. Using rats as a research model for the study of endometriosis. Ann. N.Y. Acad. Sci. 955, 318-327 (2002).
- Stilley, J. A., Woods-Marshall, R., Sutovsky, M., Sutovsky, P., Sharpe-Timms, K. L. Reduced Fecundity in Female Rats with Surgically Induced Endometriosis and in Their Daughters: A Potential Role for Tissue Inhibitors of Metalloproteinase 1. Biol. Reprod. 80, (2009).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены