Method Article
Флуоресценции на основе измерения магазин управлением поступления кальция в живых клетках: от искусственного раковых клеток в скелетных мышечных волокон
В этой статье
Резюме
Степень магазин управлением Ca 2 + Запись (SOCE) можно контролировать с помощью флуоресцентного Са 2 + Показателям. Mn 2 + Тушение таких показателей анализов SOCE в культуре клеток и скелетные мышечные волокна. Методика, позволяющая пространственным и временным разрешением SOCE по конфокальной микроскопии механически кожу мышечных волокон также описано.
Аннотация
Store operated Ca2+ entry (SOCE), earlier termed capacitative Ca2+ entry, is a tightly regulated mechanism for influx of extracellular Ca2+ into cells to replenish depleted endoplasmic reticulum (ER) or sarcoplasmic reticulum (SR) Ca2+ stores1,2. Since Ca2+ is a ubiquitous second messenger, it is not surprising to see that SOCE plays important roles in a variety of cellular processes, including proliferation, apoptosis, gene transcription and motility. Due to its wide occurrence in nearly all cell types, including epithelial cells and skeletal muscles, this pathway has received great interest3,4. However, the heterogeneity of SOCE characteristics in different cell types and the physiological function are still not clear5-7.
The functional channel properties of SOCE can be revealed by patch-clamp studies, whereas a large body of knowledge about this pathway has been gained by fluorescence-based intracellular Ca2+ measurements because of its convenience and feasibility for high-throughput screening. The objective of this report is to summarize a few fluorescence-based methods to measure the activation of SOCE in monolayer cells, suspended cells and muscle fibers5,8-10. The most commonly used of these fluorescence methods is to directly monitor the dynamics of intracellular Ca2+ using the ratio of F340nm and F380nm (510 nm for emission wavelength) of the ratiometric Ca2+ indicator Fura-2. To isolate the activity of unidirectional SOCE from intracellular Ca2+ release and Ca2+ extrusion, a Mn2+ quenching assay is frequently used. Mn2+ is known to be able to permeate into cells via SOCE while it is impervious to the surface membrane extrusion processes or to ER uptake by Ca2+ pumps due to its very high affinity with Fura-2. As a result, the quenching of Fura-2 fluorescence induced by the entry of extracellular Mn2+ into the cells represents a measurement of activity of SOCE9. Ratiometric measurement and the Mn+2 quenching assays can be performed on a cuvette-based spectrofluorometer in a cell population mode or in a microscope-based system to visualize single cells. The advantage of single cell measurements is that individual cells subjected to gene manipulations can be selected using GFP or RFP reporters, allowing studies in genetically modified or mutated cells. The spatiotemporal characteristics of SOCE in structurally specialized skeletal muscle can be achieved in skinned muscle fibers by simultaneously monitoring the fluorescence of two low affinity Ca2+ indicators targeted to specific compartments of the muscle fiber, such as Fluo-5N in the SR and Rhod-5N in the transverse tubules9,11,12.
протокол
1. Внутриклеточного Са 2 + измерение для отдельных ячеек
- KYSE-150, человек пищевода плоскоклеточный рак (ECSS) клеточной линии культивируют в 5% CO 2 атмосферы при температуре 37 ° C в смешанных RPMI 1640/Ham "с F-12, средние (1:1), содержащий 5% эмбриональной телячьей сыворотки.
- KYSE-150 клеток, трансфицированных плазмиды или содержащие ShRNA именно против Orai1 или зашифрованная последовательность. Плазмид также включен ген, кодирующий красный флуоресцентный белок (RFP) в качестве репортера, который приводится в движение отдельным промоутер.
- Клетки, выращенные в стеклянным дном посуды (№ 1.5 покровного стекла, Маттек, Массачусетс) в течение 48 часов.
- Удаление среды и промыть клетки сбалансированный солевой раствор (BSS) (140 мМ NaCl, 2,8 мМ KCl, 2 мМ CaCl 2, 2 мМ MgCl 2, 10 HEPES мМ, рН 7,2).
- Добавить 1 мл раствора, содержащего BSS 2 мкМ Фура-2 ацетоксиметил эфира (Molecular Probes) в блюдо и обернуть целое блюдо фольгой, чтобы proteКТ от света месте.
- Инкубируйте клетки в течение 40 мин при 37 ° С, а затем оставляют их в течение 15 мин период при комнатной температуре, чтобы гидролиз эфира должно быть завершено. Промойте клетки с BSS в два раза.
- Установите блюдо на сцене Nikon TE200 инвертированного микроскопа, который подключен к PTI spectrofluorometer, при возбуждении длиной волны 350 и 390 нм и излучения на длине волны 510 нм. Точное длинах волн возбуждения может быть использована слегка меняться в зависимости от оптики каждой отдельной системы. Двух длинах волн с лучшим соотношением динамических определяется спектр возбуждения сканирования Фура-2 соли в растворе, содержащем Ca 2 + в диапазоне от 0 до 39,8 мкм (или выше концентрация, при которой Фура-2 флуоресценции насыщенный).
- Настройка системы тяжести перфузии с 4 различными решениями в BSS: Ca 2 + (2 мМ), EGTA (0,5 мм), EGTA-TG (тапсигаргин, 5 мкм), Ca 2 +-2-APB (ингибитор SOCE, 75 мкМ). С компьютерным управлением автоматизированной perfusiна системы также может быть использован.
- Выделите ячейки, выразив ППП в режиме визуализации.
- Установите открытия кончик перфузии системы в 10-кратным увеличением, пока наконечник находится прямо над интересующей нас области на 45 градусов.
- Одновременно запись сигналов флуоресценции F 350 нм и F 390nm. Соотношение (350 нм F / F 390nm) отображается в третьем окне. Изменение перфузионные растворы в следующем порядке: Ca 2 +; EGTA, Ca 2 +; EGTA-TG, Ca 2 +, Ca 2 +-2-APB.
Выше протокол может быть модифицирован для измерения внутриклеточного Са 2 + в клетке система подвески.
- Культура KYSE-150 клеток в колбе T25 с тем же условием культуры, как указано выше.
- Когда клетки достигают 90% слияния, удалить среды и промыть клетки раствором BSS.
- Добавить 2,5 мл раствора, содержащего BSS 2 мкМ Фура-2 АМ и инкубироватьклетки в течение 40 мин при 37 ° С с последующим deesterification.
- Удалить BSS, добавить 2,5 мл трипсина в колбу и инкубировать при температуре 37 ° C до клетки отделяются. Затем добавить 2,5 мл питательной среды, чтобы остановить трипсинизации и уборки клетки центрифугированием при 800 оборотов в минуту в течение 5 мин.
- Промойте клетки культуральной среде еще раз с помощью центрифугирования и повторно приостанавливать клеток гранул в растворе BSS (без добавления 2 мМ CaCl 2, содержащий мкм Ca 2 +) и подсчитать количество клеток помощью hematometer.
- Добавить ~ 10 6 клеток в кварцевую кювету (10 мм, Starna клеток) и заполнить объем до 2 мл с BSS.
- Поместите кювету (перемешивание с магнитным бар) в spectrofluorometer.
- Одновременно запись сигналов флуоресценции F 340 и F 380 нм с длиной волны излучения на длине волны 510 нм. Работает протокол: КПП, добавлением 0,5 мкл EGTA (0,25 М акций), добавление 1 мкл тапсигаргин(Т., 10 мМ акций), добавление 4 мкл Са 2 + (1 М акций).
2. Mn тушение анализа в культуре клеток
- Выполните длины волны возбуждения сканирования Фура-2 в растворах, содержащих различные концентрации Са 2 + в диапазоне от 0 до 39,8 мкм для определения концентрации кальция в качестве независимого волны изобестической точки. Как правило, изобестической точка находится на или около 360 нм.
- KYSE-150 клетки культивировали в стеклянным дном посуды и загружается с Фура-2 AM.
- Настройка системы перфузии с 5 различными BSS решений: Ca 2 + (2 мМ), EGTA / TG (0,5 мм и 5 мкм соответственно), Mn 2 + (0,5 мм, без добавления EGTA или Ca 2 +, содержащих свободный Са 2 + в мкм), Mn 2 + / 2-APB (75 мкм), EGTA / Triton X-100 (0,1%).
- Установите блюдо на сцене под микроскопом и выберите "Возбуждение Ratio" режиме с длиной волны возбуждения при 360 нм и 390 нм и эмиссии при 510нм.
- Одновременно запись сигналов флуоресценции F 360 нм и F 390nm с отношением (F 360 нм / F 390nm), представленные в третьем окне. Работает протокол: Ca 2 + в течение 1 мин для стабилизации флуоресценции, Mn 2 + в течение 30 секунд, EGTA / TG в течение 10 мин, Mn 2 + в течение 2 мин, EGTA-Тритон Х-100 (0,1%) в течение 1 мин для получения фона чтении. Mn 2 + / 2-APB решение может быть использовано вместо Mn 2 + для изучения отменил тушение флуоресценции, что свидетельствует о том, что Mn 2 + запись через SOCE пути.
3. Mn тушение анализа в мышечных клетках
- C2C12, мышь миогенной линии клетки, культивированные на стеклянным дном блюда в 5% CO 2 атмосферы при температуре 37 ° C в DMEM среде, содержащей 10% эмбриональной телячьей сыворотки, 10% лошадиной сыворотки.
- После того как клетки достигают слияния, питательной среды меняется на дифференциации среды (удаление эмбриональной бычьей сыворотки и снижениюэлектронной лошадиной сыворотки до 2,5%). C2C12 миобластов будет дифференцироваться в myotubes через 4 дня.
- Загрузка C2C12 myotubes с конечной концентрации 5 мкМ Фура-2 утра, как описано в 1,4-1,6.
- Добавить в конечной концентрации 20 мкМ N-бензил-п-толуол сульфаниламидами (BTS) для подавления мышц и движение артефакты, вызванные ими и позволяет за 15 минут до начала эксперимента.
- Установите блюдо на стадии микроскоп подключен к устройству PTI и загрузить следующие решения BSS в перфузионной системе: 2 Ca 2 + (2 мМ), 0 Ca 2 +, Mn 2 + (0,5 мм); Mn 2 + / TG (0,5 мм, 20 мкм, соответственно).
- Настройка системы перфузии, как описано выше.
- Одновременно запись сигналов флуоресценции F 360 нм и F 390nm с отношением (F 360 нм / F 390nm), представленные в третьем окне. Работает протокол: 2 Ca 2 + в течение 1 мин, 0 Са 2 + в течение 1 мин этуш от Ca 2 +, Mn 2 + в течение 0,5 мин, Mn 2 + / ТГ в течение 10 минут, и Mn 2 + / EGTA-Тритон Х-100 (0,1%).
4. Пространственно и временно решен в SOCE кожей мышечных волокон
- Подготовьте следующие решения.
Изотонический буфер Тироде: 140 мм NaCl, 5 мМ KCl, 10 мМ HEPES, 2 мМ MgCl 2, 2,5 мМ CaCl 2, рН 7,2, 290 мосм
Культура среда: DMEM с 2% лошадиной сыворотки и 1% пенициллина и стрептомицина
Промывочный раствор № 1: 109,6 мМ K-глутамата, 2 мМ EGTA-KOH, 6,7 мМ MgCl 2, 2 мМ АТФ, 6 мм креатин фосфат (СР), 20 мМ N, N-бис (2-гидроксиэтил)-2-аминоэтансульфоновая кислоты (BES), KOH, рН 7,0
Промывочный раствор № 2: 140 мм К-глутамата, 5 мМ EGTA-KOH, 6,5 мМ MgCl 2, 2 мМ АТФ, 6 мм CP, 20 мМ BES-KOH, рН 7,0
Снятие шкур решение: 140 мм К-глутамата, 6,5 мМ MgCl 2, 2 мМ АТФ, 6 мм CP, 20 мМ BES-KOH, рН 7,0
TT-загрузкиРешение: 90,6 мМ K-глутамата, 18 мМ Na-глутамата, 0,55 мМ CaCl 2, 2 мМ EGTA-KOH, 6,7 мМ MgCl 2, 5,4 мМ АТР, 15 мМ CP, 0,0025 мг / мл креатинкиназы (КК), 20 мМ BES-КОН, 5 мкМ карбонилцианид р-trifluoromethoxyphenylhydrazone (FCCP), рН 7,0, 7,0 рСа
SR загрузки решение: 107,8 мМ K-глутамата, 0,98 мМ CaCl 2, 2 мМ EGTA-KOH, 6,6 мМ MgCl 2, 5,4 мМ АТР, 15 мМ CP, 0,0025 мг / мл CK, 20 мМ BES-КОН, 5 мкМ FCCP, рН 7,0, 6,6 рСа
SR истощения решение: 100 мМ К-глутамата, 40 мМ Na-глутамата, 10 мМ EGTA-КОН, 10 мМ 1,2-бис (о-аминофенокси) этан-N, N, N ', N'-тетрауксусной кислоты (BAPTA ), 0,35 мМ MgCl 2, 0,5 мМ ATP, 1 мМ CP, 20 мМ BES-КОН, 5 мкМ FCCP, рН 7,0. 25 мМ caffeine/20 мкМ тапсигаргин (ТГ) добавляются перед экспериментами. - Чтобы вскрыть длинного разгибателя пальцев (EDL) мышц, в первую лег мышей и устроить ногу в боковом положении, затем снимите кожу от лодыжки площадью до колена, сократитьповерхностные слои мышц ткани, чтобы разоблачить EDL, и отделят как верхние и нижние сухожилия, чтобы освободить нетронутыми EDL мышцы, важно сохранить сухожилий как можно дольше. EDL передается Тироде раствор, содержащий 0 Са 2 + и 0,1 мм EGTA для предотвращения сокращений.
- Под стереомикроскоп, используйте два пинцета держать ниже сухожилия вставки и разделить EDL мышцы на две пачки. Повторите процедуру, чтобы получить 4, а затем 8 пучков. Очень важно, чтобы сухожилия остаются для каждого из 8 пучков в конце процесса. Если они потеряли от некоторых пучков, отказаться от них.
- Под стереомикроскоп, каждый EDL полосы расслоение griped на обоих сухожилий и тщательно растянуты до 3 ~ 4 разделенных одним мышечные волокна остаются нетронутыми с сухожилия на обеих сторонах.
- Поместите 1 каплю Ca 2 + свободный буфер Тироде в середине стеклянным дном тарелку, сложить EDL полосы прямо на блюдо, быстро снять как можно больше изрешение, то ленту вниз и сухожилий использование водостойкого скотча, и убедитесь, что лента является жесткой. Вымойте волокна сначала с 0 Ca 2 + раствор, а затем с 2,5 мМ Ca 2 + раствор в 2 раза. Если волокно гипер-контракты и повреждения заметить, отказаться от волокна.
- При необходимости волокно можно выращивать до 96 часов, что позволяет генетических манипуляций. Вымойте волокна 3 раза с полной культуральной среде и добавьте 2 мл среды на блюдо, место в 5% CO 2 и 37 ° C инкубатора. Перед каждым экспериментом, изучить мышечных волокон и отбросить те, кто не ясно страты или с признаками заражения, или с признаками повреждения, такие как контрактура сарколеммы мембраны. Хорошо волокон реагировать на KCl, электрической стимуляции и стимуляции кофеином.
- Одноместный мышечные волокна промывали 3 раза промывочного раствора № 1 и купались в внутриклеточных-скинов, как решение с 500 мкМ Род-5N и 0,5 мМ Ca 2 + в течение 5 мин.
- Использование вольфрамовой иглы присоединяется к контактным держатель, механически коже волокна под стереомикроскоп, позволяя поперечные трубочки (TT), чтобы автоматически пломбу, и для перехвата Род-5N сопряженной с Са 2 + в ТТ, мыть кожей волокон в два раза с моющим раствором № 2. Механический процесс воплощения в оптимальных случаях, когда менее чем 25% от ширины ячеек удаляется в процессе шкуры.
- Чтобы загрузить SR, кожей волокон инкубируют с скинов раствор, содержащий 20 мкм Fluo-5N утра в течение 1 часа при комнатной температуре, а затем обширные моет использованием моющего раствора № 2, и инкубировать в течение дополнительных 30 минут, чтобы позволить полную деэтерификации на красителе.
- Через 30 мин кожей волокон визуализируются при 60X Цель конфокальной микроскопии. Флуоресцентные изображения приобрели на длинах волн соответствующие красители (возбуждение при 543 нм и излучения более 570 нм для Род-5N, возбуждение при 488 нм и эмиссии на 530-560 нм для Fluo-5N). Регидополнений интереса (трансформирования) выбираются для каждого красителя загруженных районах.
- Экспериментальный протокол выглядит следующим образом: TT-загрузки решение в течение 120 с, SR-загрузки решение в течение 120 с, SR-истощение решение с 400-750 до разрушающих SR Ca 2 + магазине. Во время этого процесса, изменения в Род-5N интенсивности (TT Ca 2 +) и Fluo-5N интенсивности (SR Ca 2 +), отражаются, создавая определения времени хода относительной флуоресценции изменений в TT и SR. Средние значения интенсивности флуоресценции из нескольких волокон в дальнейшем анализе. Максимальная интенсивность нагрузки в конце TT / SR-нагрузки нормированы на 100%.
5. Представитель Результаты
Мы рассмотрели SOCE деятельности в KYSE-150 ячеек с помощью внутриклеточного Са 2 + измерений (рис. 2.). Использование ППП в качестве репортера, мы могли бы выбрать отдельные клетки трансфицированных плазмиды, содержащие конкретные ShRNA против orai1, ген, кодирующий SOCE сhannel. По сравнению с клетками трансфицированных плазмиды, содержащие борьба ShRNA (черная линия), сбивание Orai1 белка приводит к снижению активности SOCE (красная линия).
SOCE в KYSE-150 клеток было подтверждено с Mn 2 + закалка анализа (рис. 3.). Длине волны возбуждения 360 нм сообщает изобестической точки Фура-2, где флуоресценции не зависит от концентрации Ca 2 +. После TG полностью исчерпана ER Ca 2 + магазины, перфузии Mn 2 + приводит к значительному снижению флуоресценции. В целом деятельность SOCE можно судить по снижению скорости Фура-2 интенсивность флуоресценции с более крутой наклон, что свидетельствует о более активном SOCE, в то время как мелкие склоне смысл менее активных SOCE. Наклон флуоресценции снижение в 2-APB обработанные клетки оказались гораздо мельче, который показал, что SOCE деятельность была блокирована этого соединения. Mn2 + закалка ставки определяется по записи первых 10 секунд, где тушение еще в линейном диапазоне без насыщения.
Аналогичная Mn 2 + закалка анализ был выполнен в мышцах (рис. 4.). В этом случае Mn 2 + была применена вместе с ТГ. Хотя Т. был истощения SR Ca 2 + магазины, флуоресценция склоне закалки постепенно менялся, пока не достиг своей максимальной скорости. Сигмоидального кривой указывает на градуированной активации SOCE в этих экспериментальных условиях.
Здоровый нетронутым один мышечных волокон в культуре, показало четкую и равномерную страты, никаких признаков загрязнения, и нет никаких признаков сокращения вызванного повреждения. Эти волокна были в состоянии заключить в ответ на электрическую стимуляцию или деполяризующего решений. При конфокальной микроскопии, кожу волокна захвата Род-5N красителя в купе TT показал характерный млекопитающих картина дублета (визуальномическое, реализующееся в красный канал). После загрузки с Fluo SR-5N А.М., типичный перемежается SR картина была видна (в канале зеленого цвета). После перфузии кожей волокна с TT / SR загрузки решение, интенсивности флуоресценции и Род-5N и Fluo-5N увеличилось, при перфузии раствором истощение SR, флуоресценция уровней в отделение СР и купе TT начали снижаться, что указывает на тесную связь между SR Ca 2 + истощение магазин и SOCE активации, соответственно (рис. 5.).
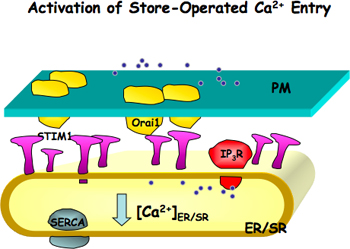
Рисунок 1. Активация магазина управлением вход Са 2 + (SOCE). Orai1, канал поры формирования блока, находится на мембране (ПМ) и STIM1, Ca 2 + датчик, расположенный на эндоплазматического или саркоплазматического ретикулума (ER / SR) мембран. Когда ER / SR Ca 2 + магазины сводятся либо из-за блокирования ER / SR Ca 2 + насос (SERCА) и Са 2 + освобождение через IP 3 рецепторов или рианодиновых рецепторов, STIM1 активирована. Активированный STIM1 молекулы образуют патчи и вызывать агрегацию Orai1, что в дальнейшем приводит активации SOCE.
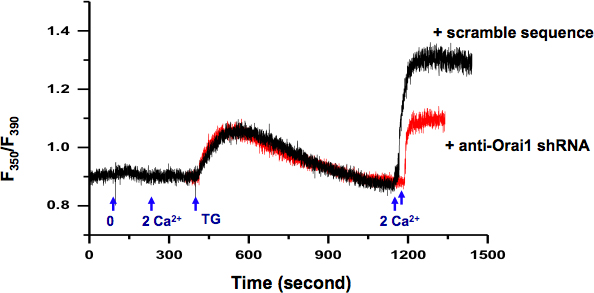
Рисунок 2. Измерение внутриклеточного Са 2 + в KYSE-150 клеток. Обмен внеклеточной решение от 0 Са 2 + (0,5 ммоль EGTA) до 2 мм Са 2 + не побуждать какое-либо изменение внутриклеточного Са 2 +. 5 мкМ ТГ в 0 Са 2 + ванна решение индуцированных пассивный ER Ca 2 + релизе. После того, как Р. Са 2 + магазины были исчерпаны (> 10 мин), добавление внеклеточного Са 2 + (2 мМ) активированный устойчивого внутриклеточного Са 2 + через повышение SOCE, который может быть заблокирован ингибиторами SOCE, например, SKF-96365 и 2 - APB (данные не показывают). Клетки трансфицированных плазмиды, содержащие ShRNA именно противorai1 (красный) продемонстрировали значительно сократить SOCE, чем клетки трансфицированных борьба последовательность (черный).
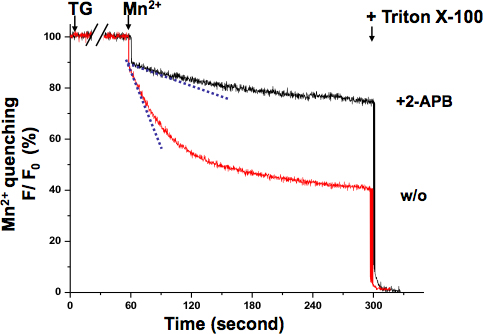
Рисунок 3. Mn 2 + закалка из анализа SOCE в KYSE-150 клеток. Тушение Фура-2 флуоресценции Mn 2 + (0,5 ммоль) измерялось в Ca 2 +-независимой длины волны возбуждения Фура-2 (360 нм). Клетки обрабатывали 5 мкМ ТГ в течение 10 минут, чтобы полностью разрушают ER Ca 2 + магазины. Распад склоне Фура-2 флуоресценции при Mn 2 + дополнение (пунктирные линии, в течение первых 10 сек) представлены активации SOCE, которая была выражена в процентах снижение флуоресценции в единицу времени (в качестве начального значения 100%). Максимально закаленных флуоресценции была создана в конце эксперимента лизиса клеток с 0,1% Тритон Х-100 (0%). Клетки обрабатывали 2-APB (75 мкм) продемонстрировали более мелкихсклон, предлагая SOCE заблокирован этого соединения в KYSE-150 клеток.
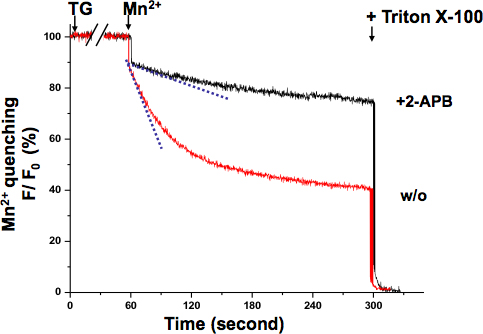
Рисунок 4. Адаптированная активации SOCE в мышечных клетках выявлены Mn 2 + закалка анализа. Активация SOCE может быть зарегистрирован в то время как Т. был истощения SR Ca 2 + магазины. Одновременное применение Mn 2 + (0,5 мм) и ТГ (20 мкм), индуцированный градуированный и сигмоидального снижение внутриклеточного Фура-2 флуоресценции (голубая пунктирная линия, чтобы показать самое быстрое тушение точка), который отличался от первоначального Mn 2 + закалка скорость (синяя линия тире). Mn 2 + закалка склон остался почти таким же, как базального уровня в клетках, обработанных 2-APB (75 мкм), что свидетельствует о SOCE было законсервировано.
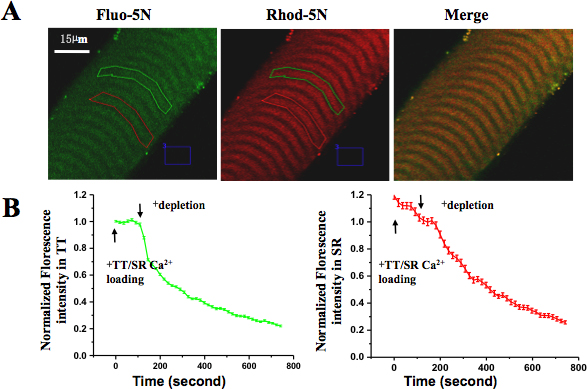
Рисунок 5. Пространственно и временно решен в SOCE кожей мышечных волокон. (A) RhОД-5N соль загружают в TT и Fluo-5N А.М. был загружен в SR. (B) После применения Ca 2 + истощение решение, флуоресценции и в TT и SR отделения снизился. Потеря Fluo-5N флуоресценции указанных быстро выпустили SR Ca 2 + содержание и потери Род-5N флуоресценции предложил активации SOCE.
Обсуждение
Несмотря на возбуждение волн для Ca 2 +-связывающих и Ca 2 + бесплатный Фура-2, 340 нм и 380 нм, соответственно, лучшее соотношение динамического диапазона Фура-2 Ca 2 + измерения концентрации может произойти и на других длинах волн в той или иной микроскопа. Такие изменения в длине волны, как правило, в связи с изменениями в оптическом тракте с добавлением различных оптических компонентов. В этом исследовании возбуждения волн для Фура-2 были определены 350 нм и 390 нм, выполняя спектральный анализ Фура-2 флуоресценции.
Внутриклеточного Са 2 + уровня в цитозоле результаты баланс из нескольких источников, в том числе внутриклеточного Са 2 + релизе, внеклеточный Са 2 +, а также Ca 2 + механизм исключения на мембране ER и плазмы. Для выделения однонаправленных SOC-опосредованной Са 2 + из внутриклеточных приток Ca 2 + и освобождение Са 2 + дрожusion, Mn 2 + закалка анализ может быть использован. Mn 2 +, как известно, чтобы иметь возможность проникать в клетки через SOCE, но непроницаемой для экструзии поверхности мембраны или ER поглощение Са 2 + насосов. Таким образом, тушение флуоресценции представляет собой измерение однонаправленной Mn 2 + в клетки поток, который оценивает степень активации SOCE. Mn 2 + закалка анализ выполняется на изобестической точки, при такой длине волны Фура-2 интенсивность флуоресценции не зависит от концентрации Са 2 +. Изобестической точки для каждой системы должны быть определены спектр сканирования. Кроме того, Mn 2 + тушение могут быть записаны скорректированный флуоресценции при любых двух длинах волн таким образом, что окончательное значение не зависит от концентрации Са 2 + 13.
Чтобы получить пространственную и временную информацию о деятельности SOCE в скелетных мышцах, мы использовали двойные краски методом, который позволяет одновременно measuremeП о SOCE деятельности и SR Са 2 + в кожа взрослого млекопитающего EDL мышечных волокон. Корреляция между изменениями в СР Са 2 + содержание и SOCE деятельности могут быть построены, чтобы указать порог и чувствительность SOCE активации к истощению SR Ca 2 + хранения. TT-загрузки Решение оптимизировано дополнительно загрузить Т-трубочки с Са 2 + и для грунтования Т-канальцев и SR-загрузки решения, направленные на содействие максимальной SR Ca 2 + загрузки и дополнительно загрузить Т-трубочки с ~ 500 мкМ Са 2 +. FCCP входит в TT / SR-загрузки решения и SR-слой решение по ликвидации последствий от митохондрий.
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Мы благодарим доктора Ноа Вайследер для чтения и редактирования этой рукописи. Эта работа была поддержана Исследовательские гранты Фонда UMDNJ 62-09 в ZP, Американской ассоциации сердца SDG2630086 на XZ, 0535555N БМ, и Национальными Институтами Здоровья RC2AR058962-01 Мб.
Материалы
Таблица специфических реагентов и оборудования:
| Name | Company | Catalog Number | Comments |
| Название реагента | Компания | Номер по каталогу | Комментарии |
| RPMI 1640 | Mediatech | 10-040-CV | |
| Хэма F-12 | Mediatech | 10-080-CV | |
| DMEM | Mediatech | 10-013-CV | |
| Блюдо со стеклянным дном | Маттек | P35G-1.5-14-C | |
| Фура-2 AM | Invitrogen (Molecular Probes) | F1221 | -20 ° C, уплотнения плотно, защищенном от света, растворяется в ДМСО |
| Fluo-5N утра | Invitrogen (Molecular Probes) | F14204 | -20 ° C, уплотнения плотно, защищенный от лIGHT |
| Род-5N | Invitrogen (Molecular Probes) | R14207 | -20 ° C, уплотнения плотно, защищенном от света |
| Кварцевые кюветы | Starna клетки | 3-Q-10 | |
| тапсигаргин | Tocris | 1138 | |
| 2-Aminoethoxydiphenylborane (2-APB) | Tocris | 1224 | |
| N-бензил-п-толуол сульфаниламидами (BTS) | Sigma-Aldrich | 435600 | |
| Коллагеназы I типа | Сигма | C0130 |
Оборудование:
- Spectrofluorometer (Photon Technology International, Нью-Джерси): ксеноновая дуговая лампа, управляемая компьютером высокоскоростной монохроматор случайный доступ, кюветы на основе монохроматора излучение, Nikon TE-200 перевернутый флуоресценции микротрещине, S Fluor 40x/1.30 нефти цели, ФЭУ детекторов.
- Лазерное сканирование конфокальной микроскопии (BioRad Radiance2100): 453/477/488/514 аргоновый лазер, гелий-неоновый лазер 543nm, Nikon TE2000 инвертированного микроскопа, 60X цель (NA 1.4, масло).
- Стереомикроскопа с увеличением мощности> 100 (Zeiss Apo Stemi SV11).
Ссылки
- Parekh, A. B., Putney, J. W. Store-operated calcium channels. Physiol. Rev. 85, 757-810 (2005).
- Ma, J., Pan, Z. Retrograde activation of store-operated calcium channel. Cell Calcium. 33, 375-384 (2003).
- Feske, S. ORAI1 and STIM1 deficiency in human and mice: roles of store-operated Ca2+ entry in the immune system and beyond. Immunol. Rev. 231, 189-209 (2009).
- Parekh, A. B. Store-operated CRAC channels: function in health and disease. Nat. Rev. Drug Discov. 9, 399-410 (2010).
- Pan, Z. Dysfunction of store-operated calcium channel in muscle cells lacking mg29. Nat. Cell Biol. 4, 379-383 (2002).
- Shin, D. W. A retrograde signal from calsequestrin for the regulation of store-operated Ca2+ entry in skeletal muscle. J. Biol. Chem. 278, 3286-3292 (2003).
- Ma, J., Pan, Z. Junctional membrane structure and store operated calcium entry in muscle cells. Front Biosci. 8, d242-d255 (2003).
- Pan, Z., Damron, D., Nieminen, A. L., Bhat, M. B., Ma, J. Depletion of intracellular Ca2+ by caffeine and ryanodine induces apoptosis of chinese hamster ovary cells transfected with ryanodine receptor. J. Biol. Chem. 275, 19978-19984 (2000).
- Hirata, Y. Uncoupling store-operated Ca2+ entry and altered Ca2+ release from sarcoplasmic reticulum through silencing of junctophilin genes. Biophys. J. 90, 4418-4427 (2006).
- Zhao, X. Enhanced resistance to fatigue and altered calcium handling properties of sarcalumenin knockout mice. Physiol. Genomics. 23, 72-78 (2005).
- Zhao, X. Azumolene inhibits a component of store-operated calcium entry coupled to the skeletal muscle ryanodine receptor. J. Biol. Chem. 281, 33477-33486 (2006).
- Launikonis, B. S., Barnes, M., Stephenson, D. G. Identification of the coupling between skeletal muscle store-operated Ca2+ entry and the inositol trisphosphate receptor. Proc. Natl. Acad. Sci. U.S.A. 100, 2941-2944 (2003).
- Shuttleworth, T. J. Temporal relationships between Ca2+ store mobilization and Ca2+ entry in an exocrine cell. Cell. Calcium. 15, 457-466 (1994).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены