Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Электрическое поле контролируемых Режиссер миграции нервных клеток предшественников в 2D и 3D среде
* Эти авторы внесли равный вклад
В этой статье
Резюме
Этот протокол свидетельствует о методах, используемых для создания 2D и 3D окружение в специально разработанных камер electrotactic, которые могут отслеживать клетки В естественных условиях / экс естественных условиях С помощью замедленной записи на одном уровне клетки, для того, чтобы исследовать гальванотаксиса / анодной и других клеточных ответов на постоянном токе (DC) электрического поля (EFS).
Аннотация
Эндогенные электрического поля (EFS) встречаются в природе в естественных условиях и играют важную роль в ткани / органа развитие и возрождение, в том числе и центральной нервной системы 1,2. Эти эндогенные КВ генерируются клеточной регуляции ионного транспорта в сочетании с электрическим сопротивлением клеток и тканей. Было сообщено, что прикладная EF лечение может способствовать функциональной ремонта повреждений спинного мозга у животных и человека 3,4. В частности, EF-направленной миграции клеток было продемонстрировано в разнообразные типы клеток 5,6, в том числе нервных клеток предшественников (НПС) 7,8. Применение постоянного тока (DC) КВ не является общедоступным техника в большинстве лабораторий. Мы описали подробные протоколы для применения КВ постоянного тока для культур клеток и тканей ранее 5,11. Здесь мы представляем видео демонстрации стандартных методов, основанных на рассчитываются поля создать 2Dг 3D-среды для NPC, и исследовать клеточный ответ на стимуляцию EF как в одной ячейке условий роста в 2D, так и органотипической спинной кусок шнура в 3D. Спинной cordslice является идеальным ткани получателя для изучения NPC бывших естественных поведения, после трансплантации, потому что цитоархитектоники организации ткани хорошо сохранились в этих культурах 9,10. Кроме того, это бывшие модели естественных также позволяет процедуры, которые технически невозможно отследить клеток в живом использование покадровой записи на одном уровне клетки. Крайне важно оценить поведение клетки не только в 2D-среде, но и в 3D органотипической условие, которое mimicks в естественных условиях окружающей среды. Эта система позволит изображений с высоким разрешением использования покровного стекла на основе блюд в ткани или органе культуры с 3D-слежения одного миграции клеток в пробирке и бывших естественных условиях и может быть промежуточный этап перед переходом на в VIВ.О. парадигм.
протокол
1. Нейронные изоляции клеток-предшественников
- Проанализируйте все мозги от E14-16 мышей и место в холодную DMEM/F12 базальной среде. Удалите все мозговые оболочки под микроскопом анатомические и передачу в мозг на 35 мм блюдо Петри.
- Используйте тонкий пинцет, чтобы механически отделить мозг в ткань фрагментов и передать их в 15 мл трубку, затем центрифугировать образцы при 800 оборотов в минуту в течение 3 минут, чтобы удалить мусор.
- Добавить DMEM/F12 содержащие bFGF и EGF и растереть с 1 пипетка мл.
- Передайте клеточной суспензии через ячейку фильтра для получения суспензии отдельных клеток.
- Пластина клеток в колбах на 2-5 х 10 4 клеток / мл, а затем выполнить полный среднего меняются каждые 3 дня, а переход клеток каждые 6 дней.
- После того, как по крайней мере 5 проходов, дайджест нейросферы к одной клетки с помощью трипсина и ЭДТА и растут на poly-D-lysine/laminin-coated камеры electrotactic (полученного, как описано ниже в 2). Использование растущей среде, содержащей N2-добавки,bFGF и EGF во все времена для поддержания свойств NPC.
2. Подготовка electrotactic камеры
- Подготовить 22 х 11 мм полоски стекла путем деления автоклаве 22 х 22 мм, толщина покровных № 1 в половине помощью алмазной ручкой.
- Создать самостоятельный стекла и внутренних размеров 22 х 10 мм при склеивании вместе четыре вертикально стоящий 22 х 11 мм полоски высокого вакуума силиконовой смазкой. Позвольте скважины полностью высохнуть и затвердеть в течение ночи.
- На следующий день, подключить два 22 х 11 мм полосы стекла, параллельно друг другу, оставляя зазор 10 мм, на базе 100 мм культуры блюдо использованием силиконовой смазкой. Печать от региона между этими полосками, поставив 22 х 22 мм покровным стеклом в каждом конце, прикрепленные ко дну сосуда с жиром с трех сторон, но не ближе к центру.
- Положите стекло хорошо подготовлены в шаге 2,2 на крышке скользит, так что внутренние стены создают замкнутое пространство для посеваклеток на дне тарелки. Водонепроницаемый все стыки с силиконовой смазкой. Пальто этой области ограничивались последовательно с поли-D-лизин то ламинин: добавьте 1 мл поли-D-лизина в камеру и оставьте на 5 минут, чтобы поли-D-лизин привязать к нижней части пластины; мыть камеру стерильной PBS в два раза, затем разбавить ламинин в стерильном PBS чтобы получить 20 мкг / мл и используют для покрытия нижней части пластины. Оставить при комнатной температуре в течение ночи.
- На следующий день, урожай клеток и подготовить 1 мл суспензии, содержащей 1 х 104 клеток. Удалить ламинин из стекла хорошо, что позволяет ему полностью высохнуть, а также заменить 1 мл клеточной суспензии. Поместите блюдо в инкубаторе при температуре 37 ° С в течение минимум 4 часов, чтобы для крепления.
- Как только клетки достаточно сливной удалить все средние из камеры. Аккуратно снимите стекло хорошо. Форма крыши над клеток тщательно крепления, с силиконовой смазкой, автоклавного 22 х 22 мм стекло покровноемост между двумя 22 х 11 мм полосы. Крышка клетки с несколькими каплями средней, чтобы избежать высыхания.
- Форма изолированного резервуара среде на каждом конце камеры путем создания двух водонепроницаемых силиконовой смазки барьеры, которые работают от одного края блюда к другому, над камерой на крыше. Заполнить камеру со свежей среды, обеспечение проточной из одной среды резервуара в другой. Вернуться блюдо инкубаторе в течение 12 часов, чтобы для восстановления клеток.
3. Применение электрического поля в камере electrotactic
- Подготовить крышкой, чтобы покрыть блюдо сверление двух отверстий, один расположен над каждым резервуаром миграции камеры.
- Заменить все среды в камере с культуральной среде, содержащей 25 мМ буфера HEPES и передать блюдо с контролируемой температурой системы визуализации. Настройка параметров эксперимента для покадровой и многопозиционные записи. Выровнять камеру так, чтобы катод и анодна левой и правой, соответственно, для того, чтобы вектор EF проходит горизонтально, если смотреть вниз, под микроскопом и записывается в системе формирования изображений.
- Заполните два стакана с раствором Штейнберг (58 мМ NaCl, 0,67 мМ KCl, 0,44 мМ Ca (NO 3) 2 4H 2 0 1,3 мм MgSO 4 .7 H 2 0 и 4,6 мм Trizma базы, рН 7,4). Подключите отдельный стакан для каждого среднего водоеме с использованием заранее подготовленных стеклянных мостов (стеклянных трубок ~ 13 см в длину и ~ 3 мм в диаметре, и согнуты в U-образной при нагревании в пламени Бунзена), наполненных 2% (в / г) Steinberg's-агар решение, проходя через отверстия в крышке. Заполните электрической цепи путем размещения Ag / AgCl электроды подключены к источнику постоянного тока в каждый стакан раствора Стейнберга.
- Установить напряжение на диск питания 0 и включите прибор. Измерьте напряжение на electrotactic камеры при включении напряжения до набора, с помощью вольтметра, а также настроить в соответствии с экспериментальным требованиям.
- Начать покадровой записи. Выполните среднего изменения и корректировки напряжения, при необходимости, каждый час. Свежий среды, наркотики, или химические вещества могут быть добавлены к водохранилищам по мере необходимости. Когда среда выполнения изменений, два варианта может рассматриваться как показано ниже:
- Вариант № 1 - Для приостановки записи со сжатием времени временно, осторожно снимите стекло мосты с камерой, чтобы избежать возмущающих крышки крышки использовать стерилизованное пипетки Пастера мягко заменить все средние свежей средой и поставил стакан мосты назад, а затем возобновить запись.
- Вариант № 2 - Кроме того, на заказ крышка крышка с 4 отверстиями (два расположены на каждом резервуаре миграции камеры) также может быть использован для средних целью изменения. Два стекла для подключения мостов, два других для изменения среды. Вариант 2 позволяет осуществлять непрерывную запись без вмешательства в среду изменения.
4. Подготовка органотипической спинной кусок кабеля
- Проанализируйте lumbар спинной мозг 2 недели старым C57 BL / 6 мышей.
- Нарежьте спинного мозга в 500 мкм секций вертолет ткани McIlwain.
- Отдельные кусочки под микроскопом анатомические и выберите кусочки с неповрежденными сагиттальной / осевой структуры спинного мозга.
- Пластина ломтики в 35 мм чашку Петри, содержащую 30 мкл Матригель и разместить их как можно ближе к центру, как возможно, и поддерживать их в 5% СО 2 инкубатор при 37 ° С в течение 30 мин до Матригель белка самостоятельно собираться для производства тонкая пленка, которая покрывает поверхность среза спинного мозга. Очень важно, чтобы убедиться, что Матригель была собрана полностью, инкубировать чашки Петри при 37 ° C в течение еще 30 минут, если необходимо.
- Добавить 4-6 мл DMEM/F-12 среде, содержащей 25 мМ HEPES буфера и 15-20% эмбриональной телячьей сыворотки очень осторожно, чтобы избежать потока среды непосредственно на срез. Убедитесь, что кусок не полностью погружен в среду, оставляя на поверхности эксплантов также подвергаютсявоздуха. Изменение средних раза в неделю.
5. Введение Hoechst 33342 помечены НПС в органотипической спинной кусок кабеля
- Подготовка NPC подвески на 1 × 10 6 кл / мкл.
- Предварительная инкубация суспензии клеток в среде с 5 мкМ Hoechst 33342 в течение 30 мин.
- Используйте капиллярной трубке стекла microinject 2 мкл суспензии в спинной кусок шнура медленно под микроскопом. Убедитесь, что капилляр стекло проходит через матригелем (розовая часть под микроскопом) и достичь внутренней спинной кусок кабеля (серые ткани под микроскопом), остаются в спинной кусок кабеля, по крайней мере 30 секунд, чтобы избежать клеточной суспензии под колеса. Поставьте чашку Петри с спинной кусок шнура в инкубатор (37 ° C 5% CO 2) и оставьте его на ночь.
- На следующий день, применять EF 500 мВ / мм в спинной кусок шнура содержащие Hoechst 33342 меченных НПС в electrotactic камеры (с помощью методов, описанных в3).
6. Представитель Результаты
Когда NPC, подвергаются ряду физиологических КВ они показали высокую направлены миграции клеток к катоду (рис. 1). То же наблюдение также было сделано на одном уровне ячейки органотипической спинного мозга часть бывших естественных модели, 3D имитации окружающей среды в естественных условиях (рис. 2).
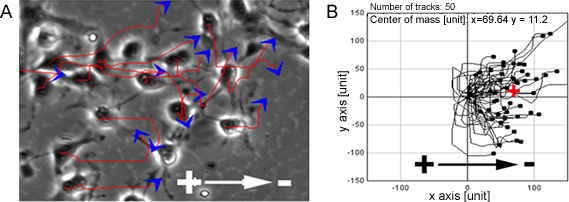
Рисунок 1. НПС показать направлены миграции в КВ. ПК показал высокую направлена миграция в сторону катода при воздействии на КВ, красные линии и синие стрелки показывают направление траектории и клеточного движения (A). B показывает пути миграции NPC. Бар: 50 мкм.
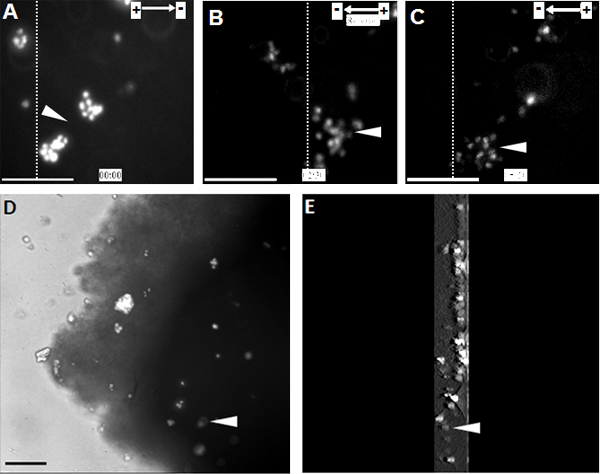
Рисунок 2. Пересаженные НПС показать направлены миграции к катоду в органотипической спинной кусок кабеля . (A) НПС помечены Hoechst 33342 были пересажены в органотипической спинной кусок шнура на начальном этапе лечения EF. НПС мигрировали направленно в сторону катода в течение 2,5 часов, после чего полярность EF было отменено (B). Изменение полярности EF вызвало резкий разворот в анодной к новым катодом (C). (D) Изображение пересаженных НПС в спинной кусок шнура в конце покадровой записи. (E) 3D-реконструкция НПС пересаженные в спинной кусок шнура. 3D сканирование разделов было 300 мкм в толщину, начиная с середины и заканчивается в нижней части среза. Пунктирные линии показывают относительное положение одного и того же населения трансплантированных клеток в начале, разворот, и в конце лечения EF (А - С, соответственно). Стрел указывают же население Hoechst 33342 меченых NPC. Бар: 50 мкм.
Обсуждение
Протоколов, которые мы используем, на основе предыдущих исследований 5,11. Используя эти методы, стабильной культуры и электрический ток условиях может быть обеспечена при применении EF через агар мостов, решение Steinberg, и Ag / AgCl электродов, в клетки или кусочки культивировали в специ?...
Раскрытие информации
Нам нечего раскрывать.
Благодарности
Эта работа выполнена при финансовой поддержке Королевского общества СПС грант UF051616, Великобритания и Европейский исследовательский совет StG грант на 243 261 BS. Работа в лаборатории МЗ также поддерживается Калифорнийского института регенеративной медицины грант RB1-01417.
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента | Компания | Номер по каталогу | Комментарии |
| FGF-основной рекомбинантного человеческого | Invitrogen | PHG0026 | 20 нг / мл |
| ЭФР рекомбинантного человеческого | Invitrogen | PHG0311 | 20 нг / мл |
| N2-дополнения (100X) жидкости | Invitrogen | 02048 | |
| DMEM/F12 среды (высокая глюкоза) | Invitrogen | 31330-095 | |
| Поли-D-лизин | Millipore | А-003-E | |
| Природные мыши Ламинин | Invitrogen | 23017-015 | |
| Рост фактора уменьшен базальной мембраны Matrix (Матригель) | BD Biosciences | 354230 | |
| HEPES буфера | Гибко | 15630 | |
| McIlwain ткани вертолет | Михайличенко лаборатории Engineering Co Ltd | TC752-PD | |
| Dow Corning высокого вакуума силиконовой смазки | Sigma-Aldrich | Z273554 |
Ссылки
- Huttenlocher, A., Horwitz, A. R. Wound healing with electric potential. N. Engl. J. Med. 356, 303-303 (2007).
- McCaig, C. D., Rajnicek, A. M., Song, B. Controlling cell behavior electrically: current views and future potential. Physiol. Rev. 85, 943-943 (2005).
- Borgens, R. B., Jaffe, L. F., Cohen, M. J. Large and persistent electrical currents enter the transected lamprey spinal cord. PNAS. 77, 1209-1209 (1980).
- Shapiro, S., Borgens, R., Pascuzzi, R. Oscillating field stimulation for complete spinal cord injury in humans: a phase 1 trial. J. Neurosurg. Spine. 2, 3-3 (2005).
- Zhao, M., Song, B., Pu, J. Electrical signals control wound healing through phosphatidylinositol-3-OH kinase-gamma and PTEN. Nature. 442, 457-457 (2006).
- Yao, L., Shanley, L., McCaig, C. Small applied electric fields guide migration of hippocampal neurons. J. Cell. Physiol. 216, 527-527 (2008).
- Li, L., El-Hayek, Y. H., Liu, B. Direct-current electrical field guides neuronal stem/progenitor cell migration. Stem Cells. 26, 2193-2193 (2008).
- Meng, X., Arocena, M., Penninger, J. PI3K mediated electrotaxis of embryonic and adult neural progenitor cells in the presence of growth factors. Exp. Neurol. 227, 210-210 (2011).
- Bonnici, B., Kapfhammer, J. P. Bone marrow stromal cells promote neurite extension in organotypic spinal cord slice: significance for cell transplantation therapy. Neurorehabil. Neural Repair. 22, 447-447 (2008).
- Shichinohe, H., Kuroda, S., Tsuji, S. Bone marrow stromal cells promote neurite extension in organotypic spinal cord slice: significance for cell transplantation therapy. Neurorehabil. Neural Repair. 22, 447-447 (2008).
- Song, B., Gu, Y., Pu, j. Application of direct current electric fields to cells and tissues in vitro and modulation of wound electric field in vivo. Nature Protocol. 2, 1479-1479 (2007).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены