Method Article
Электрофизиологические характеристика GFP-выражая клеточных популяций в Неповрежденный Retina
В этой статье
Резюме
В этой статье показаны записи отдельных клеток от флуоресцентной меткой нейронные популяции в нетронутой сетчатку мыши. При использовании двух-фотонного возбуждения инфракрасными transgenetically меченых клеток были направлены для патч-зажим записи, чтобы изучить их свете ответов, восприимчивым свойств полей и морфологии.
Аннотация
Studying the physiological properties and synaptic connections of specific neurons in the intact tissue is a challenge for those cells that lack conspicuous morphological features or show a low population density. This applies particularly to retinal amacrine cells, an exceptionally multiform class of interneurons that comprise roughly 30 subtypes in mammals1. Though being a crucial part of the visual processing by shaping the retinal output2, most of these subtypes have not been studied up to now in a functional context because encountering these cells with a recording electrode is a rare event.
Recently, a multitude of transgenic mouse lines is available that express fluorescent markers like green fluorescent protein (GFP) under the control of promoters for membrane receptors or enzymes that are specific to only a subset of neurons in a given tissue3,4. These pre-labeled cells are therefore accessible to directed microelectrode targeting under microscopic control, permitting the systematic study of their physiological properties in situ. However, excitation of fluorescent markers is accompanied by the risk of phototoxicity for the living tissue. In the retina, this approach is additionally hampered by the problem that excitation light causes appropriate stimulation of the photoreceptors, thus inflicting photopigment bleaching and transferring the retinal circuits into a light-adapted condition. These drawbacks are overcome by using infrared excitation delivered by a mode-locked laser in short pulses of the femtosecond range. Two-photon excitation provides energy sufficient for fluorophore excitation and at the same time restricts the excitation to a small tissue volume minimizing the hazards of photodamage5. Also, it leaves the retina responsive to visual stimuli since infrared light (>850 nm) is only poorly absorbed by photopigments6.
In this article we demonstrate the use of a transgenic mouse retina to attain electrophysiological in situ recordings from GFP-expressing cells that are visually targeted by two-photon excitation. The retina is prepared and maintained in darkness and can be subjected to optical stimuli which are projected through the condenser of the microscope (Figure 1). Patch-clamp recording of light responses can be combined with dye filling to reveal the morphology and to check for gap junction-mediated dye coupling to neighboring cells, so that the target cell can by studied on different experimental levels.
протокол
Следующее описание предполагает, что экспериментатор имеет общее представление о структуре сетчатки, патч-зажим записи и двухфотонной микроскопии. Полезные сведения по созданию и организации работы патч-зажим установки и двухфотонного изображения системы см. [7-12].
1. Животные и подготовки ткани
- Держите мышь темно-адаптирован для не менее 3 ч. В то же время, подготовить 1-2 л внеклеточный раствор, состоящий из (в мм) 125 NaCl, 2,5 KCl, CaCl 1 2, 1.6 2 MgCl, 25 NaHCO 3, 10 D-глюкозы и уравновешивать его рН 7,4 от отравления газом с карбогена (5% СО 2 в O 2) при комнатной температуре.
- Эвтаназии мыши в герметичных камер СО 2 передозировки следует шейки дислокации. Эта процедура и следующие шаги должны быть выполнены в темноте. Используйте тусклый длинноволновом освещении (мы блокируем коротких длин волн от холодного источника света 690 нм-longpasс фильтром) для поддержки личного видения, сохраняя при этом глаза животного темно-адаптированные (мыши есть только плохое зрение в красную часть спектра света). Для работы в полной темноте использовать инфракрасную подсветку (> 800 нм) и носить очки ночного видения.
- Выявлять глаза с парой изогнутых ножниц радужной оболочки и передавать их на блюдо внеклеточной решение под рассекает микроскопом.
- Удалить роговицы и ресничного тела, открыв глаза лампы вдоль Serrata ора (граница между сетчаткой и цилиарного тела) с парой весной ножницы (сначала с помощью ланцета пробить отправной точкой для резки). Выньте линзы и аккуратно отделить сетчатку от пигментного эпителия. Если ориентация сетчатка имеет решающее значение для вашего исследования, указывают на то, как в работе [12]. Вырезать зрительного нерва между сетчаткой и пигментным эпителием и удалить сетчатку от наглазник. Обратите внимание на направление сетчатки поверхности: внутри свернувшейся сетчатки ganglионной ячейки стороны; снаружи фоторецепторов стороны.
- Удалить из стекловидного внутренней поверхности сетчатки, осторожно потянув его с помощью деревянной зубочистки. Для этой цели использовать небольшой объем внеклеточной решение, которое охватывает только сетчатки. Стекловидного прилипает к зубочистку и можно перетаскивать центробежно от сетчатки. Затем, нанесите короткими разрезами вдоль сетчатки периметру для облегчения уплощение тканей.
- Передача сетчатки в записи камеры фоторецепторов стороной вниз, распространение его на стеклянным дном (мы используем тонкой кистью) и обездвижить его с нейлоновыми нанизаны рама из нержавеющей стали. Подготовка второго сетчатки таким же образом, и держать его темно-адаптирована в carboxygenated внеклеточный раствор для последующего использования.
2. Записи
- Установить записи камеры в темноте под вертикальном лазерного сканирующего микроскопа и переливать сетчатки подготовки постоянно (не менее 5 мл / мип) с carboxygenated внеклеточный раствор нагревают до 35 ° C. Микроскопа (также оснащен инфракрасным чувствительных ПЗС-камеры) расположен на амортизирующих воздушных таблицы внутри клетки Фарадея для электронного экранирования. Обложка клетку с непрозрачным занавесом держать подготовку в темноте. Мы также экран выключен свет от компьютерных мониторов красной прозрачной пленкой.
- Tune инфракрасного лазера 850-870 нм или более длинных волнах, переключиться в режим синхронизации состояния и использования двухфотонного возбуждения для визуализации GFP-экспрессирующие клетки. Ослабления излучения лазера использованием фильтры нейтральной плотности контролируется программное обеспечение лазерного сканирования до такой степени, что как раз достаточна для четкого признания флуоресцентные ячейки
- Для патч-зажим записей в текущей зажим режиме микропипетки использовать стекло (мы используем трубы из боросиликатного стекла 1,5 мм и наружным диаметром 0,225 мм, толщина стенки), заполненной внутриклеточного раствора, состоящего из (в мм) 125 К-глюконат, 10 KCl, 0,5 EGT, 10 HEPES, титруют до рН 7,4 с КОН (предоставление пипетки сопротивление около 5 МОм). Обратите внимание, что другие экспериментальные условия, такие как напряжения зажим записи требуется другое решение. Если краситель инъекции желании, добавить флуоресцентного зонда (мы используем 10 мМ Alexa Fluor 594) или молекула примеси (3% Neurobiotin). Вставьте микропипетки в держатель и убедитесь, что электрод сравнения (хлорированная серебряной проволоки) находится в контакте с внеклеточной решение в записи камеры.
- Надавите на микропипетки и целевых GFP-экспрессирующих клетки (мы используем 40-кратного погружения в воду цели; NA 1.25). Amacrine органы ячейки расположены в слое ганглиозных клеток (непосредственно под поверхностью в текущей ориентации сетчатки), а также в проксимальной части внутреннего ядерного слоя (около 55-75 мкм глубоко в стадии подготовки). Перед микропипетки контакт с целевой ячейки, внутренняя пограничная мембрана (оболочка из глиальных endfeet) на сетчатке глазаПоверхность должна быть проникли. Успешное проникновение признан внутриклеточных решение, которое выносится от кончика микропипетки и отделяет внутреннюю пограничная мембрана из основной ткани сетчатки, как можно наблюдать на инфракрасном изображении передачи захваченных ИК-ПЗС-камеры.
- Подход нужную ячейку, сравнивая положение сома из двухфотонного изображение с картиной ИК-ПЗС-камеры, показывающие расположение записи микропипетки. Обратите внимание, что этот шаг не легко достигается и требует некоторой практики, потому что GFP-экспрессирующих клетка должна быть признана в инфракрасной передачи изображения того, чтобы направить микропипетки к нему. Правильная ориентация достигается тогда, когда кончик микропипетки причины рябь на поверхности клеток, которые можно увидеть в двухфотонного изображения. Альтернативой этой процедуре использования флуоресцентного красителя (например, Alexa Fluor 594, 100 мкМ) в внутриклеточных решение раскрыть микропипетки позиции в двухфотонного изображения. Двухфотонного возбуждения инфракрасной обеспечивает достаточную флуоресценции этого красителя, чтобы сделать микропипетки заметны. Для этой цели, корректировать дальность обнаружения в программном обеспечении лазерного сканирования для покрытия также красной флуоресценции.
- Сбросьте давление из микропипетки и получить цельноклеточная патч-зажим конфигурации в текущем зажим режиме. Использовать записи должны дать мембранного потенциала от -50 до -55 мВ и длиться не менее 20 мин.
- Настоящий визуальные стимулы созданы стимуляции программного обеспечения (мы используем QDS Томасом Эйлера, Университет Тюбингена, Германия) 11 о мониторе компьютера. Отрегулируйте пространственного положения стимуляции быть сосредоточены на ячейке записано: Марк ячейки позиции на мониторе показывает передачи изображения ИК-ПЗС-камерой и центром спот-как стимул на него. Tune интенсивности раздражения, вставив фильтры нейтральной плотности на пути луча. Для калибровки монитора спектр и интенсивность см. [14]. Выберите пролонгироватьг interstimulus интервал (например, 15 сек), чтобы избежать адаптации. Включите фотодиод в пути луча, чтобы вести учет времени стимула.
- Начало стимуляции протокол и запись свет ответы (мы используем частоту дискретизации 10 кГц с фильтрацией на уровне 5 кГц для не-пики клеток; для записи шип высокая частота дискретизации 20 кГц, как это рекомендуется). Использование программного обеспечения стимуляции светом для запуска программного обеспечения для записи.
- Для заполнения красителя позволяют флуоресцентные диффузного вещества в ячейке записан в течение 30-45 мин до тщательно втягивания микропипетки из клетки. Будьте осторожны, не вытащить тело клетки. Если не-люминесцентные трассирующими Neurobiotin был использован, он должен визуализации путем связывания со стрептавидином конъюгированных с флуорофора (мы используем стрептавидином Cy3, 1:400 в течение ночи при 4 ° С через 20 мин параформальдегида фиксации сетчатки; на красителях связи Исследования стрептавидин инкубации может быть продлен до 3 г). Кроме того, инъекции могут быть выполнены срезкое электродов (> 100 МОм), когда краситель приводится iontophoretically в пронзил клетки (прямоугольных импульсов: 0.25-1 нА, 100 мс, интервал 100 мс, общее время 3-6 мин).
3. Представитель Результаты:
Следующие результаты исходят из исследования мыши выразив зеленый флуоресцентный белок (GFP) под промотор для тирозингидроксилазы 13,14, фермент, катализирующий ограничение скорости шаг в синтезе катехоламинов (TH:: GFP мыши). На основании яркости GFP-сигнал двух различных клеточных популяций различимы (рис. 2A). Клетки, экспрессирующие GFP выше уровня обладают клеточных тел расположенный во внутреннем ядерном слое (INL, рисунок 2А) или перемещенных в слое ганглиозных клеток (ГКЛ, рисунок 2B) и стратификации в середине внутреннего слоя плексиформные (IPL, рисунок 2C) . Они были определены в качестве 2-го типа клетки 14-16 и может систематически изучать по отношению к морфологии (рис. 3) и избратьrical активности (рис. 4), хотя его плотность населения составляет лишь 250 клеток / мм 2.

Рисунок 1. Схематическое изображение экспериментальной установки. Двухфотонного возбуждения (красная пунктирная путь света) флуорофора-экспрессирующих клеток в сетчатке нетронутыми позволяет визуальной ориентации по микропипетки (зеленого свечения путь). Сетчатки подвергается оптические раздражители проецируется через конденсатор микроскопа (желтый путь света), и клеточные ответы света записываются.
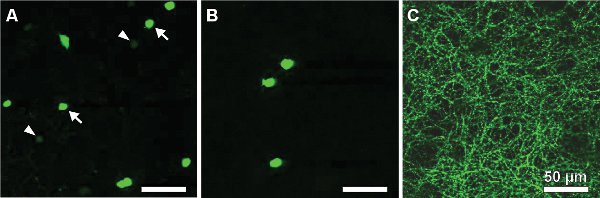
Рисунок 2. GFP-экспрессирующие клетки в сетчатке глаза flatmount из TH:: GFP мыши. Две популяции можно отличить по яркости GFP-сигнала: 1-го типа клеток (клетки Д. А.), расположенный в INL показывает слабую флуоресценцию (см. стрелки) и интенсивно помечены 2 типа клеткис клеточными органов либо в INL (см. стрелки) или перемещенных в ГКЛ (В) и дендритных стратификации в слое S3 в IPL (С). Шкала баров, 50 мкм.
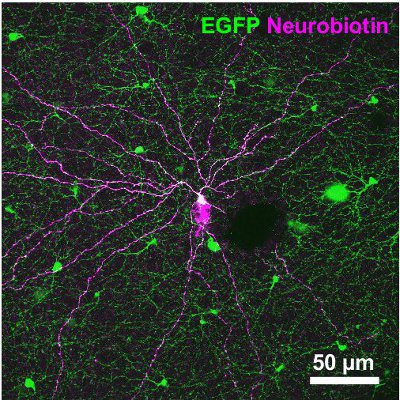
Рисунок 3. Морфология 2-го типа клетка вводили трассирующими Neurobiotin. Трассирующими был впоследствии визуализируется стрептавидином Cy3 связывания (пурпурный). Микрофотографии, который также является изображением сигнала GFP (зеленый), является проекцией изображения стеки покрытие GCL и IPL. Шкала бар, 50 мкм.
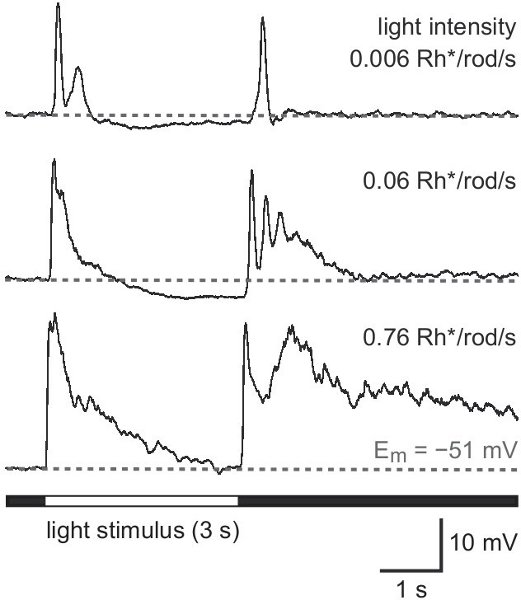
Рисунок 4. Свет ответы 2-го типа клетка находится в GCL. Ответ шаблон белый свет всего месторождения освещения увеличением интенсивности в скотопическое диапазона. Стимул интенсивности дается в photoisomerizations на стержне в секунду (Rh * / стержень / с). Длительном стимулом 3 сек была использована для улучшения различныхионной компоненты в ответ начала стимула (ON ответ) и смещения (OFF ответ).
Обсуждение
Этот метод дает возможность исследовать электрические свойства конкретных нейронов в интактной сетчатки под визуальным руководством, не влияя на адаптационные состояние сетчатки. Она особенно подходит для характеристики клеток, которые в настоящее время довольно слабо изучена из-за низкой плотности населения, как и большинство населения amacrine клеток. Двухфотонного возбуждения позволяет с высоким разрешением и высокой контрастностью изображения, даже из более глубоких частях ткани 17, предпосылкой для точной ориентации и успешный патч-зажим клетки особенно в INL с его высокой плотности клеточных тел.
Изолированной сетчатки мыши жизнеспособность в течение 3-4 ч в условиях эксперимента. Если второй сетчатки сохраняется в полной темноте под постоянным газом карбогена, он сохраняет фиолетовый цвет небеленой фотопигмент и может быть использовано после окончания экспериментов с первой сетчатки. В начале, таргетингвыбранной ячейки с микропипетки в сетчатке wholemount немного сложной и требует некоторой практики, особенно при работе в темноте. В том числе флуоресцентный краситель в микропипетки может упростить процедуру, так как клетки и микропипетки видны под двухфотонного возбуждения в то же время. Тем не менее, добавление компонентов внутриклеточных решение может препятствовать gigaseal образования или причинить качество записи страдать. После успешно достигнуты, хорошая запись может длиться около 1 ч.
В то время как инфракрасный свет возбуждения себя только плохо всасывается сетчатки, фоторецепторы, возбужденное GFP-экспрессирующие клетки излучают свет в видимой части спектра. Тем не менее, флуорофоров возбуждаются лишь в небольшом фокального объема, который вряд ли изменится адаптационных состояние сетчатки. Тем более, возбуждение необходимо только для прицеливания и может быть выключен во время записи света ответов.
UsefulnESS этого подхода уже свидетельствуют исследования на конкретных группах amacrine клетки, из которых 14,18 электрофизиологических записей противном случае была бы возможна лишь случайно 12. Наконец, эта мощная техника может быть продлен путем включения фармакологического подхода 14, Ca 2 + 19 изображений или с помощью инъекции клеток для иммуноцитохимического исследований или электронной микроскопии. Таким образом, функциональное положение данного типа клеток в сетчатке схема может быть разгадана.
Раскрытие информации
Мыши были обработаны и эвтаназии в соответствии с институциональными рекомендации по благосостоянию животных и законы об опытах над животными выданный германским правительством.
Благодарности
Эта работа была поддержана Deutsche Forschungsgemeinschaft (WE849/16 1 / 2 до КД и RW). Мы благодарны Томасу Эйлера (Töbingen, Германия) за свет QDS программного обеспечения стимуляции.
Материалы
| Name | Company | Catalog Number | Comments |
| Реагент / оборудованию | Компания | Номер по каталогу | Комментарии |
|---|---|---|---|
| Очки ночного видения | Гутцайт GmbH, Warthausen, Германия | Xtron F1 | включает в себя 800 нм источник света |
| Оптический фильтр | Шотт, Майнц, Германия | RG9 | longpass фильтр отсечки при 690 нм |
| Ирис ножницы | Инструменты изобразительных наук | 14061-09 | изогнутые, с лезвием 22 мм |
| Весна ножницы | Инструменты изобразительных наук | 15000-00 | прямые, с 3 мм лезвием |
| Запись камеры | Luigs & Neumann GmbH, Дюссельдорф, Германия | 200-100 500 0180 типа (ТС) | Тефлоновым камеры с нижней монтажа скольжения покровного стекла (около 0,15 мм, № 200-100 500 0182) |
| Поток обогреватель | Многоканальных системах, Ройтлинген, Германия | PH01, TC01 | отапливаемо канюли перфузии с температурой ыЭнсор и регулятор температуры |
| Лазерный сканирующий микроскоп | Leica Microsystems | DM LFS | контролируется программное обеспечение Leica конфокальной |
| Воздух стол | Ньюпорт | VH 3036W-OPT | |
| Лазер | Spectra-Physics | Цунами синхронизацией мод титан-сапфирового лазера | |
| ПЗС-камера | рсо AG, Кельхайм, Германия | PixelFly QE | в том числе программное обеспечение управления |
| Микропипетки стеклянных капилляров | Хильгенберг, Malsfeld, Германия | 1408411 | |
| Микропипетки съемник | Саттер инструмент | Р-97 | |
| Alexa Fluor 594 | Invitrogen | -20004 | флуоресцентного красителя |
| Neurobiotin | Axxora | VC-SP-1120-M050 | не-люминесцентные трассирующими |
| Стрептавидин-Cy3 | Дианова | 016-160-084 | |
| Микрофонromanipulator | Luigs & Neumann GmbH, Дюссельдорф, Германия | 210-100 000 0010 | моторизованные Mini25 манипулятор блок с дисплеем SM-5 |
| Патч-зажим усилителя | НПИ электронных GmbH, И. Е. Тамм, Германия | SEC-05LX НПИ | |
| Digitizer | National Instruments | BNC-2090 | |
| Сбор данных программного обеспечения WinWCP | Джон Демпстер, Университет Шотландии, Глазго, Великобритания | http://spider.science.strath. ac.uk / sipbs / software.htm | |
| Визуальный QDS генератор стимул | Томас Эйлера, Университет Тюбингена, Германия | должен работать на отдельном компьютере, контроль 2 монитора (интерфейс пользователя, стимулы монитор) | |
| Фильтры нейтральной плотности | ITOS, Майнц, Германия |
Ссылки
- Masland, R. H. The fundamental plan of the retina. Nat. Neurosci. 4, 877-886 (2001).
- Baccus, S. A. Timing and computation in inner retinal circuitry. Annu. Rev. Physiol. 69, 271-290 (2007).
- Haverkamp, S., Inta, D., Monyer, H., Wässle, H. Expression analysis of green fluorescent protein in retinal neurons of four transgenic mouse lines. Neuroscience. 160, 126-139 (2009).
- Siegert, S., Gross-Scherf, B., Del Punta, K., Didkovsky, N., Heintz, N., Roska, B. Genetic address book for retinal cell types. Nat. Neurosci. 12, 1197-1204 (2009).
- Svoboda, K., Yasuda, R. Principles of two-photon excitation microscopy and its applications to neuroscience. Neuron. 50, 823-839 (2006).
- Euler, T., Detwiler, P. W., Denk, B. Directionally selective calcium signals in dendrites of starburst amacrine cells. Nature. 418, 845-852 (2002).
- Sakmann, B., Neher, E. Single-Channel Recording. , Plenum Press. (1995).
- Jackson, M. B. Whole-cell voltage clamp recording. Current Protocols in Neuroscience. Gerfen, C. , Wiley. (1997).
- Majewska, A., Yiu, G., Yuste, R. A custom-made two-photon microscope and deconvolution system. Pfügers Arch. - Eur. J. Physiol. 441, 398-408 (2000).
- Yuste, R., Konnerth, A. maging in Neuroscience and Development: A Laboratory Manual. , Cold Spring Harbor Laboratory. (2005).
- Euler, T., Hausselt, S. E., Margolis, D. J., Breuninger, T., Castell, X., Detwiler, P. B., Denk, W. Eyecup scope - optical recordings of light stimulus-evoked fluorescence signals in the retina. Pflügers Arch. - Eur. J. Physiol. 457, 1393-1414 (2009).
- Wei, W., Elstrott, J., Feller, M. B. Two-photon targeted recording of GFP-expressing neurons for light responses and live-cell imaging in the mouse retina. Nat. Protoc. 5, 1347-1352 (2010).
- Matsushita, N., Okada, H., Yasoshima, Y., Takahashi, N., Kiuchi, K., Kobayashi, K. Dynamics of tyrosine hydroxylase promoter activity during midbrain dopaminergic neuron development. J. Neurochem. 82, 295-304 (2002).
- Knop, G. C., Feigenspan, A., Weiler, R., Dedek, K. Inputs underlying the ON-OFF light responses of type 2 wide-field amacrine cells in TH-GFP mice. J. Neurosci. 31, 4780-4791 (2011).
- Zhang, D. Q., Stone, J. F., Zhou, T., Ohta, H., McMahon, D. G. Characterization of genetically labeled catecholamine neurons in the mouse retina. Neuroreport. 15, 1761-1765 (2004).
- Contini, M., Lin, B., Kobayashi, K., Okano, H., Masland, R. H., Raviola, E. Synaptic input to ON-biploar cells onto the dopaminergic neurons of the mouse retina. J. Comp. Neurol. 518, 2035-2050 (2010).
- Helmchen, F., Denk, W. Deep tissue two-photon microscopy. Nat. Methods. 2, 932-940 (2005).
- Dedek, K., Breuninger, T., de Sevilla Müller, L. P., Maxeiner, S., Schultz, K., Janssen-Bienhold, U., Willecke, K., Euler, T., Weiler, R. A novel type of interplexiform amacrine cell in the mouse retina. Eur. J. Neurosci. 30, 217-228 (2009).
- Denk, W., Detwiler, P. B. Optical recording of light-evoked calcium signals in the functionally intact retina. Proc. Natl. Acad. Sci. U.S.A. 96, 7035-7040 (1999).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены