Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
RNAi-опосредованной Нокдаун гена и
В этой статье
Резюме
В этом протоколе мы объединим RNAi-опосредованной генов с В естественных условиях Диурез анализ, чтобы изучить эффекты нокдауна генов интерес имеет на комаров выделение жидкости.
Аннотация
Это видео демонстрирует протокол эффективный метод, чтобы нокдаун гена в частности насекомых и провести новые биопроб для измерения скорости экскреции. Этот метод может быть использован для получения более глубокого понимания процесса диурез у насекомых и особенно полезен при изучении диурез в питающимися кровью членистоногих, которые могут занимать огромное количество жидкости в одной еды кровь.
Это RNAi-опосредованной генной нокдаун в сочетании с в тесте диурез естественных условиях была разработана Хансен лабораторию для изучения влияния RNAi-опосредованной нокдаун аквапорин генов комара Aedes aegypti диурез 1.
Протокол установки из двух частей: первая демонстрация показывает, как построить простое устройство инъекции комаров и, как подготовить и ввести в дсРНК грудной клетки комаров для RNAi-опосредованной генной нокдаун. Вторая демонстрация показывает, как можно определитьвыделение ставок в использовании комаров в естественных условиях биопроб.
протокол
Часть I - RNAi-опосредованной генной нокдаун во взрослой Aedes aegypti комаров. Для эксперимента обзор см. Рисунок 1.
1. дсРНК синтеза
- Обобщение конкретных генов dsRNAs против интересов и контроль dsRNAs. Примечание: Мы рекомендуем разработке праймеров для ПЦР-фрагментов в диапазоне от 300 до 500 пар оснований, расположенных на 3 'конце конкретных кДНК 2 и последовательности T7 праймер прилагается на 5' конце (5'-TAA TAC GAC TCA CTA TAG GG-3 '). Уникальность фрагменты должны быть подтверждены BLASTN анализа 3.
- Используйте Ambion Megascript T7 Высокая доходность Kit транскрипции (Ambion, настольный реагентов), которая использует РНК-полимеразы Т7 для транскрипции реакции синтеза дсРНК. Примечание: аналогичный реагентов и комплекты доступны в других странах.
- Для очистки дсРНК, осадок хлористого лития, следуя инструкциям с Megascript комплект.
- После purificatиона, распустить дсРНК гранул в стерильной воде. Для обеспечения достаточной вязкости для микроинъекции, концентрация дсРНК не должна превышать 2 мкг / мкл.
2. Инъекция подготовка
- Простой микро инжектор может быть построена с помощью трубки, ножниц, металлической иглой, шприц 1 мл, а 1 мл пластиковой пипетки (см. Рисунок 2). Трубы должны быть сокращены до ~ 40 см в длину. Кроме того, автоматизированная микро инжектора могут быть использованы такие как Драммонд Nanojet II 4.
- Отрежьте кончик шприца (иглы хаб) в 2 мл балльной шкале и удалить голову резиновый поршень от поршня.
- Удар отверстие с помощью металлической иглы в голову резиновый поршень и место главы резиновый поршень обратно в иглу центром.
- Поместите иглу центра в один конец трубки и поместить 1 мл пластиковые пипетки на другом конце, который будет использоваться в качестве рот кусок (или, 10 мл сиRinge может быть использован для создания давления воздуха необходимого для инъекций).
- Поместите стеклянный капилляр иглу в отверстие в голове резиновой поршень и разбить кончик иглы от так ширины является достаточно большим для жидкости течь через. Примечание: оптимальный размер иглы должен быть определен эмпирически - если ширина иглы слишком велик это приведет к травме и высокая смертность комаров, если игла ширина слишком мала, то это будет невозможно проникнуть комара экзоскелет.
- Опустите иглу в готовом образце дсРНК и привлечь жидкого образца в инъекционной иглой, высасывая жидкость с рот кусок (или шприца). Примечание: Этот шаг не является одинаковым для всех жидких реагентов, которые вводятся в комаров, в том числе PBS буфера, который используется в естественных условиях в протокол анализа диурез (см. ниже).
3. Сбор и обезболить комары
- Сборт комаров с питанием от батареи аспиратор в коллекцию флаконе. Поместите колпачок флакона коллекцию и поместить во флакон на чистую CO 2 площадки, чтобы обезболить комаров. Примечание: В качестве альтернативы могут быть комары анестезии на льду.
4. Mosquito инъекций
- Откройте коллекцию флакон и поместите комаров прямо на CO 2 площадки и ждать, пока комары наркозом.
- Выбросьте все мужчины.
- Выстроить комаров на стороне, чтобы обеспечить более легкий доступ для инъекций.
- Возьмите комаров за ноги или крылья, чтобы избежать травм. Вы также можете использовать штраф кисть или перо для управления комаров.
- Когда все будет готово для введения первого комара, мягко поддерживать одну из сторон грудной клетки с пинцетом и вставить кончик иглы в сторону грудной клетки (рис. 2). Лучше вводить в тонкую часть кутикулы и не подталкивать иглуО глубоко в грудной клетке.
- Как только игла находится в месте, удар жидкости в организме комара. Желаемая сумма может быть определена путем контроля мениска жидкости в иглу. Число миллиметров необходимых для определенного объема может быть определена путем расчета объема цилиндра стеклянный капилляр иглы (тгг 2 ч). Эффективное количество дсРНК, который обычно используется для инъекций составляет 1 мкг.
- Как только жидкость впрыскивается в комара, тщательно убрать иглу. Если большие капли жидкости образуется на внешней стороне грудной клетки, комар должен быть уничтожен. Затем повторите этот процесс со следующего комара.
5. Восстановление комаров и хранение
- После инъекции, поставить комаров в контейнер для хранения. Например, одна пинта воск выстроились картонные стаканы (суп чашки) с сетчатым покрытием, обеспеченные картонной крышкой. Крышка имеет часть вырезать для сетки покрытие подвергается воздействию. После того как все моментовsquitoes помещают в контейнер, поместите контейнер в экологически контролируемых камеры для инкубации и обеспечить комаров с источником питания, например, 20% сахарозы, пропитанной ватные шарики размещены в верхней части сетки покрытие. Перед проведением анализа в естественных условиях диурез, лишить дсРНК впрыском комаров источник воды в течение 12 часов по стандартизации гидратации состояние каждого комара.
- Эффективность дсРНК опосредованного генной нокдаун может быть переменной. Генов может начаться 1 день после введения, и это может длиться до 6 дней после введения 4. Оптимальное время для достижения максимальной нокдаун гена должен быть определен эмпирически для каждого гена используется. Как правило, мы будем ждать 3 дня после инъекции дсРНК прежде чем мы продолжим.
Часть II - в анализе естественных диурез у взрослых комаров Aedes aegypti
Примечание: Этот протокол был разработан авторами идля RNAi-опосредованной нокдаун аквапорин белки в желтой лихорадки комара Aedes aegypti 1. Чтобы избежать изменчивость между отдельными комары, москиты должны быть проанализированы в группах. По техническим причинам мы рекомендуем группы из 5 комаров на лечение - есть ограниченное количество времени для выполнения первого измерения веса до комары начинают выделять мочу после инъекции.
6. Сбор и обезболить комары
- Прежде чем коллекция комаров, записывать вес пустой флакон коллекции с крышкой использованием аналитических весов точность. Этот флакон будет использоваться для всех последующих измерений.
- Соберите 5 самок комаров в коллекции весил флакон с аспиратором. Установите колпачок на флакон коллекции и оставьте на CO 2 площадки в течение нескольких секунд, чтобы обезболить комаров.
7. Начальные измерения веса
- Возьмем тОн начального измерения веса 5 комаров, поместив флакон, содержащий коллекцию комаров с крышкой на точность баланса.
- Рассчитать вес группы из 5 комаров, взяв вес комаров и сбор флакон с крышкой и вычитания веса пустого флакона коллекцию с крышкой.
- Откройте коллекцию флакон и поместите комаров прямо на CO 2 площадки после записи вес комаров. Если комары начинают просыпаться во время взвешивания, установить флакон на CO 2 площадки в течение нескольких секунд перед его открытием и размещения комаров на площадку.
8. Инъекция подготовка
- Установить микро инжектор, следуя инструкциям в RNAi-опосредованной протокол нокдаун гена.
- Поместите стеклянный капилляр иглу в микро-инжектор и разбить кончик иглы от так ширины является достаточно большим для жидкогоUID, течь через.
- Опустите иглу в буфере PBS и сделать буфер в инъекционной иглой, желаемую сумму для использования этого протокола составляет 1,25 мкл PBS для каждого комара. Примечание: Эта сумма имитирует среднее количество плазмы крови, которые занимают Самка комара 5.
9. Mosquito инъекций
- Линия до комаров, чтобы обеспечить легкий доступ с микро форсунки.
- Как только игла находится в месте, взрывать PBS буфера в комара.
- Как только жидкость впрыскивается в комара, капли могут образовываться на внешней стороне грудной клетки. Это капля должна быть тщательно удалены до следующего шага.
- Повторите этот процесс инжекции со следующего комара. С опытом, москитные выживаемость будет практически 100% после инъекции.
10. Взвешивание комары
- После укола, осторожно положите комаров в коллекции флаконеи кепка. Возьмите первый измерения веса 5 комаров, поместив флакон, содержащий коллекцию комаров с крышкой на точность баланса.
- Рассчитать вес группы из 5 комаров, взяв вес комаров и сбор флакон с крышкой и вычесть вес пустой флакон коллекции с крышкой. Примечание: комары начинают выделять мочу в течение 2 минут после извлечения из CO 2 анестезии площадки, поэтому важно, чтобы взять вес измерения, прежде чем они начинают выделять.
- Поместите комаров в небольшой контейнер, в котором они начнут выводить мочу.
11. Второй и последующие измерения веса
Примечание: Взвешивание комары должны быть приняты в 30-минутными интервалами, но это может быть настроен на более или менее длительные интервалы в зависимости от выделения ставок.
- Через 30 минут собрать Grouстр. 5 комаров с аспиратором в одном флаконе с крышкой коллекции. Сделайте следующий измерения веса комаров путем размещения коллекции флакон, содержащий комаров с крышкой на точность баланса.
- После измерения, поместить комаров в одном контейнере холдинга в течение следующих 30 минут.
- Повторите этот процесс для необходимого количества времени.
12. Определение скорости выведения комаров
- Общий объем жидкости, который был введен в группе из 5 комаров можно рассчитать путем вычитания начального веса комаров от веса сразу после инъекции.
- Количество мочи, которая выделяется группа комаров в определенный момент времени может быть рассчитана путем вычитания начального веса комаров от веса комаров на определенный момент времени.
- Выделение скорости в определенный момент времени может быть рассчитана по дивиДин количество мочи выделяется в это время точка на общее количество жидкости впрыском (табл. 1).
13. Представитель Результаты
RNAi-опосредованной генной нокдаун и в анализе диурез естественных условиях были использованы Хансен лабораторию для изучения влияния аквапорины в Aedes aegypti комаров диурез. Три аквапорины, которые выражаются в Aedes aegypti мальпигиевы сосуды были сбиты с существенного влияния на выведение ставки по сравнению с контрольной комаров 1. На рисунке 4 показана представитель результаты эксперимента, в котором диурез анализ был использован для сравнения выделение ставок между Aedes aegypti и Culex quinquefasciatus при различных температурах.
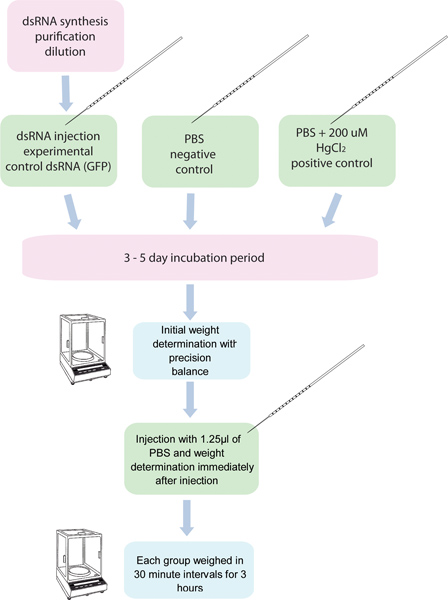
Рисунок 1. Блок-схема RNAi / диурез анализа. 5 групп по 10 шт комаровч вводят дсРНК для конкретного гена и еще пять групп из десяти комары вводят контроль дсРНК. Другая группа комары вводят 200 мкМ HgCl 2 в PBS используется в качестве положительного контроля. Эти комары взвешивают перед инъекцией, а после введения в тридцати минутным интервалом в течение 3 часов.
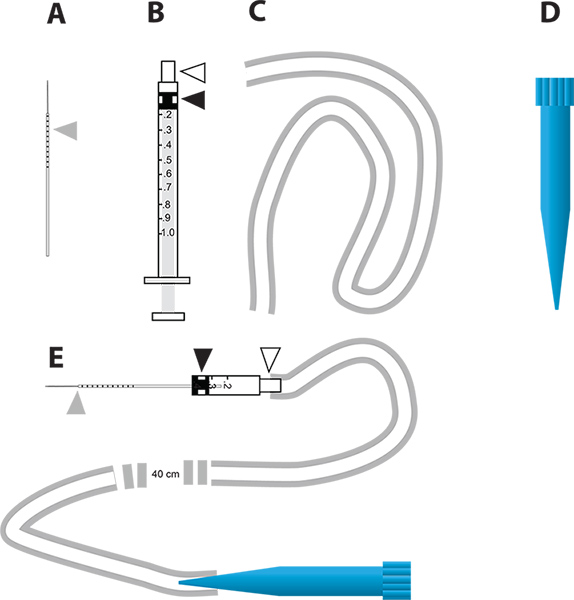
Рисунок 2. Простое устройство микро инъекций для RNAi-опосредованной генной нокдаун и в анализе диурез естественных условиях. А. Стеклянный капилляр иглы для инъекций. Серый треугольник представляет миллиметра шагом обращено на иглу, чтобы указать количество жидкости вводят в комара. B. 1 мл шприц используется для построения микро-инжектора. Белый треугольник представляет иглы ступицы и черный треугольник представляет голову резиновый поршень прикреплен к поршень в шприце. С трубкой используется для подключения к мундштукинжектора. Д. 1 мл одноразовый наконечник пипетки (синий кончик), который используется в качестве рупора микроинъекции устройства. Е. микроинъекции устройство, которое включает в себя части нашей эры. Нажмите здесь, чтобы увеличить рисунок .
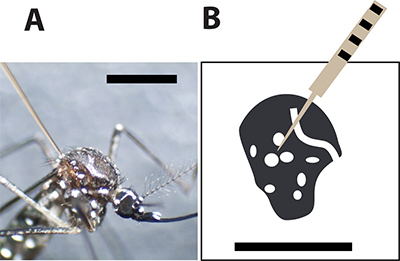
Рисунок 3. Оптимальное место инъекции комара. А. Женский Aedes aegypti комаров вводят стеклянный капилляр иглу между больших масштабах на груди. Черная полоса указывает на 1 мм для сравнения размеров. В. рисунок женской груди комаров и белые пятна представляют собой белые чешуйки в организме комара экзоскелет. Инъекции игла должна прокалывать комаров между пятнами, чтобы минимизировать смертность во время инъекции.
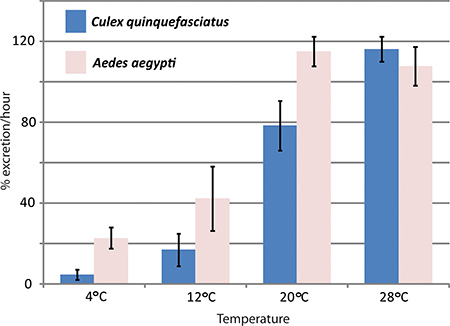
Рисунок 4. Воздействие температурытуры на Culex quinquefasciatus и Aedes aegypti диурез. диурез анализ был выполнен с двумя видами комаров, Aedes aegypti и Culex quinquefasciatus, при различных температурах. Скорость выделения в течение первого часа после укола в процентах.
| Группа | TARA (Г) | не вводится (Г) | после введения (Г) | 1 час после инъекции (Г) | Средний вес (мг) | Сумма вводится (Мкл) | Сумма выделяемых (Мкл) | % Экскретируется |
| 1 | 7,5938 | 7,6057 | 7,6104 | 7,6096 | 2,38 | 0,94 | 0,16 | 17,0 |
| 2 | 7,8252 | 7,8349 | 7,8415 | 7,8403 | 1,94 | 1,32 | 0,24 | 18,2 |
| 3 | 7,8896 | 7,9026 | 7,9077 | 7,906 | 2,6 | 1,02 | 0,34 | 33,3 |
Таблица 1. Aedes aegypti в естественных результатах диурез анализа. Исходные данные из анализа диурез в естественных условиях осуществляется с Aedes aegypti самок комаров при 4 ° C.
Обсуждение
Протокол RNAi использоваться была разработана в лаборатории Александр Райхель из Университета Калифорнии Riverside 6,7 и похож на протокол опубликован Гарвер и Dimopoulos 4. Экспериментальный подход показано в этом видео, протокол может быть использован для изучения генов, участвующи?...
Раскрытие информации
Нам нечего раскрывать.
Благодарности
Авторы выражают благодарность Виктории Карпентер ее критические замечания этого протокола.
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагентов и оборудования | Компания | Номер по каталогу | Комментарии |
| MEGAscript T7 Высокая доходность Kit | Ambion, Inc | AM1334 | |
| PBS буфера | Sigma-Aldrich | P4417 | |
| Пластиковые трубы | Местное поставщика | ПВХ | |
| 1 мл пластиковой пипетки | VWR | 83007-376 | Синий наконечник |
| 1 мл шприц | Becton, Dickinson и компании | 309602 | |
| Ножницы | Местное поставщика | ||
| Металл иглы | Каролина биологические | 654307 | Размер 5 |
| Лети площадки | Genesee Научные | 789060 | |
| С питанием от батарей аспиратор ж / Коллекция флаконе | UPMA Labs | IPMM 2000 | |
| Изобразительное щипцы наконечник | Инструменты Всемирной Precision | 14095 | |
| Стеклянные капиллярные иглы | Инструменты Всемирной Precision | 1B200-6 | |
| Стерео микроскоп вскрытия | Leica Microsystems | S6D | |
| Аналитические весы с точностью | Mettler Toledo | AB54S | |
| Сахароза | Sigma-Aldrich | 84097 | |
| Одна пинта воском выстроились чашки картона | Местное поставщика | Изготовлено чашки супа | |
| Mesh чистый | Местное поставщика | пластиковые марли лету |
Ссылки
- Drake, L. L., et al. The Aquaporin gene family of the yellow fever mosquito, Aedes aegypti. PloS one. 5, e15578 (2010).
- Shepard, A. R., Jacobson, N., Clark, A. F. Importance of quantitative PCR primer location for short interfering RNA efficacy determination. Analytical biochemistry. 344, 287-288 (2005).
- Altschul, S. F., et al. Gapped BLAST and PSI-BLAST: a new generation of protein database search programs. Nucleic acids research. 25, 3389-3402 (1997).
- Garver, L., Dimopoulos, G. Protocol for RNAi Assays in Adult Mosquitoes (A. gambiae). J. Vis. Exp. (5), e230 (2007).
- Clements, A. N. Volume 1 Development, Nutrition, and Reproduction. The Biology of Mosquitoes. 2, (1992).
- Hansen, I. A., Attardo, G. M., Park, J. H., Peng, Q., Raikhel, A. S. Target of rapamycin-mediated amino acid signaling in mosquito anautogeny. Proceedings of the National Academy of Sciences of the United States of America. 101, 10626-10631 (2004).
- Hansen, I. A., Attardo, G. M., Roy, S. G., Raikhel, A. S. Target of rapamycin-dependent activation of S6 kinase is a central step in the transduction of nutritional signals during egg development in a mosquito. The Journal of biological chemistry. 280, 20565-20572 (2005).
- Pannabecker, T. Physiology of the Malpighian Tubule. Annual review of entomology. 40, 493-510 (1995).
- Dow, J. New insights into Malpighian tubule function from functional genomics. Comp Biochem Phys A. 150, S135 (2008).
- Dow, J. A. T. Insights into the Malpighian tubule from functional genomics. Journal of Experimental Biology. 212, 435-445 (2009).
- Lawson, D., et al. VectorBase: a data resource for invertebrate vector genomics. Nucleic acids research. 37, 583-587 (2009).
- Beyenbach, K. W. Transport mechanisms of diuresis in Malpighian tubules of insects. J. Exp. Biol. 206 (Pt 21), 3845-3856 (2003).
- Coast, G. M. Continuous recording of excretory water loss from Musca domestica using a flow-through humidity meter: hormonal control of diuresis. Journal of insect physiology. 50, 455-468 (2004).
- Kersch, C. N., Pietrantonio, P. V. Mosquito Aedes aegypti (L.) leucokinin receptor is critical for in vivo fluid excretion post blood feeding. FEBS letters. 585, 3507-3512 (2011).
- Hays, A. R., Raikhel, A. S. A novel protein produced by the vitellogenic fat body and accumulated in mosquito oocytes. Development Genes and Evolution. 199, 114-121 (1990).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены