Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Маркировка стволовых клеток с Ferumoxytol, FDA-Approved Оксид железа наночастиц
В этой статье
Резюме
Мы описываем технику для маркировки и отслеживания стволовых клеток с FDA, одобрено, суперпарамагнитных оксида железа (Спио), ferumoxytol (Feraheme). Этот клеточный метод визуализации, который использует магнитного резонанса (МР) изображений для визуализации, легко доступных для долгосрочного мониторинга и диагностики успешной или неудачной стволовых клеток engraftments у пациентов.
Аннотация
Stem cell based therapies offer significant potential for the field of regenerative medicine. However, much remains to be understood regarding the in vivo kinetics of transplanted cells. A non-invasive method to repetitively monitor transplanted stem cells in vivo would allow investigators to directly monitor stem cell transplants and identify successful or unsuccessful engraftment outcomes.
A wide range of stem cells continues to be investigated for countless applications. This protocol focuses on 3 different stem cell populations: human embryonic kidney 293 (HEK293) cells, human mesenchymal stem cells (hMSC) and induced pluripotent stem (iPS) cells. HEK 293 cells are derived from human embryonic kidney cells grown in culture with sheared adenovirus 5 DNA. These cells are widely used in research because they are easily cultured, grow quickly and are easily transfected. hMSCs are found in adult marrow. These cells can be replicated as undifferentiated cells while maintaining multipotency or the potential to differentiate into a limited number of cell fates. hMSCs can differentiate to lineages of mesenchymal tissues, including osteoblasts, adipocytes, chondrocytes, tendon, muscle, and marrow stroma. iPS cells are genetically reprogrammed adult cells that have been modified to express genes and factors similar to defining properties of embryonic stem cells. These cells are pluripotent meaning they have the capacity to differentiate into all cell lineages 1. Both hMSCs and iPS cells have demonstrated tissue regenerative capacity in-vivo.
Magnetic resonance (MR) imaging together with the use of superparamagnetic iron oxide (SPIO) nanoparticle cell labels have proven effective for in vivo tracking of stem cells due to the near microscopic anatomical resolution, a longer blood half-life that permits longitudinal imaging and the high sensitivity for cell detection provided by MR imaging of SPIO nanoparticles 2-4. In addition, MR imaging with the use of SPIOs is clinically translatable. SPIOs are composed of an iron oxide core with a dextran, carboxydextran or starch surface coat that serves to contain the bioreactive iron core from plasma components. These agents create local magnetic field inhomogeneities that lead to a decreased signal on T2-weighted MR images 5. Unfortunately, SPIOs are no longer being manufactured. Second generation, ultrasmall SPIOs (USPIO), however, offer a viable alternative. Ferumoxytol (FerahemeTM) is one USPIO composed of a non-stoichiometric magnetite core surrounded by a polyglucose sorbitol carboxymethylether coat. The colloidal, particle size of ferumoxytol is 17-30 nm as determined by light scattering. The molecular weight is 750 kDa, and the relaxivity constant at 2T MRI field is 58.609 mM-1 sec-1 strength4. Ferumoxytol was recently FDA-approved as an iron supplement for treatment of iron deficiency in patients with renal failure 6. Our group has applied this agent in an “off label” use for cell labeling applications. Our technique demonstrates efficient labeling of stem cells with ferumoxytol that leads to significant MR signal effects of labeled cells on MR images. This technique may be applied for non-invasive monitoring of stem cell therapies in pre-clinical and clinical settings.
протокол
1. День 1
1) клетки пластины
- Пластина hMSC в колбе T75 на слияния 80% по крайней мере 18-24 часов до маркировки. См. Таблицу 1 для обучения в альтернативных судов.
2. День 2
2) Подготовить маркировки решение. Этот препарат будет этикетке одного (1) T75 колбу на 80% слияния с концентрацией 400 мкг Fe / мл. См. Таблицу 1 для обучения в альтернативных судов.
- Создать решение (решение 1) путем смешивания 1 мл сыворотки среде и 93,1 мкл ferumoxytol (складе: 30 мг / мл) в 15 мл коническую трубку.
- Создайте второе решение (решение 2) путем смешивания 1 мл сыворотки среде и 7 мкл протамина сульфат (складе: 10 мг / мл) в 15 мл второй конической трубе.
- Разрешить каждого решения, чтобы отдохнуть в течение 5 минут.
- Добавить решения 1 и 2 вместе. Аккуратно перемешайте новое решение этикеток. Разрешить решение, чтобы отдохнуть в течение 5 минут, чтобы позволить USPIO-проtamine комплексов сульфата форме.
- Добавьте 5 мл сыворотки среде в смешанном 2 мл Спио / протамин сульфат раствор для окончательного объемом 7 мл.
3) подготовить клеток для маркировки
- Аспирируйте средств массовой информации из клеток.
- Осторожно промыть клетки сразу с 2-3 мл подогретого Mg / Ca без D-PBS или сыворотки среде, чтобы ополоснуть от остаточной сывороточных белков и других компонентов, или средства массовой информации, которые могут ухудшить отличие поглощение агента и маркировка эффективности. Аспирацию из промыть жидкостью.
4) клетки этикетки
- Добавить полная 7 мл маркировки решение клеток.
- Место клеток в инкубаторе (37 ° C / 5% СО 2) и позволяют клеткам для инкубации в маркировке решение в течение 4 часов.
- Добавить 700 мкл FCS для маркировки решение клетки для достижения окончательного концентрацию в крови на 10%. Сыворотка добавляется для восстановления обогащенного среде которой клетки привыкли, и для оказания помощи в миnimizing гибели клеток, которые могут возникнуть в результате резкого перехода к 24-часовой экспозиции в бессывороточной среде.
- Разрешить клетки инкубировать с маркировки решение для дополнительных 20 часов.
3. День 3
5) Подготовка меченых клеток
- Аспирируйте маркировки решение из клеток.
- Аккуратно промойте клетки с 2-3 мл подогретого Mg / Ca без D-PBS. Аспирацию из PBS. Важно использовать Mg / Ca без PBS, как Mg и Са будет снизить эффективность трипсина в следующем шаге.
- Добавить 2 мл подогретого 0,05% трипсина в клетки и наклона фляжку, чтобы обеспечить всю поверхность колбы покрыта тонким слоем трипсина. Место клеток в инкубаторе (37 ° C / 5% СО 2) и позволяют клеткам, чтобы отдохнуть в течение 5-7 минут или пока клетки начинают отделяться от пластины. Это может быть необходимо для подтверждения отряд под микроскопом. Аккуратно нажмите стороны колбы, если необходимо фаcilitate клеточной поверхности отряда.
- Добавить 4 мл подогретого полный СМИ в колбу для нейтрализации трипсина. Аккуратно промойте колбу с помощью пипетки Трипсин / СМИ / элемент решение вверх и вниз несколько раз. Соберите весь раствор в 15 мл коническую трубку. Центрифуга клетка решение при 400 RCF течение 5 минут.
- Тщательно аспирата супернатант, не нарушая клеточный осадок. Ресуспендируют клеток в 5 мл среды (сыворотки, содержащей или не содержащей сыворотки). Центрифуга клетка решение при 400 RCF течение 5 минут.
- Повторите ячейки мыть, описанных в пункте 5.5. В общей сложности, клетки будут промыть три раза, чтобы удалить остатки, свободного агента контраста в средствах массовой информации и на поверхности клеток.
- Граф клетки в этот момент для достижения наиболее точного подсчета клеток, а клетки будут потеряны во время предыдущей стирки. Выполните проверку жизнеспособности клеток. Клетки готовы для последующего анализа и или пробное нанесение. МРТ может быть выполнена с T1-ю и T2-ю параметрами, потому что, хотя ferumoxytol является Т2-ю контрастное вещество, ferumoxytol также экспонаты T1 эффектов. Представитель T2-ю МРТ параметров, которые могут быть использованы для изображения ferumoxytol меченых клеток включают: FSE или SE_Multislice последовательностей с TR в 2000-2500 мс и TE на 60-80 мс. Для приобретения T1-белого изображения, уменьшение значения TE на FSE или SE_Multislice последовательности или использовать последовательность GRE с высоким и низким TR TE. Рисунок 4 демонстрирует потенциал в естественных условиях применение для помеченных изображений стволовых клеток.
4. Представитель Результаты:
Маркированный клетки демонстрируют значительное потемнение или отрицательный эффект контраста на Т2-взвешенной МРТ и яркости или положительный эффект контраста на T1-взвешенных МРТ (рис. 2). Продольные МРТ и жизнеспособность испытаний, проведенных 5 дней после маркировки не было выявлено значительных сигнала МР и не оказывает значительного влияния на жизнеспособность по сравнению с немеченого управления (данные не представлены).
jove_content "> Маркированный стволовые клетки могут впоследствии быть дифференцированы в различные типы клеток или внутривенно вводят для прижизненного исследования.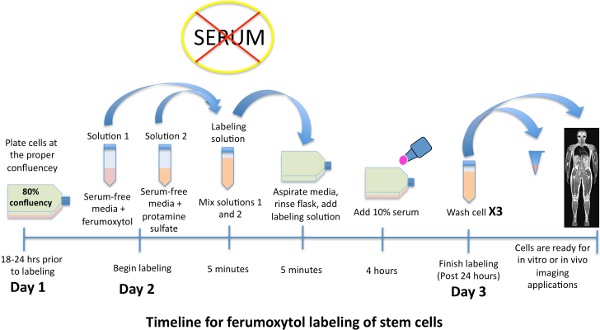
Рисунок 1. Схема сроки для маркировки стволовые клетки с наночастицами оксида железа, ferumoxytol.

Рисунок 2. MR изображения сагиттальном сечениях трубы thrrough Эппендорф с ячейками в осадок клеток. ) Немеченого управления. B) Маркированный клетки демонстрируют значительное T2 или отрицательный эффект контрастного вещества на T2-взвешенных FSE или SE_Multislice изображений и T1 или положительный эффект контрастного вещества на Т1-взвешенных последовательностей GRE.
Рисунок 3. Сагиттальный сечения трубы Эппендорф с ячейками в ячейке PELпозволяет. Как ни мало 10000 ferumoxytol меченые клетки могут быть обнаружены с помощью T2-ю МРТ.
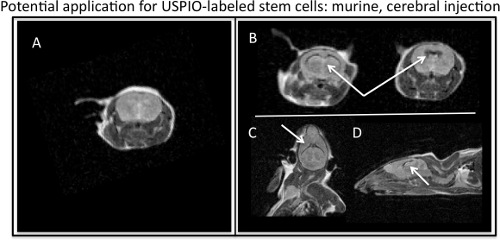
Рисунок 4. MR визуализации ferumoxytol меченных стволовые клетки вводили в мышиные желудочков головного мозга. ) Осевой, М. Р. Образ мышиной барин без каких-либо инъекции USPIO меченых стволовых клеток. Б) Осевой, С) корональных и D) сагиттальной МР изображений изображающих T2, негативный эффект контраста USPIO меченных стволовые клетки (белые стрелки) вводили в мышиные мозга.

Таблица 1. Количество адаптация для маркировки клеток в альтернативных судов.
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Улучшение эффективности engraftments стволовых клеток имеет решающее значение для продвижения регенеративной медицины. Неинвазивной визуализации технику получения стволовых клеток в естественных условиях значительно усиливает нашу способность понимать механизмы, которые приводят...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
Все участники этого исследования не дают раскрытия информации.
Благодарности
Эта работа была поддержана грантом Национального института артрита и костно-мышечной и кожных заболеваний: 3R01AR054458-02S2.
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента | Компания | Номер по каталогу | Комментарии (необязательно) |
| D-MEM высокий уровень глюкозы в | Сигма | D5648 | Или другой носитель базой для требуемой линии стволовых клеток, которые будут использоваться |
| D-PBS (Ca + +, Mg + + бесплатно) | GIBCO | 14190-144 | |
| Трипсин-EDTA 0,05% | Invitrogen | 25300-120 | |
| Эмбриональной бычьей сыворотки (FBS) | Hyclone | SH30071.03 | |
Ferumoxytol (Feraheme) | AMAG | 59338-0775-01 | |
| Протамина сульфат | APP Pharm. | 22930 |
Ссылки
- Narsinh, K. H., Plews, J., Wu, J. C. Comparison of human induced pluripotent and embryonic stem cells: fraternal or identical twins? Mol Ther. 19, 635-638 (2011).
- Bulte, J. W. In vivo MRI cell tracking: clinical studies. AJR. Am. J. Roentgenol. 193, 314-325 (2009).
- Henning, T. D., Boddington, S., Daldrup-Link, H. E. Labeling hESCs and hMSCs with Iron Oxide Nanoparticles for Non-Invasive in vivo Tracking with MR Imaging. J. Vis. Exp. (13), e685-e685 (2008).
- Tallheden, T., Nannmark, U., Lorentzon, M. In vivo MR imaging of magnetically labeled human embryonic stem cells. Life. Sci. 79, 999-1006 (2006).
- Jung, C. W., Jacobs, P. Physical and chemical properties of superparamagnetic iron oxide MR contrast agents: ferumoxides, ferumoxtran, ferumoxsil. Magn. Reson. Imaging. 13, 661-674 (1995).
- Coyne, D. W. Ferumoxytol for treatment of iron deficiency anemia in patients with chronic kidney disease. Expert. Opin. Pharmacother. 10, 2563-2568 (2009).
- Li, Z., Suzuki, Y., Huang, M. Comparison of reporter gene and iron particle labeling for tracking fate of human embryonic stem cells and differentiated endothelial cells in living subjects. Stem Cells. 26, 864-873 (2008).
- Metz, S., Bonaterra, G., Rudelius, M. Capacity of human monocytes to phagocytose approved iron oxide MR contrast agents in vitro. Eur. Radiol. 14, 1851-1858 (2004).
- Nedopil, A., Klenk, C., Kim, C. MR signal characteristics of viable and apoptotic human mesenchymal stem cells in matrix-associated stem cell implants for treatment of osteoarthritis. Invest. Radiol. 45, 634-640 (2010).
- Kraitchman, D. L., Heldman, A. W., Atalar, E. In vivo magnetic resonance imaging of mesenchymal stem cells in myocardial infarction. Circulation. 107, 2290-2293 (2003).
- Stuckey, D. J., Carr, C. A., Martin-Rendon, E. Iron particles for noninvasive monitoring of bone marrow stromal cell engraftment into, and isolation of viable engrafted donor cells from, the heart. Stem Cells. 24, 1968-1975 (2006).
- Henning, T. D., Sutton, E. J., Kim, A. The influence of ferucarbotran on the chondrogenesis of human mesenchymal stem cells. Contrast. Media. Mol. Imaging. 4, 165-173 (2009).
- Arbab, A. S., Yocum, G. T., Kalish, H. Efficient magnetic cell labeling with protamine sulfate complexed to ferumoxides for cellular MRI. Blood. 104, 1217-1223 (2004).
- Nedopil, A. J., Mandrussow, L. G., Daldrup-Link, H. E. Implantation of Ferumoxides Labeled Human Mesenchymal Stem Cells in Cartilage Defects. J. Vis. Exp. (38), e1793-e1793 (2010).
- Arbab, A. S., Yocum, G. T., Wilson, L. B. Comparison of transfection agents in forming complexes with ferumoxides, cell labeling efficiency, and cellular viability. Mol Imaging. 3, 24-32 (2004).
- Babic, M., Horak, D., Trchova, M. Poly(L-lysine)-modified iron oxide nanoparticles for stem cell labeling. Bioconjug Chem. 19, 740-750 (2008).
- Golovko, D. M., T, H. enning, Bauer, J. S. Accelerated stem cell labeling with ferucarbotran and protamine. Eur. Radiol. 20, 640-648 (2010).
- Lu, M., Cohen, M. H., Rieves, D. FDA report: Ferumoxytol for intravenous iron therapy in adult patients with chronic kidney disease. Am. J. Hematol. 85, 315-319 (2010).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены