Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Выделение мышиные клетки легких Дендритные
В этой статье
Резюме
Высоко очищенного препарата мышиные клетки легких дендритных описано. Особое внимание уделяется изоляции обычных дендритных подмножество клеток.
Аннотация
Легкого дендритные клетки (ДК) играют фундаментальную роль в зондирование вторжения патогенов 1,2, а также в управление вызывающий иммунологическую толерантность ответы 3 в дыхательных путях. По крайней мере, три основных подмножеств клеток легких дендритных были описаны у мышей: обычные DC (CDC) 4, plasmacytoid DC (PDC) 5 и ИФН-убийца производства DC (IKDC) 6,7. Подмножество CDC является наиболее известным DC подмножество в легких 8.
Общий маркер для выявления известных DC подмножеств CD11c, типа я трансмембранного интегрина (β2), что также выражается в моноциты, макрофаги, нейтрофилы и некоторых В-клетки 9. В некоторых тканях, используя CD11c в качестве маркера для выявления мыши DC действительно, как и в селезенке, где большинство CD11c + клеток представляют собой подмножество CDC который выражает высокий уровень главного комплекса гистосовместимости II класса (MHC-II). Тем не менее, легкие более разнородной ткани, где будетстороны DC подмножества, есть большой процент различных популяции клеток, что выражается высоким уровнем CD11c бой низкого уровня MHC-II. Опираясь на свои характеристики и в основном на его выражение F4/80, селезенки маркер макрофагов, CD11c привет MHC-II вот легкого населения была определена в качестве легочных макрофагов 10 и совсем недавно, в качестве потенциального предшественника DC 11.
В отличие от мыши PDC, изучение специфической роли CDC в легочной иммунный ответ был ограничен из-за отсутствия специфического маркера, который может помочь в изоляции этих клеток. Таким образом, в этой работе мы описываем процедуру, чтобы изолировать высокой степени очистки мыши легких CDC. Изоляция легочных подмножества DC представляет собой весьма полезный инструмент, чтобы получить представление о функции этих клеток в ответ на возбудителей инфекций дыхательных путей, а также экологические факторы, которые могут вызвать иммунный ответ в легких.
протокол
1. Перфузии легких и суспензии отдельных клеток
- Эвтаназии мышь с внутрибрюшинного введения кетамина / ксилазина смеси анестетиков (в мг / мышь кетамин 1.8, ксилазина 0,19) и обескровливание через бедренную вену
- Expose грудной полости за счет сокращения и осторожно потянув назад внешняя оболочка брюшины. Приступить к открытой диафрагмы за счет сокращения грудной клетки, чтобы выставить как сердце и легкие.
- Заливать мягко легких использованием 5 мл шприц с ЭДТА-HBSS (1 мм ЭДТА кальция / магния без HBSS). Подключите 25 G иглу и вставить иглу в правый желудочек. Для предотвращения утечки во время инъекции, безопасные myocardiac ткань вокруг иглы с помощью щипцов. Осторожно вводят раствор при сохранении постоянного давления. Точная перфузии приведет к инфляции, легких и изменение цвета на розовый / белый.
- Удалите дренаж лимфатических узлов, чтобы отказаться от любого возможного загрязнения из этой ткани.
- Собиратьлегочной ткани, трансфер в чашке Петри на льду, и нарезать его на небольшие части, используя лезвие бритвы.
- Передача заземленной ткани в трубке gentleMACS С, содержащий 5 мл / легких коллагеназы решение пищеварения (коллагеназы типа 1А 0,5 мг / мл плюс тип IV бычьей панкреатической ДНКазы 20 мкг / мл в HBSS, содержащего 5% FBS, 100 ед / мл пенициллина и 100 мкг / мл стрептомицина).
- Используйте диссоциатор gentleMACS для получения суспензии отдельных клеток. Выберите программу: m_lung_01. Инкубируйте образца при 37 ° С в течение 30 минут. Встряхните трубку каждые 5 минут для ресуспендирования фрагментов тканей. Приступить к программе m_lung_02.
- Передача образца до 15 мл коническую трубку и центрифуги в течение 10 минут при 335 х г при 4 ° C. После этого шага, сохранить все реагенты и центрифугирования при 4 ° С до предотвратить снижение жизнеспособности клеток.
- Удалите супернатант и лизиса оставшихся эритроцитов, добавив 2 мл ACK лизирующего буфера в течение 1 минуты при комнатной температуре. Вымойте клеток с 13мл холодной PBS/0.5% BSA и центрифуги в течение 10 минут при 335 х г при 4 ° C.
- Удалите супернатант, ресуспендируют общего числа клеток в 5 мл холодной PBS/0.5% BSA и проходят тщательную 100 мкм нейлоновая сетка.
- Определите общее количество клеток с помощью трипанового синего исключения красителя.
2. Магнитная изоляция и CD11c + клеток обогащения
- Центрифуга суспензии отдельных клеток в течение 10 минут при 200 х г при 4 ° С и отбросить супернатант.
- Ресуспендируют осадок клеток в 400 мкл буфера разделения (PBS, 0,5% BSA, и 2 мМ ЭДТА) в 10 8 общего числа клеток. Блок Fc-опосредованная неспецифического связывания антител с помощью anti-CD16/CD32 антител (0.5μg / 10 6 клеток) в течение 30 минут при 4 ° C.
- Вымойте клеток с 10 мл холодного буфера разделения и центрифуги в течение 10 минут при 200 х г при 4 ° C. Ресуспендируют клеток в 400 мкл разделения буфера.
- Добавить 100 мкл CD11c микрошарики в 10 8 общего числа клеток. Хорошо перемешать и инкубировать в течение 15 минут в холодильнике (2-8 ° С).
- Вымойте клеток с 10 мл холодного буфера разделения и центрифуги в течение 10 минут при 200 х г при 4 ° С и отбросить супернатант.
- Ресуспендируют клеточный осадок в 3 мл холодного буфера разделения.
- Выполните магнитной сепарации использованием autoMACS Pro TM сепаратор, выбрав программу posseld. Сбор положительную фракцию (0,5 мл).
3. Обычная клетка дендритные (CDC) изоляции
- Инкубируйте обогащенный CD11c положительные суспензии клеток с анти-CD11c PE-Cy7 и anti-IA/IE (MHC-II)-FITC антител в течение 30 минут при 4 ° C. Оптимизированная концентрации антител составляет 0,5 мкг / 10 6 клеток.
- Вымойте клетки с холодной PBS/0.5% BSA и центрифуги в течение 10 минут при 335 х г при 4 ° C. Ресуспендируют клеток в 0,5 мл PBS/0.5% BSA и передает их через 40 нейлоновая сетка мкм.
- Переходите ксортировать клетки с помощью ячейки FACS Ария сортировщик в чистоте режиме. Добавить 100 мкл PBS/0.5% BSA в коллекцию трубы, чтобы предотвратить повреждение очищенных клеток. Держите ваши клетки в охлажденном температуру на протяжении всего процесса сортировки клеток.
4. Альтернативный протокол для получения суспензии отдельных клеток и CD11c + клеток обогащения
- В замены диссоциатор gentleMACS, основанные легочной ткани с шагом 1,5 могут быть переданы в 15 мл коническую пробирку, содержащую 5 мл коллагеназы раствора на легких и инкубировать в течение 1 часа при температуре 37 ° C. Vortex клетки каждые 15 минут, чтобы ресуспендирования фрагментов тканей. Disrupt ткани при прохождении пробы 6-8 раза и через 3 мл шприца, соединенного с иглой 20 G. Избегайте пузырей в процессе, в противном случае жизнеспособность клеток будут поставлены под угрозу. После суспензии отдельных клеток, получается, переходите к шагу 1.8.
- В замены AutoMACSPro ТМ разделениятор, магнитная изоляция для обогащения CD11c клеток, также может быть выполнена путем пропускания клеточной суспензии вручную через два MACS столбцов. Выбор соответствующих столбцах будет варьироваться в зависимости от размера выборки.
5. Представитель Результаты:
Легкого CDC определены как CD11c привет / MHC-II привет клеточной популяции. Как показано на рис. 1, CDC представляют меньший процент на 1,4% по сравнению с некоторыми другими тканями, таких как селезенка (4,8%). Однако, в отличие от селезенки, легких CD11c положительные клетки экспрессируют различные количества MHC-II, в том числе различных клеточных популяций, чем CDC. После одноклеточных подготовки, клетка выход общего числа клеток легких был примерно 3,0 до 3,8 х 10 7 клеток / легкого с жизнеспособность 60-70%, из которых немногим более 1% представлены CDC подмножество. Этот процент был увеличен после CD11c магнитная изоляция где общее легких CDC был увеличен примерно на 10 тРедакторы IME (> 16%) от оригинального препарата (рис. 2). Тем не менее, CD11c клеток, экспрессирующих низкие объемы MHC-II (CD11c привет / MHC-II вот, макрофаги), представленных высоким загрязняющих популяции клеток (> 70%), который был смешан с подмножеством легких CDC. Как показано на рис. 2Б, эти клетки были устранены после шага сортировки клеток, когда чистота CDC достигли> 96%. Обычная выход CDC после всей процедуры составляет 5 х 10 4 клеток / легких. Микрофотографии показывают морфологических характеристик CDC в виде округлых клеток с типичными дендритов (верхняя панель). С другой стороны, CD11c привет / MHC-II вот представлена морфологически различные подмножества, который показывает сотовой выступы, характерные для макрофагов (М ^, нижний график) 12.
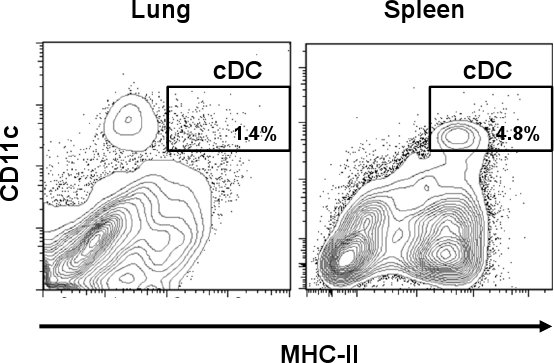
Рисунок 1. Дифференциальная DC частоты в легких мыши и селезенки. Легкогом ткани селезенки из C57BL / 6 мышей были собраны и обработаны коллагеназы. После коллагеназы пищеварения, клетки окрашивали анти-мышиных CD11c-PE-Cy7 и анти-мышь IA / IE-FITC. Представитель участки проточной цитометрии показывают процент CDC (CD11c привет / MHC-II привет) в легких и селезенке.
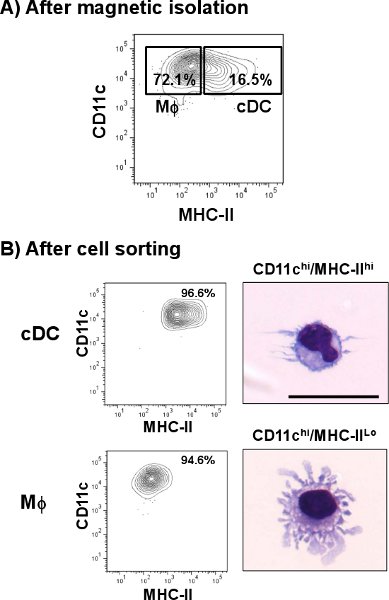
Рисунок 2. Выделение CDC легких мыши. Мышь легких суспензии отдельных клеток метили анти-CD11c микрошарики и проходил через автоматический сепаратор клеток.) Представитель график показывает процент CDC (CD11c привет / MHC-II привет) и Макрофаги (М ^, CD11c привет / MHC-II LO) населения после CD11c обогащения. Дальнейшее окрашивание фракции, обогащенной следуют с использованием анти-мышь CD11c-PE-Cy7 и анти-мышь IA / IE-FITC. Дважды положительные клетки были отсортированы и анализировали с помощью проточной цитометрии. Копределить их морфологии, клетки cytospun и окрашивали изменение Райта-Гимза окрашивания. B) представитель графики показывают проценты CDC и М ^ после сортировки клеток. Микрофотографии показывают представитель изображение легких CDC и легких М ^. Шкала бар = 20 мкм.
Обсуждение
Выделение легочных мыши DC является важным методом для изучения широкого спектра дыхательных стимулов. Процесс получения этих клеток включает в себя важные шаги, которые препятствуют потере клеток, а также жизнеспособности клеток и чистоты. Перфузии легкого до сбора поможет устранить...
Раскрытие информации
Авторы не имеют ничего раскрывать.
Благодарности
Авторы хотели бы поблагодарить Мэрилин Дитрих в цитометрии ЛГУ фонда основной поток за помощь в сортировке клеток и Питер Моттрам за его помощь в микрофотографии. Эта работа финансировалась бортпроводника Института медицинских исследований, LSU-Конкурентная исследовательской программы Award, и NIH / NIAID Гранты P20 RR020159 и R03AI081171.
Материалы
| Название реагента | Компания | Номер по каталогу | Комментарии (необязательно) |
| ACK буфера лизирующего | Invitrogen | D6-0005DG | |
| Анти-мышь CD11c (HL3) | BD Pharmingen | 5580979 | PE-Cy7 сопряженных |
| Анти-мышь IA / IE (269) | BD-Pharmingen | 553623 | FITC сопряженных |
| Collangenase типа 1А | Сигма | 9891-500мг | |
| Сотовые фильтры | BD Сокол | 352340, 352360 | |
| CD11c (N418) микрошарики | Miltenyi | 130-052-001 | |
| Я ДНКазы | Сигма | D5025-150KU | |
| Сбалансированные соли Хэнка решение | Invitrogen | 14170 | |
| Hepes буферного раствора | Invitrogen | 15630 | |
| Чашки Петри 60 мм | BD Сокол | 351016 | |
| GentleMACS ™ C труб | Miltenyi | 130-093-237 | |
| Нежный диссоциатор MACS | Miltentyi | 130-093-235 | |
| AutoMACS-Pro ™ | Miltenyi | 130-092-545 | |
| FASCS Aria | BD |
Ссылки
- Pulendran, B., Palucka, K., Banchereau, J. Sensing pathogens and tuning immune responses. Science. 293, 253-256 (2001).
- Banchereau, J. Immunobiology of dendritic cells. Annual Review of Immunology. 18, 767-811 (2000).
- Manicassamy, S., Pulendran, B. Dendritic cell control of tolerogenic responses. Immunol. Rev. 241, 206-227 (2011).
- Steinman, R. M., Cohn, Z. A. Identification of a novel cell type in peripheral lymphoid organs of mice. I. Morphology, quantitation, tissue distribution. J. Exp. Med. 137, 1142-1162 (1973).
- Asselin-Paturel, C. Mouse type I IFN-producing cells are immature APCs with plasmacytoid morphology. Nat. Immunol. 2, 1144-1150 (2001).
- Chan, C. W. Interferon-producing killer dendritic cells provide a link between innate and adaptive immunity. Nat. Med. 12, 207-213 (2006).
- Taieb, J. A novel dendritic cell subset involved in tumor immunosurveillance. Nat. Med. 12, 214-219 (2006).
- Guerrero-Plata, A., Kolli, D., Hong, C., Casola, A., Garofalo, R. P. Subversion of pulmonary dendritic cell function by paramyxovirus infections. Journal of Immunology. 182, 3072-3083 (2009).
- Larson, R. S., Springer, T. A. Structure and function of leukocyte integrins. Immunol. Rev. 114, 181-217 (1990).
- Sung, S. S. A major lung CD103 (alphaE)-beta7 integrin-positive epithelial dendritic cell population expressing Langerin and tight junction proteins. J. Immunol. 176, 2161-2172 (2006).
- Wang, H. Local CD11c+ MHC class II- precursors generate lung dendritic cells during respiratory viral infection, but are depleted in the process. J. Immunol. 177, 2536-2542 (2006).
- Bhatia, S. Rapid host defense against Aspergillus fumigatus involves alveolar macrophages with a predominance of alternatively activated phenotype. PLoS One. 6, e15943-e15943 (2011).
- Shao, Z., Makinde, T. O., McGee, H. S., Wang, X., Agrawal, D. K. Fms-like tyrosine kinase 3 ligand regulates migratory pattern and antigen uptake of lung dendritic cell subsets in a murine model of allergic airway inflammation. J. Immunol. 183, 7531-75381 (2009).
- Hao, X., Kim, T. S., Braciale, T. J. Differential response of respiratory dendritic cell subsets to influenza virus infection. J. Virol. 82, 4908-4919 (2008).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены