Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Парные Nanoinjection и электрофизиологии Анализ для выявления биологической активности соединений с использованием DROSOPHILA MELANOGASTER Гигантские системы волоконно
В этой статье
Резюме
Быстрый В естественных условиях Анализ для проверки нейромодуляторных соединений с использованием гигантских системы волокон (GFS) в DROSOPHILA MELANOGASTER Описано. Nanoinjections в голову животного, а также электрофизиологические записи GFS может выявить биологическую активность соединений на нейроны или мышц.
Аннотация
Скрининга соединений в естественных условиях деятельности могут быть использованы в качестве первого шага для выявления кандидатов, которые могут быть разработаны в 1,2 фармакологических агентов. Мы разработали новый nanoinjection / электрофизиологии анализа, что позволяет обнаружить эффекты биологически активных соединений модулирующим на функции нейронов схема, которая является посредником побега ответ дрозофилы MELANOGASTER 3,4. Наш анализ в естественных условиях, в котором используется волоконно дрозофилы гигантские System (GFS, рис. 1) позволяет скрининг различных типов соединений, таких как малые молекулы или пептиды, и требует лишь минимальных количествах, чтобы вызвать эффект. Кроме того, дрозофилы GFS предлагает большой выбор потенциальных молекулярных мишеней на нейроны или мышц. Гигантские волокна (GFS) синапсов электрически (щелевые контакты), а также химически (холинергических) на периферийных Synapsing интернейронов (PSI) и Tergo Trochanteral мышцы нейрона (TTMn) 5 6. И, наконец, нервно-мышечных соединений (NMJ) в TTMn и DLMn со скачком (TTM) и летных мышц (DLM) являются глутаматергической 7-12. Здесь мы показываем, как придать nanoliter количества соединений, при получении электрофизиологических внутриклеточных записей из системы гигантских волокон 13 и как осуществлять мониторинг воздействия соединений на функции этой цепи. Мы покажем специфику анализа с methyllycaconitine цитрата (MLA), нАХР антагонист, который нарушает PSI в DLMn связи, но не ГФ TTMn связи или функции NMJ в прыжке или полете мышцы.
Перед началом этого видео очень важно, чтобы вы внимательно смотреть и познакомиться с Юпитер видео под названием "Электрофизиологические Записи с Гигантские Путь волоконно Д. Melanogaster »от Августина и др. 7, как видео, представленные здесь, предназначены в качестве расширения для этого существующий метод. Здесь мы используем метод электрофизиологической записи и сосредоточиться подробно только на того парных nanoinjections и мониторинга техники.
протокол
1. Электрофизиология Rig Настройка
- Необходимое оборудование для установки электрофизиологии настройки подробно описан Августином и др.. В этом журнале 14. Пожалуйста, обратитесь к этой статье подробное объяснение электрофизиологических аппараты необходимы.
- Изменить ранее описанных электрофизиологии буровой установки на 14, добавив к шестой микроманипулятор, который содержит nanoinjector. Для облегчения доступа к голове животного он должен быть помещен между двумя стимулирующий электрод микроманипуляторов, как показано на рисунке 2.
- Перед началом эксперимента, убедитесь, что у вас есть удобный диапазон по всем осям вращения со всеми микроманипуляторов, и что все электроды, а также введения пипетки (см. шаг 2) может достигать животных.
2. Nanoinjection Настройка
- Nanoinjection настройка требует Nanoliter2000 (World Precisiна инструменты, Сарасоте, штат Флорида, США) или аналогичного типа инжектора, что позволяет контролируемых инъекций в nanoliter количествах.
- Подготовить инъекционной иглой использованием стекла микропипетки поставляется с инжектором, потянув их сопротивление 80-100 МОм с электродом съемника.
- Для плавного инъекции требуется конической микропипетки на 11-17 мкм открытие на 45 градусов (рис. 3).
- Медленно засыпки инъекции микропипетки с синтетическим маслом с помощью шприца Гамильтона по указанию руководства Nanoliter2000, чтобы не было воздушных пузырьков присутствуют.
- Тщательно обеспечить микропипетки на nanoinjector и подготовить его для загрузки соединения, освобождая избыток нефти по указанию Nanoliter2000 руководства.
- Установите инжектор на микроманипулятор и загрузить соединения, как указано в Nanoliter2000 руководства. Убедитесь, что кончик пипетки не нарушает при этомпроцедуры.
- Установить необходимое количество nanoliters, который будет введен в блоке управления форсунок по указанию Nanoliter2000 руководства. Пожалуйста, обратите внимание, что общий объем впрыска не должна превышать 100 NL. Мы обнаружили, что большее количество солевых растворов контроль может повлиять на функцию схемы GFS.
- Очень важно, чтобы инжектор отключен от блока управления во время записи приобретение, за исключением самой инъекцией, так как питание nanoinjector препятствует записи, которая видна как фоновый шум (рис. 4). Тем не менее, не отключайте питание к блоку управления, как он будет повторно установить его.
3. DROSOPHILA MELANOGASTER подготовка
- Анестезию 2 до 6 дневных мух с CO 2 или на льду, как описано выше 14,15.
- Как только неподвижные, использовать пинцет, чтобы передать животное в небольшом ш пластиным мягких зубных слепков, выбрав его из своей ноги. Обратите внимание, что мужчина плодовая муха весит около 1,0 мг и женщины плодовая муха весит около 1,2 мг, при этом соединение к массе тела соотношение отличается у мужчин по сравнению с женским мух. Поэтому рекомендуется использовать только одного пола для экспериментов.
- Как описано выше 14,15, тщательно смонтировать лету спинной стороной вверх и убедитесь, что грудная клетка и голова иммобилизованных с мягкой зубной воск, расположенных вокруг тела. Тщательно распространяться крылья так, чтобы они лежали перпендикулярно грудной клетки (рис. 2, C). Муха должна быть установлена с минимальным ущерб насколько это возможно.
4. Парные Nanoinjection / электрофизиологии
- Поместите установлен лету на буровой электрофизиологии с ее головой в сторону стимулирующие электроды.
- Сажать животное с соответствующей стимулирующей, наземных и регистрирующих электродов, как описано выше 14,15 (FРисунок 2, C). Если иное не желаемое, место одной записи электрод в DLM, а другой в TTM мышцы. Мышцы DLM находится в грудной клетке между передним Дорзо Центральной волос и средней линии лету. Мышцы TTM находится рядом с крылом вложения, между задней и передней Supra-Алар волосы лету 7.
- Совместите инъекции микропипетки, содержащие соединение с центром из трех глазков расположены на внутренней задней части головы, но не вводить еще (рис. 2, C).
- Перед соединением инъекции получить базовые записи ГФ TTM и GF в DLM пути гигантские системы волокон (GFS, Рисунок 1) с помощью стимуляции мозга. Чтобы сделать это, включите гигантских волокон (GFS) с 10 поездов из 10 стимулов (40-50 мВ) для каждой заданной длительности 0,03 мс при 100 Гц с 1 секунды задержки между поездами 14,15 (рис. 4). Дикий тип летит шульд быть в состоянии следовать один на один с такой скоростью стимуляции для DLM и TTM пути. Откажитесь от мух, если ГФ DLM и GF в TTM пути не следуют 100 Гц стимуляции в соотношении 1:1.
- Переключение в режим непрерывной стимуляции GF с одиночных импульсов в Гц 1 (рис. 4).
- Быстро подключить инжектор в блоке управления. Несмотря на фоновый шум будет мешать с 1 записей Гц стимуляции, не прекратить его.
- Осторожно вставьте инъекции микропипетки в головной капсулы лету прямо под кутикулу, и ввести нужное количество соединений в гемолимфы лету, сохраняя при стимуляции 1 Гц (рис. 4). Благодаря открытой системы кровообращения в лету, вся нервная система будет подвергаться воздействию соединения в течение нескольких секунд. Хотя определенный месте инъекции не является критической для доставки веществ в гемолимфе, мы находим области глазки, которые локализоватьг медиальной на самом спинной стороне головной капсулы, чтобы быть удобной площадкой, которая позволяет легко инъекции, что приводит к быстрому и равномерному распределению препарата.
- Немедленно снять инъекции микропипетки от места инъекции и отсоединить насос из блока управления, продолжая 1 Гц GF стимуляции до 1 мин после инъекции (рис. 4).
- Для того, чтобы выявить более тонкие эффекты соединений на GFS, подчеркивают гигантские волокна (GFS) с 10 поездов из 10 стимулов на 100 Гц, задержка в 1 секунду между поездами. Продолжайте проверять работу GF пути с этой парадигмой каждые 5 минут до 15 минут (рис. 4). Тем не менее, более короткие интервалы или более длительный период мониторинга также возможны.
- Для того, чтобы проверить, является ли соединение влияет на нервно-мышечного соединения (NMJs) в GFS, и, возможно, сузить эффекты соединения, переходите к активации моторных нейронов направленииTLY на грудном стимуляции. Для этого удалите стимулирующие электроды из глаз и заменить их на передней стороны грудной клетки для того, чтобы стимулировать моторных нейронов с 10 поездов из 10 стимулов на 100 Гц.
Примечание: электрофизиологии следы показано в видео не соответствуют эффект чистого введение красителя.
5. Представитель Результаты
Влияние антагонистов на PSI в DLM синапс гигантские системы волоконно
Methyllycaconitine цитрата (MLA) является антагонистом нАХР, специфичные для подтипа α7 нАХР. PSI в DLMn синапса в GF-DLM путь зависит от Dα7 нАХР подтип для нормальной работы, в то время как генетическое удаление Dα7 нАХР подтип не влияет на GF-TTM пути 5,6. Для того, чтобы продемонстрировать специфичность и чувствительность нашего анализа мы ввели ОМС в различных концентрациях (0, 0.02, 0.04, 0.08, 0,12 нг / мг, 46 п вводится) в голову животного (п = 10 в соединении лечения; п = 15 для солевого лечения). Только самцов мух (дикого типа генотип диких 10E) были использованы, и эффект соединения контролировали в общей сложности 15 минут после инъекции.
На рисунке 5 показана разница между базовой записей, полученных до инъекции и полученные после введения в ответ на ВПП и солевым раствором управления. Мы обнаружили, что введение ОМС привело к неспособности GF-DLM пути следовать один на один при 100 Гц стимуляции GFs в головном мозге, а GF-TTM путь остался неизменным. (Рис. 5, высшего и среднего следа, т-тест, проведенный между солевой контроля [0 нг / мг] и различные концентрации ОМС в каждый момент времени, если данные непараметрической [нормальности и равными дисперсиями испытания], в противном случае мы используем Манна-Уитни ранг Сумма испытаний. * р <0,001). Тем не менее, один к одному тesponse из DLM наблюдался, когда моторные нейроны были стимулированы непосредственно (рис. 5, нижний луч), демонстрируя, что функция NMJ из DLM и TTM не влияет на ОМС. MLA появились достичь максимального эффекта через 1 минуту после инъекции по 0,04, 0,08 и 0,12 нг / мг MLA вводят, так как не далее существенные изменения были отмечены в течение следующих 15 минут периода тестирования. Кроме того, соединение достигло максимального эффекта в 0,08 нг / мг, так как сильный ответ не наблюдалось с более высокой дозировкой 0,12 нг / мг.
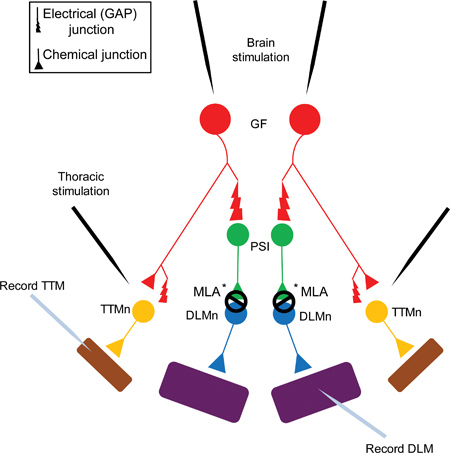
Рисунок 1. Гигантские Схема системы волоконно гигантского системы волокон (GFS). Гигантских волокон (GFS, показаны красным цветом) синапсов электрически (щелевые контакты), а также химически (холинергических) на периферийных интернейронов Synapsing (PSI, показаны зеленым цветом) и Tergo Trochanteral нейронов мышц (TTMn, показаны желтым цветом) 5. PSЯ к DLMn (спинного продольного нейронов мышц, показаны синим цветом) связи зависит от Dα7 нАХР подтипа 6. Наконец, нервно-мышечного соединения (NMJ) в TTMn и DLMn на скачок (ТТМ, как показано на фиолетовый) и летных мышц (DLM, как показано на фиолетовый) является глутаматергической.
Примечание: GF в PSI соединения электрических и химических веществ. Тем не менее, в shakB мутанты (которые не имеют щелевые контакты), ответа не может быть записан с DLM при раздражении GFs в головном мозге, что свидетельствует о том, что химические компоненты в отсутствие электрического соединения не является достаточным, чтобы вызвать потенциал действия в PSI 5,16-18. Потому что ГФ PSI связи зависит разрыв соединения, эта цифра показывает только GAP перехода в синапсах для простоты.

Рисунок 2.
Микроманипуляторы си др. меры.
- Изменение настройки ранее опубликованного протокола 14 используется, чтобы соответствовать инъекции микроманипулятор для парных записей GFS с одновременным nanoinjections. Установлены лету подготовка ориентирована с головой мухи к экспериментатору. Введение микроманипулятор (№ 1) находится в передней части экспериментатор между двумя манипуляторами для вольфрама стимулирующих электродов (2 # и # 3). Два микроманипуляторов для стекольной записи электроды (№ 4 и № 5) расположены на левой и правой стороны соответственно. Микроманипулятор для вольфрамовым электродом земле (№ 6) находится далеко в спине или на левой стороне (см. здесь) или на правой стороне.
- Крупным планом вид сверху договоренностей различные электроды и инъекцию микропипетки.
- Правильно смонтированный D. MELANOGASTER пронзил с электродами и инъекции микропипетки готово для инъекций. Обратите внимание, что животное телоустанавливается с грудной клетки по горизонтали и крыльями распространено. Воск надежно обернут вокруг его тела предотвращения животное двигаться. Кроме того, в боковом электроде (№ 6, в брюшной полости), стекло записи электроды (№ 4 и № 5, в грудной клетке, подчеркнул темные очертания) и стимулирующие электроды (№ 2 и № 3, по одному в каждом глазу ) являются пронзил на месте, как описано выше 14. Введение микропипетки (# 1) правильно выровнен с центром из трех глазков (в кружке). Введение инъекций микропипетки должны быть размещены в этой области.
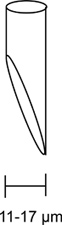
Рисунок 3. Скошенные микропипетки инъекций. Схема правильно скошенными микропипетки показано здесь. Электрод открытие должно скошенные под углом 45 градусов и имеют отверстия от 11 до 17 мкм. Правильное скошенными микропипетки инъекции имеет решающее значение для гладкого инъекции с минимальным гamage к лету.
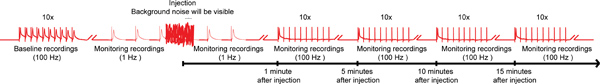
Рисунок 4. Общая схема nanoinjection / электрофизиологии протокола. Представитель диаграмм общей схеме nanoinjection / электрофизиологии протокола. Начните с получения базового записи, стимулируя гигантских волокон (GFS) при частоте 100 Гц с 10 поездов из 10 стимулов каждый (только один поезд показано на рисунке). Перед инъекцией, начинаются 1 Гц стимуляции одной секунды друг от друга. Во время впрыска (инжектор время подключен к блоку управления), вы будете наблюдать значительный фоновый шум, но не прекратит запись. После инъекции (и инжектор отключен от блока управления), продолжают 1 Гц стимуляции около 1 минуты. Наконец, перейдем к подчеркнуть GFs 10 поездов из 10 стимулов на 100 Гц и продолжает проверять работу GF пути с этой парадигмой каждые 5 минут до 15 минут. Примечание: записи Wпрежде чем управлять, чтобы создать общую схему и не представляют собой конкретный результат. Не в масштабе, не все следы показано на рисунке. Нажмите здесь, чтобы увеличить изображение .
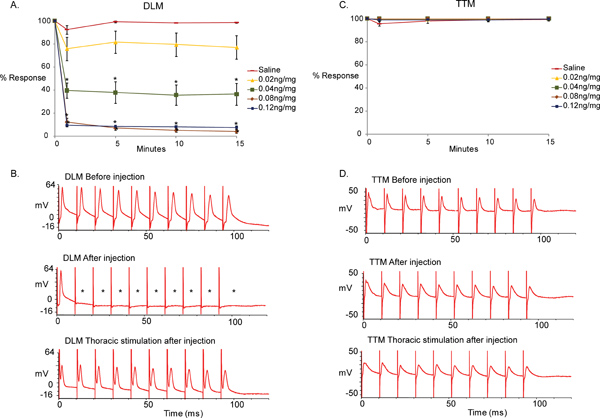
Рисунок 5. Эффект ОМС в GFS.
- Графическое изображение последствий α7 нАХР антагонист Methyllycaconitine цитрата (MLA) на GF-DLM путь дрозофилы при различных концентрациях (0, 0,02, 0,04, 0,08, 0,12 нг / мг п = 10 в соединении лечения. п = 15 для солевого лечения). Только через одну минуту после инъекции, значительный и непосредственный эффект наблюдался с 0,04 нг / мг ОМС. Значительный эффект также наблюдается и с 0.8ng/mg 0.12ng/mg ОМС на 100 Гц стимуляции GFS. Статистически значимых различий было отмечено, между солевой контроля и 0,02 нг / мг ОМС. Кроме того, я не изменитсяп. эффект наблюдался через 1 минуту после инъекции во время испытания (15 минут). Т-тест проводился между солевой управления (0 нг / мг) и различных концентраций ОМС в каждый момент времени. Уровни представлены как среднее + / - SEM, * р <0,001.
- Пример следы DLM ответы на 100 Гц стимуляции. Лучшие следа показывает реакцию мышц перед ГНД инъекции при стимуляции GF в головном мозге. Обратите внимание, что мышцы в состоянии реагировать на каждый раздражитель один на один на 100 Гц. Ближний след отображает ответы DLM после инъекции MLA (0,12 нг / мг). Обратите внимание, что мышцы не в состоянии реагировать на каждый раздражитель один на один на 100 Гц. (Звездочки). Нижняя линия показывает ответы DLM одного и того же препарата (0,12 нг / мг) при прямой стимуляции моторных нейронов в области грудной клетки. Потому что DLM отвечает один-к-одному 100 Гц с грудным стимуляции, отсутствие ответов с черепно-мозговой стимуляции можно отнести к холинергической PSI-DLMn связи.
- Графическое изображение эффекты различных концентраций MLA (0, 0,02, 0,04, 0,08, 0,12 нг / мг) на GF-TTM пути. Никакого существенного воздействия были замечены между физиологическим раствором (0 нг / мг) и соединение инъекций в любой момент времени. Т-тест проводился между солевой управления (0 нг / мг) и различных концентраций ОМС в каждый момент времени, * р <0,001.
- Пример следы TTM ответы на 100 Гц стимуляции. Лучшие следа показывает реакцию мышц перед ГНД инъекции на GF активации стимуляция мозга. Обратите внимание, что мышцы в состоянии реагировать на все раздражители в 100 Гц. Ближний след показывает ответы DLM после инъекции MLA (0,12 нг / мг). Ответы TTM мышцы на стимуляцию GF в головном мозге остаются один на один. Нижняя линия показывает ответы TTM одного и того же препарата до 100 Гц стимуляции моторных нейронов в области грудной клетки (0,12 нг / мг).
Обсуждение
Nanoinjection / электрофизиологии биопроб, представленные здесь позволяет быстрого скрининга соединений в нервной системе плодовой мушки. Это роман в естественных условиях техника, которая требует небольшого количества соединений, чтобы выявить влияние на различные молекулярные мише...
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Мы хотели бы выразить признательность членам Марий лаборатории и Godenschwege лаборатории, в частности, Алина Йонезава, комментарии и помощь с этим протоколом. Эта работа финансировалась Национальным институтом неврологических расстройств и инсульта грант R21NS06637 в FM и TAG, AB финансировалось Национальным научным фондом награды число 082925, URM: интегративной биологии для будущих исследователей.
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента | Компания | Номер по каталогу | Комментарии |
| Запись стеклянных электродов: боросиликатного стекла капилляров | Инструменты Всемирной Precision | 1B100F-4 | 1,0 мм диаметром, 0,58 мм ID |
| Стимулятор | Трава инструменты | Модель S48 | |
| Усилитель | Получение инструментов Инк | Модель 5А | |
| Сбор данных программное обеспечение: DIGIDATA | Molecular Devices | Модель 1440A | |
| Сбор данных программного обеспечения: pCLAMP | Molecular Devices | Версия 10 | |
| Стереомикроскоп Wго волоконно-оптической подсветкой кольцо микроскоп | AmScope | SM-4Т Модель HL250-AR | |
| Анатомический возможности для монтажа | AmScope | SM-2TZ | |
| Кайт Руководство Микроманипулятор и наклона базы | Инструменты Всемирной Precision | Модель M3301 # Кайт: Модель # кайт-M3-L | |
| DROSOPHILA MELANOGASTER Дикий 10E генотип (дикого типа) | Блумингтон сток центр | Лот № 3892 | |
| Вертикальная пипетки съемник | Дэвид Kopf Instruments | Модель 700c | |
| Инъекция стекло микропипетки: Боросиликатное стеклянные капилляры | Инструменты Всемирной Precision | Catalogue # 4878 | 1.14mm диаметр, 0,5 мм ID |
| Силиконовый масло | Рыбак | Catalogue # S159-500 | |
| Beveler | Саттер машиностроительный завод | KT Brown Тип Модель # BV-10 | |
| Nanoliter2000 | Инструменты Всемирной Precision | Catalogue # B203XVY | |
| Синий пищевой краситель | Маккормик | N / A | Состав: вода, пропиленгликоль, FD & C Blue 1 и 0,1% пропилпарабен (консервант). |
| Methyllycaconitine цитрата (MLA) | Tocris Bioscience | Каталог # 1029 | |
| Пластиковые палочки воска | Гигиенические Corporation (Акрон Огайо, США) |
Ссылки
- Koehn, F. E., Carter, G. T. The evolving role of natural products in drug discovery. Nat. Rev. Drug Discov. 4, 206-220 (2005).
- Miljanich, G. P. Ziconotide: neuronal calcium channel blocker for treating severe chronic pain. Curr. Med. Chem. 11, 3029-3040 (2004).
- Layer, R. T., Wagstaff, J. D., White, H. S. Conantokins: peptide antagonists of NMDA receptors. Curr. Med. Chem. 11, 3073-3084 (2004).
- Lewis, R. J. Conotoxins as selective inhibitors of neuronal ion channels, receptors and transporters. IUBMB Life. 56, 89-93 (2004).
- Allen, M. J., Godenschwege, T. A., Tanouye, M. A., Phelan, P. Making an escape: development and function of the Drosophila giant fibre system. Semin. Cell Dev. Biol. 17, 31-41 (2006).
- Fayyazuddin, A., Zaheer, M. A., Hiesinger, P. R., Bellen, H. J. The nicotinic acetylcholine receptor Dalpha7 is required for an escape behavior in Drosophila. PLoS biology. 4, e63 (2006).
- Jan, L. Y., Jan, Y. N. L-glutamate as an excitatory transmitter at the Drosophila larval neuromuscular junction. The Journal of physiology. 262, 215-236 (1976).
- Usherwood, P. N., Machili, P., Leaf, G. L-Glutamate at insect excitatory nerve-muscle synapses. Nature. 219, 1169-1172 (1968).
- Marrus, S. B., Portman, S. L., Allen, M. J., Moffat, K. G., DiAntonio, A. Differential localization of glutamate receptor subunits at the Drosophila neuromuscular junction. The Journal of neuroscience : the official journal of the Society for Neuroscience. 24, 1406-1415 (2004).
- Petersen, S. A., Fetter, R. D., Noordermeer, J. N., Goodman, C. S., DiAntonio, A. Genetic analysis of glutamate receptors in Drosophila reveals a retrograde signal regulating presynaptic transmitter release. Neuron. 19, 1237-1248 (1997).
- Qin, G. Four different subunits are essential for expressing the synaptic glutamate receptor at neuromuscular junctions of Drosophila. The Journal of neuroscience : the official journal of the Society for Neuroscience. 25, 3209-3218 (2005).
- Schuster, C. M. Molecular cloning of an invertebrate glutamate receptor subunit expressed in Drosophila muscle. Science. 254, 112-114 (1991).
- Tanouye, M. A., Wyman, R. J. Motor outputs of giant nerve fiber in Drosophila. Journal of. 44, 405-421 (1980).
- Augustin, H., Allen, M. J., Partridge, L. Electrophysiological Recordings from the Giant Fiber Pathway of D. melanogaster. J. Vis. Exp. (47), e2412 (2011).
- Allen, M. J., Godenschwege, T., Zhang, B., Freeman, M. R., Waddell, S. . Drosophila Neurobiology. , 215-224 (2010).
- Blagburn, J. M., Alexopoulos, H., Davies, J. A., Bacon, J. P. Null mutation in shaking-B eliminates electrical, but not chemical, synapses in the Drosophila giant fiber system: a structural study. J. Comp. Neurol. 404, 449-458 (1999).
- Thomas, J. B., Wyman, R. J. Mutations altering synaptic connectivity between identified neurons in Drosophila. J. Neurosci. 4, 530-538 (1984).
- Baird, D. H., Schalet, A. P., Wyman, R. J. The Passover locus in Drosophila melanogaster: complex complementation and different effects on the giant fiber neural pathway. Genetics. 126, 1045-1059 (1990).
- Gorczyca, M., Hall, J. C. Identification of a cholinergic synapse in the giant fiber pathway of Drosophila using conditional mutations of acetylcholine synthesis. J. Neurogenet. 1, 289-313 (1984).
- Allen, M. J., Murphey, R. K. The chemical component of the mixed GF-TTMn synapse in Drosophila melanogaster uses acetylcholine as its neurotransmitter. The European journal of neuroscience. 26, 439-445 (2007).
- Mejia, M. A novel approach for in vivo screening of toxins using the Drosophila Giant Fiber circuit. Toxicon. 56, 1398-1407 (2010).
- Stork, T. Organization and function of the blood-brain barrier in Drosophila. J. Neurosci. 28, 587-597 (2008).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены