Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Прижизненное микроскопия Селезенка: Количественный анализ паразитов Мобильность и кровотока
В этой статье
Резюме
Мы покажем, метод для выполнения прижизненной микроскопии селезенки использования GFP трансгенные малярийных паразитов и количественной оценки подвижности паразита и приток крови в этом органе.
Аннотация
Появлением прижизненной микроскопии в экспериментальных моделях малярии грызунов позволило значительный прогресс в знании паразит-хозяин 1,2 взаимодействий. Таким образом, в естественных изображений малярийных паразитов во время пре-эритроцитарных этапы выявили активный вход паразитов в кожу лимфатических узлов 3, полного развития паразита в коже 4, и формирование гепатоцитов полученных merosome для обеспечения миграции и выпуск мерозоиты в кровь 5. Более того, развитие отдельных паразитов в эритроцитах был недавно документально использованием 4D визуализации и бросил вызов нашим текущим видом на белок экспорта в борьбе с малярией 6. Таким образом, прижизненных изображений радикально изменила наш взгляд на ключевые события в развитии Plasmodium. К сожалению, исследования динамических прохождения малярийных паразитов через селезенку, основных лимфоидных органов изысканно адаптированы, чтобы очистить зараженный красный бlood клеткам не хватает из-за технических ограничений.
Использование мышиной модели малярии Plasmodium yoelii в BALB / C мышей, мы внедрили прижизненной визуализации селезенки и сообщил дифференциальных реконструкции оно и соблюдение зараженных эритроцитов (pRBCs), чтобы барьер клетки фибробластов происхождения в красной пульпе при инфекции нелетального паразита линии P.yoelii 17X, в отличие от инфекций с P.yoelii 17XL смертельным паразитом строке 7. Для достижения этих выводов специальной методологии использования ImageJ свободного программного обеспечения был разработан, с тем характеристику быстрой трехмерной движение одного pRBCs. Результаты, полученные с этим протоколом позволяют определить скорость, направленность и время пребывания паразитов в селезенке, все параметры решения соблюдение в естественных условиях. Кроме того, мы сообщаем методология количественного кровотока использовании прижизненной микроскопии и использованием DIFразличным красители, чтобы разобраться в сложной структуре микроциркуляторного из селезенки.
Этика заявление
Все исследования на животных были проведены на животных объектах университета Барселоны в соответствии с руководящими принципами и протоколов утвержденным Комитетом по этике защиты животных эксперименты в Университете Барселоны CEEA-UB (Протокол № DMAH: 5429). Женский BALB / C мышей 6-8 недельного возраста были получены из Charles River Laboratories.
протокол
Этот метод был использован в исследованиях сообщается в 7.
1. Животное инфекции зеленый флуоресцентный белок (GFP) паразиты трансгенных
- П. yoelii-GFP трансгенные линии 17XL и 17X были получены с использованием тех же векторов, стратегии таргетирования и протоколов, описанных в других местах для P. berghei 8. Они выражают мутанта три варианта GFP 9 под вездесущий промоутер П. berghei фактора элонгации 1 (Pbeef1a), которая направляет учредительных выражения GFP для паразита цитозоля в течение всего внутри эритроцитарного цикла развития.
- Inject животным внутрибрюшинно зараженные красные кровяные клетки (pRBCs) П. yoelii-GFP трансгенные линии 17XL и 17X полученные из хвоста кровь донора мышей на 5-10% паразитемии и разводят в PBS. Используйте дозы 5x10 5 pRBCs / мышь для достижения периферической паразитемии в 1% на 3-й день после infectiна (пи).
- На 3-й день пи, убедитесь, что паразитемии мышей, зараженных обоими линиями паразит же, делая мазок крови с каплей крови хвостом следуют Гимза окрашивания и наблюдения в световой микроскоп с 100х цель нефти. Паразитемии оценивается путем расчета процента pRBCs более общего эритроцитов в трех оптических полей около 300 БС.
- Управление животных, которым вводили FITC-меченого эритроциты могут быть использованы для характеристики движения этих клеток в нормальной селезенки.
2. Маркировка красные кровяные клетки с FITC и закачки с контрольными животными
- Соберите 1 мл крови через общую сердечной пункции BALB / C мышей в 200 мкл PBS содержащие этилендиаминтетрауксусную кислоты (ЭДТА) (100 г / л, рН 7,4) и мыть РБК гранул в PBS / ЭДТА (0,1 г / л, рН 7,4) путем центрифугирования при 300 мкг в течение 5 минут (мин) при комнатной температуре (RT).
- Ресуспендируют 200 мкл РБК гранул в 300 иму; л PBS / ЭДТА (0,1 г / л, рН 8), содержащих FITC (10 г / л) и инкубировать в течение 2 часов при комнатной температуре в темном месте при легком помешивании. После этого времени, супернатант удаляли, а клетки промывают пять раз (300 мкг, 5 мин, РТ) в PBS / ЭДТА (0,1 г / л, рН 7,4).
- Для экспериментов в естественных условиях, развести 10 мкл FITC-меченого РБК осадок в 200 мкл PBS и вводят внутривенно Balb / с мышью, чтобы достичь 1% FITC-эритроцитов в обращении.
3. Хирургические процедуры
- Подготовка инъекционных анестетиков состоят из 100 мг / кг кетамина и 5 мг / кг мидазолама на дозу в зависимости от веса животного. Inject мышь внутрибрюшинно одну дозу анестетика. Readminister половину дозы каждые 30 мин для поддержания мыши полный рабочий день под наркозом.
- Держите мышь теплой и убедитесь, что мышь полностью под наркозом (обычно через 5-20 мин), зажимая ногу площадку перед переходом.
- Для того, чтобыоблегчить внутривенного введения вещества в ходе эксперимента, иглу хвостовую вену мыши, используя 27G канюли. Убедитесь, что игла имеет все возможности внутри вены путем введения 20-50 мкл солевого буфера и заклейте его скотчем. Если он препятствует, повторите катетеризации перед вены. Будьте осторожны, чтобы не вводить пузырьков воздуха.
- Expose нижнюю часть селезенки через небольшой разрез в коже и мускулатуре на левой стороне спины животного. Место селезенку, где меньше движения дыхания наблюдается и применяют PBS на поверхность подвергается держать его в чистоте шерсти мыши и увлажненной.
- Уплотнение крышки скольжения 60x24mm с цианакрилатного клея (супер клей Loctite-3) для кожи вокруг селезенки, чтобы визуализации.
4. Визуализация жизни паразитов в селезенке
- Прижизненное экспериментов микроскопии проводились в Leica TCS SP5-конфокальной микроскопии (LeicaMicrosystems, Гейдельберг, Германия), оснащенных системой инкубации с контролем температуры, APO 63x глицерина погружения объектива (NA 1.3), резонансный сканер, 8000 линий / с и аргона (488 нм) и He-Ne (594 нм, 633 нм) лазеров. Дополнительная лазеры, такие как синий диод (405 нм) и диодной насоса твердом состоянии (561 нм), которые могут потребоваться для возбуждения зондов приведены в таблице 1.
- Место животных на стадии микроскоп с кавер-поскользнулся селезенки вниз к цели. Общий вид микроциркуляторного структура селезенки опционально может быть визуализированы использовании 20-кратного объектива. РБК отражение контраст будет полезен для выбора различных регионах, представляющих интерес для изображения при большем увеличении впоследствии.
- Фокус выбранных регионах, представляющих интерес с глицерином погружения 63x объектив с использованием ткани аутофлюоресценция. GFP паразитов наблюдаются, проходящих через различные области селезенки.
- Флуоресценции регистрируется на двух разных чаnnels (возбуждение / излучение длиной волны 488/505-580 нм для FITC / GFP и 488/570-630 нм для ткани аутофлюоресценция) с отверстием установлена в 3,0 Эйри единиц. РБК отражения (488/480-495 нм), вместе с флуоресцентными красителями для обозначения крови сосудистой (см. Таблицу 1), используются для получения дополнительной информации о зоне будучи отображаемого и в кровоток экспериментов, описанных ниже.
- Захват изображений с помощью пяти Z-стеки покрытия глубиной 8 мкм из-за трехмерности орган, со скоростью 8 кГц для создания видео в 1,5 мин.
- Запись видеоклипов различных зон селезенки для количественного анализа.
5. Прижизненное микроскопии микроциркуляторном русле селезенки и получения изображений для измерения кровяного потока
- Vital флуоресцентных зондов, растворенных в изотонический солевой раствор могут быть введены в хвостовую вену во время эксперимента, чтобы изображение сосудистой и проникнуть в суть структуры селезенки. Списокзондов и их применение представлены в таблице 1 10.
- Чтобы пометить сосудистой системы с люминесцентными декстран, подготовить 1 мг декстрана 70 кДа помечены Texas Red в 100 мкл солевого буфера.
- Используйте канюлированные хвостовую вену для введения флуоресцентных декстран для животного, образ.
- Установить суда по горизонтали, в направлении лазерного сканирования, по оптического вращения поля (не затрагивающие скорость). Используйте ху и х строчной развертки мод в центральной просвет сосуда. Использование двунаправленного сканирования с линии среднем на 32 со скоростью 8 кГц для получения образа 512x512 пикселей.
- Получение изображений судов на три различных канала (возбуждение / излучение длиной волны 488/505-580 нм, 594/605-660 нм, 488/480-495 нм для FITC / GFP, декстран-Техас Красное и эритроцитов отражение, соответственно).
- Возьмите образы судов различного диаметра и более различных фаз сердечного цикла, чтобы компенсировать колебания. В этих образах, полосы в результате перемещения клетки будут использоваться для количественного кровотока 11.
6. Обработка изображений и количественный анализ мобильности паразита использованием программного обеспечения ImageJ
- Создайте видео в реальном времени от последовательности изображений генерируется с использованием ImageJ программного обеспечения (версия 1.39o, Уэйн Rasband, NIH, www.macbiophotonics.ca ).
- Открытая ". LiF" файл в соответствии ImageJ "xyzct" последовательность и разделенных каналами.
- Регистрация некоторую полезную информацию из метаданных файла: dblvoxelX-воксела ширины, dblvoxelY-воксела высоты, dblvoxelZ-воксела углубленного и рамы интервал между последовательными Z-кадров, а также между стеками. Эта информация будет использована для калибровки.
- Вычтите аутофлюоресценция (канал 2), GFP-паразита изображения (канал 1). Фильтры изображений с Gaussian Blur = 1. Вспомните, пожалуйста, что с помощью Gaussian Blur Filter в изображениях должны быть заявлены к ПУБЛИКАЦИИнс. Сохранить файл "animal1_m1_substract.seq".
- Z-закодированных цветное видео создан как вспомогательный материал для количественного анализа подвижность паразита, как это будет способствовать одночастичных идентификации быстро движущихся частиц и Z-движение характеристику.
- Преобразование стека изображений 5D, с третьим измерением будучи Z и четвертое измерение будучи времени. Дайте другим цветом, чтобы каждый Z и наложения.
- Проект все Z использованием максимальной интенсивностью в течение всех сроков для создания Z-закодированы цвета видео. Сохранить как "animal1_m1_Z_color.avi".
- Классификация и маркировка всех частиц, которые появляются в первые 10 временных рамок видео в зависимости от количества кадров с места жительства (от 1 до 10). В каждом видео, 20 частиц будут отслеживаться следующие пропорции получены. В общей сложности, 120 паразитов будет количественно от 3 животных, используя шесть видео / животных, представляющих различные зоны селезенки.
- Доклад кадров жительства на каждого Zи за весь фильм для всех частиц быть определены количественно.
- Выполните 4D (х, у, г, г) ручного отслеживания частиц с использованием MTrackJ плагин (автор Е. Meijering). Откройте файл "animal1_m1_substract.seq" как изображение 5D и набор свойств изображения, используя информацию из зарегистрированных до пикселя ширина, высота, глубина (в мкм) и стек интервал (в секундах). Настройка отслеживать параметры следующим образом: "перейти на следующий раз" и "применять локальный курсор яркий centroid/25x25pixel". Настройка отображения: "показать происхождение", "показать изображение", "показать активный трек", "показать только треки в нынешнем каналы", "показать только точки трека в текущее время".
- Добавить трек для каждой частицы. Рассмотрим движение в Z-оси, только если смещение превышает 6 мкм (средний диаметр PRBC). Следуйте частиц с максимальным числом 100 кадров.
- Сохранить х, у, г и т координаты, измеренные с трассы, как "animal1_m1_p1". XLS.
- Меры по перемещению (D = SQRT ((х окончательноеНачальное-х) 2 + (у-у окончательное Начальное) 2 + (Z-Z окончательного Начальное) 2); длина пути (Р = Σ п = 0 → окончательного SQRT ((х п + 1-х п) 2 + ( уп +1-уп) 2 + (Z N +1-Z N) 2) при п указывает каждая позиция отслеживается; среднюю скорость и время пребывания можно рассчитать, используя значения из х, у, г, т координаты гусеничных калиброванный в соответствии с данными регистрации. Направленность частиц определяется как частное от деления перемещений по сравнению с длиной пути при значениях, близких к 1 указывает направленное движение и ценности близки к 0 означает, сдержанные движения 12. шаблон для расчетов способствует прилагается.
7. Расчет объемного кровотока
- Объемный поток крови оценивается как Q = V * π * D V 2 / 4, с V, эритроцитов скорости по сечениюй Д В, просвет диаметр сосуда 11.
- Для расчета V, измерьте углы (θ) из пяти полос частиц показывает яркое отражение (РБК) и четырех частиц полосы показывает зеленую флуоресценцию (PRBC-GFP) в каждом изображении х ImageJ использованием программного обеспечения. Мера просвета диаметра сосуда на изображение ху.
- Скорость, то в виде V = 1/tan (θ) * D е / Д В нормализовать для эритроцитов (D е = 6 мкм) и диаметром просвета сосуда.
- Количественная минимум три судна с различными диаметрами и пять х изображений для каждого судна.
8. Статистический анализ
- Для статистического анализа, участок направленности, средней скорости и времени пребывания, как плотность распределения и использования равенство-оф-тест медианы в STATA (IC10) для оценки различий между двумя линиями паразита.
9. Представитель Результаты
Прижизненное IMAГинг из GFP паразитов в селезенке выявило различия в мобильности между двумя штаммами паразитов. Количественный анализ мобильности параметры одного паразитов указано снижение скорости, отсутствие направленности и дополненное время пребывания паразитов мышей, инфицированных штаммом 17X. Более того, объемного кровотока в сосудах не было изменено между штаммами 7. Техническая процедура представлена на рисунке 1а. На рисунке 1б показан общий вид нормальной селезенки мышей вводили FITC-меченого эритроцитов, с увеличения в красной мякотью, а другой сосуд (рис. 1В, увеличение в 1 и 2, соответственно). Сосудистую свидетельствовали инъекционных 70 кДа декстрана-Texas Red вместе с эритроцитов отличие отражения. Другие флуоресцентных красителей приведены в таблице 1, могут быть использованы для получения информации об органе время отображаемого, таких как Hoechst (рис. 1C, 1D).
В режиме реального времени изображения паразитов 17XL и 17X штамм фильмы, представленные в 1 и 2,с некоторыми 17X-PRBC (Movie 2) показывает подвижного круга поведения. Количественный анализ параметров подвижности было достигнуто за счет отслеживания отдельных паразитов с помощью Z-кодированных изображений цвета. Рисунок 2А показывает Z-проекции Z-закодированный цвет стек, где окруженные частица появляется двигаться в разных плоскостях. Рисунок 2B и 2C представляют дорожек для различных паразитов в 17X и 17XL инфекции, соответственно. Результаты направленность и время пребывания всех частиц количественно представлены в виде карты распределения плотности населения паразита на рисунке 2D и 2E, соответственно. Для контроля потока крови в селезенке использовании прижизненной микроскопии, полосы, полученные в образы х центральных просвет сосудов в результате движения эритроцитов измеряли для расчета скорости 11. Изображения показывают ху проверки судна (рис. 2F) с соответствующими х строчной развертки (рис. 2G).
| Флуоресцентные Probэлектронной | Локализация | 1 фотон возбуждения (нм) | 2 фотонного возбуждения (нм) | Обнаруженные выбросов (нм) | Количество / вес мыши |
| Hoechst 33342 | Мембрана-проникающий ДНК-связывающих зонда. Это этикетки ядра всех клеток (живые и мертвые) после внутривенного введения. | 405 | 800 | 410-480 | 12,5 г / кг |
| Пропидий йодида | Мембрана-impermeant ДНК-связывающих зонда. Это этикетки ядрах клеток с нарушением мембраны (апоптоза и некроза клеток). | 561 | 800 | 570-650 | 250 мг / кг |
| 70000 мол вес Декстран-флуоресцентный (FITC, Texas Red) | Жидкость фазе маркер, который повышает контрастность плазме. | FITC 488 Texas Red 594 | 800 | 500-540 600-650 | 50 мг / кг |
| Натрий Fluorescein | Массовая жидкости фазы альбумина маркер, который повышает контрастность плазме. | 488 | 800 | 500-540 | 2 ммоль / кг |
| Evans Blue | Массовая жидкости фазы альбумина маркер, который повышает контрастность плазме. | 633 | й | 645-700 | 20 мг / кг |
| Родамина R6 | Vital зонд, который накапливается в митохондриях активные. Это этикетки эндотелий и циркулирующие лейкоциты после внутривенного введения. | 561 | 800 | 570-650 | 25 мг / кг |
| Fluospheres-1micron диаметра | Бисер, которые uptaken клетками с фагоцитарной активности. | 488 | 800 | 500-540 | й |
| Alexa488 меченных фибрина IIβ цепи-специфических антител | Зонд, что метки фибрина IIβ цепи | 488 | 800 | 500-540 | 0,3 мг / кг |
Таблица 1. Флуоресцентные зонды для прижизненной микроскопии. Vital флуоресцентных красителей с различной локализации, которые могут использоваться для обозначения селезенки в естественных условиях. Возбуждение / излучение (Exc / ет) диапазонов для использования с одного фотона (или двух-фотонной микроскопии) предоставляются. Дозы указаны растворяют в 0,1-0,2 мл физиологического раствора буфера и вводят в хвостовую вену мыши. [Й: не определена в этом исследовании.
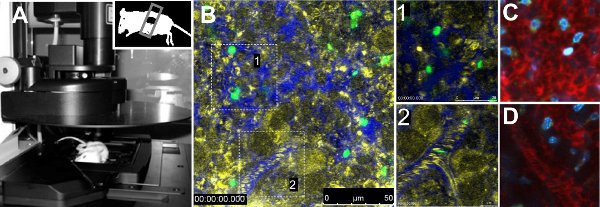
Рисунок 1. Прижизненное микроскопии селезенки. А. Leica TCS SP5-конфокальной микроскопии одним кликом размещены на столик микроскопа. Мышь нижнюю часть селезенки выявлены и запечатаны с крышкой-скольжения. B. Изображение представителя область селезенки незараженных животных вводили FITC-меченого эритроцитов и70 кДа декстрана-Texas Red для визуализации сосудов. Отражение (желтый), декстрана (синий) и FITC-эритроцитов (зеленый) показаны. Раздутия в белые прямоугольники представляют открытом обращении (1) и крупный тираж (2) областях. Открытого обращения (C) и близко циркуляции (D) окрашивали декстрана 70 кДа (красный) и Hoechst 33342 (синий).
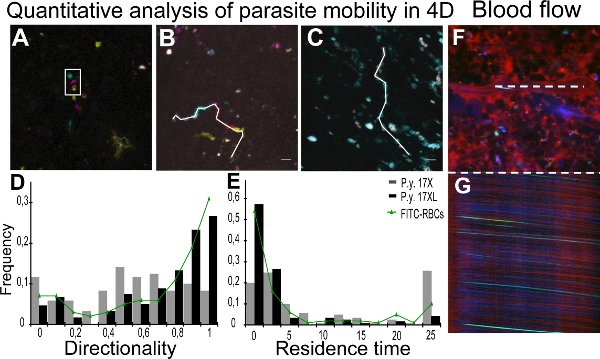
Рисунок 2. Количественная оценка паразита мобильности и кровотока. Переменного тока. Количественный анализ движения частиц в четырех измерениях (4D) облегчается с помощью цветных обработки изображений. A. Отслеживание был проведен с глубины информацию из Z-закодированных цветных изображений, представлены с помощью проекции максимальной интенсивности пяти различных глубинах. Белый прямоугольник представляет тот же частицы в различные Z в одной временной точке. Различные позиции из-за временных провалы между приобретениемразличных изображений Z. Глубина код:. Желтые (0 мкм), оранжевый (2 мкм), розовый (4 мкм), синий (6 мкм), зеленый (8 мкм), B, C. Время прогнозы движения частиц с любой интервал времени в цветные, как: серый (0-2.4 сек), голубой (2.4-4.8 сек), пурпурный (4.8-7.0 сек), красный (7.0-9.4 сек) и желтый (9.4-11.8 сек). Белая линия представляет 4D ручного отслеживания частиц 17X (11,8 сек) (B) и 17XL (4,8 сек) (С) GFP паразитов использованием MTrackJ. D, E. Распределение плотности GFP частиц по значениям направленности (D) и Время пребывания (E). Данные соответствуют до 120 частиц в каждой строке паразитов и 100 FITC-меченого эритроцитов из трех независимых экспериментов проанализированы с равенством-оф-медианы тест. 17X/17XL/FITC-RBCs медианы 0.53/0.75/0.85 (D) и 4.61/0.67/0.9 с (Е). Различия между двумя линиями в Ронг> (D) и (Е) являются статистически значимыми (р <0,001). Различия между FITC-меченого эритроцитов и 17XL паразиты не являются статистически значимыми (р> 0,05). F, G. Селезенка измерения кровотока. Представление ху изображения (F) и х изображений (G) из линии сканирования центрального просвета же судне (белая линия). Селезенка судну плазмы с декстрана 70 кДа (красный), PRBC (зеленый) и эритроцитов отражения (синий).
Фильмы 1 и 2. Покадровый прижизненных изображений микроскопии мышиной селезенки инфицированных 17XL (1) или 17X (2) GFP-трансгенной паразитов на 10% паразитемии (Z-максимальное проекции). Паразита и тканей аутофлюоресценция показаны зеленым и красным соответственно. Шкала барах составляют 10 мкм и временной интервал в секундах.
х "> Нажмите сюда, чтобы посмотреть фильм 1.
Нажмите сюда, чтобы посмотреть кино 2.
Обсуждение
Реализация прижизненной микроскопии селезенки в этой модели малярии грызунов открыл возможность исследовать динамическое прохождение паразитов через этот орган, который до сих пор считается "черный ящик" из-за технических соображений. В здесь, основные усилия были поставлены н?...
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Мы особенно благодарны С. Graewe и В. Heussler для начальной подготовки и непрерывного ввода в прижизненной микроскопии малярийных паразитов, чтобы Бернс за благотворительный взнос GFP трансгенные паразитов, А. Bosch (конфокальной Unit, CCIT-UB, IDIBAPS) за помощь в анализе изображений и количественной оценки и П. Astola для оказания технической помощи. Мы благодарим Р. Tous и И. Caralt для видео производства. MF является получателем стипендий от Общность Каталонии. Компенсации является профессором ICREA исследований. Работа в лаборатории о компенсации финансируется Седьмой рамочной Европейского Сообщества Наций (FP7/2007-2013) в рамках грантового соглашения N ° 242095, в частный фонд Селлекс (Каталония, Испания), а также испанского министерства по науке и инновациям ( SAF2009-07760).
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента | Компания | Номер по каталогу | Комментарии |
| Leica TCS SP5-конфокальной микроскопии | Leica Microsystems, Гейдельберг, Германия | TCS-SP5 Серийный номер. 5100000419 | |
| Кетамин (Ketolar 50 мг / мл) | Pfizer | 631028 | |
| Мидазолам 15 мг / 3 мл | Normon | 838193 | |
| 70000 МВт Декстран, сопряженных с Texas Red | Молекулярные зонды | D1830 | |
| Fluorescein изотиоцианат, изомер I (FITC) | Сигма | F7250 | |
| Hoechst 33342 | Сигма | H1399 | |
| Гимза | Сигма | GS1 | Рабочий раствор находится на уровне 10% в дистиллированной воде |
| Супер клей Loctite-3 | Loctite | 9975-0880 |
Ссылки
- Amino, R., Menard, R., Frischknecht, F. In vivo imaging of malaria parasites--recent advances and future directions. Curr. Opin. Microbiol. 8, 407-414 (2005).
- Heussler, V., Doerig, C. In vivo imaging enters parasitology. Trends. Parasitol. 22, 192-195 (2006).
- Amino, R., Thiberge, S., Blazquez, S., Baldacci, P., Renaud, O., Shorte, S. Imaging malaria sporozoites. in the dermis of the mammalian. 2, 1705-1712 (2007).
- Gueirard, P., Tavares, J., Thiberge, S., Bernex, F., Ishino, T., Milon, G. Development of the malaria parasite in the skin of the mammalian host. Proc. Natl. Acad. Sci. U. S. A. 107, 18640-18645 (2010).
- Sturm, A., Amino, R., van de Sand, C., Regen, T., Retzlaff, S., Rennenberg, A. Manipulation of host hepatocytes by the malaria parasite for delivery into liver sinusoids. Science. 313, 1287-1290 (2006).
- Gruring, C., Heiber, A., Kruse, F., Ungefehr, J., Gilberger, T. W., Spielmann, T. Development and host cell modifications of Plasmodium falciparum blood stages in four dimensions. Nat. Commun. 2, 165-165 (2011).
- Martin-Jaular, L., Ferrer, M., Calvo, M., Rosanas-Urgell, A., Kalko, S., Graewe, S. Strain-specific spleen remodelling in Plasmodium yoelii infections in Balb/c mice facilitates adherence and spleen macrophage-clearance escape. Cell. Microbiol. 13, 109-122 (2011).
- Linden, M. v. a. n. d. e. r., R, . A Plasmodium berghei reference line that constitutively expresses GFP at a high level throughout the complete life cycle. Mol. Biochem. Parasitol. 137, 23-33 (2004).
- Cormack, B. P., Valdivia, R. H., Falkow, S. FACS-optimized mutants of the green fluorescent protein. 173, 33-38 (1996).
- Dunn, K. W., Sandoval, R. M., Kelly, K. J., Dagher, P. C., Tanner, G. A., Atkinson, S. J. Functional studies of the kidney of living animals using multicolor two-photon microscopy. Am. J. Physiol. Cell. Physiol. 283, C905-C916 (2002).
- Zhong, Z., Petrig, B. L., Qi, X., Burns, S. A. In vivo measurement of erythrocyte velocity and retinal blood flow using adaptive optics scanning laser ophthalmoscopy. Opt. Express. 16, 12746-12756 (2008).
- Miller, M. J., Wei, S. H., Parker, I., Cahalan, M. D. Two-photon imaging of lymphocyte motility and antigen response in intact lymph node. Science. 296, 1869-1873 (2002).
- Bowdler, A. J. . The complete spleen. , (2002).
- Grayson, M. H., Hotchkiss, R. S., Karl, I. E., Holtzman, M. J., Chaplin, D. D. Intravital microscopy comparing T lymphocyte trafficking to the spleen and the mesenteric lymph node. Am. J. Physiol. Heart. Circ. Physiol. 284, H2213-H2226 (2003).
- Khandoga, A. G., Khandoga, A., Reichel, C. A., Bihari, P., Rehberg, M., Krombach, F. In vivo imaging and quantitative analysis of leukocyte directional migration and polarization in inflamed tissue. PLoS. One. 4, 4693-4693 (2009).
- Weiss, L., Geduldig, U., Weidanz, W. Mechanisms of splenic control of murine malaria: reticular cell activation and the development of a blood-spleen barrier. Am. J. Anat. 176, 251-285 (1986).
- Swirski, F. K., Nahrendorf, M., Etzrodt, M., Wildgruber, M., Cortez-Retamozo, V., Panizzi, P. Identification of splenic reservoir monocytes and their deployment to inflammatory sites. Science. 325, 612-616 (2009).
- Grayson, M. H., Chaplin, D. D., Karl, I. E., Hotchkiss, R. S. Confocal fluorescent intravital microscopy of the murine spleen. J. Immunol. Methods. 256, 55-63 (2001).
- Bajenoff, M., Glaichenhaus, N., Germain, R. N. Fibroblastic reticular cells guide T lymphocyte entry into and migration within the splenic T cell zone. J. Immunol. 181, 3947-3954 (2008).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены