Method Article
Доставка генов и Трансфекция в человеческий рак поджелудочной железы клетки, используя эпидермального фактора роста рецепторов ориентированных Желатин основе Engineered Nanovectors
В этой статье
Резюме
Тип B желатин основе инженерной nanovectors (РОД) был разработан для системной доставки генов и трансфекции в лечении рака поджелудочной железы. По модификация с рецептор эпидермального фактора роста (EGFR) конкретных пептид на поверхности nanparticles, они могут быть нацелены на рецепторы EGFR и отпустите плазмиды в восстановительных окружающей среды, такие как высокая внутриклеточная концентрация глутатиона.
Аннотация
Более 32 000 пациентов с диагнозом рака поджелудочной железы в США в год, и заболевание связано с очень высокой смертностью 1. Срочно существует необходимость в разработке новых клинически переводимые терапевтических стратегий, которые могут улучшить мрачной статистики выживаемости больных раком поджелудочной железы. Хотя генная терапия при раке показал огромные перспективы, основная задача заключается в разработке безопасной и эффективной системы доставки, которые могут привести к устойчивым выражение трансгена.
Желатин является одним из наиболее универсальных природных биополимер, широко используется в пищевой и фармацевтической продукции. Предыдущие исследования, проведенные в нашей лаборатории, показали, что тип В желатин может инкапсулировать физическую ДНК, которые сохранились суперспиральной структуре плазмид и улучшения эффективности трансфекции при внутриклеточной доставки. По thiolation желатина, сульфгидрильные группы можно было бы ввести в полимер и будет FORM дисульфидные связи внутри наночастиц, который стабилизирует весь комплекс и один раз дисульфидных связей нарушается из-за присутствия глутатиона в цитозоле, полезная нагрузка будет выпущен 2-5. Поли (этиленгликоля) (ПЭГ)-изменение рода, при введении в системный кровоток, обеспечивает длительную циркуляцию раза и преимущественно целей для опухолевой массы из-за гипер-проницаемость neovasculature по повышенной проницаемости и удержания эффекта 6. Исследования показали, чрезмерная экспрессия рецептора эпидермального фактора роста (EGFR) на Panc-1 человека поджелудочной железы аденокарцинома клетки 7. Для того, чтобы активно целевой рака поджелудочной железы клеточная линия, EGFR конкретного пептида сопряженных на поверхности частиц через прокладку PEG 8.
Большинство противоопухолевой терапии гена ориентированы на администрацию генов-супрессоров опухолей, таких, как дикого типа р53 (мас-p53), чтобы восстановить проапоптическую функции в клетках 9 10. В рак поджелудочной железы, большинство клеток имеют мутации в белок р53, что приводит к потере активности апоптоза. С введением в мас-p53, апоптоз может быть отремонтировано и далее вызывает гибель клеток в раковые клетки 11.
Исходя из вышеизложенного обоснование, мы разработали EGFR ориентации пептид-модифицированный желатин тиолированного наночастиц для мас-доставки генов р53 и оценивать эффективность доставки и трансфекции в Panc-1 клеток.
протокол
1. Подготовка ДНК плазмиды Encapsulated EGFR-целевой Желатин Наночастицы
- Синтез тиолированного желатина
- Тиолированного желатина были синтезированы, как предыдущий метод 2-5, ковалентными сопряжения с 2-iminothiolane на первичных аминогрупп типа B желатин. 1 г желатина растворяют в 100 мл деионизированной воды и инкубировали с 20 мг 2-iminothiolane гидрохлорид при комнатной температуре в течение 15 часов.
- Непрореагировавшего реагента удаляли диализом против 5 мМ HCl раствор, затем по 1 мМ HCl решение для 3-х часов каждая. Очищенная тиолированного желатина сублимированных и хранили при 4 ° C для дальнейшего использования.
- Подготовка ДНК-содержащих наночастицы
- 200 мг тиолированного желатин растворяют в воде и рН раствора доводили до 7 добавлением 0,2 М раствора NaOH. 1 мг ДНК была добавлена и осторожно смешать с желатином решение.
- Охлажденные этанола медленно добавляют в смесь прираствору на высокой скорости. Наночастицы были сформированы, когда состав растворителя изменен на 75% водно-спиртового раствора.
- Наночастицы были дополнительно сшитого медленным добавлением 0,1 мл 8% (объем / объем) глиоксаля решение. Непрореагировавшие реагентов гасили 0,5 мл 0,2 М раствора глицина.
- Наночастицы были ультра-центрифугировали при 16000 оборотов в минуту в течение 30 минут. Гранулы промывали деионизованной водой в два раза и очищенный наночастицы лиофилизированной и хранили при температуре 4 ° С.
- Модификация поверхности наночастиц
- Наночастицы были приостановлены в 0,1 М фосфатного буфера (рН 7,4) при концентрации 10 мг / мл и инкубировали с 2 раза вес метокси-PEG-сукцинимидил карбокси метиловый эфир (MPEG-SCM, МВт 2000 Da) или малеимида-ПЭГ-сукцинимидил карбокси метиловый эфир (MAL-PEG-SCM, МВт 2000 Da) в течение 2 часов при комнатной температуре при медленном перемешивании.
- Пегилированный наночастицы были собраны с ультра-центрифугирования при 16000 оборотов в минуту в течение 30 минутs. Гранулы промывали деионизованной водой в два раза и очищенный наночастицы лиофилизированной и хранили при температуре 4 ° С.
- MAL-PEG-СКМ изменение наночастицы были приостановлены в 0,1 М фосфатный буфер (рН 6,5) с концентрацией 10mg/ml и инкубировали с 10% веса EGFR конкретного пептида (YHWYGYTPQNVI-GGGGC) в течение 6 часов при комнатной температуре при медленном перемешивании.
- Пептиды изменение наночастицы были собраны с ультра-центрифугирования при 16000 оборотов в минуту в течение 30 минут. Гранулы промывали деионизованной водой в два раза и очищенный наночастицы лиофилизированной и хранили при температуре 4 ° С.
2. Характеристика EGFR-целевых наночастиц
- Размер частиц и дзета-потенциал измерения
Наночастицы были приостановлены в воде с концентрацией 1mg/ml. Подвеска была проанализирована с помощью Zetasizer Nano (Malvern Inc). Анализ размеров частиц проводилась при рассеянии под углом 90 градусов при 25 °С. Дзета-потенциал был измерен по умолчанию параметры диэлектрической проницаемости, показателя преломления и вязкость воды при температуре 25 ° C. - Сканирование электронной микроскопии
Лиофилизированный наночастицы были установлены на алюминий крепление образца и распыления покрытый палладием для повышения проводимости и свести к минимуму накопление зарядов. Образцы были получены для морфологии поверхности под Hitachi 4800 автоэмиссии сканирующего электронного микроскопа при 3 кВ. - Электрон спектроскоп для химического анализа (ESCA)
Лиофилизированные формулировка контроля, пегилированный и пептидные изменение наночастицы были проанализированы ESCA. Она была выполнена в Национальном ESCA и анализа поверхности Центр медико-биологических проблем (NESAC / BIO), Университет штата Вашингтон (Сиэтл, штат Вашингтон).- Образцы были помещены в сверхвысоком вакууме и подвергались низкоэнергетических рентгеновских лучей, которые индуцированной эмиссии вторичных фотоэлектронов с поверхности.
- Построив число зарегистрированных электронов в зависимости от бендинь энергии, наблюдаемые пики спектра были отнесены к каждой химических компонентов.
- Высокое разрешение анализ C1s спектров была проведена для определения точного химического состава от углеводородных (CC или CH на 285mV), эфир (СО) в 286.4mV), и карбонильных (С = О на 288,1 мВ), и относительный состав каждой функции, определялась площадь под кривой.
- Стабильность инкапсулированные плазмиды
Стабильность инкапсулированных плазмидной ДНК подтвердил, запустив извлеченные ДНК на сборных гелей. Наночастицы были переварены с 0,2 мг / мл протеазы содержащие PBS (30 мин при 37 ° С) и 0,2 Ед / мл ДНКазы (10 мин при комнатной температуре) отдельно, одновременно или последовательно. Образцы затем загружены на 1,2% агарозном геле (GP) (E-гель, Invitrogen, Калифорния) в концентрации 100ng/well в 18μL объема на лунку. Голая плазмиды был загружен, как контроль и геля проводили при 75 В в течение 30 минут. Kodak Digital рентгеновский образца (DXS) система была использована для визуализации бпучки с УФ transluminescence. - Определение плазмиды загрузки
Плазмиды инкапсулированных наночастиц были приостановлены на 1mg/ml и переваривают 0.2mg/ml протеазы при температуре 37 ° С в течение 30 минут. Решение центрифугировали при 13000 оборотов в минуту в течение 10 минут и супернатант собраны и протестированы на концентрацию плазмиды с Picogreen анализа (Invitrogen). Инкапсуляция Норматив рассчитан путем деления инкапсулированные плазмиды концентрации с начальной загрузки 0,5% (в / в).
3. In Vitro Трансфекция исследований в Panc-1 клетки рака поджелудочной железы
- Условиях культуры клеток
Panc-1 и Capan-1 поджелудочной линии аденокарциномы клетки, SKOV3 яичников линии клеток аденокарциномы и NIH-3T3 мышиной линии клеток фибробластов были получены из АТСС. Panc-1 и NIH-3T3 были выращены с DMEM поставляется с L-глутамин, Пен-стрептококк и 10% эмбриональной телячьей сыворотки при температуре 37 ° С и 5% CO 2, в то время как Capan-1 требуется DMEM поставляется 20% эмбриональной телячьей сыворотки.SKOV3 был выращен в RPMI-1640 поставляется с 10% эмбриональной телячьей сыворотки. - Вестерн-блот анализа для выражения EGFR
- Сотовые лизаты были собраны с 2 млн. клеток и проанализированы на общую концентрацию белка использованием BCA анализ (Pierce). NIH-3T3 был использован в качестве отрицательного контроля и SKOV3 был использован в качестве положительного контроля для выражения EGFR.
- 10 мкг общего экстракта белка работать на сборных додецилсульфата натрия-электрофореза в полиакриламидном геле (SDS-PAGE) системы на 135V в течение 90 минут.
- Затем гель был переведен на PVDF мембрану iBlot Сухой Blotting системы (Invitrogen).
- Мембрана была блокирована с 5% обезжиренного молока в Твин-содержащих трис буфер солевом растворе (TBS-т) в течение 1 часа при комнатной температуре.
- Мембранные был вырезан и инкубировали с 1:1000 разбавления первичной кролика бета-актина антителами и 1:1000 разбавления первичных антител кролика EGFR отдельно ночи при 4 ° C.
- Мембрана была дважды промываютTBS-т и инкубировали с 1:2000 разведения вторичных анти-кролик хрена пероксидаза-сопряженных IgG в TBS-т на 1 час при комнатной температуре.
- После промывки избыток антител с TBS-т и воды, 4 мл ECL подложки (Pierce, Rockford, IL, США) и инкубировали с мембранами на 5 минут.
- Хемилюминесцентные полос затем визуализируются использовании Kodak Digital рентгеновский образца (DXS) системы.
- Жизнеспособность клеток исследования с различными формулировками
- Panc-1 клетки выращивали в 96-луночных на 10000 клеток на лунку в 200 мкл DMEM дополнены в одночасье.
- Рост среду заменяли бессывороточной среде, содержащей различные концентрации наночастиц с 0, 0,5, 1, 2, 4, 6 мг / мл. 1mg/ml PEI, известные цитотоксических полимера катионные, был использован в качестве положительного контроля.
- Клетки обрабатывали 200 мкл наночастиц в течение 6 часов, а затем заменили 20 мкл МТС реагента и 100 мкл полнойпитательных сред.
- После сообщению инкубации в течение 3 часов при 37 ° С в 5% CO 2, абсорбцию продукта формазана измеряли при 490nm с Biotek SynergyHT ридер (Winooski, VT).
- Процентов жизнеспособность клеток была выражена как отношение оптической плотности полимера обработанных клеток по сравнению с отрицательным контролем (0mg/ml), умноженное на 100 и на графике как функцию концентрации полимера.
- Исследования сотовый торговли
- Родамина Б изотиоцианат (RBITC) был использован для сопряжения на тиолированного желатина в результате реакции с аминогруппу. После диализа и лиофилизации, RBITC помечены тиолированного желатина используется для приготовления наночастиц.
- Перед десольватации, 25 мкл PicoGreen смешивали с 1 мг плазмиды в течение 1 минуты и маркированы плазмиды были добавлены в раствор желатина. Различные формулировки были сделаны следующие предыдущего метода.
- Panc-1 клетки были выращены в 6-луночных содержащие стеклянной крышкой-квитанции с 200000 клеток рэр хорошо. После роста ночь, 2 мл меченых наночастиц лечились в каждую лунку с концентрацией 1mg/ml в бессывороточной среде.
- После различные моменты времени, от 15 минут до 6 часов, средний был заменен на культуральной среде, содержащей 1μg/ml из Hoest 33342 (Invitrogen) в течение 15 минут инкубации при комнатной температуре. 2 мл 4% параформальдегида решение было заменено в каждую лунку исправить клеток. Затем клетки промывали PBS в два раза.
- Coversilps были смонтированы на предметных стеклах. Лазерное сканирование конфокальной флуоресцентной микроскопии был использован для получения изображений фиксированных клеток.
- Качественное определение эффективности трансфекции помощью флуоресцентной микроскопии с pEGFP-N1 инкапсулированных наночастиц
- pEGFP-N1 плазмиды инкапсулированные в наночастицы и взвешенных в сыворотке крови свободных средств массовой информации с концентрацией эквивалентно 10 мкг на мл плазмиды для дальнейшего лечения.
- Panc-1 клетки выращивали в течение ночи в 6-луночных contaiНин стеклянной крышкой-квитанции с 200 000 клеток на лунку. 2 мл pEGFP-N1 плазмид наночастиц инкапсулированные лечились в каждую лунку. 20 мкг плазмид были смешаны с 20 мкл липофектина, катионных реагентов трансфекции липидов, и она была использована в качестве положительного контроля, а необработанных клеток были использованы в качестве отрицательного контроля.
- Клетки инкубировали с различными формулировками в течение 6 часов.
- Средний был заменен на питательную среду и клетки после трансфекции в течение 24, 48, 72 и 96 часов.
- После после трансфекции, средний был заменен на культуральной среде, содержащей 1μg/ml из Hoest 33342 (Invitrogen) и инкубировали с клетками в течение 15 минут при комнатной температуре.
- Покровные стекла были установлены на стеклах и выражения GFP в клетках было обнаружено флуоресцентного микроскопа. Дифференциальная интерференционного контраста (DIC) и флуоресцентные изображения получены с помощью микроскопа Olympus BX61 и цифровые изображения были обработаны с изображением программного обеспечения J.
- Количественное определение эффективности трансфекции с помощью ИФА с pEGFP-N1 инкапсулированных наночастиц
- pEGFP-N1 плазмиды инкапсулированные в наночастицы и взвешенных в сыворотке крови свободных средств массовой информации с концентрацией эквивалентно 10 мкг на мл плазмиды для дальнейшего лечения.
- Panc-1 клетки выращивали в течение ночи в 6-луночных планшет с 200 000 клеток на лунку. 2 мл pEGFP-N1 плазмид наночастиц инкапсулированные лечились в каждую лунку. 20 мкг плазмид были смешаны с 20 мкл липофектина, катионных реагентов трансфекции липидов, который использовался в качестве положительного контроля и необработанных клеток были использованы в качестве отрицательного контроля.
- Клетки инкубировали с различными формулировками в течение 6 часов.
- Средний был заменен на питательную среду и клетки после инкубировали в течение 24, 48, 72 и 96 часов.
- После после трансфекции, клеточные лизаты были собраны из каждой лунки и проанализированы на общую концентрацию белка использованием BCA анализ (Pierce).
- луночного планшета была соаТед с 100 мкл 1:1000 разведения моноклональных анти-GFP антител в каждую лунку. После инкубации 2 часа, пластины промывали PBS-0,5% (м / о) Твин-80 в 4 раза.
- 300 мкл TBS блокировки буфера были добавлены в каждую лунку и инкубировали в течение 2 часов. Затем пластину промывали PBS-0,5% (м / о) Твин-80 в 4 раза.
- 30μg белков каждой группы были добавлены в пластину и инкубировали в течение ночи при 4 °. Затем пластину промывали PBS-0,5% (м / о) Твин-80 в 4 раза.
- 100 мкл разведения 1:2400 вторичных анти-GFP антитела по отношению к щелочной фосфатазы были добавлены в каждую лунку и инкубировали в течение 1 часа. Затем пластину промывали PBS-0,5% (м / о) Твин-80 в 4 раза.
- 100 мкл щелочной фосфатазы субстратов добавляли в каждую лунку и инкубировали в течение 30 минут до 1 часа. Пластина была измерена с Biotek Synergy HT ридер по поглощению при 405 нм.
- Выраженный GFP концентрация была отмечена как нанограмм на миlligrams общего белка.
- Качественное определение эффективности трансфекции ОТ-ПЦР с мас-плазмиды р53 инкапсулированных наночастиц
- Вес-р53 плазмиды инкапсулированные в наночастицы и взвешенных в сыворотке крови свободных средств массовой информации с концентрацией эквивалентно 10 мкг на мл плазмиды для дальнейшего лечения.
- Panc-1 клетки выращивали в течение ночи в 6-луночных планшет с 200 000 клеток на лунку. 2 мл мас-плазмиды р53 инкапсулированных наночастиц лечились в каждую лунку. 20 мкг плазмид были смешаны с 20 мкл липофектина, катионных реагентов трансфекции липидов, который использовался в качестве положительного контроля и необработанных клеток были использованы в качестве отрицательного контроля.
- Клетки инкубировали с различными формулировками в течение 6 часов.
- Средний был заменен на питательную среду и клетки после инкубировали в течение 48 часов.
- мРНК были извлечены из каждой лунки с помощью особо чистых РНК изоляции комплект (Roche, Indianapolis, IN) и измеряется с Nanodrop 2000 (Thermo Научные, Wilminton, DE).
- RT-PCR было сделано с помощью QIAGEN один шаг ОТ-ПЦР комплект (QIAGEN, Валенсия, Калифорния). Грунтовки для р53, Bax, Bcl-2, бета-актина, DR5, Apaf-1, PUMA, сурвивина были синтезированы Eurofins MWG Оперон (Хантсвилле, Алабама).
- ПЦР-продукты были оценены с помощью гель-электрофореза и пикселей кДНК полосы были проанализированы с помощью программного обеспечения ImageJ.
- Количественное определение терапевтической эффективности с мас-p53 palsmid инкапсулированных наночастиц
- Вес-р53 плазмиды инкапсулированные в наночастицы и взвешенных в сыворотке крови свободных средств массовой информации с концентрацией эквивалентно 10 мкг на мл плазмиды для дальнейшего лечения.
- Panc-1 клетки выращивали в течение ночи в 6-луночных планшет с 200 000 клеток на лунку. 2 мл мас-плазмиды р53 инкапсулированных наночастиц лечились в каждую лунку. 20 мкг плазмид были смешаны с 20 мкл липофектина, катионных реагентов трансфекции липидов, который использовался в качестве положительного контроля и необработанных клеткахиспользуется в качестве отрицательного контроля.
- Клетки инкубировали с различными формулировками в течение 6 часов.
- Средний был заменен на питательную среду и клетки после инкубировали в течение 24, 48, 72 и 96 часов.
- Конденсации хроматина / проницаемость мембран / Dead Kit апоптоза клеток (Invitrogen, Карлсбад, Калифорния) был использован для обозначения апоптоза клетки, отмершие клетки и живые клетки с различными красителями.
- iCys исследований изображений Цитометр от CompuCyte (Westwood, Массачусетс) был использован для анализа и сравнения уровня апоптоза после лечения. На основе флуоресценции микроскопических изображений, интенсивности всех цветов был записан и построены по сравнению с графов и проценты для различных групп населения были рассчитаны.
- По сравнению с отрицательным контролем, а значит не было никакого лечения для клеток, апоптоза клеток раз изменения были рассчитаны, и перечисленных в график.
- 3.8.8 Апо-ONE Однородная каспазы-3 / 7 Пробирной комплект (Promega, Madison, WI) был использован для изучения рро-апоптотических деятельность после трансфекции мас-р53 плазмиды. 1mg/ml PEI была использована в качестве отрицательного контроля в целях ликвидации всех апоптоза деятельности. После после трансфекции, клетки обрабатывали родамин 110, бис-(N-CBZL-аспартил-L-глутамил-L-валил-L-аспарагиновой кислоты амида; Z-DEVD-R110), который является субстратом каспазы 3 / 7, в течение 18 часов.
- Пластина была измерена с Biotek Synergy HT ридер для флуоресценции при 490/520 нм. На основе интенсивности флуоресценции зеленых, проапоптическую деятельности может быть оценена.
4. Представитель Результаты
1. Синтез и Chatacterization из EGFR целевых наночастиц
EGFR ориентации пептида модифицированные наночастицы были синтезированы, как и схема показали на рисунке 1. Наночастиц подготовленный десольватации были характерны для размера частиц и дзета-потенциал. Средний заряд размер и поверхность частиц, полученных из тиолированного желатиныс разной степенью thiolation приведены в таблице 1. Средний диаметр частиц различных наночастиц между 150-250 нм. Тиолированного наночастицы имеют меньшие размеры по сравнению с желатином наночастиц, может за счет образования дисульфидных мостов внутри частиц. С различными модификациями поверхности, размеры наночастиц возросли. Дзета-потенциалы различных формулировок было около -20 мВ. При анализе СЭМ, размеры, морфологию поверхности и сферическая форма наночастиц наблюдались и соответствующие Zetasizer результат. ДНК загрузке эффективность в желатиновые наночастицы и тиолированного желатин наночастицы были выше, чем на 95% (табл. 1).
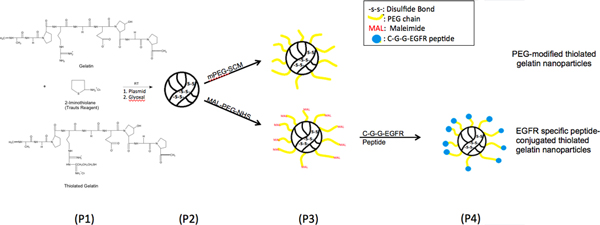
Рисунок 1. Химической реакции Схема, иллюстрирующая модификации поверхности наночастиц тиолированного желатин с эпидермального роста фактоГ-рецепторов (EGFR), обязательные пептида через поли (этиленгликоля) (ПЭГ) распорки.
Характеристика Наночастицы
| Формулирование | Диаметр наночастиц (нм) | Зета потенциал (мВ) | Эффективность Загрузка плазмидой ДНК (%) |
| Гель Н.П. | 151,4 ± 23,5 | -17,1 ± 5,23 | 95,6 ± 2,2 |
| SH-гель Н.П. | 132,6 ± 17,9 | -24,6 ± 5,16 | 97,0 ± 3,8 |
| SH-гель-ПЭГ | 179,0 ± 30,9 | -22,3 ± 9,50 | 95,8 ± 6,5 |
| SH-гель ПЭГ пептид | 230,8 ± 41,5 | -18,1 ± 4,02 | 94,8 ± 5,1 |
ТаBLE 1. Размер частиц, поверхностный заряд, и плазмидной ДНК инкапсуляции эффективность контроля и EGFR-целевых желатина и желатин тиолированного наночастиц.
Высокое разрешение C 1S сканирование электронной спектроскопии для химического анализа (ESCA) была использована для анализа поверхности компонент тиолированного желатин (SH-гель NP), ПЭГ-модифицированный тиолированного желатин (SH-гель ПЭГ) и EGFR ориентации пептид-модифицированный желатин тиолированного наночастиц (SH-гель ПЭГ пептид). Результаты в таблице 2, показал, пик интенсивности СН (углеводородов), CO (эфир), и С = О (карбонил) групп на 285,0, 286,3 и 288,1 эВ соответственно. Сигнал эфир СО усилилась после PEG изменения и снизилась после пептид сопряжения. Хотя состав азота снизился после PEG модификации и возросла после пептид модификация, которая подтвердила наличие EGFR-таргетинга пептида на наночастицах. ЭСХА еще раз подтвердил ПЭГ и пептидные модификации поверхности.
Электронной спектроскопии для химического анализа состава поверхности наночастиц
| Формулирование | С 1s (%) | О 1s (%) | N 1 с (%) |
| SH-гель Н.П. | 59,3 ± 0,8 | 22,9 ± 0,5 | 12,9 ± 0,1 |
| SH-гель-ПЭГ | 58,2 ± 0,6 | 28,0 ± 1,2 | 9,5 ± 0,7 |
| SH-гель ПЭГ пептид | 56,7 ± 0,8 | 25,9 ± 0,7 | 12,3 ± 0,6 |
| Формулирование | CC (%) | CO, N (%) | C = O (% ) |
| SH-гель Н.П. | 51,5 | 26,6 | 21,9 |
| SH-гель-ПЭГ | 17,1 | 63,1 | 19,8 |
| SH-гель ПЭГ пептид | 33,1 | 42,8 | 24,1 |
Таблица 2. C 1S с высоким разрешением сканирования электронной спектроскопии для химического анализа (ESCA)
Для того, чтобы исследовать стабильность инкапсулированных плазмиды, наночастицы лечили протеазы или ДНКазы отдельно, simuntaneously или последовательно. После электрофореза результаты на рисунке 2 показано, что ДНК плазмиды инкапсулируются во всех наночастицы защищена наночастиц и стабильной, сравнимых с голой ДНК плазмиды. Эти изучал показали, что все эти наночастицы могут инкапсулировать и сохранение плазмиды структуры после инкапсуляции.
/ Files/ftp_upload/3612/3612fig2.jpg "/>
Рисунок 2. Стабильность ДНК плазмиды инкапсулированных в тиолированного желатин, ПЭГ-модифицированный тиолированного желатин и EGFR пептид-модифицированный желатин тиолированного наночастиц с помощью электрофореза в агарозном геле. Наночастиц лечились 0,2 мг / мл протеазы доказать плазмиды инкапсуляции ДНК в наночастицы матрицы
2. Базовый EGFR Выражение в клетках рака поджелудочной железы
Два человека поджелудочной железы аденокарцинома клеточных линий (Panc-1 и Capan-1) были проанализированы иммуноблоттинг для EGFR выражения. Человек аденокарциномы яичников (SKOV3) и мышиных фибробластов ((NIH-3T3) клеток были выбраны в качестве положительного и отрицательного контроля, соответственно. Бета-актина было проанализировано, как белок контроля нагрузки. Panc-1 клеток показали более высокую EGFR выражении по сравнению с Capan-1 и эта клеточная линия была затем использована для следующих в лабораторных исследованиях
3. Цитотоксичность управления и Surfaсе-Modified тиолированного Желатин Наночастицы
Для того чтобы оценить сотовой взаимодействия наночастиц, цитотоксичности проводилось после лечения с помощью наночастиц. По результатам на рисунке 3, и контроль, и с модифицированной поверхностью наночастицы были относительно безопасны и биосовместимых в Panc-1 клеток, даже при высоких концентрациях, при сравнении с PEI. Следующие исследования проводились с 1mg/ml наночастиц.
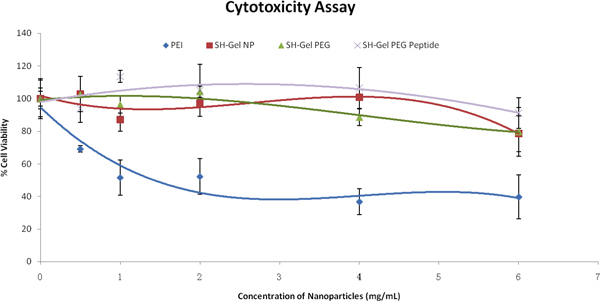
Рисунок 3. Процент выживаемости клеток в зависимости от концентрации наночастиц состава в Panc-1 клетки, как оценивается тетразолия красителя (МТС) анализ
4. Рецептор опосредованного сотовый Поглощение в Panc-1 клетки
Чтобы убедиться в доступности поверхности EGFR-таргетинга пептида и рецептор-опосредованных внутриклеточных поглощения наночастиц, система была разработана, маркируя каждую сотрудничестваmponent с различными флуоресценции для визуализации наночастиц поглощения и торговли в клетках. С помощью этой системы маркировки, плазмидной ДНК, наночастицы и ядра клетки могут быть определены. Лазерное сканирование конфокальной флуоресцентной микроскопии был использован для получения изображений в различные моменты времени, от 15 минут до 6 часов. Сравнивая изображения различных формулировках, пептид сопряженные желатин наночастицы показали быстрое поглощение и плазмиды освобождение в течение 30 минут. Этот результат того доказывается, что EGFR пептид-сопряженных наночастиц прошли способствовало эндоцитоза быстрого взаимодействия между EGFR конкретного пептида и EGFR рецепторами на поверхности клетки, который был намного быстрее, по сравнению с другими наночастицами, которые прошли неспецифические эндоцитоза.
Исследование сотовый торговли
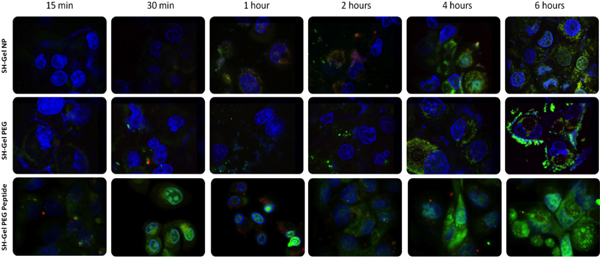
Рисунок 4. Конфокальной флуоресцентной микроскопииalysis ДНК-инкапсулированных поглощения наночастиц и торговли Panc-1 клеток. (Красный = родамина меченных наночастицами, зеленый = PicoGreen меченых ДНК плазмиды, и синий = DAPI меченные ядра). Мощность лазера был в 7 раз меньше в последние четыре цифры нижней панели.
5. Качественный и количественный In Vitro Трансфекция с увеличенной зеленый флуоресцентный белок
ИФА на рисунке 5 и флуоресценции микроскопического анализа на рисунке 6, были использованы для измерения качественных и количественных эффективности GFP tranfection в Panc-1 клетки при введении немодифицированных, ПЭГ-модифицированный и EGFR пептид-модифицированный желатин тиолированного наночастиц. Плазмиды выступил EGFR-целевых наночастиц в результате высокого уровня экспрессии GFP после 48 часов по отношению к другим элементам управления, в том числе липофектина-комплекс ДНК.
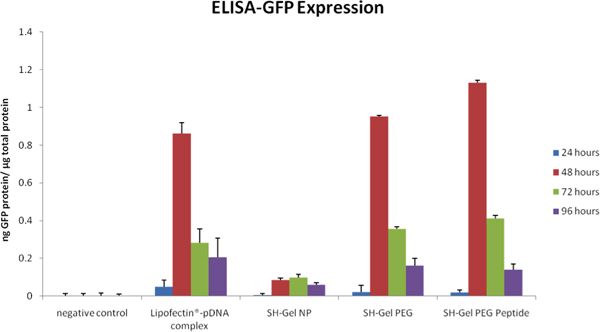
Рисунок 5. GFP выраженияnalyzed методом ИФА на графике как функцию времени после администрацией плазмидной ДНК в контроле и EGFR-целевых наночастиц.
Флуоресценции микроскопического анализа для трансфекции GFP
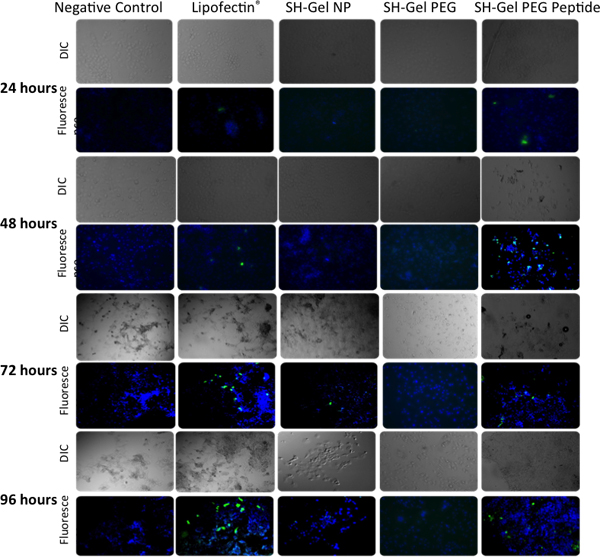
Рисунок 6. Качественный анализ зеленого флуоресцентного белка в выражении Panc-1 клеток epifluoresence микроскопии после 24, 48, 72 и 96 часов после трансфекции с EGFP-N1. Липофектина-ДНК комплекс был использован в качестве положительного контроля.
6. In Vitro Tranfection с вирусом дикого типа р53 плазмиды в Panc-1 клетки
Дикого типа р53 плазмиды НОРС-hp53 с EF-1α / HTLV гибридных промоутер были извлечены из E. палочки и заключены в наночастицы для изучения апоптоза терапевтический эффект. Panc-1 клетки обрабатывали частиц в течение 6 часов и после трансфекции дополнительных 24, 48, 72 и 96 часов.
Так как p53 может индуцировать апоптоз в клетках и для того, чтобы выполнить эту функцию, много ниже по течению транскрипционные факторы будут участвовать и напрямую регулируется выражение мас-р53. Среди них, Bax, каспазы-3, каспазы-9, DR5, PUMA и Apaf-1 будет до регулируемой экспрессией р53 и в то время как Bcl-2, сурвивина бы вниз регулируется. С целью изучения уровня этих факторов транскрипции, мРНК была извлечена из Panc-1 клетки через 48 часов после трансфекции и используется для ОТ-ПЦР. Продукты были оценены с помощью гель-электрофореза и групп были проанализированы с ImageJ. На основании полученных результатов показал, на рисунке 7, сурвивина значительно снизилась при лечении EGFR целевых тиолированного желатин наночастиц по сравнению с другими методами лечения, никаких очевидных изменений был замечен в Bcl-2, Bax и выражение каспазы-3, каспазы-9, DR5, PUMA и Apaf-1increased с целенаправленного лечения наночастицы.
les/ftp_upload/3612/3612fig7.jpg "/>
Рисунок 7. МРНК уровни вниз по течению факторов мас-экспрессии p53 сравнивались с помощью ОТ-ПЦР через 48 часа после трансфекции.
После мас-p53 трансфекции, конденсации хроматина / проницаемость мембран / Dead комплект Сотовые Апоптоз используется для дифференциации апоптоза клетки, отмершие клетки и живые клетки с различными красителями. iCys исследований изображений Цитометр от CompuCyte (Westwood, Массачусетс) был использован для анализа и сравнения уровня апоптоза после лечения. По сравнению с отрицательным контролем, апоптотических клеток раз изменения были рассчитаны, и перечисленных на рисунке 8. EGFR целевых тиолированного желатин nanopaticles показали высокий апоптоза популяции клеток после после трансфекции. Анализ каспазы 3 / 7 деятельности также показал, что EGFR-целевых наночастиц была быстрой интернализации и высокий уровень апоптоза деятельности в Panc-1 клеток.
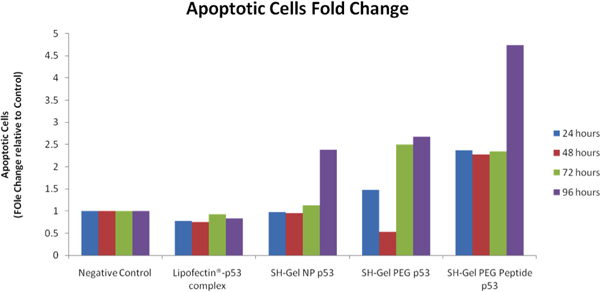
Рисунок 8. Цитометрии анализа проапоптическую деятельности в управлении мас-p53 трансфицированных Panc-1 клеток с использованием iCys ° изображений Цитометр
Обсуждение
Контроль и EGFR целевых тиолированного желатин наночастицы были подготовлены с эффективной инкапсуляции ДНК и стабильность. Размером частиц все эти системы находились в диапазоне 150-250 нм в диаметре. Дзета-потенциал доказал, что эта система представляет собой слегка отрицательной системы. При анализе СЭМ, размеры наночастиц то же самое с Zetasizer результат. ЭСХА может подтвердить ПЭГ и пептидные модификации поверхности.
Вестерн-блот анализ показал, что Panc-1 клетки имели высокий уровень экспрессии EGFR и эта клеточная линия была использована для исследования в лабораторных условиях. Оба управления и модифицированной поверхностью наночастицы были относительно менее цитотоксические в Panc-1 клеток по сравнению с PEI.
Исследования показали, сотовый торговли быстрое поглощение и плазмиды выпуск EGFR ориентированных наночастиц в Panc-1 клеток. Доставка репортера плазмиды ДНК выразить с EGFR-целевых наночастиц в результате высоких уровнейGFP выражения по отношению к другим элементам управления, в том числе липофектина-комплекс ДНК. С той же системе, трансфекции с мас-плазмиды р53 срабатывает вниз по течению апоптоза и индуцированного апоптоза в быстром Panc-1 клеток.
Эти предварительные результаты показывают, что EGFR ориентированных тиолированного желатин наночастицы могут служить в качестве безопасной и эффективной системы доставки ДНК для генной терапии для лечения рака поджелудочной железы.
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Это исследование было поддержано Альянс Национального института рака в области нанотехнологий Центра Рака Рака совершенства нанотехнологий (CCNE) грант U54-CA151881.
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента | Компания | Номер по каталогу | Комментарии |
| Тип B желатин, Блум 225 | Sigma-Aldrich | G9391 | |
| 2-iminothiolane гидрохлорид | Sigma-Aldrich | I6256 | |
| pEGFP-N1 плазмиды | Элим Биофарм | N / A | |
| НОРС-hp53 кишечная палочка | Invivogen | НОРС-hp53 | |
| Глиоксаль решение (40wt.% в H 2 O) | Sigma-Aldrich | 128465 | |
| Глицин | Sigma-Aldrich | 410225-250G | |
| КИП фильтр плазмиды Мега комплект | Qiageн | 12281 | |
| Бекман LE 80K ультрацентрифуге | Beckman | N / A | |
| Freezone 6 литров консоли Замораживание Сухой системы | Labconco | 7753020 | |
| MPEG-SCM, 2000 МВт Da | Лейсан | MPEG-SCM-2K-1g | |
| MAL-PEG-SCM, 2000 МВт Da | Jenkem технологии | A5001-1 | |
| Zetasizer Nano | Малверн | Zetasizer Nano ZS | |
| Hitachi 4800 автоэмиссии сканирующего электронного микроскопа | Hitachi | S-4800 грн FE-SEM | |
| Квант-IT PicoGreen двухцепочечной ДНК и наборы реагентов | Invitrogen | P7589 | |
| Липофектина реагент Трансфекция | Invitrogen | 18292011 | |
| DMEM | Mediatech cellgro | 10 013 СМ | |
| RPMI | Mediatech cellgro | 50 020 PB | |
| Пирс BCA белка Пробирной Kit | Thermo Scientific | 23225 | |
| iBlot Сухой Blotting системы | Invitrogen | IB1001 | |
| XCell SureLock Мини-Cell и XCell II Blot модуль Kit CE Mark | Invitrogen | EI0002 | |
| Пирс ECL Вестерн-блоттинг основания | Thermo Scientific | 32109 | |
| Kodak Digital рентгеновский образца (DXS) Системные | Кодак | N / A | ; |
| CellTiter 96 AQ ueous одно решение пролиферации клеток анализ (МТС) | Promega | G3580 | |
| Biotek SynergyHT ридер | Biotek | N / A | |
| Nanodrop 2000 | Thermo Scientific | N / A | |
| Один шаг ОТ-ПЦР в комплекте | Qiagen | 210212 | |
| Конденсации хроматина / проницаемость мембран / Dead Kit апоптоза клеток | Invitrogen | V23201 | |
| Апо-ONE Однородная каспазы-3 / 7 Пробирной комплект | Promega | G7790 | |
| Hybaid ПЦР Sprint термоциклер | Thermo Scientific | N / A | |
| Рецептор эпидермального фактора роста антител | Ячейкасигнализация | 2232 | |
| β-актин антител | Сотовые сигнализации | 4967 | |
| Анти-IgG кролика, HRP-связанных антител | Сотовые сигнализации | 7074 | |
| Мышь моноклональные антитела GFP | Novus биологические препараты | NB600-597 | |
| Коза Поликлональные антитела GFP (щелочной фосфатазы) | Novus биологические препараты | NB600-1502 | |
| Комплект фосфатазы основания | Thermo Scientific | 37620 |
Ссылки
- Vimalachandran, D. Genetics and prevention of pancreatic cancer. Cancer. Control. 11, 6-14 (2004).
- Kommareddy, S., Amiji, M. Preparation and evaluation of thiol-modified gelatin nanoparticles for intracellular DNA delivery in response to glutathione. Bioconjug. Chem. 16, 1423-1432 (2005).
- Kommareddy, S., Amiji, M. Poly(ethylene glycol)-modified thiolated gelatin nanoparticles for glutathione-responsive intracellular DNA delivery. Nanomedicine. 3, 32-42 (2007).
- Kommareddy, S., Amiji, M. Antiangiogenic gene therapy with systemically administered sFlt-1 plasmid DNA in engineered gelatin-based nanovectors. Cancer. Gene. Ther. 14, 488-498 (2007).
- Kommareddy, S., Amiji, M. Biodistribution and pharmacokinetic analysis of long-circulating thiolated gelatin nanoparticles following systemic administration in breast cancer-bearing mice. J. Pharm. Sci. 96, 397-407 (2007).
- Kaul, G., Amiji, M. Tumor-targeted gene delivery using poly(ethylene glycol)-modified gelatin nanoparticles: in vitro and in vivo studies. Pharm. Res. 22, 951-961 (2005).
- Bardeesy, N., DePinho, R. A. Pancreatic cancer biology and genetics. Nat. Rev. Cancer. 2, 897-909 (2002).
- Li, Z. Identification and characterization of a novel peptide ligand of epidermal growth factor receptor for targeted delivery of therapeutics. FASEB. J. 19, 1978-1985 (2005).
- McCormick, F. Cancer gene therapy: fringe or cutting edge. Nat. Rev. Cancer. 1, 130-141 (2001).
- Green, D. R., Kroemer, G. Cytoplasmic functions of the tumour suppressor p53. Nature. 458, 1127-1130 (2009).
- Barton, C. M. Abnormalities of the p53 tumour suppressor gene in human pancreatic cancer. Br. J. Cancer. 64, 1076-1082 (1991).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены