Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Построение коллагена Гидрогель для доставки стволовых клеток, загруженных Хитозан микросфер
В этой статье
Резюме
Главным препятствием в текущем лечения стволовыми клетками заключается в определении наиболее эффективных методов для достижения этих клеток в ткани хозяина. Здесь мы описываем на основе хитозана способ доставки, что является эффективным и простым в подходах, позволяя при этом жировых стволовых клеток для поддержания их multipotency.
Аннотация
Мультипотентных стволовых клеток было показано, что чрезвычайно полезно в области регенеративной медицины 1-3. Тем не менее, для того, чтобы использовать эти клетки эффективно для регенерации тканей, число переменных должны быть приняты во внимание. Эти переменные включают в себя: общий объем и площадь поверхности имплантации сайта, механические свойства ткани и ткани микросреда, которая включает в себя сумму васкуляризации и компоненты внеклеточного матрикса. Таким образом, материалов, которые используются, чтобы предоставить эти клетки должны быть биологически совместимыми с определенным химическим составом при сохранении механической прочности, который имитирует ткани хозяина. Эти материалы также должны быть проницаемы для кислорода и питательных веществ для обеспечения благоприятной микросреды для клеток приложить и размножаться. Хитозан, катионный полисахарид с отличной биосовместимости, может быть легко химически модифицированных и обладает высоким сродством связываться с Mac в естественных условияхromolecules 4-5. Хитозан имитирует гликозаминогликана часть внеклеточного матрикса, что позволяет ему функционировать в качестве субстрата для клеточной адгезии, миграции и пролиферации. В этом исследовании мы используем хитозана в виде микросфер для доставки жировых производных стволовых клеток (АОК) в коллагена основаны трехмерных леса 6. Идеальная клетка-микросфер соотношение определяется по времени инкубации и плотности клеток для достижения максимального числа клеток, которые могут быть загружены. Как только ASC высевают на микросферы хитозана (CSM), они встроены в коллаген леса и может сохраняться в культуре в течение длительного периода времени. Таким образом, данное исследование представляет собой метод точно доставить стволовые клетки в трехмерном биоматериала эшафот.
протокол
1. Изоляция жировой производные стволовые клетки (ASC)
Примечание: Все процедуры были выполнены при комнатной температуре, если не указано иное.
- Изолировать крысы паранефральная и придатка жировой и промыть буферной соли стерильной Хэнка решение (HBSS), содержащей 1% эмбриональной телячьей сыворотки (FBS), как описано выше 6.
- Фарш ткани и передавать 1-2 г на 25 мл HBSS, содержащим 1% FBS в 50 мл трубку и центрифуги в 500 г в течение 8 минут при комнатной температуре.
- Соберите свободно плавающего слоя жировой ткани и передачи до 125 мл колбу Эрленмейера и лечение с 25 мл коллагеназы тип II (200 ЕД / мл) в HBSS в течение 45 мин при 37 ° С на орбитальном шейкере (125 оборотов в минуту).
- Осторожно снимите жидкой фракции (ниже масла и жировой слой) и фильтровать последовательно через 100 мкм и 70 мкм сетчатый фильтр из нейлона. Центрифуга фильтрата на 500 г в течение 10 мин при комнатной температуре, аспирации supernatanт и промыть осадок дважды с 25 мл HBSS.
- Ресуспендируют клеточный осадок в 50 мл среды роста (MesenPRO RS базальной среды) с добавлением MesenPRO RS роста дополнения, противогрибковых антибиотиков (100 ЕД / мл пенициллина G, 100 мкг / мл стрептомицина сульфат и 0,25 мкг / мл амфотерицина B) и 2 мМ L-глутамина и пипетки клетки на 2 колбы T75 (25 мл / колбы).
- Культура ASC в 5% CO 2 увлажненном инкубаторе при температуре 37 ° C (проезд 2-4 ASC используются для всех опытов).
2. Подготовка Хитозан микросфер (CSM)
Примечание: Все процедуры были выполнены при комнатной температуре, если не указано иное.
- CSM готовятся воды в нефти эмульгирование процесс наряду с ионной техники коацервации используя наш предыдущий протокол 6. Эмульсию водный раствор хитозана (6 мл 3% вес / объем хитозана в 0,5 М уксусной кислоты) в 100 мл смеси масляную фазу, состоящую из соевыхмасла, октаноле (1:2 об / об) и 5% сорбита-моноолеат (диапазон 80) эмульгатор, с помощью накладных расходов (1700 оборотов в минуту) и магнитной мешалкой (1000 оборотов в минуту) одновременно в противоположных направлениях. Этот двойной метод смешивания гарантирует, что мицеллы образуются на ранних стадиях до сшивания происходит, может оставаться в растворе и не оседают на дно. Кроме того, магнитная мешалка средств в де-объединения хитозана в мицеллообразования и rigidization.
- Смесь непрерывно перемешивают в течение примерно 1 часа до стабильных водно-нефтяной эмульсии получается. Ионные сшивания начинается с добавлением 1,5 мл 1% вес / объем гидроксида калия в октаноле каждые 15 мин в течение 4 ч (24 мл общего объема).
- После завершения реакции сшивания, медленно перелить масло фазы смеси, содержащей CSM и сразу же добавлять сферы до 100 мл ацетона. Вымойте сферы с ацетоном до масляной фазы полностью удаляется.
- Высушите восстановленные сферы в эксикаторе вакуум и анальныйyze без дальнейшей обработки. Средний размер частиц CSM, площадь поверхности на миллиграмм и устройство кубический объем определяли с помощью анализатора размера частиц.
- В последующих экспериментах, мыть CSM три раза стерильной водой для удаления остатков солей и стерилизуют при абсолютном спирте.
3. Определение количества свободных аминогрупп в CSM
Примечание: Все процедуры были выполнены при комнатной температуре, если не указано иное.
- Определить количество свободных аминокислот групп, присутствующих в CSM после ионной сшивание с помощью тринитро бензолсульфоновая (TNBS) кислоты из анализа Bubins и Ofner 7. Инкубировать 5 мг микросфер с 1 мл 0,5% раствора TNBS в 50 мл стеклянной трубки в течение 4 ч при 40 ° С и гидролиза с добавлением 3 мл 6N HCl при 60 ° С в течение 2ч.
- Охладите образцы до комнатной температуры, и извлекать свободную TNBS добавлением 5 мл дистиллированной воды и 10 мл этиловогоэфира.
- Теплый 5 мл аликвоты водной фазы до 40 ° С на водяной бане в течение 15 минут для испарения остаточной эфир, охладить до комнатной температуры и разбавляют 15 мл воды.
- Измерьте оптическую плотность при 345 нм с помощью спектрофотометра использованием TNBS решение без хитозана как пустые и хитозана для CSM подготовка для определения общего количества аминогрупп. Оцените количество свободных аминогрупп CSM относительно хитозана.
4. Загрузка ASC в CSM
Примечание: Все процедуры были выполнены при комнатной температуре, если не указано иное.
- Уравновешивать 5 мг стерилизовать CSM из раздела 2.5 в стерильной HBSS в ночное время и добавить в 8 мкм, размер пор мембраны культуры пластины вставки (24-луночного планшета).
- После CSM поселились на мембране, тщательно аспирации HBSS и добавить 300 мкл питательной среды для внутренней вставкой и 700 мкл питательной среды для гоэлектронной вне вставки.
- Ресуспендируйте ASC в соответствующей концентрации (1 х 10 4 до 4 х 10 4) в 200 мкл среднего роста и семян на МКС внутри вставки пластины культуры. Окончательный объем среды в культуре вставки, после посева, составляет 500 мкл.
- Инкубируйте ASC семенами на МКС в течение 24 ч в 5% CO 2 увлажненном инкубаторе при температуре 37 ° C.
5. Определение Процент ASC Загрузка и жизнеспособность клеток в CSM
Примечание: Все процедуры были выполнены при комнатной температуре, если не указано иное.
- После инкубации собирают ASC-загруженным CSM в стерильном 1,5 мл микроцентрифужных трубы, не нарушая клетки, которые мигрировали в вставкой мембраны.
- Удаление остаточных средних и добавить 250 мкл свежей среды, рост к трубе.
- В каждую пробирку добавляют 25 мкл МТТ [3 - (4,5-dimethylthiozole-2-ил) -2,5-diphenyltetrazolium метила]Решение (5 мг / мл) и инкубировать в течение 4 ч в 5% CO 2 увлажненном инкубаторе при температуре 37 ° C.
- После инкубации удалить среды, добавить 250 мкл диметилсульфоксида, и вихрь смесь в течение 2-5 мин для растворения формазана комплекса.
- Центрифуга CSM при 2700 х г в течение 5 минут, и определить, супернатант поглощения измеряется при 570 нм с использованием 630 нм в качестве ссылки.
- Определить количество клеток связано с CSM по отношению к поглощению значением, полученным от известных количества жизнеспособных ASC.
6. Характеризуя ASC-CSM-Embedded Коллаген гель
Примечание: Все процедуры были выполнены при комнатной температуре, если не указано иное.
- Mix ASC-загруженным CSM (5 мг содержащих ≈ 2 × 10 4 клеток) с коллагена 1 типа (7,5 мг / мл), выделенных из сухожилий хвоста крысы по методу Борнштейн 8 и фибриллировать после корректировки рН до 6,8 с помощью 2 н.
- Добавить фибриллированная коллагена ASC-CSM смесь на 12-луночного планшета и инкубировать 30 минут при температуре в 5% CO 2 увлажненном инкубаторе при температуре 37 ° C.
- После полного аритмия, инкубировать коллагена ASC-CSM гели на срок до 14 дней в 5% CO 2 увлажненном инкубаторе при температуре 37 ° C.
- Выпуск и миграции клеток из CSM в геле наблюдаются с использованием стандартных методов микроскопии.
7. Представитель Результаты
В настоящем исследовании мы разработали стратегию в пробирке для доставки стволовых клеток из хитозана микросфер (CSM) в коллагеновый гель эшафот. Пористые CSM одинакового размера (175-225 мкм в диаметре) и состава были подготовлены и использовались как мобильные носители (рис. 2). После инкубации с ASC CSM, клетки приводятся в концентрации 2 х 10 4 cells/5mg из CSM. Клетки были способны к распространению в микросферы, в то время как расширение филоподиив пористую расщелинах микросферы (рис. 3). Как только клетка загруженных CSM были смешаны с коллагеновый гель, клетки сразу же начали мигрировать в гель (рис. 4).
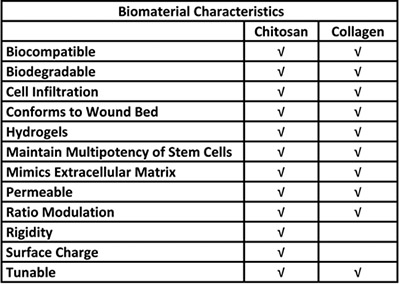
Таблица 1. Биологические преимущества использования хитозана и коллагена в систему доставки стволовых клеток.
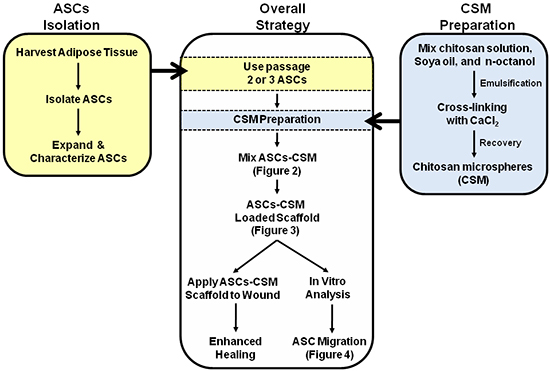
Рисунок 1. Схема изображающая общую стратегию двойного использования ASC-CSM леса загруженных коллагена. На рисунках 2, 3 и 4, аннотированные в схему для интерпретации образов.
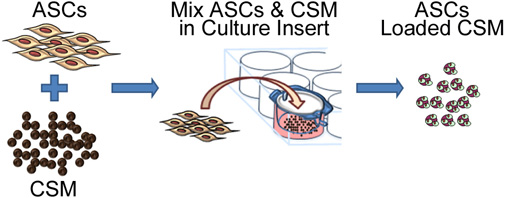
Рисунок 2. Схематическое изображение изображающие процесс посева стволовых клеток на хитозана микросферы. ПроцессESS включает в себя совместное культивирование с ASC CSM в 8 - мкм размер пор мембраны культуры пластины вставки. После 24 часов, микросферы удаляются из вставки и готовы для внедрения в матрицу биоматериала.
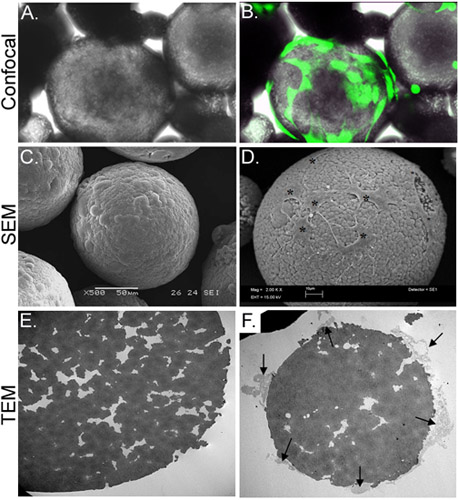
Рисунок 3. Морфологические характеристики CSM загружены с ASC. Группа изображает свет микрофотография ASC-загруженным CSM, в то время как панель B показывает те же поля зрения с наложенными на изображение, полученное с помощью конфокальной флуоресцентной микроскопии. ASC был с предустановленной кальцеин AM (зеленый). Группа C изображает образ изображения SEM без нагрузки микросфер, а панель D показывает клетки загружены на микросфер (звездочки). ПЭМ-изображение в электронной панели показывает сечение патронов микросфер. Множество пор и трещин, расположенных на территории микросфер. Группа F показывает поперечного сечения микросферы с клетками (стрелки), который прилагается и расширение филоподии в создапороков. Оригинальный увеличениях: и B = 70X, C = 500x, D = 2000 х, E и F = 2500 х.

Рисунок 4. Миграция из ASC CSM в трехмерном коллагена эшафот. Панели А и В изображают КСМ с клетки мигрируют от микросфер и в коллагеновой матрице на 3 день (A, стрелки). Группа B показывает аналогичную культуру через 12 дней. Просвечивающей электронной микроскопии (ПЭМ) изображения представлены на C, D и E. Звездочки в C и D показывают, микросферы, которые были поперечного сечения с клетки мигрируют от микросфер (стрелки). Высшее увеличение панели D изображен на панель E и показывает клетку филоподии прикреплены к коллагена (вставка). Оригинальный увеличение: и B = 100x, C и D = 6000 х, E = 20000 х, вставка = 150000 х.
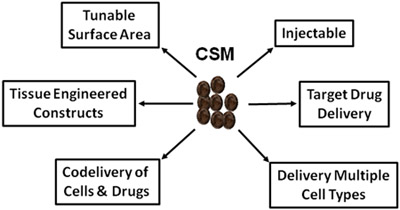
Рисунок 5.Схема изображающий огромного использования CSM в регенеративной медицине и доставки лекарств.
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Главным препятствием в стволовой клеточной терапии разрабатывает эффективные методы для доставки клеток к указанной области для ремонта. В связи с пациента к пациенту изменчивости, тип ткани, размер повреждений и глубины; методика доставки стволовых клеток должны определяться в кажд...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
Нет конкурирующих финансовых интересов существуют.
Отказ от ответственности
Мнения или утверждения, содержащиеся в настоящем личные взгляды авторов и не должно истолковываться как официальная или отражает мнение министерства обороны или американского правительства. Авторами являются сотрудники правительства США, и эта работа была подготовлена в рамках своих служебных обязанностей. Все Работа выполнена при поддержке армии США медицинских исследований и материального командования. Данное исследование было проведено в рамках протокола рассматриваются и утверждаются в армии США медицинских исследований и материального командной Экспертный совет организации, а также в соответствии с утвержденным протоколом.
Благодарности
ДОЗ поддерживается гранта от Фонда Женеве. Н. была поддержана Грантом Докторантура стипендий от инженерной инициативы тканей Питтсбурге.
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента / оборудование | Компания | Номер по каталогу | Комментарии |
| Хэнкс BalancedSalt Решение (HBSS) | Гибко | 14175 | Потребляемый |
| Эмбриональной телячьей сыворотки | Hyclone | SH30071.03 | Потребляемый |
| Коллагеназы II типа | Sigma-Aldrich | C6685 | Потребляемый |
| 70-мкм нейлоновая сетка фильтра | BD Biosciences | 352350 | Потребляемый |
| 100 мкм нейлоновая сетка фильтра | BD Biosciences | 352360 | Потребляемый |
| MesenPRO рост средней система | Invitrogen | 12746-012 | Потребляемый |
| L-глютамин | Гибко | 25030 | Потребляемый |
| T75 тканевой культуры колбу | BD Biosciences | 137787 | Потребляемый |
| Хитозан | Sigma-Aldrich | 448869 | Потребляемый |
| Уксусная кислота | Sigma-Aldrich | 320099 | Потребляемый |
| Октаноле | Acros Organics | 150630025 | Потребляемый |
| Сорбитан-моноолеат | Sigma-Aldrich | S6760 | Потребляемый |
| Гидроксид калия | Sigma-Aldrich | P1767 | Потребляемый |
| Ацетон | Fisher Scientific | L-4859 | Потребляемый |
| Этанол | Sigma-Aldrich | 270741 | Потребляемый |
| Тринитро бензолсульфокислота | Sigma-Aldrich | P2297 | Потребляемый |
| Соляная кислота | Sigma-Aldrich | 320331 | Потребляемый |
| Этиловый эфир | Sigma-Aldrich | 472-484 | Потребляемый |
| 8 мкм ткани Вставки культуры плиты | BD Biosciences | 353097 | Потребляемый |
| 1,5 мл Трубы Микроцентрифуга | Рыбак | 05-408-129 | Потребляемый |
| МТТ реагентов | Invitrogen | M6494 | Потребляемый |
| Диметилсульфоксида | Sigma-Aldrich | D8779 | Потребляемый |
| Qtracker мечения клеток Kit (Q трекер 655) | Молекулярные зонды | Q2502PMP | Потребляемый |
| Коллаген типа 1 | Travigen | 3447-020-01 | Потребляемый |
| Едкий натр | Sigma-Aldrich | S8045 | Потребляемый |
| 12-луночных тканевой культуры | BD Biosciences | 353043 | Потребляемый |
| Центрифугировать | Эппендорф | 5417R | Оборудование |
| Орбитальный Шейкер | Нью-Брансуик Scienctific | C24 | Оборудование |
| Увлажненном инкубаторе с воздушным 5% CO 2 | Thermo Scientific | Модель 370 | Оборудование |
| Накладные мешалки | IKA | Visc6000 | Оборудование |
| Магнитная мешалка | Гранулирование | PC-210 | Оборудование |
| Вакуум-эксикатор | - | - | Оборудование |
| Анализатор размеров частиц | Малверн | STP2000 Spraytec | Оборудование |
| Водяная баня | Fisher Scientific | Isotemp210 | Оборудование |
| Спектрофотометр | Beckman | Beckman Coulter DU800UV/Visible спектрофотометр | Оборудование |
| Вихревой | Diagger | 3030a | Оборудование |
| Считыватель микропланшетов | Molecular Devices | SpectraMax M2 | Оборудование |
| Свет / флуоресцентный микроскоп | Олимп | IX71 | Оборудование |
| Конфокальной микроскопии | Олимп | FV-500 лазерный сканирующий конфокальный микроскоп | Оборудование |
| Сканирующий электронный микроскоп | Carl Zeiss микрофонаroImaging | Лев 435 VP | Оборудование |
| Просвечивающего электронного микроскопа | JEOL | JEOL 1230 | Оборудование |
Ссылки
- Krampera, M. Mesenchymal stem cells for bone, cartilage, tendon and skeletal muscle repair. Bone. 39, 678-683 (2006).
- Patrick, C. W. Tissue engineering strategies for adipose tissue repair. Anat. Rec. 263, 361-366 (2001).
- Pountos, I., Giannoudis, P. V. Biology of mesenchymal stem cells. Injury. 36, Suppl 3. S8-S12 (2005).
- Kim, I. Y. Chitosan and its derivatives for tissue engineering applications. Biotechnol. Adv. 26, 1-21 (2008).
- Shi, C. Therapeutic potential of chitosan and its derivatives in regenerative medicine. J. Surg. Res. 133, 185-192 (2006).
- Natesan, S. Adipose-derived stem cell delivery into collagen gels using chitosan microspheres. Tissue Eng. Part. A. 16, 1369-1384 (2010).
- Bubnis, W. A., Ofner, C. M. 3rd The determination of epsilon-amino groups in soluble and poorly soluble proteinaceous materials by a spectrophotometric method using trinitrobenzenesulfonic acid. Anal. Biochem. 207, 129-133 (1992).
- Bornstein, M. B. Reconstituted rattail collagen used as substrate for tissue cultures on coverslips in Maximow slides and roller tubes. Lab Invest. 7, 134-137 (1958).
- Benoit, D. S. Integrin-linked kinase production prevents anoikis in human mesenchymal stem cells. J. Biomed. Mater. Res. A. 81, 259-268 (2007).
- Nuttelman, C. R., Tripodi, M. C., Anseth, K. S. Synthetic hydrogel niches that promote hMSC viability. Matrix Biol. 24, 208-218 (2005).
- Shanmuganathan, S. Preparation and characterization of chitosan microspheres for doxycycline delivery. Carbohydr. Polym. 73, 201-211 (2008).
- Haque, T., Chen, H., Ouyang, W., Martoni, C., Lawuyi, B., Urbanska, A., Prakash, S. Investigation of a new microcapsule membrane combining alginate, chitosan, polyethylene glycol and poly-L-lysine for cell transplantation applications. Int. J. Artif. Organs. 28, 631-637 (2005).
- Goren, A., Dahan, N., Goren, E., Baruch, L., Machluf, M. Encapsulated human mesenchymal stem cells: a unique hypoimmunogenic platform for long-term cellular therapy. FASEB J. 24, 22-31 (2010).
- Zielinski, B. A., Aebischer, P. Chitosan as a matrix for mammalian cell encapsulation. Biomaterials. 15, 1049-1056 (1994).
- Girandon, L., Kregar-Velikonja, N., Božikov, K., Barliç, A. In vitro Models for Adipose Tissue Engineering with Adipose-Derived Stem Cells Using Different Scaffolds of Natural Origin. Folia Biol. (Praha). 57, 47-56 (2011).
- Baruch, L., Machluf, M. Alginate-chitosan complex coacervation for cell encapsulation: effect on mechanical properties and on long-term viability. Biopolymers. 82, 570-579 (2006).
- Wei, Y., Gong, K., Zheng, Z., Wang, A., Ao, Q., Gong, Y., Zhang, X. Chitosan/silk fibroin-based tissue-engineered graft seeded with adipose-derived stem cells enhances nerve regeneration in a rat model. J. Mater. Sci. Mater. Med. , (2011).
- Wang, Q., Jamal, S., Detamore, M. S., Berkland, C. PLGA-chitosan/PLGA-alginate nanoparticle blends as biodegradable colloidal gels for seeding human umbilical cord mesenchymal stem cells. J. Biomed. Mater. Res. A. 96, 520-527 (2011).
- Alves da Silva, M. L., Martins, A., Costa-Pinto, A. R., Correlo, V. M., Sol, P., Bhattacharya, M., Faria, S., Reis, R. L., Neves, N. M. Chondrogenic differentiation of human bone marrow mesenchymal stem cells in chitosan-based scaffolds using a flow-perfusion bioreactor. J. Tissue Eng. Regen. Med. , (2010).
- Kang, Y. M., Lee, B. N., Ko, J. H., Kim, G. H., Kang, K. N., Kim da, Y., Kim, J. H., Park, Y. H., Chun, H. J., Kim, C. H., Kim, M. S. In vivo biocompatibility study of electrospun chitosan microfiber for tissue engineering. Int. J. Mol. Sci. 11, 4140-4148 (2010).
- Bozkurt, G., Mothe, A. J., Zahir, T., Kim, H., Shoichet, M. S., Tator, C. H. Chitosan channels containing spinal cord-derived stem/progenitor cells for repair of subacute spinal cord injury in the rat. Neurosurgery. 67, 1733-1744 (2010).
- Leipzig, N. D., Wylie, R. G., Kim, H., Shoichet, M. S. Differentiation of neural stem cells in three-dimensional growth factor-immobilized chitosan hydrogel scaffolds. Biomaterials. 32, 57-64 (2011).
- Altman, A. M., Gupta, V., RÃos, C. N., Alt, E. U., Mathur, A. B. Adhesion, migration and mechanics of human adipose-tissue-derived stem cells on silk fibroin-chitosan matrix. Acta Biomater. 6, 1388-1397 (2010).
- Altman, A. M., Yan, Y., Matthias, N., Bai, X., Rios, C., Mathur, A. B., Song, Y. H., Alt, E. U. IFATS collection: Human adipose-derived stem cells seeded on a silk fibroin-chitosan scaffold enhance wound repair in a murine soft tissue injury model. Stem Cells. 27, 250-258 (2009).
- Machado, C. B., Ventura, J. M., Lemos, A. F., Ferreira, J. M., Leite, M. F., Goes, A. M. 3D chitosan-gelatin-chondroitin porous scaffold improves osteogenic differentiation of mesenchymal stem cells. Biomed. Mater. 2, 124-131 (2007).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены