Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Vampiric выделение внеклеточной жидкости из
В этой статье
Резюме
Модель организма C. Элеганс Использует pseudocoelomic жидкости в качестве пассивной системы кровообращения. Прямой анализ этой жидкости не было возможно ранее. Здесь мы представляем новый метод анализа непосредственно в межклеточное пространство, а также использовать системные сигналы глушителя во время ответа RNAi как доказательство принципа пример.
Аннотация
Генетически послушной моделью организма C. Элеганс предоставил взглянуть на множество биологических вопросов, включен по своим коротким временем генерации, простота роста и небольшого размера. Этот небольшой размер, однако, имеет запретил ряд технических подходов в других модельных системах. Например, переливания крови в системах млекопитающих и методы пересадки растений позволяют задавать вопросы кровообращения состав системы и сигнализации. Кровеносная система червя, pseudocoelom, до недавнего времени было невозможно анализа напрямую. Чтобы ответить на вопросы межклеточной сигнализации и системы кровообращения состава C. Элеганс исследователи традиционно обратился к генетическому анализу, клеток / тканей конкретных спасения, и мозаика анализа. Эти методы дают возможность сделать вывод, что происходит между клетками, но не универсально применимые в выявлении и характеристике внеклеточных молекул. Здесь мы представляем пеwly разработанной методики непосредственного анализа pseudocoelomic жидкость C. Элеганс. Техника начинается либо с генетическими или физические манипуляции для увеличения объема внеклеточной жидкости. После этого животные подвергаются микроинъекции вампиров обратном технологии с использованием микроинъекций буровой установки, которая позволяет удобно управлять давлением баланса. После выделения внеклеточной жидкости, собранной жидкости может быть анализировали с помощью перевода на других животных или молекулярных средств. Чтобы продемонстрировать эффективность этой методики мы представляем детальный подход для анализа конкретных примеров внеклеточных сигнальных молекул, длинные дцРНК в системный ответ RNAi. Хотя характеристика системного RNAi является доказательством принципа, например, мы видим, эта техника как адаптироваться, чтобы ответить на различные вопросы кровообращения состав системы и сигнализации.
протокол
1. Подготовка материалов
Материалов, необходимых для микроинъекции обратном вампира похож на который требуется для стандартных методов микроинъекции используется, чтобы сделать трансгенный C. Элеганс штаммы 1. Хотя некоторые реагенты (например, плиты анализа) производится в день экспериментальные передачи, многие из материалов должно быть согласованно подготовлен в течение 8 дней (см. таблицу 1 на время таблице). Таким образом, важно тщательно планировать заранее, при использовании этого метода (для необходимых реактивов и оборудования см. таблицу 2).
Инъекции лап:
- Сделайте 2% агарозном решение в H 2 O и тепло до полного растворения. Алиготе в 1 мл аликвоты в 1,5 мл микроцентрифужных трубы и хранить при 4 ° C.
- Выложить 22 х 50 мм стекла крышка на скамью верхней их края слегка выступающий на замену верхнего края для облегчения их собирать быстрее.
- ПокEA небольшое отверстие в крышке микроцентрифужных трубки (используется чертежная кнопка), чтобы позволить вентиляции. Поместите пробирку в 15 мл стакан с примерно 5 мл воды, и микроволновую печь для плавления (около 35 секунд).
- С помощью пипетки Пастера и лампочки месте падения (примерно 35 мкл) расплавленного агарозы на стеклянной крышкой и сразу же поместить вторую стеклянную крышку над падения на угол 90 ° к первой. Повторите несколько других стекол крышкой.
- После агарозном укрепил, снимите крышку стекла и позволяют площадке полностью высохнуть в течение ночи (при необходимости рано, слайды могут быть помещены в 50-80 ° C духовке в течение 15-30 минут).
- Колодки можно хранить в коробке стеклянной крышкой при комнатной температуре на неопределенный срок.
Анализ плиты:
Для опробования эмбриональной летальности, связанных с PAL-1 РНК-интерференции, подготовка анализа пластин должно быть сделано на день эксперимента вампиров. Цель состоит в том, чтобы гаве минимальный бактериальный газон при этом не голодать ваши черви. Слишком толстый газон делает забил Pal-1 личинки чрезвычайно трудно, так как небольшие, полупрозрачные деформированных животных L1 может быть легко потерян в пищу. Плита подготовка должна быть оптимизирована для озвучивания фенотип интерес.
- Подготовка OP50: Seed 5mLs Л.Б. бульон с одной OP50 колонии, выращенных на пластинах LB агар. Инкубируйте OP50 при 37 ° С в течение ночи при встряхивании, а затем сохранить при 4 ° C.
- Подготовка 35-мм пластинах NGM в соответствии с протоколом основной (см. примечание 1).
- Пятно 20 мкл ночной культуры OP50 (шаг 1,7) на каждый NGM пластины. Разрешить LB-OP50 до полного высыхания (это займет не более 20 минут).
Иглы для инъекций:
- Потяните инъекционных игл из боросиликатного стеклянные капилляры использованием P97 пламенный / коричневый микропипетки съемник из инструментов Sutter (см. Рисунок 1 представитель форму иглы).
- Магазин инъекцийиглы в иглодержатель построены из чашки Петри и моделирование глины (см. 1).
2. Подготовка червей
Предполагаемый объем pseudocoelomic взрослого C. Элеганс гермафродит составляет 40-80 пиколитра (чел ком. David Hall). Для получения образцов внеклеточной жидкости из такой небольшой водоем это выгодно, чтобы увеличить общий объем имеющихся ресурсов. Мы определили три метода значительно увеличить доступный жидкости в донорской червей. Наш основной метод использует фенотип CLR-1 (e1745) мутантов, которые могут привести к 10-кратное и более увеличение объема внеклеточной жидкости (рис. 2). Два альтернативных метода воспользоваться тем, что зародышевой линии составляет почти одну треть от общего объема червя, и ее удаление от GLP-1 (RNAi) или результатах лазерной абляции у животных с pseudocoelomic жидкости, заполняющей пустоту зародышевой линии (рис. 2) 2 </ SUP>.
Подготовка донора червей использующих CLR-1 (e1745)
См. Рисунок 3 для CLR-1 (e1745) рабочий процесс передачи анализе
- Подряд из бактерий, выразив дцРНК для одной колонии на LB + 25μg/mL карбенициллин пластин. Мы будем использовать PAL-1 дцРНК бактерий для этой демонстрации. Выдержите в течение ночи при 37 ° C.
- С прожилками LB + 25 мкг / мл карбенициллин пластины PAL-1 (RNAi) бактерии, выбрать одну колонию, чтобы привить 3 мл ночной культуры в LB дополнены 25μg/mL карбенициллин.
- Внесите 15 мкл ночной культуры на 35 мм пластинах NGM с добавлением 25 мкг / мл карбенициллин и 1 мМ IPTG. Убедитесь, что пластина бактерии от центра пластины. Дайте высохнуть (около 20 минут).
- Сделать 500 мкл свежей раствором хлорной извести (1:1 5М KOH: NaHypochlorite).
- Внесите 10 мкл раствор отбеливателя на тарелку семенами. Будьте уверены, тО разместить отбеливатель капли от бактериальной пятнистости.
- Чтобы получить небольшой, чистый, синхронизированные населения CLR-1 (e1745) животных для обратной микроинъекции, выбрать 2-10 беременной взрослых в отбеливателем капли. Взрослые растворяются, оставляя чистую, частично развитием поставил эмбрионов. Эти эмбрионы затем вылупляются личинки и будут ползти к еде.
- Выдержите в течение четырех дней при температуре 20 ° C.
- Сдвиг плит до 25 ° C в течение четырех часов, чтобы вызвать отек.
- Возьмите червей unseeded пластины NGM и дать время, чтобы очистить от бактерий из кутикулы. (Необязательный шаг) промыть червей в M9 при переходе к NGM пластин.
- Переместить L4/Young взрослых (YA) червей получателя unseeded пластины NGM пластины и дать время, чтобы очистить от бактерий из кутикулы. (Необязательный шаг) промыть червей в M9 при переходе к NGM пластин.
A2) Альтернативные подготовка донора червей использующих GLP-1 (RNAi)
- С прожилками плитаЛ.Б. + 25 мкг / мл карбенициллин привить 3 мл ночной культуры Л.Б. дополнить карбенициллин с одной колонии GLP-1 (RNAi) бактерий. Инкубировать при 37 ° С в течение ночи.
- Внесите 15 мкл GLP-1 (RNAi) ночной культуры на 35 мм NGM пластин с добавлением 25 мкг / мл карбенициллин и 1 мМ IPTG. Выдержите при комнатной температуре в течение ночи.
- Передача пять L3/L4 животных GLP-1 (RNAi) пластин. Выдержите в течение двух дней при температуре 20 ° C. RNAi таргетинга GLP-1 приводит к потомству с дефектами зародышевой линии распространения. Неспособность в полной мере развивать зародышевой линии приводит к незанятым пространство, которое наполняет внеклеточной жидкости. Оптимизация пищи РНК-интерференции для получения потомства, что прогресс во взрослую жизнь без пролиферативной germlines могут быть необходимы в зависимости.
- Были подготовлены PAL-л (RNAi) пластин, как в шагах 2.1-2.3 подготовки CLR-1 (e1745) червя протокола выше.
- Сделать свежий раствор отбеливателяния (1:1 5М KOH: NaHypochlorite).
- Внесите 10 мкл раствор отбеливателя на посеян PAL-1 (RNAi) пластины. Будьте уверены, чтобы поместить каплю отбеливателя от бактериальной пятнистости.
- Трансфер эмбрионов, выбирая 2-10 беременной GLP-1 (RNAi) взрослых в отбеливателем капли.
- Выдержите в течение четырех дней при температуре 20 ° C.
- Возьмите червей unseeded 60 мм пластины NGM и дать время, чтобы очистить от бактерий из кутикулы. (Необязательный шаг) промыть червей в M9 при переходе к NGM пластин.
B2) Альтернативные подготовка донора червей использующих зародышевой линии лазерной абляции
- Подряд из бактерий, выразив дцРНК для одной колонии на LB + 25 мкг / мл карбенициллин пластин. Мы будем использовать PAL-1 дцРНК бактерий для этой демонстрации. Выдержите в течение ночи при 37 ° C.
- Из пластины с карбенициллин привить 3 мл ночной культуры в LB с добавлением 25 мкг / мл карбенициллин.
- Внесите 15 мкл-йэлектронной ночи культуры PAL-1 дцРНК-экспрессирующие бактерий на 35 мм пластинах NGM с добавлением 25 мкг / мл карбенициллин и 1 мМ IPTG. Дайте высохнуть в течение ночи.
- Изолировать L1 животных от стандартных OP50 плиты и лазерной абляции соматических зародышевых клеток-предшественников Z1 и Z4 с использованием стандартного протокола 3.
- Восстановление лазерной абляции червей на вышеупомянутом PAL-1 плиты RNAi.
- Выдержите в течение 3 дней при температуре 20 ° C.
- Возьмите червей в чистую тарелку NGM и дать время, чтобы очистить от бактерий из кутикулы. (Необязательный шаг) промыть червей в M9 при переходе к NGM пластин.
Подготовка червей получателя
- Подряд из OP50 для одной колонии на LB пластины. Выдержите в течение ночи при 37 ° C.
- Из LB пластины привить 3 мл ночной культуры в LB.
- Внесите 15 мкл ночной культуры на 35 мм пластин NGM. Убедитесь, что пластина бактерии от центра пластины. Дайте высохнуть (примерно 20 минут).
- Сделать свежим раствором хлорной извести (1:1 5М KOH: NaHypochlorite).
- Внесите 10 мкл раствор отбеливателя на тарелку семенами. Будьте уверены, чтобы поместить каплю отбеливателя от бактериальной пятнистости.
- Трансфер эмбрионов, выбирая 2-10 беременной взрослых N2 в отбеливателем капли.
- Выдержите в течение трех дней при температуре 20 ° C.
- Переместить червей чистая, unseeded NGM пластины и инкубировать при 20 ° C в течение не менее 30 минут.
3. Vampiric выделение внеклеточной жидкости
Следующий протокол является специфическим для микроинъекции установка, состоящая из PLI-100 пико-инжектор, стационарные игла прошла в микроманипулятора, и плавучей сцене, в которой червь может скользить в иглу. Тем не менее, обобщенный метод, чтобы вставить пустую иглу микроинъекции в донора животных, при сохранении достаточного давления для предотвращения капиллярного потока минерального масла до вступления и сотовой маterial в то время как проникать в тело стены ткани. В то время как игла находится в пределах давления животных-доноров уменьшается, чтобы капиллярного заполнения иглы с внеклеточной жидкости, которая затем может быть перемещен в иглу получателю червей и выслан за счет увеличения давления достаточно. Удаление жидкости под действием капиллярных сил может также способствовать с помощью заливки или всасывания, функция пико-инжектор. Эта обобщенная методика должна быть легко адаптированы к другим микро-системы впрыска, что позволяет управлять балансом давления.
- Включите инвертированный микроскоп, микроскоп рассечения, и пико-инжектор (см. Рисунок 1).
- Поверните ручку из Pico инжектор P ясно, и убедитесь, что измерения тока в бар. Это чтение, ясно давления, это давление на входе и должно быть приблизительно 0 фунтов на кв.
- Проверьте первичный клапан на регуляторе бака азота, чтобы убедиться, что выход закрыт (поворот counterclockwise до ручки отдельно).
- Откройте основной клапан бака азота. Регулятор калибровочных ближайшего N2 танк должен теперь читать внутреннего давления в баке.
- Медленно увеличивайте давление при поворотом основной клапан регулятора по часовой стрелке. Контроль за увеличением давления на пико-инжектор (это более точный, чем чтение выходного давления на регуляторе датчик). Медленно увеличивайте давление до 100 атм. Не позволяют превышать 105 фунтов на квадратный дюйм.
- Когда 100 фунтов на квадратный дюйм достигнута переключения селектора в положение P внедрить и установить давление впрыска до 30 фунтов на квадратный дюйм использованием Pinject ручку.
- Переключите переключатель в положение P баланс.
- Поместите 15 мкл каплю минерального масла на чистую донора и реципиента пластин.
- Накройте 2% агарозном инъекции площадку в минеральном масле.
- Загрузите вытащил микропипетки иглу в держатель и выровнять.
- Использование рассечение микроскопом, горе 1-доноров и 1 получатель червь рядом друг с другом на агарозном робъявление.
- Позиция червей использующих низкое увеличение и принести иглу в минеральном масле около доноров.
- Переход к высокой мощности и положения иглы около pseudocoelomic полости.
- Увеличение баланса давления примерно до 10 фунтов на квадратный дюйм. Обратите внимание, вилки минерального масла на кончике иглы.
- Нажмите на червя в иглу в положение кончика иглы в pseudocoelomic полости путем перемещения на сцене.
- Обратите внимание, прыжок в положении минерального масла на кончике иглы.
- Уменьшите давление равновесия, чтобы капиллярного действия, чтобы заполнить иглы. (Можно также использовать функцию заливки, чтобы ускорить процесс).
- После сбора жидкости слайд червя от иглы.
- Переключить на малом увеличении власть и положение иглы получателя червя (НЕ ПОЗВОЛЯЮТ кончик иглы оставить минеральное масло). [Кроме того, держатель иглы могут быть удалены и жидкость переносят в каплю в микроцентрифуге трубы.]
- Вернитесь кбольшого увеличения и перемещения иглы в получателем червь, сдвинув столик микроскопа.
- После расположена в получателем червя используют инъекции (установлен на уровне 35 фунтов на квадратный дюйм), чтобы придать pseudocoelomic жидкость, полученная от донора.
- Удалите иглу из получателей червь, сдвинув столик микроскопа в противоположном направлении, что и используется для ввода получателя.
- С иглы из червей, поднять иглу от инъекций площадку.
- Снимите инъекции площадки и поместить каплю M9 на червей, чтобы восстановиться.
- Поместите 10 мкл капли M9 на анализ пластины.
- Выберите получателя червя в M9 на анализ пластины.
4. Пробирного RNAi Фенотипические передачи
- Разрешить восстановился червей расти в течение 24 часов при 20 ° C.
- Удалить получателя взрослых, оставив эмбрионов и вылупившихся потомство на тарелку. Инкубируйте пластины в течение дополнительных 24 часов при 20 ° C.
- Оценка потомства, какбудучи не вылупились, вылупились, но быть фенотипически мутант, или быть диким типом личинок.
Примечания
- NGM средств массовой информации производится в 1-литровых пакетах, добавляя 18 г агара, 2,5 г bactopeptone, 3 г хлористого натрия и H 2 O. Добавить мешалкой и автоклав. После автоклавирования поставить колбу на магнитной мешалки и позволить средствам массовой информации, чтобы охладить до 60 ° С при перемешивании. После того, как средства массовой информации охлаждают, добавляют 1 мл холестерина (5 мг / мл в этаноле), 1 мл 1М CaCl 2, 1 мл 1 М MgSO 4, 25 мл калий-фосфатного буфера (рН 6.0). Если таблички будут использованы для RNAi NGM дополнен с 1 мл 1 М IPTG и 1 мл 25 мг / мл карбенициллин после охлаждения до 60 ° C. Плиты выливают в любой 35-мм (3,5 мл NGM) или 60 мм (8,5 мл NGM) чашки Петри.
- 2% агарозном сделано в воде. Хранить в холодильнике. Растопить и сделать колодки задолго до дня pseudocoelomic изоляцию жидкости. Сухость площадку делает червь придерживаться площадку,и как минимум один день сушки воздуха необходима для прокладки быть достаточно сухой. Если инъекции колодки слишком сухой и ваши черви доноров осушающий быстрее, чем вы можете управлять ими вы можете добавить дополнительную влагу для инъекций колодки, вдыхая на площадке перед добавлением минерального масла. Независимо умение работать быстро, чтобы изолировать pseudocoelomic жидкости до червь сушит абсолютно необходимо.
- Мы используем карбенициллин на всех этапах наши приготовления пищи RNAi, чтобы выбрать для маркера устойчивости к ампициллину. Карбенициллин является аналогом ампициллин который является более стабильным и приводит к меньшему количеству спутниковых колоний, чем ампициллин.
- Мы используем RNAi пластин, которые NGM дополнен 1 мМ IPTG и 25 мкг / мл карбенициллин. Векторы RNAi кормления в HT115 E. палочки штамма, который является недостаточным для дцРНК конкретных нуклеазы.
- (Необязательно Step) Мы считаем, что данный час на unseeded NGM пластин донора и реципиента черви делают адекватную работу потеря кутикулысвязанном бактерий, которые переносятся от кормления пластин. Это не так, хотя в тех случаях, когда целевые RNAi в донорском животных препятствует мобильности (например, UNC-22 (RNAi)). Поэтому становится необходимым, чтобы помочь в этом процессе. Для этого мы используем депрессии слайд с примерно 50 мкл M9. Сбор червей в M9 с пластин RNAi кормления, то перемешивание со стандартным выбором червь платины достаточно, чтобы удалить самое приверженцем бактерий.
5. Представитель Результаты
Представлены результаты для представителей экспериментальной передачи для внеклеточной жидкости из CLR-1 (e1745) червей, выращенных на бактерии, выразив дцРНК таргетинга PAL-1. Потомства животных-доноров умер и / или выставлены задние дефекты рисунка. Мы переносили внеклеточной жидкостиИз этих животных pseudocoelom РНК-интерференции наивным дикого типа червей. Часть последующего потомства животного-реципиента затем отображается ожидаемое PAL-1 мутантные фенотипы (рис. 4). Это в отличие от потомства животных, которые получатель получил внеклеточной жидкости от животных-доноров выросло на любой стандартной бактериальной пищи или контроля RNAi вектор бактерий которые отображаются только фоновый уровень летальности (рис. 4). В то время как потомство получателей внеклеточной жидкости от животных-доноров проходит RNAi показывают значительное увеличение частоты фенотипов дцРНК индуцированной, пенетрантность не так сильна, как в потомстве животных-доноров, где почти 100% потомства погибает невылупившиеся эмбрионов, и Только редкие, сильно деформированных животных люк.
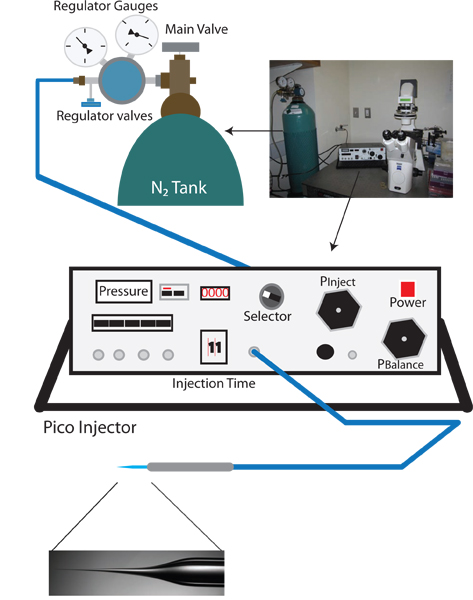
Рисунок 1. Vampiric обратной инъекции установки. Соответствующий л установкуРА вампиров обратной установки микроинъекции похож на стандартный C. Элеганс микроинъекции буровой установки, и включает в себя рассечение микроскопом, инвертированный микроскоп с 10х и 40х цели, подвижная сцена для позиционирования и микроманипулятора с впрыском держатель иглы. Кроме того, игла съемник для приготовления инъекционных игл также необходима. Уникальный для обратной протокол микроинъекции пико-форсунка, которая позволяет точно управлять балансом давления (например, Warner Instruments PLI-100) не требуется.
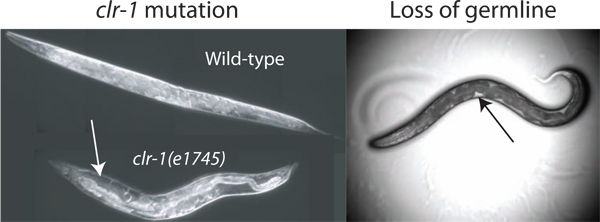
Рисунок 2. Повышение pseudocoelomic объеме. Объем pseudocoelomic жидкость для изоляции недостаточно для анализа в животных дикого типа. Объем может быть увеличен путем нарушения регуляции осмотического баланса через температурный сдвиг CLR-1 (e1745) животных, в результате очевидного накопления pseudocoelomic жидкости (белая стрелка). Кроме того, потеря гонады путем лазерной абляции или GLP-1 (RNAi) позволяет получить доступ к внеклеточной жидкости (убыток методом лазерной абляции показано). Имеющиеся жидкости легче всего наблюдать, как ясно патчей между темными кишечник и стенки тела (черная стрелка), хотя общее доступный объем значительно меньше, чем во CLR-1 (e1745) животных, выращенных при рестриктивной температуре.
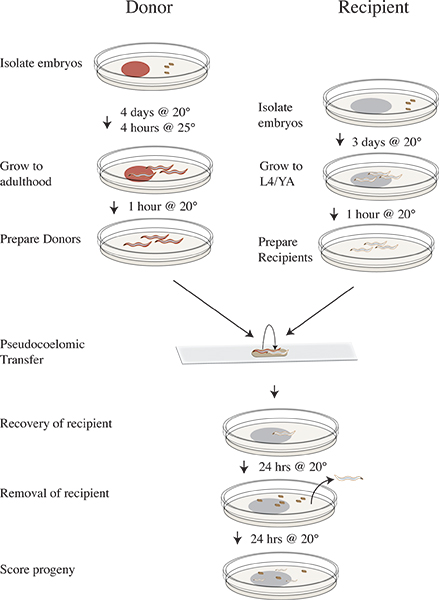
Рисунок 3. Vampiric изоляции и сроки передачи протокола. За четыре дня до передачи эксперименте изолировать CLR-1 (e1745) доноров эмбрионов на пластинах с RNAi пищи и инкубировать при 20 ° C. За три дня до изолировать эмбрионов N2 получателя на OP50. В день эксперимента переложить доноров пластин до 25 ° C в течение четырех часов. Снимите доноров после 25 ° C инкубации в чистых тарелок не хватает пищи и переход на 20 ° C. Переместить получателя животных для очистки плитне хватает еды и продолжают инкубацию при 20 ° C. Выполните передачу опыта и восстановить получателя червей на OP50 пластины и инкубировать при 20 ° C. Удалить получателя животных после 24 часов при 20 ° C. Инкубируйте получателя потомство в течение 24 часов при 20 ° C. Оценка потомства, как дикого типа, мутант, или невылупившиеся.
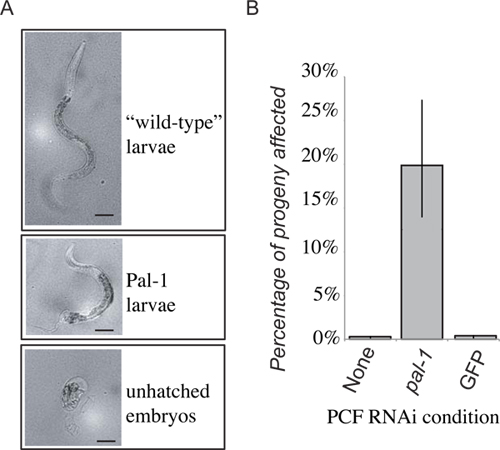
Рисунок 4. Представитель результаты. Потеря PAL-1 функция получатель может привести к эмбриональной летальности, или отличительные потери задних развития (A). 48 часов после PCF передачи потомству заложены в течение первых 24 часов набрал либо как дикого типа личинок, PAL-1 личинки, или невылупившиеся эмбрионов. Частота невылупившиеся эмбрионов и фенотипически Pal-1 личинки объединены, чтобы дать меру PAL-1 (RNAi) передача индуцированных фенотипов. Получение pseudocoelomic жидкости из животных, выращенных на PAL-1 дцРНК пищи производит сильное индукции связанногофенотипов невиданные в передаче управления получателями (B).
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Мы представили здесь новый метод, который позволяет выделение и характеристика внеклеточной жидкости из модельного организма C. Элеганс. Техника начинается с генетической или физические манипуляции доноров червей увеличить их общего объема внеклеточной жидкости. Внеклеточной ж...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Мы хотели бы отметить совместный характер Hunter лаборатории, и поблагодарить их за полезные обсуждения и помощь, которая сделала развития этой техники возможно и весело. Мы хотели бы поблагодарить Найджела Делани и Caenorhabditis генетический центр для червя и бактериальных штаммов. Эта работа была поддержана Национальным институтом здоровья GM089795 грант CPH.
Access restricted. Please log in or start a trial to view this content.
Материалы
День Worm Prep Материал Prep
| Name | Company | Catalog Number | Comments |
| -7 Или предварительное | Поддержание чистой, хорошо кормят CLR-1 (e1745) N2 и черви | Сделайте инъекцию колодки, NGM пластин, NGM + Carb / IPTG пластин, OP50 LB складе | |
| -6 | Подряд из RNAi еду на LB + Carb | ||
| -5 | Инокулировать 3 мл в течение ночи с RNAi еды | ||
| -4 | Переместить эмбрионов RNAi пластины | Семя RNAi пластины | |
| -3 | |||
| -2 | |||
| -1 | |||
| 0 | Shift, червей до 25 в течение 4 часов | Сделайте анализ пластин | |
| Переместить червей для очистки NGM пластин | |||
| Vampiric передачи | |||
| Восстановление получателя | |||
| +1 | Удалить передачи получателю | ||
| +2 | Оценка Потомки |
Таблица 1. Подготовка материала шкале.
Оборудование О компании Номер по каталогу CLR-1 (e1745) II 9 GLP-1 RNAi вектор 10 PAL-1 RNAi вектор 11| Пиколитра давления инжектора | Warner Instruments | 65-0001 (PLI-100) |
| Flaming / коричневый микропипетки съемник | Sutter Instruments | P97 |
| Axiovert 200 | Zeiss | |
| Реагенты | ||
| Минеральные масла | EM Science | MX1560-1 |
| 22x50 № 1 ½ стеклом | Corning | |
| SeaKem LE агарозы | Lonza | 50004 |
| Боросиликатного стеклянные капилляры | World Precisions инструменты | 1B100F-4 |
| Раствор гипохлорита натрия (5% активного хлора) | JT Baker | 9416-01 |
| C. Элеганс И бактериальные штаммы | ||
| Caenorhabditis генетический центр (CGC) | CB3241 | |
| Источник Bioscience (Ahringer кормления Library) | F02A9.6 | |
| PHC187 | ||
| OP50-GFP 5 | Caenorhabditis генетический центр (CGC) | OP50-GFP |
| YFP E. палочки 4 | MC4100-YFP | |
Таблица 2. Специфические реактивы и оборудование.
Ссылки
- Berkowitz, L. A., Knight, A. L., Caldwell, G. A., Caldwell, K. A. Generation of Stable Transgenic C. elegans Using Microinjection. J. Vis. Exp. (18), e833-e833 (2008).
- Hirose, T., Nakano, Y., Nagamatsu, Y., Misumi, T., Ohta, H., Ohshima, Y. Cyclic GMP-dependent protein kinase EGL-4 controls body size and lifespan in C elegans. Development. 130, 1089-1099 (2003).
- Kimble, J. Alterations in cell lineage following laser ablation of cells in the somatic gonad of Caenorhabditis elegans. Dev. Biol. 87, 286-300 (1981).
- Hegreness, M., Shoresh, N., Hartl, D., Kishony, R. An equivalence principle for the incorporation of favorable mutations in asexual populations. Science. 311, 1615-1617 (2006).
- Labrousse, A., Chauvet, S., Couillault, C., Kurz, C. L., Ewbank, J. J. Caenorhabditis elegans is a model host for Salmonella typhimurium. Curr. Biol. 10, 1543-1545 (2000).
- Kamath, R. S., Martinez-Campos, M., Zipperlen, P., Fraser, A. G., Ahringer, J. Effectiveness of specific RNA-mediated interference through ingested double-stranded RNA in Caenorhabditis elegans. Genome. Biol. 2, (2001).
- Min, K., Kang, J., Lee, J. A modified feeding RNAi method for simultaneous knock-down of more than one gene in Caenorhabditis elegans. Biotechniques. 48, 229-232 (2010).
- Zhuang, J. J., Hunter, C. P. Tissue-specificity of Caenorhabditis elegans Enhanced RNAi Mutants. Genetics. 188 (1), 235-237 (2011).
- Way, J. C., Chalfie, M. mec-3, a homeobox-containing gene that specifies differentiation of the touch receptor neurons in C. elegans. Cell. 54, 5-16 (1988).
- Kamath, R. S., Fraser, A. G., Dong, Y., Poulin, G., Durbin, R., Gotta, M., Kanapin, A., Bot, N. L. e, Moreno, S., Sohrmann, M. Systematic functional analysis of the Caenorhabditis elegans genome using RNAi. Nature. 421, 231-237 (2003).
- Winston, W. M., Molodowitch, C., Hunter, C. P. Systemic RNAi in C. elegans requires the putative transmembrane protein SID-1. Science. 295, 2456-2459 (2002).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены