Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
DII-маркировки DRG нейроны по изучению аксонального Ветвление в Всего Подготовка горе мышиных эмбриональных спинного мозга
В этой статье
Резюме
Стереотипные проекции сенсорных афферентов в спинном мозге грызунов предлагаем легко доступны экспериментальной системы для изучения аксонального ветвления через отслеживание одного аксонов.
Аннотация
Здесь мы представляем технику для обозначения траектории небольших групп нейронов DRG в эмбриональном спинного мозга диффузионного окрашивания использованием липофильных трассирующими 1,1 '-dioctadecyl-3, 3,3', 3'-tetramethylindocarbocyanine перхлорат (DII) 1 . Сравнение аксонального пути дикого типа с теми, мыши строки, в которых гены мутировали позволяет тестирование на функциональную роль кандидата белков в управление аксонального ветвления которых является существенным механизмом проводки нервной системы. Аксонального ветвлений позволяет отдельного нейрона, чтобы соединиться с несколькими целями, обеспечивая тем самым физическую основу для параллельной обработки информации. Ветви на промежуточных целевых регионах в рост аксонов можно отличить от терминала разветвление. Кроме того, различные режимы аксонального формирование отделения могут быть классифицированы в зависимости от того, ветвление результаты деятельности роста конуса (расщепления или задержки бюстгальтерnching) или от начинающего коллатералей от аксона вала в процессе, называемом интерстициальный ветвления 2 (рис. 1).
Центральной проекции нейронов DRG предлагаем полезную экспериментальная система для изучения обоих типов аксонального разветвления: когда их афферентные аксоны достигают спинного зоне корневой записи (DREZ) спинного мозга между эмбриональными дней от 10 до 13 (E10 - E13), они дисплей стереотипные картины Т-или У-образный бифуркации. Два полученных аксонов дочь действовать на ростральной или хвостового направлений, соответственно, на дорсолатеральной краю шнуром, и только после ожидания залогов период прорастают из этих стволовых аксонов проникнуть серого вещества (интерстициальный ветвления) и проект по релейной нейронов в специфических Пластинки спинного мозга, где они дальше ветвиться (терминал ветвления) 3. DII обводка показали рост конусами в спинной зоне корневой записи спинного мозга, который оказался в прocess расщепления предполагая, что бифуркации вызван расщеплением рост сам конус 4 (рис. 2), однако, и другие варианты были обсуждены также 5.
Это видео демонстрирует первые, как рассекают спинной мозг мышей E12.5 оставляя DRG прилагается. После фиксации образца небольшое количество DII применяются для DRG с использованием стеклянных игл вытащил из капилляров. После инкубации, помечены спинного мозга устанавливается в виде перевернутой буквы открытой книги подготовка к анализу отдельных аксонов с помощью флуоресцентной микроскопии.
протокол
1. Препарирование процедуры
Примечание: Экспериментальное использование мыши должны следовать официально утверждены методические рекомендации по уходу и использованию лабораторных животных.
- Перед подготовкой, настроить рассекает микроскопа и выложить хирургических инструментов, необходимых для вскрытия в том числе большие и маленькие ножницы, большие зубчатые щипцы, изогнутые щипцы и четыре комплекта Дюмон № 5 рассекает щипцы (два из которых имеют внутри полированного советы) ( подробнее см. таблицу специфических реагентов и оборудования). Место лист фильтровальной бумаги в 100-мм Sylgard покрытием чашке Петри. Залить холодным ФСБ в лунки 12-луночного планшета, 100-мм чашки Петри и 12-мл трубку и выйти на лед. Внести 2 мл фиксации буфера (4% параформальдегида в PBS, рН 7,4) в каждую лунку второй 12-луночного планшета и место на льду.
- После обезболивания, жертвенность приурочен беременных плотины E12.5 (обнаружение вагинальной плагин был назначен E0.5), при наведениис его вентральной стороной вверх на трех листах бумаги полотенца и замочить брюшной области с 70% этанола.
- Открытое брюшной полости полости, изолировать двусторонних рогах матки и перенести их в один из 100-мм блюда с ледяным PBS.
- Под микроскопическим контролем, сделать продольный разрез стенки матки с небольшим, прямые ножницы и отрезать каждому амниотической оболочки от плаценты.
- Очистите от амниотической оболочки от каждого эмбриона и перерезать пуповину.
- Используя небольшие ножницы, обезглавить эмбрионов и положил голову или часть их в сторону для выделения геномной ДНК генотипирование, если требуется. Впоследствии, передача torsi к соответствующему скважин 12-луночного планшета с холодным PBS.
- Влажный бумажный фильтр в блюдо Sylgard с несколькими каплями PBS и положение эмбриональных торс с его спинной стороны на бумаге. Для лучшей стабильности, выпрямить ее хвост и конечности от тела человека.
- Рабочийпри вскрытии микроскоп с увеличением примерно 16x, тщательно ущипнуть кожу эмбрионе выше спинного мозга с двумя парами тонких наконечником пинцетом и аккуратно разорвать его на части. Начиная с середины, перейти сначала к хвосту, а затем возобновлении от середины к передней стороне.
- Влажные эмбриона, время от времени с двумя-тремя каплями PBS, чтобы предотвратить его от высыхания.
- Чтобы не допустить этого DRG являются развернулся от от спинного мозга, когда он удаляется из эмбриона отделить DRG и спинной мозг из окружающего хрящевой позвоночника горизонтальными скользящими движениями с лезвием тонкой щипцов с внутренней полированной советы. Начиная с середины правой стороны эмбриона, работать ваш путь к хвосту, а затем к переднему концу. Затем повторите процедуру с другой стороны. Будьте осторожны, чтобы не сорвать связанные DRG.
- Чтобы отключить полностью ослабить спинной мозг от эмбриона, забрать его cervicдр. часть с мелкими щипцов и вытащите его из одного куска к ее хвостовой конец.
- Погрузитесь изолированных спинного мозга с прикрепленными DRG в скважине 12-луночного планшета заполнены фиксации буфера и приступить к подготовке спинной мозг из оставшихся эмбрионов.
- Fix спинного мозга по крайней мере два часа на льду.
2. DII маркировки нейронов DRG
- Для каждого спинного мозга, подлежащих маркировке, подготовить две иглы стекла с съемник микропипетки. Мы используем модель Саттер Р-97 электрода съемник (программа установки: 1 ТЕПЛО = 625, VEL = 35, TIME = 175; 2 ТЕПЛО = 600, VEL = 25, ВРЕМЯ = 175, 3 ТЕПЛО = 630, VEL =... 30, TIME = 150).
- Под микроскопический контроль падения кончике иглы каждый стакан три-пять раз в 5% (вес / объем) раствор DII в этаноле. Испарение этанола создает тонкий слой кристаллов DII на игле.
- Работая под рассекает микроскоп с увеличением приблизительно 40x, место спинного мозга с его VЕНТРАЛЬНОЙ вверх на слайде. Использование весной ножницы, открытые шнур на брюшной стороне на всей своей длине, проходящем через floorplate, чтобы позже монтаж препарата в перевернутом открытой книги режиме (см. раздел С).
- Позиция спинного мозга с дорзальной стороны на слайде. Затем вручную подход шнур с DII покрытый кончик иглы под стеклом микроскопические визуализации и аккуратно проколоть каждый второй DRG на одной стороне спинного мозга. Почти никаких следов DII должны быть видны в пронзил DRG обеспечить маркировку лишь небольшое число нейронов. Возьмите вторую иглу для другой стороны мозга. Стремясь только каждый второй DRG избежать перекрытия меченых аксонального прогнозы из соседних DRG, которые могли бы осложнить дифференциации отдельных аксонов.
- Вернуться спинного мозга в буфер фиксации и инкубировать в темноте в течение не менее шести часов при комнатной температуре или на ночь при 4 ° C, чтобы дать время для красителя диffuse вдоль аксона в плазматической мембране. Разрешить на более длительный инкубационный период (до двух дней при температуре 4 ° С), если анализ обеспечения роста в спинной мозг желательно.
3. Монтаж и микроскопического анализа
- После красителя диффузии, положение одного спинного мозга с его спинной стороной вниз на покровное в капле PBS. Позаботьтесь о том, прилагается DRG в правильной ориентации в стороны и не смешиваются. Аспирируйте лишней жидкости и выравниваться мозга в перевернутом открытом режиме с использованием книги щипцами.
- Горы препарат на предметное стекло микроскопа использованием PBS.
- Чтобы предотвратить увеличение нежелательного окрашивания фона флуоресценции микроскопического анализа меченых аксонального прогнозам должна осуществляться в день монтажа. До тех пор сохранить слайды в темноте при 4 ° C.
4. Представитель Результаты:
Спинного мозга мыши получает афферентные пр.ojections из 8 пар шейных, 13 пар грудных, 5 пар поясничных и 4 пары сакральное DRG на общую сумму 60 спинальных ганглиев. После некоторой тренировки спинного мозга с наиболее DRG еще привязаны может быть изолирован от эмбриона в возрасте до пяти минут. Эта процедура подходит для изоляции спинного мозга с прикрепленными DRG от E11.5 к E13.5 эмбрионов мыши. Тем не менее, наилучшие результаты достигаются от E12.5. Образцовый результаты маркировки процедуру, описанную здесь показаны на рисунке 3. Маркировка DRG по всей длине спинного мозга может быть использован для количественного аксонального ветвления поведения на разных позвоночных уровней (рис. 4).

Рисунок 1. Схема изображением двух основных режимах аксонального ветвления. (А) Ветвление деятельностью роста конус, который может привести к раздвоению - как указано здесь, - а также комплекс беседок терминала или(Б) обеспечения образования на валу аксона (интерстициальный ветвления). Последний режим является доминирующим типом ветвления проектирования корковых и таламокортикального аксонов 6,7.

Рисунок 2 Афферентные проекции DRG нейроны в спинном мозге эмбриональных отображения обоих типов аксонального ветвления. Аксоны первый филиал в DREZ от бифуркации (1) и из полученного дочерних ветвей залогов форму после периода ожидания междоузельными ветвления (2).
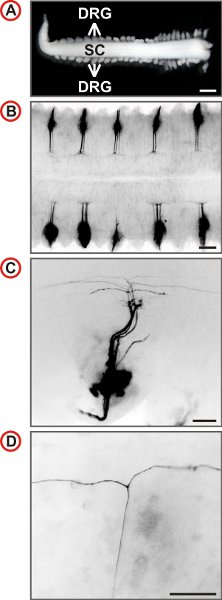
Рисунок 3. Визуализация одного аксонального траекториям эмбриональных нейронов DRG мыши. (А) спинного мозга с прикрепленными DRG приготовленный из E12.5 эмбриона мыши. (Масштаб бар, 1 мм.) (BD) Спинной видом DII меченных DRG от мышей дикого типа на повышение увеличением показаны. В B каждый второй DRG является labeleд в DII. Флуоресцентные изображения инвертируются, хвостовой находится на левой и на С и D, боковая находится на дне. В C небольшое количество аксонов обозначена и на большем увеличении присутствия Т-как ветви могут быть идентифицированы в DREZ спинного мозга. (Масштаб баров, 250 мкм (Б), 100 мкм (C) и 50 мкм (D).)
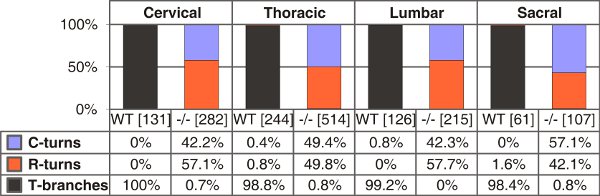
Рисунок 4. Количественное Т-образных ветвей, одна ростральной или хвостового превращается в дикого типа и C-тип натрийуретического пептида (CNP)-дефицитных мышей на E13.5. Количество аксонов одного рассчитывали в скобках приведены для различных уровней ствол для каждого генотипа. С-или R-очереди - рост только в хвостовом или ростральной направлении соответственно.
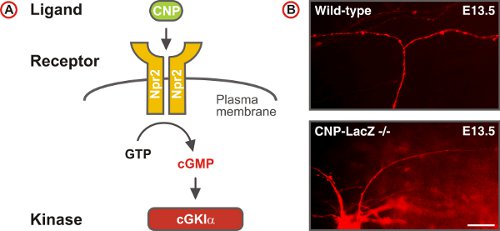
Рисунок 5. ЦГМФ сигнального пути триггеры сенсорных аксонов бифуркации в DREZ спинного мозга. (А) СхемацГМФ сигнальный путь состоит из лигандов CNP, рецептор guanylyl циклазы Npr2 и серин / треонин киназа cGKIα в эмбриональных нейронов DRG. Npr2 генерирует цГМФ из ГТФ при стимуляции CNP. (B) DII отслеживание одного аксоны нейронов DRG дикого типа и CNP-дефицитных мышей. (Масштаб бар, 25 мкм.)
Обсуждение
Стереотипные проекции включающий оба типа аксонального формирование филиала вместе с простотой подготовки в сочетании с использованием основных тканей для DII маркировки делает эмбрионального спинного мозга с прикрепленными DRG благоприятной моделью для изучения аксонального ветвле...
Раскрытие информации
Авторы не имеют ничего раскрывать.
Благодарности
Авторы хотели бы поблагодарить доктора Алистер Garratt (Дельбрюк центр, Берлин) за полезные комментарии. Эта работа была поддержана совместным исследовательским центром (SFB665) из Немецкого научно-исследовательского совета (DFG).
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента | Компания | Номер по каталогу | Комментарии (необязательно) |
| Стереомикроскоп Stemi ДРК | Zeiss | ||
| Фосфат-буферный раствор (PBS) | Biochrom AG | L182-50 | |
| Параформальдегид | Merck | 8.18715.1000 | |
| Стандартные хирургические ножницы | Инструменты изобразительных наук | 14001-13 | |
| Зубчатые стандартные щипцы | Инструменты изобразительных наук | 11021-14 | |
| Дополнительный штраф ножницы диафрагмой | Инструменты изобразительных наук | 14088-10 | |
| Изогнутый зажим | Инструменты изобразительных наук | 11003-13 | |
| Дюмон № 5 тонкой советы щипцы | Инструменты изобразительных наук | 11254-20 | |
| Дюмон № 5 зеркального блеска щипцы | Инструменты изобразительных наук | 11252-23 | |
| Vannas-Тюбинген весной ножницы | Инструменты изобразительных наук | 15008-08 | |
| Фильтровальная бумага | Fisher Scientific | FB59041 | |
| Sylgard 184 | Инструменты Всемирной Precission | SYLG184 | |
| 100-мм чашки Петри | Greiner | 663102 | |
| 12-мл полипропиленовые трубки | Карл Рот GmbH | ECO3.1 | |
| 12-а культуры пластины | Becton Dickinson | 35-3043 | |
| Этанол | Merck | 1.00983.2500 | |
| Flaming / коричневый микропипетки съемник Р-97 | Саттер машиностроительный завод | ||
| Боросиликатного стекла капилляров | Гарвардский аппарата | 30-0066 | |
| DII (1,1 '-Dioctadecyl-3, 3,3', 3'-тетраметил - indocarbocyanine перхлорат) | Sigma-Aldrich | 468495 | |
| Микроскоп слайды SuperFrost Plus | Карл Рот GmbH | H867.1 | |
| Скользит Стеклянная крышка | Карл Рот GmbH | 1870,2 |
Ссылки
- Honig, M. G., Hume, R. I. Dil and diO: versatile fluorescent dyes for neuronal labelling and pathway tracing. Trends. Neurosci. 12 (9), 333-333 (1989).
- Acebes, A., Ferrus, A. Cellular and molecular features of axon collaterals and dendrites. Trends. Neurosci. 23 (11), 557-557 (2000).
- Ozaki, S., Snider, W. D. Initial trajectories of sensory axons toward laminar targets in the developing mouse spinal cord. J. Comp. Neurol. 380 (2), 215-215 (1997).
- Schmidt, H. The receptor guanylyl cyclase Npr2 is essential for sensory axon bifurcation within the spinal cord. J. Cell Biol. 179 (2), 331-331 (2007).
- Gibson, D. A., Ma, L. Developmental regulation of axon branching in the vertebrate nervous system. Development. 138 (2), 183-183 (2011).
- O'Leary, D. D., Terashima, T. Cortical axons branch to multiple subcortical targets by interstitial axon budding: implications for target recognition and "waiting periods". Neuron. 1 (10), 901-901 (1988).
- Portera-Cailliau, C. Diverse modes of axon elaboration in the developing neocortex. PLoS. Biol. 3 (8), e272-e272 (2005).
- Gan, W. B. Vital imaging and ultrastructural analysis of individual axon terminals labeled by iontophoretic application of lipophilic dye. J. Neurosci. Methods. 93 (1), 13-13 (1999).
- Schmidt, H. C-type natriuretic peptide (CNP) is a bifurcation factor for sensory neurons. Proc. Natl. Acad. Sci. U. S. A. 106 (39), 16847-16847 (2009).
- Zhao, Z. Regulate axon branching by the cyclic GMP pathway via inhibition of glycogen synthase kinase 3 in dorsal root ganglion sensory neurons. Journal of Neuroscience. 29 (5), 1350-1350 (2009).
- Zhao, Z., Ma, L. Regulation of axonal development by natriuretic peptide hormones. Proc. Natl. Acad. Sci. U. S. A. 106 (42), 18016-18016 (2009).
- Schmidt, H., Rathjen, F. G. Signalling mechanisms regulating axonal branching in vivo. Bioessays. , (2010).
- Feng, G. Imaging neuronal subsets in transgenic mice expressing multiple spectral variants of GFP. Neuron. 28 (1), 41-41 (2000).
- Livet, J. Transgenic strategies for combinatorial expression of fluorescent proteins in the nervous system. Nature. 450 (7166), 56-56 (2007).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены