Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Пример подготовки
В этой статье
Резюме
Metabolomic профиля Микобактерий туберкулеза Определяется после роста в бульоне культуры. Условия могут быть изменены, чтобы проверить влияние пищевых добавок, окислители, и противотуберкулезных препаратов на метаболический профиль этого микроорганизма. Порядок подготовки экстракт применяют как для 1D 1 H и 2D 1 H- 13 C-ЯМР-анализа.
Аннотация
Mycobacterium tuberculosis is a major cause of mortality in human beings on a global scale. The emergence of both multi- (MDR) and extensively-(XDR) drug-resistant strains threatens to derail current disease control efforts. Thus, there is an urgent need to develop drugs and vaccines that are more effective than those currently available. The genome of M. tuberculosis has been known for more than 10 years, yet there are important gaps in our knowledge of gene function and essentiality. Many studies have since used gene expression analysis at both the transcriptomic and proteomic levels to determine the effects of drugs, oxidants, and growth conditions on the global patterns of gene expression. Ultimately, the final response of these changes is reflected in the metabolic composition of the bacterium including a few thousand small molecular weight chemicals. Comparing the metabolic profiles of wild type and mutant strains, either untreated or treated with a particular drug, can effectively allow target identification and may lead to the development of novel inhibitors with anti-tubercular activity. Likewise, the effects of two or more conditions on the metabolome can also be assessed. Nuclear magnetic resonance (NMR) is a powerful technology that is used to identify and quantify metabolic intermediates. In this protocol, procedures for the preparation of M. tuberculosis cell extracts for NMR metabolomic analysis are described. Cell cultures are grown under appropriate conditions and required Biosafety Level 3 containment,1 harvested, and subjected to mechanical lysis while maintaining cold temperatures to maximize preservation of metabolites. Cell lysates are recovered, filtered sterilized, and stored at ultra-low temperatures. Aliquots from these cell extracts are plated on Middlebrook 7H9 agar for colony-forming units to verify absence of viable cells. Upon two months of incubation at 37 °C, if no viable colonies are observed, samples are removed from the containment facility for downstream processing. Extracts are lyophilized, resuspended in deuterated buffer and injected in the NMR instrument, capturing spectroscopic data that is then subjected to statistical analysis. The procedures described can be applied for both one-dimensional (1D) 1H NMR and two-dimensional (2D) 1H-13C NMR analyses. This methodology provides more reliable small molecular weight metabolite identification and more reliable and sensitive quantitative analyses of cell extract metabolic compositions than chromatographic methods. Variations of the procedure described following the cell lysis step can also be adapted for parallel proteomic analysis.
протокол
1. Текст протокола
Этот протокол выдвигает на первый план адаптации методологии ЯМР M. туберкулез (класс III агента). Таким образом, уровень биобезопасности 3 (BSL3) практики необходимо следовать при проведении M. туберкулез исследований в ежегодной сертифицированной лаборатории. Воздействие лаборатории генерируемых аэрозолей является наиболее важным опасности, с которыми сталкивается персонал, работающий с этими микроорганизмами. Следующие процедуры проводятся в нашем институте и вариации могут существовать на основе рекомендаций институциональным биобезопасности комитета. Общие средства защиты персонала будет состоять из Tyvek костюм, пышные шапки, пинетки, N95 респиратор, защитные очки, рукава, и две пары нитриловые перчатки. Работа с участием М. туберкулез культур и / или манипуляции с открытым М. туберкулез контейнеров осуществляется в тип А2 или В2 бокс биологической безопасности. Пластиковые покрытых фильтровальной бумаги помещают на Working поверхности. Все материалы / расходные материалы необходимо утилизировать или удалены из объекта должны быть размещены в двух биологически сумки и обеззараживания в автоклаве. Рабочие поверхности и оборудование, которые используются в пределах шкафа (FastPrep-24 лизис гомогенизатор, спектрофотометр, ведерко со льдом и т. д.) должны быть продезинфицированы после каждого сеанса работы с 1% Amphyl (туберкулоцидным, бактерицидное, фунгицидное, и вирулицидной агента). M. туберкулез культуры должны быть поставлены под двойная защитная оболочка для транспортировки крупногабаритного оборудования находится за пределами бокс биологической безопасности, такие как морозильные камеры, инкубаторы, центрифуги, холодильники. Центрифугирование проводится с закрытыми чашками безопасности и уплотнительное кольцо винта верхней трубы. Для дальнейшего анализа за пределами лаборатории BSL3, бесклеточной экстракты фильтруют через фильтр 0,2 мкм или микроорганизмов, тепла убит при 95 ° С в течение 15 мин. 2 Образцы помещали чтобы убедиться в отсутствии колониеобразующих единиц до отстранения от сдерживания.
- Передача 110 мл Middlebrook 7H9 полную среду, содержащую полисорбат 80 (твин 80, чтобы предотвратить слипание) бульон (MADC-TW) или подходящую среду в 250 мл колбу Эрленмейера. Triplicate культуры обычно выращивают в условиях, когда с использованием 13 С-метаболитов, и десять идентичных культур выращиваются для профилирования 1D 1 H ЯМР. В течение двух условий (например, с и без добавления препарата), двойной объем культуры в повторных можно выращивать и разбит на два одинаковых культур. Все реагентов и растворов рецепты приведены в конце протокола.
- Инокулировать бульон с 0,150 мл M. туберкулезом 50% глицерина акций (позволяют таять на льду). См. Примечание 1 ниже.
- Пусть культуры растут при температуре 37 ° C встряхивании при 100 оборотов в минуту в течение приблизительно 6 дней (OD 600 0,6-0,8). См. примечание 2 ниже.
- Если нет антибиотиков, альтернативные дополнения или другие виды лечения необходимы, культуры готовы быть собраны. Если лечение используется, продолжаютнепосредственно к шагу 5. Удалить 0,5 мл пробы из каждой колбы, передать трубку микроцентрифужных и место при 4 ° С для титрования культуры и контроль качества: загрязнение тесты, фенотипический анализ, ПЦР-тестов. См. примечание 3 ниже. На данный момент, переходите к шагу 6.
- Удалить из колбы шейкере и выполнения требуемого лечения (например, добавить препарат или метаболит). Место колб обратно в шейкере и инкубировать в течение дополнительного периода времени (например, 6-18 часов). В конце этого времени, взять другую аликвоту 1,0 мл и определяют OD 600. Удалить 0,5 мл пробы из каждой колбы, передать трубку микроцентрифужных и место при 4 ° С для титрования культуры и контроль качества.
- Место культур на льду в течение 5 мин. После этого шага, оставил клетки на льду в течение всего оставшегося протокол. Урожай культур путем центрифугирования при 2000 х г и 4 ° C в течение 15 мин в 50 мл труб с помощью настольной центрифуге. Каждая культура требует четыре пробирки с 25 мл каждый (в общей сложности 100 мл, необходимых для получения адекватного отношения сигнал-шум для 2D 1 H-13 C-ЯМР-экспериментах, где только 50 мл в культуре необходимы для 1D 1 H ЯМР экспериментов).
- Промойте каждую ячейку гранул в два раза ледяной DDH 2 O (примерно 15 мл в первый раз и 10 мл во второй раз) на центрифугирования параметрам, описанным выше. Для второго мытья, объединить 10 мл аликвоты в ту же трубу перед формованием. Ресуспендируют осадок клеток в конечном объеме 1,0 мл DDH 2 O (нужно настроить для объема осадок клеток). Если суспензии отдельных клеток бесплатно слипания желательно на этом этапе клетки могут быть кратко ультразвуком и / или прошли через 27-иглу в три раза. Кроме того, осадок клеток могут быть заморожены при температуре -80 ° C и хранят до дальнейшей обработки. В последнем случае, замороженные шарики размораживают на льду до ресуспендирования. Ресуспендируют ячейки гранул в конечном объеме 1,0 мл DDH 2 O, как указано выше.
- TransfeГ ячейки 1,0 мл суспензии винт 2,0 мл крышкой пробирку, содержащую Лизирующий матрицы B (0,1 мм сфер кремнезема). Поместите FastPrep-24 лизис гомогенизатор внутри шкафа биобезопасности. Поместите образцы в держатель образца, обеспечивая сохранение говорил пластину на верхней части трубки. Процесс образцов в течение 60 секунд в гомогенизаторе при скорости вращения 6 метров / сек.
- Побочные образцов в микроцентрифуге при 15000 х г и 4 ° C в течение 10 мин для осаждения мусора клеток и целых клеток.
- Удалите супернатант и пароль образца через шприц фильтр (0,2 мкм) в стерильную пробирку. Плита 0,1 мл образца (или представитель фракции образца, как, например, 10%) на MADC агар чтобы убедиться, что нет никаких жизнеспособных клеток. Следователи также может проводить более одной стадии фильтрации и / или проверить наличие жизнеспособных клеток в экстрактах с использованием живого-мертвого процедуры окрашивания, чтобы предотвратить или выявить любые потенциальные проблемы биобезопасности. Замораживание образцов в этаноле сухой лед ванны для храненияпри -80 ° C, пока они не будут готовы к лиофилизировали и обрабатываются в центр ЯМР.
- После 2 месяцев, проверить пластин для проверки отсутствия колониеобразующих единиц. Если нет КОЕ найдены образцы могут быть взяты из лаборатории BSL3. Дальнейший анализ проводится в стандартных ЯМР-центр, который обычно обслуживает несколько пользователей и действует на основании каких-либо конкретных требований сдерживания.
- Lyophilize образцов досуха, затем ресуспендируют в 0,7 мл буфера ЯМР и передачи микроцентрифужных трубку. Центрифуга в течение 3 мин при 13000 х г. Удалить 0,6 мл и переносят в 5 мм ЯМР-трубку. Кроме того, лиофилизированных образцов может быть отправлен на внешний объект как не заразны регулярные образцы.
- ЯМР данные собираются немедленно. Несмотря на все меры предосторожности, активные ферменты могут все еще присутствовать и образец, как правило, не стабильны в течение длительного периода времени. Изменения в спектре ЯМР заметны, когда образцы оставляют при комнатной температуре или при температуре 4 ° С мруды, чем 1 неделя. Кроме того, данные ЯМР коллекции чередовались между необработанной и наркотиков обработанных культурах, где Образцы выбираются случайным образом из каждой категории. Это позволяет избежать ненужных предубеждений, потому что определенной категории было больше задержка перед спектров ЯМР были собраны. Смещения в данных может произойти, если спектров ЯМР для всех необработанных образцов были собраны, а затем следуют препарата обработанные образцы. Если образцы не могут быть немедленно анализируют методом ЯМР, пробы должны храниться в 1 мл Эппендорфа при температуре -80 ° C.
- После установки образцов в BACS-120 образца чейнджер, калибровку прибора, который включает в себя несколько шагов рутины, такие как замок, прокладки, настройки и оптимизации 90 ° длительность импульса, требует, чтобы максимизировать качество результатов. Одном образце используется для калибровки 90 ° длительности импульса и настраивать инструмент для остальных образцов. Замок, прокладок и ЯМР сбора данных для каждого образца автоматизированной Усинг ICONNMR и gradshim.
- 1D 1 H ЯМР-спектр собираются с использованием Bruker zgesgp последовательность импульсов с водой подавлении возбуждения скульптуры. В общей сложности 32k точек данных с размаху ширину 5482.5Hz, 128 сканирований, и 16 фиктивных сканирования используется. 2D 1 H-13 C HSQC спектр собираются с использованием Bruker hsqcetgp последовательности импульсов. В общей сложности из 2048 точек данных с размахом ширина 5000,0 Гц собирают вдоль прямой 1 измерение H, и 64 точек данных с размаху ширину 18864,9 Гц вдоль косвенные измерения C 13. Спектр собранных с 128 сканирований и 16 сканирований манекен для получения хорошего сигнала к шуму.
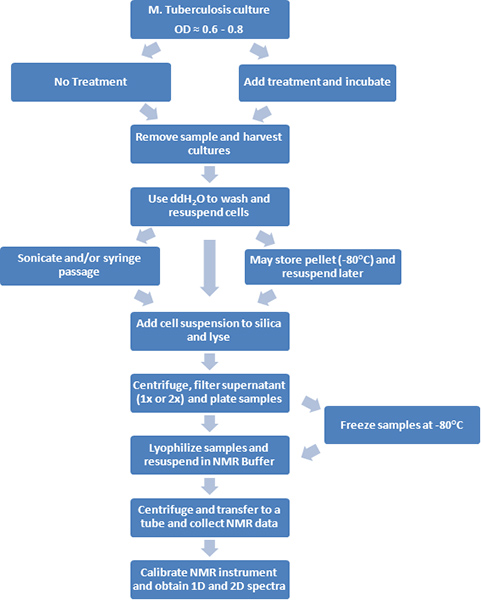
Рисунок 1. Блок-схема экспериментальной процедуры изображено.
ЯМР буфер
Раствор 50 мМ фосфата калия баффER 50 мкМ ТСГУ:
- 2,17 г К 2 НРО 4 (фосфат калия двузамещенный)
- 1,70 г KH 2 PO 4 (фосфат калия однозамещенный)
- 7,86 мг Натрий-3-Trimethylsilylpropionate (ТСГУ-2 ,2,3,3-D 4 (D, 98%))
- Растворите в 500 мл "100%" D 2 O
- Окончательное решение должно быть при рН 7,2 (поправки)
MADC-TW или MOADC-TW (1 л)
- 4,7 г Middlebrook 7H9 бульон базы
- 900 мл DDH 2 O
- 2 мл глицерина
- Смешайте компоненты и автоклаве в течение 25 мин. Прохладный жидкость на ощупь и добавьте следующие решения:
- 100 мл ADC при подготовке MADC или 100 мл OADC при подготовке MOADC
- 2,5 мл 20% Tween 80 (альтернативно, 1 мл без обменной 20% Тилоксапол)
- 10 мл 1% циклогексимид
ADC (1 л)
- 20 г D (+)-Глюкоза
- 50 г BSA доляV
- 8,5 г NaCl
- 800 мл DDH 2 O
- Растворите вместе, регулировать громкость до 1 л и стерилизуют при 0,2 мкм фильтр. Хранить при температуре 4 ° C.
Кроме того, для подготовки OADC (1L), добавьте все компоненты, перечисленные выше плюс 50 мл 1% олеиновой кислоты (рецепт ниже составляет 250 мл партии). Растворите вместе, регулировать громкость до 1 л и стерилизуют при 0,2 мкм фильтр. Бутылка должна быть завернуты в алюминиевую фольгу и хранить при 4 ° C.
- 2,5 г олеиновой кислоты
- 250 мл 0,2 М NaOH
- Оттепель олеиновой кислоты (затвердевает при охлаждении) путем нагревания при 55 ° C в течение 10 минут и добавьте в раствор NaOH и тепла при перемешивании в течение 60 мин. Хранить в стерильные стеклянные бутылки, которые завернуты в алюминиевую фольгу. Печать бутылки с парафином и хранят при 4 ° C.
Если предпочтительнее, вы можете приобрести коммерческую BD BBL Middlebrook АЦП или OADC с каталазы обогащения.
1% Циклогексимид (100 мл)
- 1 г циклогексимид
- 100 мл DDH 2 O
Растворить и стерилизовать с 0,2 мкм фильтр. Хранить при температуре 4 ° C. Внимание: циклогексимид является токсичным так обращаться с крайней осторожностью.
20% (V / V) Tween 80 (100мл)
- 20 мл Tween 80
- 80 мл DDH 2 O
Кроме того, вес 20 г Tween 80 (около 18,9 мл, плотность 1,06 г / мл), подготовить 20% вес / объем раствора. Тепло решение до 55 ° С в течение 30 мин до растворения, и смешать полностью. Стерилизовать жидкость с 0,2 мкм фильтр. Хранить окончательное решение при комнатной температуре.
20% (V / V) Тилоксапол (100 мл)
- 20 мл Тилоксапол
- 80 мл DDH 2 O
Кроме того, вес 20 г Тилоксапол (около 18,2 мл, плотность 1,1 г / мл), подготовить 20% вес / объем раствора. Тепло решение до 55 ° С в течение 30 мин до ди-ssolve, и смешивать полностью. Стерилизовать жидкость с 0,2 мкм фильтр. Хранить окончательное решение при комнатной температуре.
Примечание 1: Глицерин запасов M. туберкулезом, получают с использованием следующих протоколов.
Чулок М. туберкулез
- Расти M. туберкулез в 50 мл MADC к насыщению (OD 600 = 1,5 до 2,0) при 37 ° C при встряхивании условиях (100 оборотов в минуту). В зависимости от штамма, это займет 7-14 дней.
- Побочные образцов при 2000 мкг при 4 ° С в течение 15 мин с культурой гранул. Удалить супернатант.
- Ресуспендируют в 6 мл стерильного 50% глицерина.
- Алиготе 1,5 мл на 4 Corning флаконы криогенные и этикетки надлежащим образом.
- Сразу вспышки замораживания флаконов в этанол / сухой лед и хранят при температуре -80 ° C.
Примечание 2: Бактериологические штамм H37Rv (-80 ° C складе до 1,5 лет) в 70 мл MADC СМИ дает OD 600 </ SUB> около 0,6 после 5 дней роста при 37 ° C при встряхивании условиях (100 оборотов в минуту) в Innova 40 Shaker.
Примечание 3: Для проверки культуре загрязнения, следователи могли привить культуру аликвоты на стандартные богатой средой и проверки отсутствия роста после инкубации в течение ночи. Регулярно, культуры высевают на агар MADC для наблюдения морфологии колонии и изучать по фазово-контрастной микроскопии. При желании, культур могут быть проверены методом ПЦР с использованием IS 6110 праймеров, как описано 3.
2. Представитель Результаты
Образец, который хорошо подготовлен даст ЯМР-спектр похож на тот, изображенный на рисунке 2. Этот спектр является представление M. туберкулез диких бассейн метаболического типа. Определены метаболиты которые прямо или косвенно связаны с D-аланин пути. Кроме того, величины интенсивностей пиков пропорциональна концентрации метаболитов представитьВ клеточный экстракт. Поэтому изменения в интенсивности пиков между необработанными культурами, медикаментозное лечение, и мутантные штаммы могут указывать возмущения в метаболиты и метаболические пути. М. туберкулез 1D 1 H ЯМР-спектры были собраны на Bruker Avance 500 МГц спектрометре оснащены тройным резонансом, Z-оси градиента криозонда. Спектр содержит ок. 400 пиков, из которых можно было идентифицировать и количественно 40-50 метаболитов, в том числе аминокислоты, нуклеотидные прекурсоров, а также гликолиза и лимонной кислоты промежуточные. BACS-120 смены образца с программным обеспечением Bruker икона была использована для автоматизации сбора данных ЯМР. 1D 1 H ЯМР-спектры были собраны с помощью возбуждения скульптуры от 4 до эффективного удаления растворителя и поддержания плоской базовой линии, исключая любую необходимость базовой коллекции, которые могут вызывать артефакты в последующем анализе главных компонент (PCA) или ортогональной частичных наименьших квадратов дискриминантного анализа (OPLS- DA). А 1D 1 Н-ЯМР-спектр собранных при 25 ° C с шириной спектра 5482,5 Гц и 32 точек данных. В общей сложности 16 фиктивных сканирований и 128 сканирований были использованы для получения спектра. 1D ACD Labs ЯМР процессор программное обеспечение было использовано для полуавтоматической обработки всех 1D 1 H ЯМР спектров. Спектры преобразования Фурье, поэтапно, и ссылки на ТСГУ пика (0,0 промилле). Пакет NMRpipe программного обеспечения была использована для индивидуальной обработки 2D 1 H-13 C-ЯМР-спектры и проанализированы с NMRDraw. Bruker FID файл данных сначала преобразуются в формат файла узнать по NMRpipe, а затем спектра преобразования Фурье, фаза исправлены, и нулями. Наблюдаемые пики ЯМР в 1D 1 H ЯМР-спектр и 2D 1 H-13 C-ЯМР-спектр назначены на специфических метаболитов с использованием 1 Н и 13 С химическим сдвигом допуски 0,05 и 0,50 промилле, соответственно, и Мэдисон Metabolomics консорциума базы данных (MMCD ) 5 BioMagResBank, 6 и правам метаболом базы данных. 7 В частности, 1D и 2D ЯМР-спектров вручную отобранные пик, где пик список ЯМР химических сдвигов затем загружены на человека метаболом базы данных. Метаболиты определенных прав База данных метаболом назначены на ЯМР-спектр на основе как максимальное количество совпадающих ЯМР резонансов и принадлежности к метаболической сети. Каждое соединение или метаболит, как правило, имеет несколько пар CH и, соответственно, несколько резонансов ЯМР. Таким образом, чем больше этих ЯМР резонансы, которые наблюдаются в экспериментальных спектров ЯМР, тем больше вероятность метаболита присутствует. Кроме того, выявление нескольких метаболитов, ассоциированных с тем же пути увеличивает вероятность правильного назначения. Наличие метаболитов и метаболических путях проверяются Энциклопедия Киотского генов и геномов (KEGG) 8 и MetaCyc баз данных. 9 Mycobacterium smegmАтис является полезной модели системы для М. туберкулеза и других микобактериальных патогенов. Как описано в другом месте, образцы M. smegmatis также может быть нарушена путем обработки ультразвуком 10.
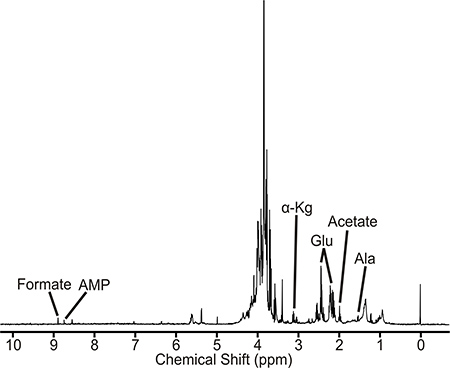
Рисунок 2. 1D 1 H ЯМР-спектр микобактерий туберкулеза клеточного экстракта. ЯМР пиков, связанных с представителем метаболитов помечены. Сокращения являются следующие: AMP, аденозин фосфат моно; α-кг, α-КГ, Glu, глутамат, и Ала, аланин.
Обсуждение
Значительное число исследований были проанализированы транскриптомных и протеомных профилей M. туберкулезом в различных в пробирке и в естественных условиях. 11-16 конечном счете, изменения в экспрессии генов и активность фермента приводит к изменениям в концентра?...
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Авторы хотели бы поблагодарить всех членов лаборатории д-ра Барлетта и д-р держав за полезные замечания при разработке протокола. Мы благодарим Wendy Остина за полезные обсуждения и редактирование рукописи. Работа, описанная в этой рукописи была профинансирована за счет грантов семян пилот каждого следователя, перечисленные выше из Университета Небраски-Линкольна окислительно-восстановительного центра биологии (родитель грант № NCRR 2P20RR 017675, Д. Беккер, PI). Кроме того, мы благодарим доктора Офелия Чакона для предоставления средств из своего гранта R21 (1R21AI087561-01A1) для исследования материалов и частичная поддержка зарплата г-н Halouska, чтобы стандартизировать методы ЯМР включены в эту публикацию.
Материалы
| Name | Company | Catalog Number | Comments |
| Название Реагенты / Оборудование | Компания | Номер по каталогу | Комментарии |
| ADC обогащению | BD BBL Middlebrook | 212352 | |
| BACS-120 образца Changer | Bruker | ||
| Bruker Avance ЯМР | Bruker | 500 МГц | |
| Бычьего сывороточного альбумина | Fisher Scientific | BP1600-100 | Доля V |
| Центрифугировать | Beckman Coulter | Allegra X-15R | Настольные |
| Центрифуги трубы | Гранулирование | 430291 | 50 мл стерильной полипропилена |
| Криогенная Флаконы | Гранулирование | 430488 | 2,0 мл стерильного полипропилена |
| Cycloheximide | Научно AG | C-1189 | Токсичный |
| D (+) - Глюкоза | ACROS | 41095-0010 | |
| Оксид дейтерия | Sigma Aldrich | 617385 | |
| Коническая колба Эрленмейера | VWR | 89095-266 | Стерильные, плоское основание, поликарбонат, 0,22 мкм PTFE мембраны вентилируемый колпачок |
| Flash Freeze колба | VWR | 82018-226 | 750 мл |
| Замораживание сушилка | VWR | 82019-038 | 4,5 л Настольные |
| Глицерин | GibcoBRL | 15514-029 | |
| Инкубатор | Нью-Брансуик | Innova 40 | Настольный шейкер |
| Лизирующий матрицы B | MP Biomedicals | 6911-100 | |
| Лизис машины | MP Biomedicals | ФаastPrep-24 | |
| Микроцентрифуга | Eppendorf | 5415D | Настольные |
| Микроцентрифуга | Beckman Coulter | Микроцентрифуге 22R | Настольные |
| Middlebrook 7H9 Broth | Difco | 271310 | |
| ЯМР труб | Norell | ST500-7 | 5 мМ |
| OADC обогащению | BD BBL Middlebrook | 212351 | |
| Олеиновая кислота | Сигма | O1008 | |
| Калия фосфат двузамещенный | VWR | BDH0266 | |
| Фосфат калия однозамещенный | VWR | BDH0268 | |
| Ротор - микроцентрифуге 22R | Beckman Coulter | F241.5P | Герметичные и полипропилена |
| Ротор - Allegra X-15R | Beckman Coulter | SX4750 | С био-сертифицированную крышки |
| Хлористый натрий | Fisher Scientific | S271-3 | |
| Натрий-3-trimethylsilylpropionate-2 ,2,3,3-D4 | Cambridge Изотопный | DLM-48 | |
| Спектрофотометр | Beckman Coulter | DU-530 | |
| Спектрофотометр кювет | Спасательный трос | LS-2410 | 1,5 мл полистирола, 2 ясно сторон |
| Шприц | Becton Dickinson | 309585 | Стерильные, 3 мл Luer-Lok |
| Шприц фильтр | Nalgene | 190-2520 | 0,2 мкм стерильные ацетата целлюлозы |
| Tween 80 | Fisher Scientific | BP338-500 |
Ссылки
- Larsen, M. H., Biermann, K., Tandberg, S., Hsu, T., Jacobs, W. R. Genetic Manipulation of Mycobacterium tuberculosis. Curr. Protoc. Microbiol. Chapter 10, 2 (2007).
- Larsen, M. H., Biermann, K., Jacobs, W. R. Laboratory Maintenance of Mycobacterium tuberculosis. Curr. Protoc. Microbiol. Chapter 10, 1 (2007).
- Clarridge, J. E., Shawar, R. M., Shinnick, T. M., Plikaytis, B. B. Large-scale use of polymerase chain reaction for detection of Mycobacterium tuberculosis in a routine mycobacteriology laboratory. J. Clin. Microbiol. 31, 2049-2056 (1993).
- Nguyen, B. D., Meng, X., Donovan, K. J., Shaka, A. J. SOGGY: solvent-optimized double gradient spectroscopy for water suppression. A comparison with some existing techniques. J. Magn. Reson. 184, 263-274 (2007).
- Cui, Q. Metabolite identification via the Madison Metabolomics Consortium Database. Nat. Biotechnol. 26, 162-164 (2008).
- Ulrich, E. L. BioMagResBank. Nucleic Acids Res. 36, 402-408 (2008).
- Wishart, D. S. HMDB: the Human Metabolome Database. Nucleic Acids Res. 35, 521-526 (2007).
- Kanehisa, M. KEGG for linking genomes to life and the environment. Nucleic Acids Res. 36, 480-484 (2008).
- Karp, P. D. Expansion of the BioCyc collection of pathway/genome databases to 160 genomes. Nucleic Acids Res. 33, 6083-6089 (2005).
- Halouska, S. Use of NMR metabolomics to analyze the targets of D-cycloserine in mycobacteria: role of D-alanine racemase. J. Proteome. Res. 6, 4608-4614 (2007).
- Boshoff, H. I. The transcriptional responses of Mycobacterium tuberculosis to inhibitors of metabolism: novel insights into drug mechanisms of action. J. Biol. Chem. 279, 40174-40184 (2004).
- Mehaffy, C. Descriptive proteomic analysis shows protein variability between closely related clinical isolates of Mycobacterium tuberculosis. Proteomics. 10, 1966-1984 (2010).
- Schnappinger, D. Transcriptional Adaptation of Mycobacterium tuberculosis within Macrophages: Insights into the Phagosomal Environment. J. Exp. Med. 198, 693-704 (2003).
- Schnappinger, D., Schoolnik, G. K., Ehrt, S. Expression profiling of host pathogen interactions: how Mycobacterium tuberculosis and the macrophage adapt to one another. Microbes. Infect. 8, 1132-1140 (2006).
- Shui, W. Quantitative proteomic profiling of host-pathogen interactions: the macrophage response to Mycobacterium tuberculosis lipids. J. Proteome. Res. 8, 282-289 (2009).
- Talaat, A. M., Lyons, R., Howard, S. T., Johnston, S. A. The temporal expression profile of Mycobacterium tuberculosis infection in mice. Proc. Natl. Acad. Sci. U.S.A. 101, 4602-4607 (2004).
- Forgue, P. NMR metabolic profiling of Aspergillus nidulans to monitor drug and protein activity. J. Proteome Res. 5, 1916-1923 (2006).
- Goodacre, R., Vaidyanathan, S., Dunn, W. B., Harrigan, G. G., Kell, D. B. Metabolomics by numbers: acquiring and understanding global metabolite data. Trends Biotechnol. 22, 245-252 (2004).
- Shin, J. H. NMR-based Metabolomic Profiling in Mice Infected with Mycobacterium tuberculosis. J. Proteome Res. 10, 2238-2247 (2011).
- Jaki, B. U., Franzblau, S. G., Cho, S. H., Pauli, G. F. Development of an extraction method for mycobacterial metabolome analysis. J. Pharm. Biomed. Anal. 41, 196-200 (2006).
- de Carvalho, L. P. Metabolomics of Mycobacterium tuberculosis reveals compartmentalized co-catabolism of carbon substrates. Chem. Biol. 17, 1122-1131 (2010).
- de Carvalho, L. P. Activity-based metabolomic profiling of enzymatic function: identification of Rv1248c as a mycobacterial 2-hydroxy-3-oxoadipate synthase. Chem. Biol. 17, 323-332 (2010).
- Marrero, J., Rhee, K. Y., Schnappinger, D., Pethe, K., Ehrt, S. Gluconeogenic carbon flow of tricarboxylic acid cycle intermediates is critical for Mycobacterium tuberculosis to establish and maintain infection. Proc. Natl. Acad. Sci. U.S.A. 107, 9819-9824 (2010).
- Tang, Y. J. Central metabolism in Mycobacterium smegmatis during the transition from O2-rich to O2-poor conditions as studied by isotopomer-assisted metabolite analysis. Biotechnol. Lett. 31, 1233-1240 (2009).
- Kweon, O. A polyomic approach to elucidate the fluoranthene-degradative pathway in Mycobacterium vanbaalenii PYR-1. J. Bacteriol. 189, 4635-4647 (2007).
- Hasan, M. R., Rahman, M., Jaques, S., Purwantini, E., Daniels, L. Glucose 6-phosphate accumulation in mycobacteria: implications for a novel F420-dependent anti-oxidant defense system. J. Biol. Chem. 285, 19135-19144 (2010).
- Soga, T. Quantitative metabolome analysis using capillary electrophoresis mass spectrometry. J. Proteome Res. 2, 488-494 (2003).
- Metz, T. O. The future of liquid chromatography-mass spectrometry (LC-MS) in metabolic profiling and metabolomic studies for biomarker discovery. Biomark Med. 1, 159-185 (2007).
- Ludwig, C., Viant, M. R. Two-dimensional J-resolved NMR spectroscopy: review of a key methodology in the metabolomics toolbox. Phytochem. Anal. 21, 22-32 (2010).
- Simpson, R. J., Inglis, J. . Proteins and Proteomics: A Laboratory Manual. , 425-595 (2003).
- Beste, D. J., McFadden, J. System-level strategies for studying the metabolism of Mycobacterium tuberculosis. Mol. Biosyst. 6, 2363-2372 (2010).
- Rhee, K. Y. Central carbon metabolism in Mycobacterium tuberculosis: an unexpected frontier. Trends Microbiol. , (2011).
- Who. Health Organization. Anti-tuberculosis Drug Resistance in the World: Report No. 4. , (2008).
- Jassal, M., Bishai, W. R. Extensively drug-resistant tuberculosis. Lancet Infect Dis. 9, 19-30 (2009).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены