Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Индукционная трансплантат против хозяина и
В этой статье
Резюме
Мышиные трансплантации костного мозга является широко используемым методом для изучения иммунологических механизмов, регулирующих трансплантат против хозяина заболевания у людей. Возможность мониторинга T моделей торговли клетки В естественных условиях Позволяет для детального анализа развития и увековечения Т-клеточные реакции во время трансплантат против хозяина.
Аннотация
Трансплантат против хозяина (РТПХ) является ограничивающим барьером для широкого использования трансплантации костного мозга в качестве лечебной терапии для различных гематологических недостатков. GVHD вызвано аллореактивных зрелых Т-клеток, присутствующих в трансплантат костного мозга, которые переплетаются в получателе и привести к повреждению принимающих органов. Тем не менее, у мышей, Т-клетки должны быть добавлены к посевной костного мозга, чтобы вызвать РТПХ. Хотя большая работа была проделана для характеристики Т-клеточного ответа после трансплантации, биолюминесцентные технологий визуализации является неинвазивным методом контроля T модели ячейки торговли в естественных условиях.
После смертельного облучения, получатель мышам трансплантировали клетки костного мозга и селезенки мышей-доноров. Т-клеток подмножества из L2G85.B6 (трансгенных мышей, которые конструктивно выражать люциферазы) включены в пересадке. По пересадке только определенные подмножества T клетки, один в состоянии отслеживать специфические Т-клетки подмножеств в естественных условиях,и на основе их местоположения, разработка гипотез о роли специфических Т подмножеств ячейки в развитии РТПХ в различные моменты времени. На заданный после пересадки интервалы, получатель мышей загружаются использованием Xenogen ИВИС CCD камера. Интенсивность света может быть определена количественно с помощью программного обеспечения живой образ, чтобы создать псевдо-цветное изображение на основе фотонов света (красный = высокая интенсивность, фиолетовый = низкая интенсивность).
Между 4-7 дней после пересадки, получатель мышей начинают проявляться клинические признаки РТПХ. Кук и др. 1. Разработана система баллов для количественной оценки прогрессирования заболевания на основе меха получателя мышей текстуры, целостность кожи, активность, потеря веса, и осанка. Мыши, забитых в день, и эвтаназии, когда они становятся умирающей. Мыши-реципиенты обычно становятся умирающей 20-30 дней после пересадки.
Мышиной модели являются ценными инструментами для изучения иммунологии РТПХ. Выборочно пересадка частности Т-клеток подмножества др.минимумы тщательное определение роли каждого подмножества играет. Неинвазивного отслеживания Т-клеточные реакции в естественных добавляет еще один слой ценность для мышиных моделях РТПХ.
протокол
1. Летального облучения
- Разместить до 10 мышей получателя в microisolator клетки совместимы с облучателем, которые будут использоваться.
- Облучения в 2 равные дозы подведения суммарной дозы (суммарная доза = 9 сГр для получателей BALB.B). Второй облучения должна быть 3 часа после первого. Инъекции должны происходить между 4-6 ч после окончательного облучения. Облучения мышей в любом Cs 137 источников или RS2, 000, облучатель.
- После второй дозы облучения мышей в магазине microisolator клетку с подкисленной водой до момента пересадки.
2. Подготовка спленоцитов
- Усыпить одного донора мыши в соответствии с ведомственным руководящим принципам. Каждый донор обычно дает 75x10 6 - 125x10 6 спленоцитов. Использование CD8 комплекты очистки, каждая мышь обычно дает 6x10 6 - 12x10 6 CD8 Т-клеток.
- Удалить селезенки, сначала делает вертикальный разрез 2 см на 2 см вправо от средней линии непосредственнопод грудной клеткой. Разрезать меха, кожи и висцеральных мембраны.
- Удалить селезенки и создать единый суспензии клеток селезенки, создав в 40 мкл сито в чашку Петри с 1640 RPMI с 5% FBS. Используйте поршень шприца, чтобы разбить селезенку, пока весь селезенка была пропускают через сито.
- Повторите этот процесс для каждого WT и L2G85.B6 донора. Соберите все WT одного клеточные суспензии в 1-50 мл коническую трубку, и собрать все L2G85.B6 одного клеточные суспензии в отдельную 50 мл коническую трубку.
- Центрифуга клетки при 1200 оборотов в минуту в течение 10 мин при 4 ° C. Ресуспендируют окатышей в 1640 году RPMI с 5% FBS и подсчет клеток.
3. Подготовка костного мозга
- Удалите кожу от одной задней конечности донора мыши.
- Аккуратно срезаем столько мышечной ткани как можно дальше от бедра и голени / малоберцовой кости.
- Удалить задних конечностей, сокращая расстояние бедренной кости в тазобедренном суставе. Срежьте задние лапы чуть ниже голени / малоберцовой кости пересечения. Все кости сокращения должны быть сделаны с помощью надежное ножницы.
- Осторожно удалите оставшиеся мышечной ткани. Отрежьте малоберцовой кости, относительно небольшой костный мозг находится в малоберцовой кости и не стоит усилий.
- Поместите заднюю конечность в холодную 1640 RPMI 5% FBS процесса и повторите со второй задней конечности. Каждая мышь должна принести между 20x10 6 - 40x10 6 клеток костного мозга.
4. Удаление костного мозга
- Удалите одну из задних конечностей средств массовой информации и поместить в большую чашку Петри с небольшим количеством холодной среды (~ 1 мл).
- Срежьте коленного сустава. Использование шприцев (объем> 5 мл), вставки подкожной иглой в голень и нажмите шприца, пока все красные материал удаляется из салона голени. Повторите процесс с бедренной костью. Удалите оставшиеся кости лишенной костного мозга. Повторите процесс со второй задней конечности.
- Создать суспензии отдельных клеток с помощью пипетки средах, содержащих костного мозга в большое блюдо Петри и использовании поршень шприца и 40 мклмеш. Внесите одной клеточной суспензии в 50 мл коническую трубку и держать на льду.
5. CD3 истощения
Есть множество способов, чтобы исчерпать CD3 + клеток из костного мозга. Наша лаборатория использует набор сделанных Miltenyi Biotec (CD3-биотин - 130-093-021). Разрушающим CD3 + клеток из костного мозга следуя протоколу производителя. Буфер для комплектов Miltenyi в дальнейшем будем называть MACS буфера (2 мМ ЭДТА, 0,5% BSA в PBS, рН 7,2).
- Вымойте клеток путем центрифугирования селезенки и костного мозга при 1200 оборотов в минуту в течение 10 мин при 4 ° С и количество клеток.
- Удалите ВСЕ супернатант. Ресуспендируют клеток костного мозга в 100 мкл на 10 млн. клеток костного мозга в буфер MACS.
- Продолжить с использованием CD3 истощения производств »протокол.
- Вымойте CD3 обедненного клетки костного мозга 3 раза в стерильной PBS. Граф CD3 обедненного клетки костного мозга и ресуспендируют в соответствующем объеме внедрить 10 7 клеток.
6. L2G85.B6 CD8 + Т-клеток очистки
Есть множество способов, чтобы очистить CD8 Т-клеток от L2G85.B6 мышей. Кроме того, есть несколько способов, чтобы исчерпать CD8 Т-клеток от WT спленоцитов доноров. Наша лаборатория использует комплекты из Miltenyi Biotec (CD8 истощения - 130-049-401, CD8 очистки - 130-095-236).
- Ресуспендируют WT гранул в 90 мкл буфера MACS на 10 7 клеток. Продолжить с CD8 T истощение клеток в соответствии с производств "протокол (CD8 истощения - 130-049-401).
- Ресуспендируют L2G85.B6 гранул в 40 мкл буфера MACS на 10 7 клеток. Продолжить CD8 Т-клетки очистки в соответствии с производств "протокол (CD8 очистки - 130-095-236).
- Граф каждой популяции клеток и мыть каждую населения в 3 раза стерильной PBS. Ресуспендируют каждой группы населения в соответствующем объеме внедрить 18x10 6 Вт (CD8 обедненного) спленоцитов и 2х10 6 L2G85.B6 очищают CD8 Т-клеток.
7. Инъекционного препарата
- Комбинат 10 7 CD3 обедненного клетки костного мозга, 18x10 6 вес (CD8 обедненного) спленоцитов и 2х10 6 L2G85.B6 очищают CD8 Т-клеток в микроцентрифуге трубку. Промыть стерильной PBS и ресуспендируют в 300 мкл.
- Inject клеточный препарат в хвостовую вену получателя мышей. Инъекции должно быть сделано с помощью иглы 28 калибра.
- Магазин мышей в microisolator клетку с подкисленной водой. Оценка мышей ежедневно с использованием скоринга GVHD системы скоринга разработан Кук и др. 1.
8. Bioluminescent изображений
- Через шесть дней после пересадки, вводить получателя мышей с 4 мг D-люциферин. Разрешить 5 мин для люциферин в реакцию с люциферазы.
- Anesthetize мыши в изофлуран камере тепловизора биолюминесценции и изображений получателям в течение 5 минут с небольшим биннинга. Это создаст изображение с высоким разрешением во время сбора столько событий, насколько это возможно.
- Анализ данных с использованием живыхИзображение программного обеспечения. Масштабы псевдо-цветное изображение может быть изменена для получения наилучших результатов. Тем не менее, важно, что в том же масштабе быть использованы в экспериментах.
- Регионы интересов может быть создан с помощью программного обеспечения Живые изображения и света излучение может быть определена количественно путем расчета потока (фотонов / сек), излучаемый из каждой области интереса.
9. Представитель Результаты
Примерно через 7-10 дней после пересадки, мыши начинают показывать клинические признаки РТПХ. Мыши появляются потрепанным из-за отсутствия ухода. Получатели также начнет терять вес между 7-10 дней после пересадки. Деятельность и положение получателя мышей будет оставаться относительно нормальных примерно до 12-14 дня после пересадки. Накопительное GVHD баллов будет неуклонно возрастать в течение первых 2-3 недель после трансплантации (рис. 1А). Болезнь конечно очень изменчива между мышами, однако, получатели должны равномерно поддаваться РТПХ на 30-40 гн я после пересадки (рис. 1б).
На рисунке 2 показан получателю мышей, которые были обследованы 6 дней после пересадки. Псевдо-цветная шкала показывает различной свет эмиттанса по всему телу с самой высокой интенсивности света, излучаемого в селезенке и кишечнике. CD8 Т-клеток накопление в кишечнике согласуется с предыдущими выводами 6. Мыши-реципиенты может быть помещен обратно в клетку, чтобы microisolator быть отображены на более позднем этапе времени или эвтаназии для работы с изображениями бывших естественных условиях.
| Критерии | Оценка 0 | 1 класс | 2 класс |
| Потеря веса (wkly.) | <10% | > 10% - <25% | > 25% |
| Поза | Нормальный | Скрючившись только в состоянии покоя | Несколько скрючившись, ухудшает movemeNT |
| Деятельность | Нормальный | От легкой до умеренной снижение активности | Стационарные если стимулировало |
| Мех текстуры | Нормальный | От легкой до умеренной ероша | Тяжелая рассердило / плохой уход |
| Кожа Текстура | Нормальный | Масштабирование лапы / хвост | Очевидные области оголенный кожи |
Таблица 1. Кук и др. разработали эту систему оценки в 1996 1. Мышь должна быть набрано в день на каждого из критериев слева. Каждая мышь дается счетом 0-2 для каждого критерия и общая оценка является суммой всех индивидуальных баллов.

Рисунок 1. Летально облученных BALB.B были пересажены с 10 7 костейклеток костного мозга в одиночку или с 18x10 6 CD8 Т-клеток обедненного WT спленоцитов и 2х10 6 очищенных L2G85.B6 CD8 Т-клеток. А) Клинические данные счет получателя костного мозга в одиночку или с CD8 Т-клеток, обедненной WT спленоцитов и очищают L2G85.B6 CD8 Т-клеток. B) Данные по выживаемости реципиентов костного мозга в одиночку или с CD8 Т-клеток обедненного WT спленоцитов и очищают L2G85.B6 CD8 Т-клеток. Нажмите, чтобы увеличить показатель .
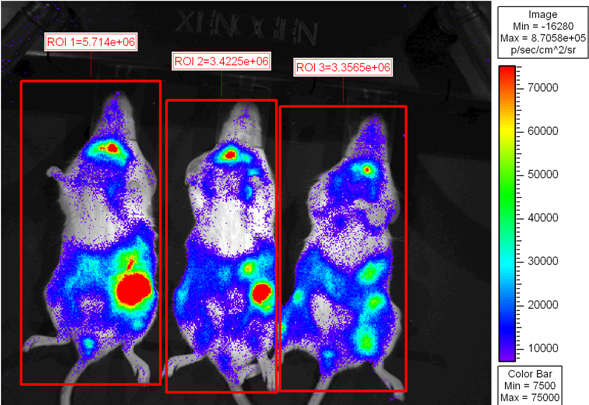
Рисунок 2. Летально облученных мышей BALB.B были пересажены с 10 7 клеток костного мозга в одиночку или с 18x10 6 CD8 Т-клеток обедненного WT спленоцитов и 2х10 6 очищенных L2G85.B6 CD8 Т-клеток. Получатели вводили 4 мг D-люциферин с помощью внутрибрюшинного введения и были обследованы использованием Xenogen ИВИС в течение 5 мин при малых биннинга. Pseudo цвета изображений показал, где фиолетовый представляет низкой интенсивности и красный представляет высокую регионов интенсивности интереса были сделаны по всему мыши и полного потока (фотонов / сек) были количественно.
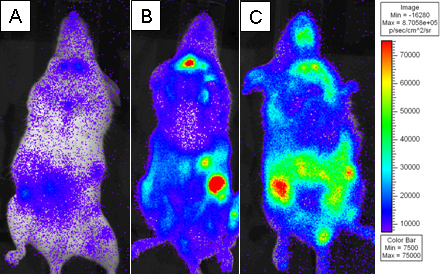
Рисунок 3. Летально облученных мышей BALB.B были пересажены с 10 7 клеток костного мозга в одиночку или с 18x10 6 CD8 Т-клеток обедненного WT спленоцитов и 2х10 6 очищенных L2G85.B6 CD8 Т-клеток. Получатели вводили 4 мг D-люциферин с помощью внутрибрюшинного введения и были обследованы использованием Xenogen ИВИС в течение 5 мин при малых биннинга. Псевдо-цветных изображений показал, где фиолетовый представляет низкой интенсивности и красный представляет высокой интенсивности. Получатели были обследованы на) 4-й день, B) 6-й день, и C) 8-й день почтовым переводом.
Обсуждение
Протокол для стимулирования РТПХ у мышей, представленные здесь представляет собой клинически значимые модели мышиной РТПХ. Первоначально установленный Berger и соавт. В 1994 году, C57Bl / 6 в комбинации штамм BALB.B является MHC-соответствие с РТПХ смертности опосредовано CD4 зависимым, CD8 Т-эфф...
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Мы в долгу перед Алисой Gaughan и Цзяо-Ван Цзин чьи выдающиеся технической поддержки, интеллектуальный вклад, и моральная поддержка сыграли важную роль в продвижении этих исследований вперед. Эти исследования были поддержаны NIH грант AI036532 в Гах.
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента | Компания | Номер по каталогу | Комментарии |
| RPMI 1640 | Invitrogen | 12633-012 | |
| Эмбриональной телячьей сыворотки | Invitrogen | 10439016 | |
| 40 мкМ фильтр сотовый | BD Biosciences | 352340 | |
| CD3e-биотин | Miltenyi Biotech | 130-093-021 | |
| Anti-биотин микрошарики | Miltenyi Biotech | 130-091-147 | |
| CD8a микрошарики | Miltenyi Biotech | 130-049-401 | Используется для разрушающих CD8 Т-клетки из селезенки. |
| CD8a Очистка антител коктейль | Miltenyi Biotech | 130-095-236 | Используется для очисткиCD8 Т-клетки из селезенки. |
| D-Luciferin | Суппорт Life Sciences | 122796 |
Ссылки
- Cooke, K. R. An experimental model of idiopathic pneumonia syndrome after bone marrow transplantation: The roles of minor H antigens and endotoxin. Blood. 88, 3230-3239 (1996).
- Berger, M. T cell subsets involved in lethal graft-versus-host disease directed to immunodominant minor histocompatibility antigens. Transplantation. 57, 1095-1102 (1994).
- Nimer, S. D. Selective depletion of CD8+ cells for prevention of graft-versus-host disease after bone marrowtransplantation. A randomized controlled trial. Transplantation. 57, 82-87 (1994).
- Korngold, R., Sprent, J. Surface markers of T cells causing lethal graft-vs-host disease to class I vs class II H-2 differences. Journal of Immunology. 135, 3004-3010 (1985).
- Cao, Y. A. Molecular imaging using labeled donor tissues reveals patterns of engraftment, rejection, and survival in transplantation. Transplantation. 80, 134-139 (2005).
- Asady, R. E. l. TGF-{beta}-dependent CD103 expression by CD8(+) T cells promotes selective destruction of the host intestinal epithelium during graft-versus-host disease. J. Exp. Med. 201, 1647-1657 (2005).
- Larson, R. S., Springer, T. A. Structure and function of leukocyte integrins. Immunol Rev. 114, 181-217 (1990).
- Karecla, P. I. Recognition of E-cadherin on epithelial cells by the mucosal T cell integrin alpha M290 beta 7 (alpha E beta 7). Eur. J. Immunol. 25, 852-856 (1995).
- Cepek, K. L. Adhesion between epithelial cells and T lymphocytes mediated by E-cadherin and the alpha E beta 7 integrin. Nature. 372, 190-193 (1994).
- Malarkannan, S. The molecular and functional characterization of a dominant minor H antigen, H60. J. Immunol. 161, 3501-3509 (1998).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены