Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Полированные и железобетона тоньше череп-Window для долгосрочных изображений из мозга мыши
В этой статье
Резюме
Представлен метод формирования изображения окна в мышь череп, который охватывает миллиметров и стабилен в течение месяца без воспаление головного мозга. Этот метод хорошо подходит для продольного исследования кровотока, клеточной динамики, и клетка / сосудистые структуры с использованием двух-фотонной микроскопии.
Аннотация
В естественных изображений корковых функций требует оптического доступа к мозгу без нарушения внутричерепного окружающей среды. Представлен метод формирования полированного и железобетонных разбавленной черепа (портов) в окно мыши череп, который охватывает несколько миллиметров в диаметре и стабилен в течение месяца. Череп разбавленной от 10 до 15 мкм в толщину с ручной буровой для достижения оптической прозрачностью, а затем обложил цианакрилатного клея и покровного стекла: 1) обеспечивает жесткость, 2) подавляют костный подроста и 3) уменьшить рассеяние света от неровностей на поверхности кости. С черепа не нарушена, любое воспаление, которое может повлиять на процесс изучается значительно снижается. Изображений глубине до 250 мкм ниже поверхности коры может быть достигнуто с помощью двухфотонного лазерной сканирующей микроскопии. Это окно хорошо подходит для изучения мозгового кровотока и клеточной функции как наркоз и проснуться препаратов. Кроме того, он предлагает опможность управлять клеточной активности использования optogenetics или нарушать кровоток в сосудах целевых облучения циркулирующего фотосенсибилизаторов.
протокол
1. Подготовка к операции я
- Очистите хирургических инструментов, sonicating в смеси Maxizyme и хирургических молока в ультразвуковой очиститель. Автоклава хирургические инструменты перед каждым экспериментом.
- Убедитесь, что все необходимые реагенты и расходные материалы имеются. Список реактивов и расходных материалов приведены в таблице 2. Реагенты и расходные материалы, которые вступают в контакт с открытыми ткани должны быть стерильными, когда это возможно.
- Вызвать анестезии. Типичные анестетики подходит для выживания исследования представлены в таблице 1. Убедитесь, хирургический наркоз плоскости, проверяя отсутствие ног рефлекс крайнем случае. Оптимальный возраст мыши составляет от 3 до 6-недельного возраста. Черепов молодых мышей являются более мягкими и тонкими трудно. Пожилые мышей толще черепа, которые будут кровоточить еще во время прореживания процедуры.
- Защита животных в стереотаксической раме 1. Список хирургического оборудования приведены в таблице 2.
- Поддержание температуры телатуры при 37 ° C с использованием обратной связи регулируется ректального датчика и тепло панели.
- Применение глазной мази для глаз, чтобы сохранить влагу.
- Бритье головы с небольшой электрической бритвой.
- Очистите кожу головы Бетадин, а затем потереть на 70% (объем / объем) изопропилового спирта.
- При желании, убедитесь, что сердца и дыхания находятся в пределах нормального диапазона использования пульсоксиметр. Для мыши, эти цифры должны центре около 10, 2 Гц, соответственно.
- Теплый аликвоту стерильной фильтрацией искусственной спинномозговой жидкости (ACSF) до 37 ° C (125 мМ NaCl, 10 мМ глюкозы, 10 мМ HEPES, 3,1 мМ
CaCl 2, 1,3 мМ MgCl 2, рН 7,4), (все химические вещества из Sigma) 2.
2. Монтаж Глава кадров
- Снимите кожу головы в течение всей спинной поверхности черепа с парой щипцов и хирургические ножницы. Обрежьте кожу с боков до краев височных мышц с обеих сторон черепа и послеerior для мышц шеи (рис. 1А).
- Используйте лезвие скальпеля для удаления тонких надкостницы с поверхности черепа.
- Очистите череп с влажным хлопок наконечником аппликатором и сухой поверхности черепа с потоком воздуха от пыли может. Затем нанесите тонкий слой клея цианакрилатного по всей поверхности черепа. Дайте клею высохнуть. Этот слой клея, необходимые для надлежащего соблюдения зубного цемента в последующих шагах. Цианакрилатного клея не должны быть стерилизованы.
- Прикрепите металлический разъем на поверхности черепа, от области нужное окно. Для анестезии препаратов, небольшая гайка может быть прикреплен к черепу с прикосновением цианакрилатного клея, который впоследствии может быть пьяным в изображение установки с помощью болтов (рис. 1B, 1L и 1N). Печать заднюю гайку с лентой, чтобы клей не входит в темы во время прикрепления к черепу. Гайки и лента должна быть стерилизована в автоклаве до операции.
- Для подготовки изображения проснулся, придают более жесткие пользовательский разъем с двумя точками крепления (рис. 1М и 1Н). Просверлите два отверстия в черепе по противоположной коры полушария с половиной мм сверло заусенцев, а затем ввести два # 000 саморезов. Эти винты поможет закрепить голову монтировать к черепу. Наносить только на один полный оборот винта, чтобы избежать давления на основного мозга. Затем приложите пользовательские панели крест металла с небольшим прикосновением цианакрилатного клея на мозжечке. Позвольте цианакрилатного клей полностью высохнуть. Этот металл разъем значительно сокращает число степеней свободы и упрощает перемещение той же области изображения в продольных исследованиях. Широкий бар крест дает широкие возможности для размещения электродов и стимуляции вибриссы. Подробные планы создания пользовательских крепление головы и крепление устройств можно ознакомиться в Интернете (зики / links.html "> http://physics.ucsd.edu/neurophysics/links.html). винты и перекладина должны быть стерилизованы в автоклаве до операции.
- Покройте всю поверхность черепа, за исключением расположения окна слоем стоматологического цемента (рис. 1С и 1D). Убедитесь, что все открытые края кожи покрыты цементом. Компоненты зубной цемент не должны быть стерилизованы.
3. Генерация полированные и усиленные тоньше, череп (портов) в окне
- Убедитесь, что сверло заусенцы остры и избежать их повторного использования. Использование низких скоростях на бормашины, тонкий 2 мм на 2 мм регионе за соматосенсорной коры с половиной мм заусенцев. Переключение между смачивания череп с ACSF и сушки поверхности черепа с нежным потоком воздуха от газов тряпкой, мокрый для охлаждения, и сухой для разбавления. Это требует прореживания через губчатый слой черепа, которые могут кровоточить, но могут быть проверочныеред, смывая с ACSF (рис. 1д). Череп начинает сгибаться под небольшим давлением буровой, когда она составляет ~ 50 мкм, и мягкой мозговой оболочки сосудов должны быть видны через мокрую кости (рис. 1е). При этом толщина, небольшие белые пятна в кости становятся видимыми на несколько секунд сразу после сухой поверхности черепа увлажняется.
- На данный момент, тонкие кости еще больше. Используйте медленный дрели, т.е. 1000 оборотов в минуту, который бреет поверхности черепа и только легким касанием. Использование небольших контролируемых движений, держа сверло, как перо, и только применить силу в боковом направлении. Кость должна быть ~ 10 до 15 мкм на конечной толщины (рис. 1Г). Когда кости достаточно тонкие, мелкие белые пятна в кости больше не будет видна, когда сухой поверхности черепа увлажняется.
- Польские окна региона порошка оксида олова. Прикрепить готовых сверло, которое опускают в аквариум силиконовым герметиком и собращается, в результате чего конической кнут (вставка на рис. 1 полугодие). Силиконовые кнут должен быть готов по крайней мере за день до операции, и стерилизовать 70% изопропанола до использования. Нанесите небольшое щепотка порошка на окно вместе с каплей ACSF (рис. 1 полугодие). Перемешивать раствор в окно на срок до десяти минут, осторожно касаясь кончиком бича движущихся к поверхности черепа. Смыть порошок оксида олова полностью из окна с помощью ACSF и сухой кости тщательно струю воздуха. Неровности поверхности и сторонник чипов кости оставленные бурение на предыдущих этапах, должны быть удалены после полировки (рис. 1 полугодие и 1I). Порошок оксида олова не должны быть стерилизованы.
- Вырезать квадратных куска нет. 0 остекление немного меньше, чем размер окна. Используйте писец мягко забить отделены горизонтальными и вертикальными линиями в покровным стеклом с использованием прямой край. Затем положите крышку скольжения в чашку Петри и кпОка блюдо на край стола, чтобы отделить осколки стекла. Весь чашке Петри может быть автоклаве для обеспечения стерильности.
- Поместите соответствующего размера покровного стекла рядом с сухой окна. Нанесите небольшое прикосновение цианакрилатного клея над окном с помощью иглы сломанных деревянных аппликатор хлопок, и быстро нажать нарезанные части покровного стекла поверх клея. Избегайте создания пузырьков под покровного стекла. Аккуратно надавите на крышку стекла на поверхности черепа, и удерживайте в течение нескольких секунд (рис. 1J и 1O). Дайте клею высохнуть в течение 15 минут. Превышение цианакрилатного клея могут быть удалены из верхней поверхности покровного стекла с лезвие скальпеля после его высушивают. Печать края покровного стекла с зубным цементом и образуют слегка приподняты и удерживать воду для погружения линз (рис. 1K и 1O).
4. Восстановление
- Поместите животное в теплой операции следующие клетки. Мониторингживотное периодически, пока он полностью оправится от анестезии.
- Если препарат предназначен, чтобы выжить в течение более одного дня, обеспечить бупренорфин (0,03 мкг на грызунах г) для обезболивания. Мы обычно изображение животного хотя бы один день после первоначального внедрения.
5. Подготовка изображений
- Стабилизация животных на оптический макет для работы с изображениями, используя кадр как руководитель поддержки (Рис. 1L и 1M). Сдержанность аппарат может быть изготовлен из коммерчески доступных компонентов оптико Qioptiq или ThorLabs. Наша отдельная пластина может транспортироваться между хирургическим и двухфотонного изображения люксы с животными, и все физиологические устройств мониторинга собраны в единое целое 3.
- Если изображение кровотока желательно, вводят 0,05 мл 5% (вес / объем) флуоресцентных красителей-декстран растворенного в стерильном физиологическом растворе или через хвостовую вену или вены подглазничной для обозначения сыворотке крови (рис. 2A и 2C-2H ) 4-7. Это должно быть сделано под общим наркозом. Подглазничной администрации вены может быть проще для начинающих, как декстран решения более вязкой. Хвостовую вену может быть трудно найти в темной мышей, а вены заметно снижается после неудачной инъекции. Для визуализации сосудистой с зеленым излучением, использовать изотиоцианат флуоресцеина декстран. Для излучения красного, использовать Texas Red декстран. С высоким молекулярным весом декстраны, краска останется в обращении в течение нескольких часов. Кроме того, животные с эндогенными флуоресцентные метки могут быть отображены непосредственно в соответствующих двухфотонного возбуждения волны. Решение декстран могут быть заморожены в порции для использования в будущем.
- Аккуратно очистите поверхность окна влажной хлопок наконечником аппликатором.
- Для длительной визуализации анестезии препараты, вводят внутрибрюшинно раствор стерильной лактата Рингера в объеме 3 мкл на грамм каждые 2 часа, чтобы поддерживать тело жидкости и энергетических потребностей.
- Когда изображение животных в бодрствующем состоянии, подголовники ограничивают лишь несколько часов в то время, чтобы снизить уровень стресса. Вернуть животное в дом клетке между изображениями сессий для пищи и воды.
6. Представитель Результаты
Успешный окно позволит изображений глубине до 250 мкм ниже пиальных поверхности в течение нескольких месяцев. Этот метод был использован для изучения в естественных условиях капиллярного кровотока 4, 8, активации микроглии 8, 9, и дендритные структуры в корковой паренхиме 8. В одном примере, мы используем двухфотонного изображения, чтобы показать коры сосудистой из наркоза Thy1-желтый флуоресцентный белок (YFP) мыши, после того, как в сыворотке крови помечена внутривенного введения декстрана Texas Red (рис. 2). Dural суда часто видны чуть выше поверхности коры в твердой мозговой оболочки (рис. 2, стрелки). Большой мягкой мозговой оболочки артериол и венул лие на поверхности коры (рис. 2D). Проникающие отделение суда от этой сети поверхность и погружение в коре, где они разветвляются в плотную капиллярного русла, которая кормит корковой ткани (рис. 2, д-2H). Дендритных беседки глубокой YFP выражения корковых нейронов, сигнал эндогенного этой линии мышей, могут быть отображены одновременно во втором канале 10 (рис. 2, б-2H). Второй гармоники сигнала кости были собраны в третий канал, и может быть использован для оценки толщины разбавленной черепа после сбора изображений стеков (рис. 2, в 2С).
Корковые сосудистой динамика глубокое воздействие анестетиков 11. Во втором примере мы покажем, видео спонтанного vasoactivity собранные двухфотонной микроскопии от привыкшей спать мыши. Известный колебаний вазомоторный в диаметре просвета видны с пиальных артериол, а не с соседней венулы. Этобазальных спектр vasoactivity уменьшается с 4 уретана анестезии. Для количественной оценки спонтанных и вызванных изменениями в кровоток, мы используем адаптирована линия методы сканирования, чтобы захватить как сосудистый диаметр и красных кровяных телец скорости отдельных судов. Подробная ресурсов на количественные изображения кровотока с помощью двух-фотонного микроскопа имеются 3, 12.
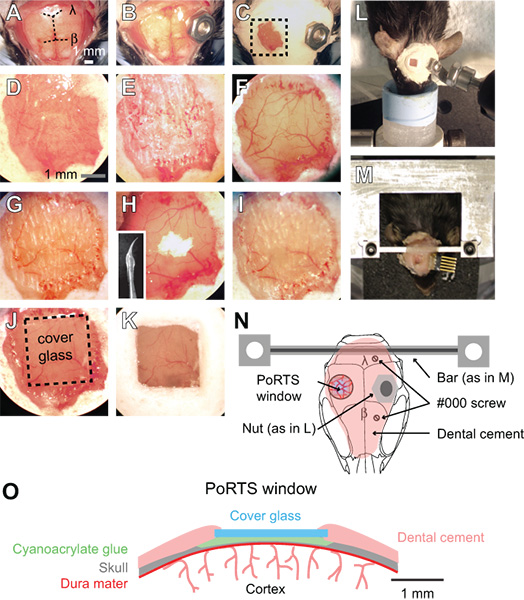
Рисунок 1. Порядок окно портов. (К) Изображения последовательных шагов в процедуре создания портов окна. См. текст для подробных инструкций. β = брегмы и λ = лямбда. (L) болт и гайка на голову во время съемки из наркоза препаратов. (М), пользовательских обрабатываются крест крепление головы планку бодрствования препаратов. В этом примере, разъем был имплантирован для повторной записи ЭГ. (N)Схема показывает вид сверху горы головы и положение различных компонентов. Гайки, используемые в панели L предназначен как альтернатива перекладину использования в панели М. Два # 000 саморезов добавляются с поперечиной крепления для дополнительной устойчивости с препаратами проснулся изображений. (O) Схема показывает сечение окна портов.
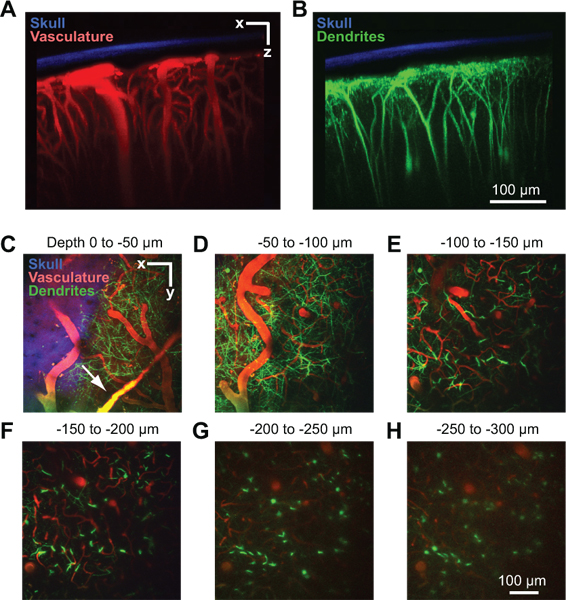
Рисунок 2. Двухфотонного визуализации сосудистой и нейронные структуры коры мыши. Все изображения были собраны через окно портов в Thy1-YFP мышь через 2 дня после того, как окно имплантации 10. Максимальный прогноз более 150 мкм ткани в корональной ориентации показывает разбавленной черепа по отношению к сосудистой (A) и дендритов (B). Кости (синий) было обнаружено, собирая второй гармоники флуоресценции при 450 нм излучения с 900 нм возбуждение 8. Сосудистой (красный) была помечена внутривенно 70 кДа Texas Red декстран 6. Дендритные поля нейронов (зеленого цвета) являются эндогенными для Thy1-YFP линии трансгенных мышей. (CH) Максимальная прогнозы более чем на 50 мкм тканей в горизонтальной ориентации на различных глубинах под мягкой. Данные за тот же стек изображение, показанное в панели А и В. Dural суда могут быть видны только выше поверхности коры (стрелка на C).
Сокращения
ACSF = искусственной спинномозговой жидкости
Порты = полированной и железобетонных разбавленной черепа окно
YFP = желтый флуоресцентный белок
я Убедитесь, что процедуры, описанные утверждаются локальной Уходу за животными и использование комитета.
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Двухфотонного изображений через окно портов требует передачи через разбавленной костей и твердой мозговой оболочкой, которая ослабляет свет лазера и добавляет оптических аберраций на больших глубинах 8. Однако, несмотря на этот недостаток, изображения глубиной до 250 мкм ниже пи?...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
Ничего не раскрывать.
Благодарности
Эта работа выполнена при финансовой поддержке Американской Ассоциации Сердца (пост-докторские стипендии для AYS) и Национального института здоровья (MH085499, EB003832 и OD006831 Д. К.). Мы благодарим Beth Фридман и Пабло Блиндер замечания по рукописи.
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments | |||
| Агент | Маршрут доставки | Доза для мыши | Продолжительность | Примечания | Источник | Работы работы |
| Фенобарбитала (Nembutal) | IP | 90 мкг / г | 15-60 мин | Ограниченный запас прочности. Работа до надлежащую дозу наркоза медленно. Дополнение 10% от индукционной дозы по мере необходимости. | 036093, Шейн Батлер | 7 |
| Кетамин (Ketaset), смешанного с Ксилазин (Anased) | IP | 60 мкг / г (К) 10 мкг / г (X) (соединение в одном шприце) | 20-30 мин | Ксилазин совместно вводят как мышечный релаксант и анальгетик. Дополнение только кетамина на 50% индукции дозу по мере необходимости. | (K) 010177, (X) 033198; Шейн Батлер | 7 |
| Изофлюран (Isothesia) | Вдыхание | 4% означает, альвеолярной концентрации (ПДК) для индукции; 1-2% MAC для обеспечения | 4-6 часов. | Предоставляется в смеси из 70% кислорода и 30% закиси азота. Длительная анестезия приводит к медленному восстановлению. | 029403, Шейн Батлер | 26 |
Таблица 1. Предлагаемые анестетиков для выживания исследований.
| ПУНКТ | КОМПАНИИ | КАТАЛОГ # / МОДЕЛЬ |
| Бетадин | Шейн Батлер | 6906950 |
| Бупренорфин (Buprenex) | Шейн Батлер | 031919 |
| Флуоресцеина изотиоцианат декстран, 2 МДа молекулярной массой | Сигма | FD2000S |
| Изопропиловый спирт | Рыбак | AC42383-0010 |
| Лактата раствор Рингера | Шейн Батлер | 009846; |
| Раствор лидокаина, 2% (объем / объем) | Шейн Батлер | 002468 |
| Солевой | Шейн Батлер | 009861 |
| Хирургическое молока | Шейн Батлер | 014325 |
| Texas Red декстрана 70 кДа молекулярной массой | Invitrogen | D1864 |
| Maxizyme | Шейн Батлер | 035646 |
| Расходные материалы | ||
| Карбида заусенцев, 1/2 мм размер сопла | Изобразительных средств наук | 19007-05 |
| Cottoned аппликаторы наконечник | Fisher Scientific | 23-400-100 |
| Крышка стекла, нет. 0 толщины | Томас Научно | 6661B40 |
| Цианакрилатный клей | ND промышленности | 31428 H04308 |
| Газ тряпкой | Newegg | N82E16848043429 |
| Порошок сцепление цемента | Dentsply | 675571 |
| Сцепление цементного растворителя | Dentsply | 675572 |
| Инсулиновый шприц, объемом 0,3 мл с иглой 29,5 | Шейн Батлер | 018384 |
| Гайку и болт для обеспечения головы | Конденсаторы | Орех, H723-ND, болт, R2-56X1/4-ND |
| Офтальмология мазь | Шейн Батлер | 039886 |
| Скальпель лезвия | Fisher Scientific | 12-460-448 |
| Винты, саморезы # 000 | СО Morris компании | FF000CE125 |
| Силиконовый герметик аквариум | Производство Perfecto | 31001 |
| Порошок оксида олова | Мама Минералов | EQT-TINOX |
| ОБОРУДОВАНИЕ | ||
| Стекло писец | Fisher Scientific | 08-675 |
| Препаровальная лупа | Carl Zeiss | OPMI FC-1 |
| Электрическая дрель | Foredom или Осада | K.1020 (Foredom) или EXL-M40 (Осада) |
| Электрическая бритва | Wahl | Серия 8900 |
| Пинцет, Дюмон нет. 55 | Изобразительных средств наук | 11255-20 |
| Обратная связь регулируемой площадке тепло | FHC | 40-90-8 (ректальные термистор, 40-90-5D-02, честь площадки, 40-90-2-07) |
| Изофлюран испаритель | Ohmeda | IsoTec4 |
| Пульсоксиметр | Старр наук о жизни | MouseOx |
| Отвертка, миниатюрные | Гаррет Уэйд | 26B09.01 |
| Стереотаксической кадров | Kopf Instruments | Модель 900 (с помощью мыши маска анестезией и не разрыв уха бары) |
| Хирургические ножницы, тупым концом | Изобразительных средств наук | 14078-10 |
| Ультразвуковой очиститель | Fisher Scientific | 15-335-30 |
Таблица 2. Перечень специфических реагентов, расходных материалов и оборудования.
Ссылки
- Cetin, A. Stereotaxic gene delivery in the rodent brain. Nature Protocols. 1, 3166-3173 (2006).
- Kleinfeld, D., Delaney, K. R. Distributed representation of vibrissa movement in the upper layers of somatosensory cortex revealed with voltage sensitive dyes. Journal of Comparative Neurology. 375, 89-108 (1996).
- Driscoll, J. D. Quantitative two-photon imaging of blood flow in cortex. Imaging in Neuroscience and Development. Yuste, R. , Cold Spring Harbor Laboratory Press. New York. 927-937 (2011).
- Drew, P. J., Shih, A. Y., Kleinfeld, D. Fluctuating and sensory-induced vasodynamics in rodent cortex extends arteriole capacity. Proceedings of the National Academy of Sciences U.S.A. 108, 8473-8473 (2011).
- Mostany, R., Portera-Cailliau, C. A Method for 2-Photon Imaging of Blood Flow in the Neocortex through a Cranial Window. J. Vis. Exp. (12), e678-e678 (2008).
- Zhang, S. Rapid reversible changes in dendritic spine structure in vivo gated by the degree of ischemia. Journal of Neuroscience. 25, 5333-5338 (2005).
- Takano, T. Astrocyte-mediated control of cerebral blood flow. Nature Neuroscience. 9, 260-267 (2006).
- Drew, P. J. Chronic optical access through a polished and reinforced thinned skull. Nature Methods. 7, 981-984 (2010).
- Marker, D. F. A thin-skull window technique for chronic two-photon in vivo imaging of murine microglia in models of neuroinflammation. Journal of Visualized Experiments. (43), e2059-e2059 (2010).
- Feng, G. Imaging neuronal subsets in transgenic mice expressing multiple spectral variants of GFP. Neuron. 28, 41-51 (2000).
- Martin, C. Investigating neural-hemodynamic coupling and the hemodynamic response function in the awake rat. Neuroimage. 32, 33-48 (2006).
- Shih, A. Y. Two-photon microscopy as a tool to study blood flow and neurovascular coupling in the rodent brain. Journal of Cerebral Blood Flow and Metabolism. , Forthcoming (2011).
- Kobat, D. Deep tissue multiphoton microscopy using longer wavelength excitation. Optics Express. 17, 13354-13364 (2009).
- Holtmaat, A. high-resolution imaging in the mouse neocortex through a chronic cranial window. Nature Protocols. 4, 1128-1144 (2009).
- Xu, H. T. Choice of cranial window type for in vivo imaging affects dendritic spine turnover in the cortex. Nature Neuroscience. 10, 549-551 (2007).
- Nimmerjahn, A., Kirchhoff, F., Helmchen, F. Resting microglial cells are highly dynamic surveillants of brain parenchyma in vivo. Science. 308, 1314-1318 (2005).
- Davalos, D. ATP mediates rapid microglial response to local brain injury in vivo. Nature Neuroscience. 8, 752-758 (2005).
- Ascenzi, A., Fabry, C. Technique for dissection and measurement of refractive index of osteons. The Journal of Biophysical and Biochemical Cytology. 6, 139-142 (1959).
- Stosiek, C. In vivo two-photon calcium imaging of neuronal networks. Proceedings of the National Academy of Sciences U.S.A. 100, 7319-7324 (2003).
- Grinvald, A. Functional architecture of cortex revealed by optical imaging of intrinsic signals. Nature. 324, 361-364 (1986).
- Dunn, A. K. Dynamic imaging of cerebral blood flow using laser speckle. Journal of Cerebral Blood Flow & Metabolism. 21, 195-201 (2001).
- Villringer, A. Capillary perfusion of the rat brain cortex: An in vivo confocal microscopy study. Circulation Research. 75, 55-62 (1994).
- Denk, W., Strickler, J. H., Webb, W. W. Two-photon laser scanning fluorescence microscopy. Science. 248, 73-76 (1990).
- Srinivasan, V. J. Optical coherence tomography for the quantitative study of cerebrovascular physiology. Journal of Cerebral Blood Flow & Metabolism. 31, 1339-1345 (2011).
- Hu, S., Wang, L. V. Photoacoustic imaging and characterization of the microvasculature. Journal of Biomedical Optics. 15, 011101-011101 (2010).
- Flecknell, P. A. Laboratory animal anesthesia. , Academic Press. San Diego. (1987).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены