Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Мышиной модели астма Аллерген Индуцированные
В этой статье
Резюме
Экспериментальные модели мыши аллергическая астма открывают новые возможности для изучения патогенеза заболевания и разработке новых методов лечения. Эти модели хорошо подходят для измерительных факторы, определяющие аллергической иммунной реакции, воспаления дыхательных путей и легочной патофизиологии.
Аннотация
Астма является одной из основных причин заболеваемости и смертности, затрагивающие около 300 миллионов человек во всем мире. 1 Более 8% населения США имеет астму, с преобладанием повышения 2. Как и при других заболеваниях, животных аллергических заболеваний дыхательных путей в значительной степени способствовать понимания патофизиологии, помочь выявить потенциальные терапевтические цели, и позволяют доклинические испытания возможных новых методов лечения. Модели аллергических заболеваний дыхательных путей были разработаны несколько видов животных, но мышиной модели особенно привлекательны благодаря низкой стоимости, доступности и хорошо характеризуется иммунной системы этих животных. 3 Наличие разнообразных трансгенных линий еще больше повышает привлекательность этих моделей. 4 Здесь мы рассмотрим два мышиных моделях аллергические заболевания дыхательных путей, как овальбумина использованием в качестве антигена. После первоначального сенсибилизацию путем внутрибрюшинного введения одной модели DelivErs антигена через небулайзер, другой интратрахеального доставки. Эти две модели обладают дополнительными преимуществами, с каждым имитируя основные черты человека астма 5.
Основные возможности обострения бронхиальной астмы включает преувеличенной реакции дыхательных путей на раздражители, такие как метахолина (гиперчувствительность дыхательных путей; AHR) и эозинофилов богатых воспаления дыхательных путей. Это тоже известный эффект аллерген задачей в нашей мышиной модели, 5,6 и опишем методы их измерения и, следовательно, оценки влияния экспериментальных манипуляций. В частности, мы описываем как инвазивные 7 и неинвазивные методы 8 для измерения гиперреактивности дыхательных путей, а также методы оценки инфильтрации воспалительных клеток в дыхательных путях и легких. Дыхательных путей воспалительных клеток собираются бронхоальвеолярного лаважа при легких гистопатология используется для оценки маркеров воспаления по всему органу. Этиметоды являются мощным инструментом для изучения астмы таким образом, что не было бы возможно в людях.
протокол
I. сенсибилизация аллерген и Challenge (см. Рисунок 1)
А. Для интратрахеального вызов
- Для начального сенсибилизации, вводить мужчина или женщина C57BL / 6 и BALB / с мышей (6-8 недель) внутрибрюшинно в день 0 и снова на 7-й день с 20 мкг овальбумина (OVA, Sigma-Aldrich, Сент-Луис, Миссури) эмульгированного в 0,2 мл стерильного фосфатного буфера (PBS), содержащий 2 мг гидроксида алюминия (Sigma-Aldrich) или 2 мг гидроксида алюминия в 0,2 мл стерильной PBS в качестве контроля.
- Проблемы с антигеном при необходимости (например, в дни 14, 16, 18 и 20). Вызов процедуры следующим образом.
- Анестезию мыши внутрибрюшинного (ф) инъекции из смеси кетамина (90 мг / кг) и ксилазина (10 мг / кг). Убедитесь, что мышь полностью под наркозом в течение 10 мин.
- Угол поверхности операция под углом 45 градусов или больше. Место мыши на этой поверхности поддержания брюшной стороне головы вверх и сверху.
- Крюк тhread под передних резцов держать голову. Уровень лапами друг с другом для обеспечения трахея прямая и использовать метки ленты держать ноги. Замочите хирургических сайт с 70% этанола и тампоном.
- Применить bupivicaine (от 0,1 до 0,2 мл 0,25% раствора) местно в месте разреза.
- Nip кожи на горле пинцетом и аккуратно вытащить наружу. Сделайте небольшой вертикальный разрез с хирургическими ножницами. Минимизировать размер разреза.
- Подготовить 1 мл шприц с 50 мкл PBS или на 0,1% OVA в PBS и вставить его в повторяющихся пипетки (Tridak Шаговый, Torrington, CT). Возьмите пипеткой в одной руке и использовать другие провести ткани обратно с помощью пинцета и подвергать трахеи.
- Держа шприц, как параллельно трахеи возможно, вставить иглу через трахею стене и вводят раствор.
- Поддерживать мыши в вертикальной ориентации инъекции следующее, чтобы дать время на решение обосноваться в легких.
- Мягко и стерильно близко раны областьпинцет и печать с изображением шва.
- Место мыши грудины вниз на грелку и дайте ему полностью восстановиться до амбулаторно. После восстановления, возвращения мыши на объект ухода за животными и следить за ним ежедневно признаки серома, воспаления или инфекции, а также раны, пока рана полностью зажила.
B. Для вызов через небулайзер
- Доведение до мышей в день 0 путем внутрибрюшинного введения 20 мкг OVA (Sigma-Aldrich), эмульгированного в 0,2 мл стерильной PBS, содержащего 2 мг гидроксида алюминия (Sigma-Aldrich) или 2 мг гидроксида алюминия в 0,2 мл стерильной PBS в качестве контроля .
- На 14-й день, повышение чувствительности к ф инъекции, как описано выше.
- На 21-й, 22-й, 23-й, 24-й и 25-й день после первоначального сенсибилизации, проблема мышей при воздействии в течение 30 мин в 1% распыленного OVA или PBS только доставляется через ультразвуковой небулайзер (Buxco Research Systems, Wilmington, NC).
- Место мышей в основной камере ФСФ, акклиматизации их в плетизмографии камеры, по крайней мере 10 мин.
- Поместите 1 мл 0,1% OVA в стерильной PBS или стерильной PBS один, как описано в пунктах 4-6 ниже, через колбу. Распылять в течение 30 мин.
- Удалить колбу и отбросить оставшиеся решение.
- Распыление может быть выполнена на все мыши одновременно с помощью распыления камеры.
II. Определение гиперчувствительность дыхательных путей к метахолина
А. Неинвазивная Измерение гиперчувствительность дыхательных путей от всего тела плетизмографии (ФСФ, Buxco Research Systems, г. Уилмингтон, штат Северная Каролина)
- Дайте бутылку порошкового метахолина нагреться до комнатной температуры перед открытием (метахолина очень гигроскопичен и станет бесполезным, если это разрешено сгустки поглощают воду). Подготовьте 200 мг / мл раствора акции в стерильной PBS, а затем сделать серийный 2-кратные разведения (например, 100, 50, 25, 12,5 и 60,25 мг / мл). Держите решения холодно.
- Настройка оборудования следующим образом: подключить основной вход WBP в распылитель, смещение потока входе воздушного насоса, и ФСФ выход на газ ловушки, используя облегающие резиновые трубки. Прикрепите датчик давления для преодоления выходы основного и ссылки палаты ФСФ. Подключить преобразователь давления для предусилителя с кабелями при условии, и подключить усилитель к компьютеру с помощью конкретных сбора данных карты.
- Калибровка предусилитель с помощью программного обеспечения в соответствии с рекомендациями производителя.
- Место мышей в основной камере ФСФ, акклиматизации их в плетизмографии камеру в течение 10 мин, затем запись показаний базового (Penhbase) в течение 3 мин.
- Поместите 1 мл стерильной PBS в колбы. Распылять в течение 2 минут, а затем следить дыхательных переменные дополнительные 6 минут во время фазы сушки. Удалить колбу и отбросить оставшиеся PBS.
- Место 1 мл 6,25 мг / мл метахолина в колбу и тEPEAT распыления в течение 2 минут, плюс 6-минутной мониторинг цикла.
- Повторите измерение с 12.5, 25, 50 и 100 мг / мл метахолина, используя те же 2 мин период распыления и 6-минутный цикл мониторинга.
- Удалить мышей от камер и вернуть их в клетках.
- Refill колбу с 1 мл стерильной PBS и запустить другую последовательность, чтобы промыть трубы.
- Выключите воздушные потоки, не разбирайте и протирайте все камеры перед запуском второй группы животных.
B. Инвазивные измерения реактивности дыхательных путей по компьютерным управлением вентилятора (flexiVent; SCIREQ Inc, Монреаль, Канада)
- Взвесьте мыши и обезболивания при внутрибрюшинном (ф) раствор для инъекций 60 мг на кг массы тела фенобарбиталом натрия.
- После адекватное обезболивание, положение мыши вентро-дорсально к трахеостомии.
- Лечить кожи шеи с 70% этанола. Применить bupivicaine (от 0,1 до 0,2 мл 0,25% раствора) местно в яncision сайта. Надрезать и открыть шеи. Отделите мышц шеи и подвергать трахеи.
- Сделать 1 - 2 мм разрез в трахее с мелкими ножницы (быть уверены, не разорвать трахеи) и вставьте трахеи трубку осторожно. Свяжите шва вокруг трахеи, чтобы предотвратить утечку воздуха.
- Положите мышь в камере плетизмографа тело и подключить вставленную трахеи трубку к искусственной вентиляции легких.
- Начать искусственной вентиляции легких. Установите соответствующие частоты дыхания и приливные / ударного объема (150 ударов / мин и 200 мкл, соответственно, на 20-г мышь). Будьте уверены, что грудная клетка движется синхронно с вентилятором. Если мышь "борьбы" с вентилятором (само дыхание), добавить еще обезболивающего и ждать синхронизации.
- После базового измерения, сохранения мышей в базовой вентиляции в течение еще 3 мин, а затем 2-й набор измерения импеданса. Это 2-й набор базовых измерений используется для известковоУлате среднего значения базового уровня.
- Доставка PBS или метахолина (MCH) проблемы (6.25, 12.5, 25, 50 и 100 мг / мл), направляя вдохе поток от вентилятора через ультразвуковой небулайзер.
- После каждой проблемы с МЧ (6.25, 12.5, 25, 50 и 100 мг / мл), вернуть поршень доставки Вт 10 мл / кг при 120 вдохов / мин и принимать измерения импеданса.
III. Измерение клеточной инфильтрации в воздушном пространстве
А. Perform бронхоальвеолярного лаважа (БАЛ)
- После измерения AHR, усыпить мышей с CO 2, и положение каждой мыши на спине на хирургическом площадку.
- Замочите области с 70% этанола.
- Начиная с нижней части живота, вскрыть брюшную полость и удалить кожу / верхних мышц, двигаясь вверх к ребрам.
- После того, ребра видны, используйте ножницы, чтобы тщательно прокола мембраны. Легкие должны рухнуть от диафрагмы. Будьте особенно околоreful не ник легких или сердца.
- Срежьте грудной клетки, чтобы полностью раскрыть легкие / сердце (избежать сокращения каких-либо крупных кровеносных сосудов, чтобы держать кровь наполнение сайта).
- С помощью 1 мл шприц с иглой 27 (BD шприцы, Франклин озер, NJ), пункция желудочков сердца и медленно и осторожно потяните шприц для сбора крови. Будьте осторожны, чтобы избежать коллапса в сердце.
- Сбор сыворотки крови от этого с использованием стандартного протокола. Хранить при температуре от -70 ° C до использования.
- Срежьте кожу и ткани от горла до трахеи выявлено. Очистить от достаточного ткань легко работать в поле (опять же, избежать сокращения любых крупных кровеносных сосудов).
- Используя изогнутые ножницы, разрезать по трахее, чтобы расчистить путь.
- Передайте точки изогнутый пинцет в трахее и понять в конце куска шва. Нарисуйте шва нить в трахею.
- Галстук свободно половину узел около трахеи, низко в горле.
- Carefully вырезать паз, достаточные размеры для канюлю, над швом нитью.
- Осторожно введите канюлю в отверстие и вниз по трахее мимо точки шва нитью. Осторожно надавите вперед, пока канюля возникает только при входе в легкие (слишком далеко: прокол легких, слишком короткий: коллапс трахеи при попытке восстановить БАЛ).
- Закрепите нить шва и полный узел для герметизации трахеи вокруг канюли.
- Блокировка шприц (содержащий в 1 мл PBS) на канюлю, и плавно нажмите жидкости в легких. Легкие доли в отдельности должен раздувать медленно. Не более заполнения. Для взрослого 0,9-1,0 мл мышь является абсолютным максимумом. 0,8 мл может быть безопасным. Блокировка шприца свободно, чтобы канюля, в противном случае это может вызвать повреждение при попытке освободиться.
- Вывод жидкости из легких. Если сопротивление встречается (ткань всасывается в канюлю), пресс-канюлю медленно дальше в легкие и продолжить удаление. Также можно попробовать повернуть канюли на месте. Если все ELSE не может отозвать пути канюля части, трахею, намного более вероятно, чтобы свернуть в этом случае.
- Отсоедините шприц от канюли, депозитные БАЛ в контейнере, и повторить 2 раза свежим раствором PBS.
- Держите БАЛ решения на льду, пока остановлен.
- Используйте БАЛ и сыворотке для оценки ОВА конкретных IgE с использованием коммерчески доступных мыши IgE ИФА наборов (MD биопродуктов, Сент-Пол, Миннесота).
Б. Граф клеток и определить дифференциалы
- Центрифуга БАЛ 5 минут при температуре ~ 600 × г, 4 ° C.
- Ресуспендируйте осадок клеток в PBS осторожно и держать на льду.
- Загрузка стандартных hemacytometer Нойбауэр с разбавленной суспензии клеток и подсчета клеток.
- Удалить аликвоты 2 × 10 4 клеток от 10 до 40 мкл для cytospins. Развести клеток, если это необходимо.
- Для cytospins, смешайте 2 × 10 4 клеток, 130 мкл PBS и 10 мкл FBS. Добавить всю смесь клетки дубле цитоспин воронку и центрифуги 10 мин при 700 оборотах в минуту, использование двойной cytoslides одинаковых образцов.
- Позвольте слайды высохнуть при комнатной температуре в течение 1 часа до окрашивания.
- Пятно слайды с помощью Diff-Quick пятно (Siemens, Newark, DE).
IV. Представитель Результаты
Чрезмерное сужение дыхательных путей после провокационных раздражителей является характерной особенностью клинического астмы. Дается описание двух методов измерения такой гиперреактивности дыхательных путей к метахолина в OVA-чувствительных и призвал мышей: всего тела плетизмографии (рис. 2) и вынужденных колебаний использованием flexiVent системы (рис. 3). Оба метода показали, что чувствительность и OVA задача производит гиперреактивности дыхательных путей у мышей.
Эозинофилов богатых воспаления дыхательных путей Другой характерной особенностью клинических астмы и аллергических заболеваний дыхательных путей у мышей. Как показано на рисунке 4 OVA сенсибилизации и задача значительно увеличивает общее количество клеток, которые могут быть восстановлены из дыхательных путей при БАЛ. Количество эозинофилов и, в меньшей степени, нейтрофилов особенно возросла.
Практика показывает, что аллергические заболевания дыхательных путей результате перепроизводства антитела IgE к сенсибилизирующего антигена. Сенсибилизация и проблемы с OVA с использованием протоколов мы описываем увеличивает уровни IgE в сыворотке и БАЛ от мышей (рис. 5).
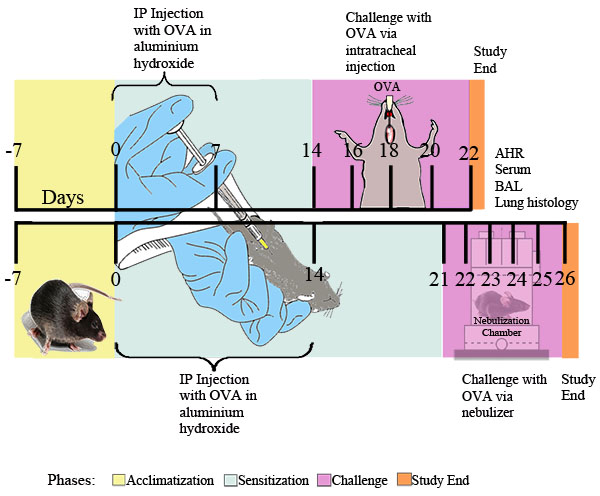
Рисунок 1. Экспериментальная схема для ОВА-индуцированной аллергической астмы. Мыши были сенсибилизированы дважды IP с 20 мкг ОВА эмульгированного в 2 мг гидроксида алюминия в 0,2 мл стерильной PBS, или 2 мг гидроксида алюминия в 0,2 мл стерильной PBS один, а затем в Указанные моменты времени им вызов с 0,1% OVA или стерильным раствором PBS или ежедневно бывший экспозиций в течение 30 минут, чтобы распылять 1% ОВА в PBS или PBS только доставляется через ультразвуковой небулайзер (Buxco). Двадцать четыре часа после последней экспозиции OVA, реактивности дыхательных путей была определена. Впоследствии, БАЛ, образцы крови, легких клеток и тканей были собраны для последующего анализа.
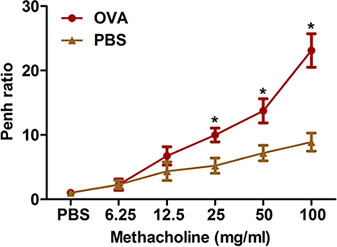
Рисунок 2. Оценка аллерген-индуцированной гиперреактивности дыхательных путей с помощью неинвазивных методов. Мыши (п = 4/group) ощущали и сталкиваются с проблемой OVA. Двадцать четыре часа после последнего вызова, гиперчувствительность дыхательных путей для ингаляционного метахолина определяли с помощью всего тела плетизмографии, как описано в протоколе. Пеня определяется и выражается в Пномпене соотношение (в среднем Пень за 8 мин интервал времени с метахолина, деленное на среднее Пень в течение 8-минутный интервал с PBS). * P <0,05 по сравнению с PBS.
iles/ftp_upload/3771/3771fig3.jpg "/>
Рисунок 3. Оценка аллерген-индуцированной гиперреактивности дыхательных путей с помощью инвазивных методов (вынужденные колебания). Мыши (п = 4/group) ощущали и сталкиваются с проблемой OVA. Двадцать четыре часа после последнего вызова, гиперчувствительность дыхательных путей повышения концентрации ингаляционных метахолина была определена вынужденных колебаний (flexiVent) методом, как описано в протоколе. A, B) дыхательных путей сопротивления C) эластичность легких. * P <0,05 по сравнению с PBS.
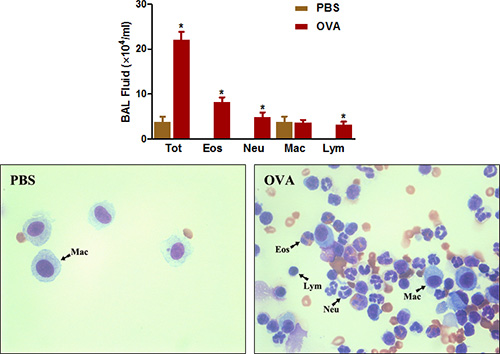
Рисунок 4. BAL количества клеток жидкости. Мыши (п = 4/group) ощущали и сталкиваются с проблемой OVA. Двадцать четыре часа после последнего вызова, (Top) BAL клетки были собраны и общего числа клеток было подсчитано, как это описано в протоколе. (Внизу) цитоспин слайды были рrepared и окрашенных Diff-Quick. Тот = общее клеток; Eos = эозинофилов, нейтрофилов Neu =; Mac = макрофаги, лимфо = лимфоцитов. * P <0,05 по сравнению с PBS.
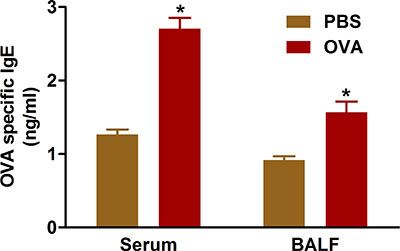
Рисунок 5. OVA конкретных IgE. Мыши (п = 4/group) ощущали и сталкиваются с проблемой OVA. Двадцать четыре часа после последнего вызова, IgE измеряли в БАЛ и сыворотке крови собраны пункции сердца, как описано в протоколе. * P <0,05 по сравнению с PBS.
Обсуждение
Животные модели аллергические заболевания дыхательных путей имеют важное значение для исследований, имеющих отношение к клиническим астмы. Большое количество различных моделей, используя различные виды и антигенов, были разработаны. Мышь, привлекательные и часто используемых видов ...
Раскрытие информации
Эксперименты на животных были проведены в соответствии с руководящими принципами и правилами, установленными Атланте VAMC IACUC комитета по протоколу # V010-10.
Благодарности
Эта работа была поддержана NIH Грант HL093196 (РКП) и Атланте научно-образовательного фонда (AREF).
Материалы
| Name | Company | Catalog Number | Comments |
| Материал Имя | Компания | Номер по каталогу | Комментарии |
| Ovalbumin | Sigma-Aldrich Сент-Луис, Миссури | A5503 | |
| Гидроксид алюминия | Sigma-Aldrich | 239186 | |
| Ацетил-β-methylcholine хлорид | Sigma-Aldrich | A2251 | |
| Пентобарбитал натриевая соль | Sigma-Aldrich | P3761 | |
| Всего плетизмографии тела (ФСФ) системы | Buxco Research Systems Уилмингтон, штат Северная Каролина | http://www.buxco.com | |
| FlexiVent | SCIREQ, Inc Монреаль, Канада | http://www.scireq.com | |
| Оптический микроскоп | Leica Microsystems, Inc Buffalo Grove, IL | ||
| Цитоспин 4 | Thermo Scientific Asheville, NC | ||
| Diff-Быстрый пятно | Сименс Newark, DE | B4132-1A | |
| Повторяющиеся пипетки | Tridak Torrington, CT | STP4001-0025 |
Ссылки
- Braman, S. S. The global burden of asthma. Chest. 130, 4S-12S (2006).
- Akinbami, L. J., Mooman, J. E., Liu, X. Asthma Prevalence, Health Care Use, and Mortality: 2005-2009. National Health Statistics Reports. 32, 2005-2009 (2011).
- Bates, J. H., Rincon, M., Irvin, C. G. Animal models of asthma. Am. J. Physiol. Lung. Cell. Mol. Physiol. 297, 401-410 (2009).
- Drazen, J. M., Finn, P. W., De Sanctis, G. T. Mouse models of airway responsiveness: physiological basis of observed outcomes and analysis of selected examples using these outcome indicators. Annu. Rev. Physiol. 61, 593-625 (1999).
- Epstein, M. M. Do mouse models of allergic asthma mimic clinical disease. Int. Arch. Allergy Immunol. 133, 84-100 (2004).
- Blyth, D. I., Pedrick, M. S., Savage, T. J., Hessel, E. M., Fattah, D. Lung inflammation and epithelial changes in a murine model of atopic asthma. Am. J. Respir. Cell Mol. Biol. 14, 425-438 (1996).
- Martin, T. R., Gerard, N. P., Galli, S. J., Drazen, J. M. Pulmonary responses to bronchoconstrictor agonists in the mouse. J. Appl. Physiol. 64, 2318-2323 (1988).
- Hamelmann, E. Noninvasive measurement of airway responsiveness in allergic mice using barometric plethysmography. Am. J. Respir. Crit. Care Med. 156, 766-775 (1997).
- Gelfand, E. W. Pro: mice are a good model of human airway disease. Am. J. Respir. Crit. Care Med. 166, 5-8 (2002).
- Shapiro, S. D. Animal models of asthma: Pro: Allergic avoidance of animal (model[s]) is not an option. Am. J. Respir. Crit. Care Med. 174, 1171-1173 (2006).
- Zosky, G. R. Ovalbumin-sensitized mice are good models for airway hyperresponsiveness but not acute physiological responses to allergen inhalation. Clin. Exp. Allergy. 38, 829-838 (2008).
- Nials, A. T., Uddin, S. Mouse models of allergic asthma: acute and chronic allergen challenge. Dis. Model. Mech. 1, 213-220 (2008).
- Wenzel, S., Holgate, S. T. The mouse trap: It still yields few answers in asthma. Am. J. Respir. Crit. Care Med. 174, 1173-1178 (2006).
- Rayamajhi, M. Non-surgical Intratracheal Instillation of Mice with Analysis of Lungs and Lung Draining Lymph Nodes by Flow Cytometry. J. Vis. Exp. (51), e2702 (2011).
- Swedin, L. Comparison of aerosol and intranasal challenge in a mouse model of allergic airway inflammation and hyperresponsiveness. Int. Arch. Allergy Immunol. 153, 249-258 (2010).
- Gueders, M. M. Mouse models of asthma: a comparison between C57BL/6 and BALB/c strains regarding bronchial responsiveness, inflammation, and cytokine production. Inflamm. Res. 58, 845-854 (2009).
- Zhu, W., Gilmour, M. I. Comparison of allergic lung disease in three mouse strains after systemic or mucosal sensitization with ovalbumin antigen. Immunogenetics. 61, 199-207 (2009).
- Flandre, T. D., Leroy, P. L., Desmecht, D. J. Effect of somatic growth, strain, and sex on double-chamber plethysmographic respiratory function values in healthy mice. J. Appl. Physiol. 94, 1129-1136 (2003).
- Hoymann, H. G. Invasive and noninvasive lung function measurements in rodents. J. Pharmacol. Toxicol. Methods. 55, 16-26 (2007).
- Chong, B. T., Agrawal, D. K., Romero, F. A., Townley, R. G. Measurement of bronchoconstriction using whole-body plethysmograph: comparison of freely moving versus restrained guinea pigs. J. Pharmacol. Toxicol. Methods. 39, 163-168 (1998).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены