Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Выделение и культуры крысы эмбриональных нервных клеток: Быстрый протокол
В этой статье
Резюме
Мы описываем методологию быстрой, чтобы изолировать и культуры гиппокампе и коре нейроны от грызунов эмбрионов. Этот протокол позволяет проводить эксперименты, в которых почти чистой культуры нейронов не требуется.
Аннотация
Мы описываем быстрый способ отделить и культуры гиппокампа и коры нейроны от E15-17 крысиных эмбрионов. Эта процедура может быть успешно применен для выделения мышиных и человеческих первичных нейронов и нейронных предшественников. Диссоциированных нейронов поддерживается в бессывороточной среде до нескольких недель. Эти культуры могут быть использованы для nucleofection, иммуноцитохимия, нуклеиновых кислот подготовки, а также электрофизиологии. Пожилые нейронов культуры можно трансфекции с хорошей скоростью эффективность лентивирусов трансдукции и менее эффективно, с фосфатом кальция или на основе липидов такие методы, как липофектамина.
протокол
1. Поли-D-лизин (PDL): Подготовка
- Добавьте 5 мл стерильной DDH 2 O 5 мг PDL для получения маточного раствора 1 мг / мл.
- Смешайте маточного раствора с помощью пипетки несколько раз.
- Используйте сразу или хранить поли-D-лизин решения при температуре 2-8 ° C.
2. Поли-D-лизин (PDL): Покрытие пластиковой посуды культуре клеток
- Развести PDL маточного раствора стерильной DDH 2 O в конечной концентрации 10 мкг / мл.
- Внесите достаточно раствора в 60 мм блюдо для покрытия культуры поверхности (3 мл на 60 мм блюдо).
- Рок осторожно, чтобы обеспечить ровное покрытие культуры поверхности.
- Выдержите покрытие пластин при комнатной температуре (RT) в течение ночи.
- На следующий день, как правило, в день вскрытия, удаления поли-D-лизин Решение стремление и промойте кратко с 3 мл стерильной DDH 2 O. Повторите этот шаг. После второго мытья, удаления воды полностью аспирации.
- Плиты можно хранить при температуре 4 ° С в течение трех недель.
3. Поли-D-лизин (PDL) и Ламинин: подготовка и покрытие стекла двухпалатный Слайды
- Mix PDL (1 мг / мл) и ламинин (1 мг / мл) растворы в стерильных DDH 2 O до конечной концентрации 10 и 5 мкг / мл, соответственно.
- Внесите достаточно раствора в лунки стекло двухкамерного слайд, чтобы покрыть площадь поверхности культуры (1 мл на каждую лунку 2 и стекло двухкамерного слайд).
- Рок осторожно, чтобы обеспечить ровное покрытие культуры поверхности.
- Выдержите покрытие пластин при комнатной температуре на ночь.
- На следующий день, удалить поли-D-лизин-Ламинин раствор для покрытия через стремление и промойте кратко в два раза с 1 мл стерильной DDH 2 O. После второго мытья, удаления воды полностью аспирации.
- Палата слайды могут храниться при температуре 4 ° С до трех недель.
Примечание: Любое предметное стекло камеры могут быть покрыты followinг этого протокола. Мы часто используем двухкамерный слайды, потому что каждый слайд обеспечивает контроль испытания экспериментальной установки (например, по сравнению с необработанной лечение, по сравнению с нетрансфицированных трансфекции).
4. Вскрытие нейронов и культуры
- Теплый следующие реагенты при 37 ° С на водяной бане:
- TrypLE Экспресс на первоначальных 100 мл флакон.
- Neurobasal/B27 полной среде (см. таблицу I). Объем подогревается в зависимости от количества блюд, что покрытие (например, 30 мл в течение десяти 60 мм покрытие посуда).
- Добавьте 3 мл холодной решение Hibernate E-четыре 60 мм культуры блюд и 13 мл до 15 мл BD Сокол высокой четкости полипропилена конической трубе.
- Добавить 25-30 мл холодной среды вскрытия (см. таблицу II, д-р Олимпия Meucci, личное сообщение) в каждой из трех блюд 100 мм культуры. Эти пластины, содержащей большой объем среды, будут использованы для мытья эмбрионы сразу после ихУдаление из амниотической мешка (шаги 4.7 и 4.8).
- Эвтаназии E17 своевременной беременных крыс по CO 2 в соответствии с здравоохранении политики на гуманное лечение и использования лабораторных животных и в институциональном утвержденного ухода за животными и использовать протокол.
- Спрей нижней части живота с 70% этанола и сократить медиально через кожу и мышцы с ножницами подвергая матки и эмбрионов.
- Удалите все плоды и поместить их в стерильную 100-мм блюдо с более холодной среды рассечение (25-30 мл, см. п. 4.3).
- Вырезать эмбрионов с помощью небольшого ножницы из амниотической полости и разместить их во второй 100-мм блюдо с холодной среды рассечение.
- Промойте эмбрионы при комнатной температуре, слегка наклоняя 100-мм блюдо в течение 5-10 секунд. Затем перенесите промытый эмбрионов третий 100 мм блюдо с рассечения среды. Два моет более среднего, как правило, достаточно, чтобы удалить все следы крови. Однако, если NECessary, мыть одно время с помощью новой 100-мм блюдо с 25-30 мл холодной среды рассечение.
- Использование стереомикроскоп и изогнутых щипцов, извлечение мозга каждой крысы эмбриона, потянув за кожей и черепом. Положите весь мозг в одном из 60-мм блюда (как правило, не более чем на 5 мозги на блюдо) с холодным Hibernate Е. Храните эти пластины на льду.
- Возьмите одно блюдо в то время, и при вскрытии микроскоп, разделить и изолировать полушарий головного коры удаления мозга и мозговых оболочек.
- Дополнительно: разрез по средней линии мозга, гиппокампе извлечь, и следуйте приведенным ниже инструкциям, чтобы изолировать нейронов гиппокампа.
- Соберите все расчлененный коры в 15 мл коническую ясно пробирку, содержащую 13 мл холодной Hibernate Е. Оставьте кору головного мозга на льду, пока все вскрытия будут завершены. Из-за своих небольших размеров, расчлененный гиппокампе может быть собрана в 1,5 мл Eppendorf трубки вместо 15 мл трубку. При необходимости на этом этапе коры илигиппокампе может быть помещен в криоскопической пробирки флакон, содержащий 1 мл Hibernate E + 2% B27 + гентамицин (50 мкг / мл) + Fungizone (250 нг / мл) в соотношении 2-4 или 2-4 коре гиппокампа в одном флаконе. Мозговая ткань может храниться при температуре 4 ° С в темное время суток на срок до одной недели (более поздние времена не тестируется пока). При необходимости использовать тонкий пинцет для передачи ткани головного мозга в 15 мл пробирку с Hibernate E, а затем следовать протоколу ниже, чтобы изолировать нейронов.
- Передайте трубку капот культуре ткани. Позвольте коры осели на дне пробирки, а затем осторожно удалить супернатант.
- Добавить 13 мл свежего E Hibernate в 15 мл коническую трубку, позволяющие коры оседают на дне пробирки и тщательно удалите супернатант. Повторите этот шаг еще 2 раза, а после последнего мытья, аккуратно удалите все средства массовой информации.
- Ферментативно переварить кору головного мозга, добавив 1-2 мл (в зависимости от количества коры, использовать меньше изоляции гиппокампе) теплой ТрypLE Express. Закройте крышку трубки с парафильмом и плавать трубки в 37 ° С на водяной бане 10 минут.
- Спрей трубка с 70% этанола, прежде чем открывать крышку и добавить 10 мл Hibernate Е. Позвольте коры, чтобы поселиться в нижней части трубы и удалите супернатант. Повторите этот шаг в три раза промыть TrypLE Express. В последний шаг, тщательно удалить все средства массовой информации.
- Осторожно растереть (4-5 раз) коры в 2 мл Neurobasal/B27 полной среде с использованием пожарной полированного стекла Пастера (примерно 1 мм в диаметре). Будьте осторожны, чтобы избежать пузырей.
- Повторить 4-5 раз другой стерильной стеклянной пипетки Пастера меньше в диаметре (т.е. пипетка о 1/2-3/4 мм в диаметре). Не используйте пипетку Пастера меньше этого или он будет разрушать клетки.
- Позвольте оставшихся кусочков ткани (как правило, очень немногие, если таковые имеются), чтобы обосноваться.
- Передача верхней одной клеточной суспензии в новый 15-мл трубку, оставив поселились кусочки ткани. Мехше, разбавленные суспензии клеток до 10-12 мл Neurobasal/B27 полной среде.
- Хорошо перемешайте и разбавьте для подсчета клеток путем добавления 10 мкл клеточной суспензии до 490 мкл 50x Решение подсчет (см. таблицу III) в 1,5 мл Eppendorf трубку.
- Пластина клеток на PDL-покрытие пластин при плотности 5,0 х 10 4 / см 2. Если nucleofection должны быть выполнены, мы рекомендуем нанесение клеток при более высокой концентрации (8-10 х 10 4 / см 2).
- Как правило, мы проанализируем 9-10 плодов в эксперименте, так как примерно 13 х 10 6 нейронов, полученных от каждого E17 плода. Если больше эмбрионов необходимы, чтобы убедиться, что вся процедура длится не более двух часов.
- При желании, через 24 часа после изоляции, 10 мкМ цитозин-β-D-арабинофуранозида (AraC) могут быть добавлены к каждому блюду, в целях предотвращения распространения глии. Тем не менее, этот шаг не требуется, поскольку Neurobasal/B27 среднего подавляет пролиферацию глиальных, В соответствии с рекомендациями производителя (Invitrogen / Gibco).
- Нейроны могут быть использованы для экспериментов, через 4-5 дней в лабораторных условиях, хотя точное время зависит от желаемой стадии дифференцировки. У нас есть культивируемых нейронов на срок до 4 недель без существенного снижения выживаемости (рис. 1).
- Для длительного культивирования, замене культивирования средних каждую неделю с свежеприготовленный Neurobasal/B27 полной среде.
5. Представитель Результаты
Нейроны культивировали на предметные стекла камеры могут быть подвергнуты иммуноцитохимия. На рисунке 1 показан типичный образ корковых нейронов установлен после пяти дней в культуре и immunolabeled с анти-MAP-2 антител, чтобы показать нейронных процессов.
На рисунке 2 показан представитель образ нейронов гиппокампа крыс через 3 недели в культуре. Морфологии нейронов полностью дифференцированных клеток выделяется МАП-2 яmmunolabeling (MAP-2 нейронов маркер мышиных моноклональных антител клона AP-20, Джин Tex, Irvine, CA), следуя стандартной процедуре, как описано выше 1. Изображения были визуализированы с Nikon Eclipse E400 вертикально флуоресцентный микроскоп оснащен EXI аква камеры (Qimaging), моторизованный Z-оси, а SlideBook5 приобретение / деконволюции программного обеспечения (Intelligent изображений Innovations, Inc, Денвер, Колорадо). Серии трехмерных изображений каждого картины были deconvoluted одного двумерного изображения и решены путем изменения сигнала отключение почти до максимальной интенсивности увеличить разрешение.
На рисунке 3 показана чистота нейронных культур. Белки лизатов были получены из нейронов крысы DIV7 культур (CTX), а также случай человеческой глиобластомы (GBM). Как и ожидалось, нейронные лизат сильно положительным для нейронов белки MAP-2 и отрицательной астроцитов GFAP маркером, тогда как GBM лизат белков отрицательный еили MAP-2 и положительный для GFAP.
Хотя в нашей протокола мы используем Hibernate E в течение нескольких лет, рассечения и промывки среды, недавно мы рассмотрели дополнительные и очень практично использовать его для сохранения тканей мозга для дальнейшего использования. На рисунке 4 показана дней в пробирке 5 (DIV5) Культура крысы корковых нейронов изолированной от коры хранить при температуре 4 ° C в течение одной недели в Hibernate E + B27 после их первоначального вскрытия из эмбрионов. Нейроны высевали на стекло двухкамерного слайд покрыты PDL и ламинин, как описано выше. Полученные изображения были deconvoluted использованием SlideBook5 приобретение / деконволюции программное обеспечение, как описано выше (рис. 2).

Рисунок 1. Представитель образ корковых нейронов nucleofected с pmaxGFP (Amaxa, Lonza, Walkersville, MD) и immunolabeled с ПДЧ-2 Антител, в красный цвет. Оригинальный увеличение 100x.
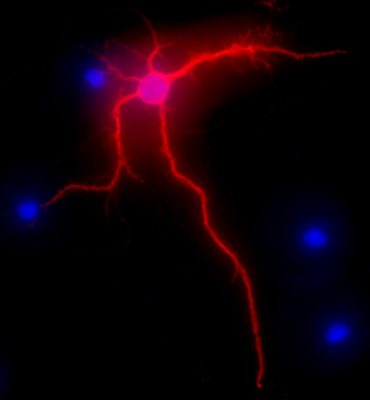
Рисунок 2. Представителю изображение, показывающее MAP-2 immunolabeling, красный, нейронов гиппокампа через 3 недели в культуре. DAPI окрашивания, в синем, показывает, клеточных ядер. Оригинальный увеличение 40x.

Рисунок 3. Вестерн-блот показывает чистоту нейронов клеточных культурах. 30 мкг крыс и человеческих нейронов лизатов GBM белки были разделены с помощью электрофореза и подвергается Вестерн-блот анализе в соответствии со стандартными процедурами 1. Anti-MAP-2 кролика поликлональных из клеточной сигнализации (Денвер, штат Массачусетс), анти-GFAP антителами было мышиных моноклональных от Chemicon (Millipore, Billerica, MA), и мышиных моноклональных анти-Grb2 антител был из лаборатории BD трансдукция ( Sparks, MD). Grb2 был использован в качестве управления загрузкой.

Рисунок 4. Представитель фотографии дней в пробирке 5 (DIV5) корковых нейронов крысы получена из коры остается в Hibernate E + B27 при 4 ° С в течение одной недели после их вскрытия. А) фазового контраста нейроны культивировали на стекло двухкамерного слайдов. Оригинальный увеличение 20X. B) иммунофлуоресценции показывает выражение MAP-2 в нейронных процессах, в зеленом, культура была отрицательной для астроцитов GFAP маркером. DAPI окрашивания, в синем, указывает клеточных ядер. Оригинальный увеличение 40x.
Обсуждение
Метод вскрытия и культуры гиппокампа крыс и корковых нейронов описаны здесь позволяет проводить эксперименты с использованием почти чистый нейронных культур, выращенных в химически определенной среде (рис. 3). Хотя протоколы для культивирования почти чистый нейронов в сывор?...
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Мы благодарим Jonna Ellis за помощь в редактировании. Проект описан была поддержана премии Количество R01MH079751 (PI: Ф. Перуцци) из Национального института психического здоровья. Содержания несут их авторы и не обязательно отражает официальную точку зрения Национального института психического здоровья и Национального института здоровья.
Материалы
| Name | Company | Catalog Number | Comments |
| Реагент | Концентрация | ||
| Neurobasal | 98% | ||
| B27 | 2% | ||
| Glutamax | 0,5 мМ |
Таблица I. Neurobasal/B27 полной среде.
| Реагент | Концентрация |
| Глюкоза | 16 мм |
| Сахароза | 22 мм |
| HEPES | 10 мМ |
| NaCl | 160 мМ |
| KCl | 5 мМ |
| Na 2 HPO 4 | 1 мМ |
| KH 2 PO 2 | 0,22 мм |
| Гентамицин | 50 мкг / мл |
| Fungizone | 250 нг / мл |
| рН | 7,4 |
| Осмолярность | 320-330 мОсм |
Таблица II. Вскрытие среды.
| Реагент | Объем (мкл) |
| Neurobasal/B27 полной среде | 240 |
| Трипановый синевы 0,4% | 250 |
| Общий | 490 |
Таблица III. 50x Подсчет решение.
Таблица IV. Специальные реагенты.
| Реагент | Компания | Кат. номер |
| Hibernate E | Brainbits | 767171 |
| Neurobasal | Gibco, Invitrogen | 21103-049 |
| B27 | Gibco, Invitrogen | 17504-044 |
| Fungizone | Gibco, Invitrogen | 15290-018 |
| Гентамицина сульфат | Sigma Aldrich | G1264 |
| Glutamax 200 мМ | Gibco, Invitrogen | 35050 |
| TrypLE Экспресс без фенола красного | Gibco, Invitrogen | 12604 |
| Цитозин-β-D-арабинофуранозида гидрохлорид | Sigma Aldrich | C6645 |
| Поли-D-лизин | Sigma Aldrich | P6407 |
| Ламинин 1 мг / мл | Millipore | CC095 |
| HEPES | Sigma Aldrich | H3375 |
| Трипановый синевы 0,4% | Gibco, Invitrogen | 15250 |
| Оборудование | Компания | Кат. номер |
| Стерео микроскоп | Олимп | SZ61 |
| Большие щипцы | FST | 11022-14 |
| С острым концом щипцов | Мория | MC40B |
| Micro острым концом щипцов | Мория | MC31 |
| Razor-острыми ножницами | Roboz | RS-6820 |
| Micro Анатомический ножницы | FST | 91460-11 |
| Micro Анатомический изогнутые ножницы | FST | 14067-11 |
| Стекло 2-камерные слайды | Лаборатория-Tek | 154461 |
| 60 мм блюда | BD Сокол | 353002 |
| 100 мм блюда | Гранулирование | 430167 |
| 15 мл труб | BD Сокол | 352099 |
| 1,5 мл крио-трубка флакон | Nunc | 375353 |
Таблица V. Специальное оборудование.
Ссылки
- Aprea, S. Tubulin-mediated binding of human immunodeficiency virus-1 Tat to the cytoskeleton causes proteasomal-dependent degradation of microtubule-associated protein 2 and neuronal damage. J. Neurosci. 26, 4054-4062 (2006).
- Kivell, B. M., McDonald, F. J., Miller, J. H. Serum-free culture of rat post-natal and fetal brainstem neurons. Brain Res. Dev. Brain Res. 120, 199-210 (2000).
- Kivell, B. M., McDonald, F. J., Miller, J. H. Method for serum-free culture of late fetal and early postnatal rat brainstem neurons. Brain Res. Brain Res. Protoc. 6, 91-99 (2001).
- Brewer, G. J. Serum-free B27/neurobasal medium supports differentiated growth of neurons from the striatum, substantia nigra, septum, cerebral cortex, cerebellum, and dentate gyrus. J. Neurosci. Res. 42, 674-683 (1995).
- Banker, G., Goslin, K. . Culturing nerve cells. , (1998).
- Eletto, D. Inhibition of SNAP25 expression by HIV-1 Tat involves the activity of mir-128a. J. Cell Physiol. 216, 764-770 (2008).
- Gualco, E. IGF-IR-dependent expression of Survivin is required for T-antigen-mediated protection from apoptosis and proliferation of neural progenitors. Cell Death Differ. 17, 439-451 (2010).
- Gage, F. H. Survival and differentiation of adult neuronal progenitor cells transplanted to the adult brain. Proc. Natl. Acad. Sci. U.S.A. 92, 11879-11883 (1995).
- Keyser, D. O., Pellmar, T. C. Synaptic transmission in the hippocampus: critical role for glial cells. Glia. 10, 237-243 (1994).
- Pfrieger, F. W., Barres, B. A. Synaptic efficacy enhanced by glial cells in vitro. Science. 277, 1684-1687 (1997).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены