Method Article
Бесконтактная, этикетки без мониторинга клеток и внеклеточного матрикса использованием спектроскопии комбинационного
В этой статье
Резюме
Спектроскопии комбинационного рассеяния света является подходящим способом для бесконтактного, этикетки без анализа живых клеток, тканевой инженерии конструкций и местных тканей. Источник конкретных спектральных отпечатков пальцев могут быть получены и проанализированы с помощью многомерного анализа.
Аннотация
Неразрушающий, бесконтактный и без наклеек технологии для мониторинга культур клеток и тканей, необходимых в области биомедицинских исследований. 1-5 Тем не менее, в настоящее время методы рутина требует обработки шаги и изменить образец честности. Спектроскопии комбинационного рассеяния света является быстрый метод, который позволяет измерять биологические образцы без необходимости дальнейших шагов обработки. . Эта лазерная технология определяет рассеяние монохроматического света 6 В каждый химический вибрации присваивается определенный полосы КР (волновое число в см -1), каждый биологический образец имеет типичные спектральные картины в связи с присущими им биохимический состав 7. - 9 В спектрах КР, пик интенсивности коррелирует с количеством настоящих молекулярных связей 1. Сходства и различия в спектральных наборов данных может быть обнаружено, используя многомерный анализ (например, анализ основных компонент (PCA)) 10. Здесь мы проводим спектроскопии комбинационного рассеяния живых клеток и тканей, родной. Клетки высевают либо на блюда со стеклянным дном или храниться во взвешенном состоянии в нормальных условиях культуры клеток (37 ° C, 5% СО 2) до измерения. Родные тканей расчлененные и хранится в фосфатный буферный раствор (PBS) при 4 ° С до измерения. В зависимости от нашей экспериментальной установки, то мы либо сосредоточены на ядре клетки и внеклеточного матрикса (ECM), белки, такие как эластин и коллаген. Для всех исследований, не менее 30 клеток или 30 случайных точек интереса в ECM измеряется. Обработка данных шаги включали вычитания фона и нормализации.
протокол
1. Подготовка биологических образцов
- Подготовка живых клеток
- Подготовка прилипшие клетки
- Семенной в пробирке-культурных или свежевыделенных клеток на блюдо со стеклянным дном (Greiner BioOne / Германия) и инкубировать их при 37 ° С и 5% CO 2 до клеточном завершена.
- Удалить культуральной среде и мытья аккуратно три раза PBS до измерения. Держите клетки покрыты либо PBS или среду клеточной культуры на всей процедуры измерения.
- Подготовка клеток в суспензии
- Снимите в пробирке, культивируемых клеток в соответствии с общими протоколами (например, трипсин-EDTA, сотовые выскабливание), центрифуги клетки и вновь приостановить получить осадок клеток в PBS или средней клеточной культуре.
- Передача 100 мкл клеточной суспензии (концентрация: макс. 100 000 клеток / мл), чтобы блюдо со стеклянным дном.
- Подготовка прилипшие клетки
- Подготовка физив тканей
- После уборки тканей, перевести их в стерильной, ледяной PBS и держать их не более 12 часов при температуре 4 ° С или на льду до измерения. Предыдущие эксперименты показали, что длительный срок хранения (холодное время ишемии> 12 часов при температуре 4 ° С), в результате спектральные изменения, связанные с природными процессами деградации.
- Измерения должны быть выполнены с тканью рассматривается в PBS или средней, чтобы избежать повреждения белков ECM и клетки тканей из-за высыхания.
2. Спектрометр комбинационного
Наши настроенные комбинационного спектрометра сочетает в себе стандартный флуоресцентного микроскопа (Olympus IX 71) с комбинационным спектрометр, который позволяет прямое сравнение светлого поля и флуоресцентных изображений с спектров комбинационного рассеяния. Основные настройки состоит из 784 нм лазерный диод (Toptica фотоники AG / Германия), режекторный фильтр для разделения комбинационного рассеянного света от возбуждающего света, микроскопм спектрограф (Kaiser оптических Systems, Анн-Арбор / США) с зарядовой связью (ПЗС), оптимизированных для определения спектральной информации (F-вид с Soft Systems Imaging / Германия).
3. Контроль лазерной функции
- Запустите программу Андор Солис (Андор / Великобритания) и установите температуру ПЗС-камеры до -60 ° C, чтобы минимизировать шум, вызванный термически индуцированных токов в камере.
- Поместите кремниевых пластин на предметный столик микроскопа для калибровки.
- Включите лазер и установить мощность до 85 мВт.
- Используйте программное обеспечение сотового B (Olympus / Германия), чтобы сфокусировать лазер на пластине до XY появляется.
- Измерьте кремниевых пластин с одним временем интегрирования 1 с помощью 60x цель воздуха.
- Изменение единицы оси Х от числа пикселей рамановского сдвига (см -1) в программном обеспечении Андор Солис.
- Вар лазерный фокус пика кремния при 520 см -1 всобранных спектра для того, чтобы найти максимально возможную интенсивность этой полосы КР. Минимальная сумма отсчетов должна быть выше, чем 11000 для успешной калибровки.
4. Комбинационного спектроскопических измерений
Все измерения проводились при комнатной температуре.
- Основные параметры
- Используйте 60x цель погружением в воду (Olympus / Германия) с числовой апертурой 1,2 собрать спектр образцов.
- Измените настройки приобретение до 10 интеграций / 10 секунды на общую сумму 100 секунд в измерениях.
- Измерение прилипшие клетки
- Возьмите блюдо со стеклянным дном с клетками и поместить его на предметный столик микроскопа.
- Для того, чтобы получить лучший сигнал и обеспечить воспроизводимость, фокусировки лазерного на ядре клетки, поверните световой микроскоп и начать сбор спектра.
- Измерьте ссылкой спектр фоне электронной10 спектры очень перемещением лазерного фокуса у клетки. Важно учитывать, что при изменении фокуса новый фон должны быть собраны для каждой фокус глубину.
- Измерение клеток в суспензии
- Передача 100 мкл суспензии клеток в блюдо со стеклянным дном и поместите его на предметный столик микроскопа.
- Фокус на лазерном центре клетки, поверните световой микроскоп и начать сбор спектра.
- Измерьте ссылкой спектр фона каждые 10 спектров путем перемещения фокуса лазера рядом с ячейкой. При изменении фокуса, новый фон должны быть собраны для новой глубины фокуса.
- Измерение родной ткани
- Возьмите образец и поместите его в блюдо со стеклянным дном. Область интереса (ROI) должны быть ориентированы направлен к нижней части блюда.
- Заполните блюдо достаточно, чтобы покрыть PBS образца.
- Поместите крышку стекла по образцу, чтобы избежать любых мовВЫРАЖЕНИЕ образца в процессе измерения.
- Установите лазерный фокус в структуру интересов (глубина резкости является лазерная и ткань-зависимые) и начать собирать спектры.
- Соберите ссылкой спектр фона каждые 10 спектров путем перемещения лазерной внимание из всей площади ткани. При изменении фокуса, новый фон должны быть собраны для новой глубины фокуса.
- Измерение иммунофлюоресценции (ИФ)-меченных cryosections
- Раздел свежие, замороженные оснастки образцы тканей с использованием стандартного cryotom и смонтировать их на кремнезема покрытием покровных стекол.
- Пятно cryosections после обычного протокола для IF, используя только один шаг фиксации (не более 10 минут с 4% параформальдегид) и с помощью соответствующих антител для обнаружения белка интерес.
- Выполните измерения комбинационного внимание в районе, где происходит флуоресценция.
- Эксперименты эластина деградации
- Пласе ventricularis из расчлененных свиней аортального клапана листовки (эластин богатых, приток крови стороне слой листовки клапанов сердца), стоящих перед дно тарелки со стеклянным дном.
- Измерьте родной ткани, как «не-инкубационных контроль» на 30 случайных точек по всей поверхности ткани фокусировки в фибриллярных структур.
- Разделите образец на 3 части и поместить их в отдельный 2,5 мл Eppendorf трубы заполнены с 2 мл раствора эластазы (5 ЕД / мл, Уортингтон / Германия).
- Инкубируйте ткани для 15 или 30 минут при 37 ° C.
- После инкубации в течение 15 или 30 минут, снимите ткани из пробирки Эппендорф и мыть тщательно PBS, чтобы полностью остановить ферментативной реакции.
- Измерьте каждого образца на 30 случайных точек фокусировки в фибриллярных структур.
5. Обработки и анализа данных
- Обработки спектров комбинационного
Предварительная обработкапорожденных спектров проводили с использованием программного обеспечения OPUS (Bruker Optik GmbH / Германия).- В целях уменьшения помех от стекла и средних, а также, чтобы избежать изменений, вызванных изменениями в центре внимания во время измерений, вычесть соответствующие спектр фона от собранных спектров.
- Уменьшить спектров волновых области между 400-1800 см -1, которая предлагает самое большое количество информации.
- Если необходимо, нормализовать спектров к максимальной точке. Нормализация факторов из флуктуаций интенсивности и систематических отказов, упрощая выявление структурных изменений в образце спектров.
- Выполнять базовые поправки к увеличению сопоставимости между различными экспериментами.
- Анализ спектров комбинационного
Спектров комбинационного рассеяния были проанализированы с использованием СПС с Unscrambler (CAMO / Норвегия) программного обеспечения. Это многофакторный анализ обнаруживает сходства и различия в спектральных данныхмножеств. Каждый спектр строится как единая точка в многомерном пространстве на основе собранных рассчитывает для каждой рамановского сдвига. Каждый принцип компонент (PC) описывает определенное количество общей информации, содержащейся в исходных данных. Первый компьютер, который содержит высокий источник изменчивости. Каждый следующий ПК содержит в порядке, меньше информации, чем предыдущий. Каждая переменная имеет счет и нагрузку на каждый ПК. Построив ПК (= баллов), важный пример корреляции могут быть выставлены. Нагрузки описать вклад каждого проанализированы переменной СПС.- Пометьте каждую группу измерений, создав ряд диапазонов для каждой выборки.
- Используйте следующие основные параметры СПС: кросс проверки NIPALS алгоритм, без вращения и начала анализа. Эти параметры спектров зависимость.
- Выполните СПС.
6. Представитель Результаты
Комбинационного зрectra полученные от прилипшие клетки часто обнаруживают низкий сигнал-шум и низкой общей интенсивности сигнала (рис. 1) 11. В связи с тем, что лазерный фокус должен быть установлен рядом со стеклянным дном, влияние интерферирующих стекло сигнала достаточно высока, в результате чего маскировка реального сигнала образца. Таким образом, выборка сигнала может быть сведено к минимуму или даже устранены в течение последующего вычитания фона. Таким образом, мы предпочитаем использовать клеток в суспензии для наших комбинационного спектроскопического анализа, так как они позволяют обнаруживать более детальной спектральной информации. Тем не менее, спектр сторонником и подвески клетки обладают теми же основные пики, отличающиеся только в их интенсивности.
Для характеристики различных типов клеток в суспензии, без предварительной обработки не требуется. Средний спектров комбинационного рассеяния и стандартного отклонения фибробластов человека, мезенхимальные стволовые клетки (МСК), хондроциты и кератиноцитов измеряется подвескиизображенный на рисунке 2. Все спектры комбинационного рассеяния аналогичным структурированные, с пиками, происходящих из типичных биомолекул, таких как белки, нуклеиновые кислоты и липиды (см. Таблицу 1) 12. Для этих типов клеток, спектральную область между 600 и 1800 см -1, содержит наиболее важные спектральной информации, по который четкие различия обнаруживаются между различными типами клеток (рис. 2). Образцовый, мы подчеркнули одной спектральной области (1280-1350 см -1) отображение ясно структурные различия, которые назначаются на колебания молекул коллагена и липидов. В отличие от морфологического анализа не пригодны для идентификации и различия большинство клеток (рис. 2, б-I). Хотя разница между хондроцитов и клеток кожи наблюдается (рис. 2, H по сравнению с B, F и E, I), фибробластов и МСК трудно отделить использование исключительно светлого поля micrsocКопировать (рис. 2, F по сравнению с C, G) 13.
Комбинационного спектроскопического анализа нативной ткани, в частности ECM белков, требует, чтобы рентабельность может быть визуализированы светлого поля изображения для того, чтобы иметь возможность сосредоточиться на соответствующие структуры. Для назначения белков к конкретной спектр отпечатки пальцев, мы получили спектры комбинационного рассеяния коммерчески доступных чистых белков и immunohistologically окрашенных cryosections. Здесь мы определили отпечатков пальцев спектр эластичных волокон в ткани родной сравнения лиофилизированный эластина и иммунофлюоресценции окрашенных cryosections использованием антител против эластина. Однако, так как эластин обладает высокой флуоресценции, что нашло отражение в спектрах комбинационного рассеяния, анализ данных является сложной задачей (рис. 3А). Чтобы уменьшить систематические неудачи из-за пример конкретных свойств, таких как флуоресценции, соответствующую обработку наборов данных имеет решающее значение. В наших данныхalyses, мы использовали нормализации устранить значительно выше интенсивности сигнала чистого белка эластина, и таким образом, мы смогли обеспечить сопоставимость спектров комбинационного рассеяния (рис. 3В). Эластин является одним из самых стабильных ECM белков в организме, и поэтому очень трудно ухудшить. 14 В нашей экспериментальной установки, мы индуцированных эластина деградации здоровых листовки аортального клапана свиньи, выполняя ферментативного пищеварения. Применение многомерного анализа СПС, мы обнаружили значительные различия между спектров комбинационного рассеяния ферментативно обработанных образцов и собственные элементы управления (рис. 3в). Эти спектральные различия наблюдались в спектре при нагрузке 861, 1003 и 1664 см -1. Ожидаемое структурных изменений в эластина содержащих волокна за счет продолжительного времени воздействия эластазы было показано окрашиванием HART (рис. 4), которые также были отражены в более четкой сепарабельных кластеров оценка (рис. 3C).

Рисунок 1. Средний спектров комбинационного рассеяния отдельных и сторонник фибробластов.
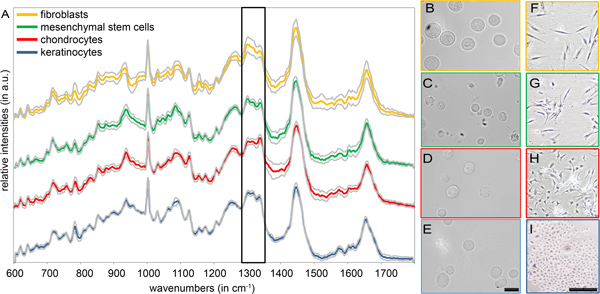
Рисунок 2. (А) Средние спектров комбинационного рассеяния и стандартные отклонения из четырех изолированных первичных типов клеток (фибробласты, МСК, хондроциты и кератиноцитов). Рама подчеркивает спектральной области 1280 - 1350 см -1 со структурными различиями. (BE) Светлое поле изображения отдельно (B) фибробласты, (C) МСК, (D) и хондроцитов (E) кератиноцитов. Шкала бар равен 20 мкм. (FI) Светлое поле изображения приверженцем (F) фибробласты, (G) МСК, (H) и хондроцитов (I) кератиноцитов. Масштаб панели равна 200 мкм.

Рисунок 3. (A) спектров комбинационного рассеяния без нормализации lyophiliZED эластина (синяя линия), иммунофлюоресценции (ИФ)-меченных cryosections (оранжевая линия) и эластичных волокон (красная линия), измеренных в пределах родной листовки аортального клапана. Высокая интенсивность сигнала лиофилизированный эластина вызвано флуоресценции. (B) спектров комбинационного рассеяния после нормализации в целях устранения системных сбоев. (C) результаты и нагрузки сравнения между необработанной управления (красный) и ферментативно-деградированные (синий и зеленый) эластичных волокон в родной ткани.

Рисунок 4. HART's окрашенных листовки аортального клапана свиньи. Эластичные волокна визуализируются в черный цвет. (А) и (Б) показывают, необработанных контроля и (C) и (D) изображают образцы тканей, которые подвергались эластина, разрушающих ферментов эластазы в течение 30 минут.
| Спектральный в см -1 | Назначение 12 | |
| 717-719 | CN | Фосфолипиды |
| 785-788 | ДНК / РНК базы, ПГС позвоночник | ДНК / РНК |
| 1003 - 1005 | Фенилаланин | Белок |
| 1220-1280 | Амид III | Белок |
| 1445-1447 | CH 2 | Белки / Липидный |
| 1655-1680 | Амид IC = C | Белки липидного |
Таблица 1. Полос КР, которые были обнаружены в спектрах всех типах клеток (фибробласты, МСК, хондроциты и кератиноцитов).
Обсуждение
Спектроскопии комбинационного рассеяния света является подходящим инструментом для анализа биологических образцов, таких, как в пробирке, культивируемых клеток и ECM белков, а также клеток в родной ткани. 11,15,16 Здесь мы показали, что это бесконтактный, без наклеек методика позволяет дискриминации в отношении различных типов клеток и обнаружение ECM деградации белка, основанный исключительно на внутренний состав биомолекул этих биологических образцов.
Основным преимуществом спектроскопии комбинационного рассеяния является возможность неинвазивного количественно биохимических отпечатков пальцев образца его полученная спектров комбинационного рассеяния. В отличие от ИК-спектроскопии, которая дает подобную информацию, спектров комбинационного рассеяния могут быть собраны из водных образцов, как комбинационного рассеяния воды слабый. Кроме того, спектроскопии комбинационного рассеяния света основана исключительно на обнаружение рассеяния монохроматического света, поэтому нет обработки образцов требуется до измерения. Эти свойства делают RaЧеловек спектроскопии перспективной альтернативой для потенциальных применений в естественных изображений. В связи с этим, КАРС спектроскопии комбинационного рассеяния света (КАРС) очень интересная техника, поскольку она позволяет быстрее и более чувствительны сбора данных на основе тех же колебательных сигналов, используемых в наших экспериментах. 15,16 Другие альтернативные методы, включая многофотонные вызванных аутофлюоресценция и второй гармоники изображения поколение ранее оказались подходящими для мониторинга биологических образцов без или минимальным инвазивным 17. Однако эти изображения форм связано с очень высокими издержками и ограничиваются аутофлюоресценция генерирующих молекул. Кроме того, спектрометр комбинационного легко сочетать с обычными оптическими микроскопами. Эти характеристики делают спектроскопии комбинационного рассеяния света является ценным инструментом для изучения биологических образцов в физиологических условиях.
Один из нынешних ограничений нашего спектроскопии комбинационного рассеяния света настроить,относительно небольшой лазерный фокус (250 нм максимуму полуширина (FWHM) боковой и 700 нм FWHM осевой), который создается высокое численное цель апертуры (NA = 1.2). Несмотря на высокий числовой апертурой позволяет охватить хорошее количество излучаемого света комбинационного уступая в высоком отношении сигнал-шум, высокая Н.А. производит лишь небольшое внимание в коллекции образцов, которые, как правило, намного меньше, чем клетки. Для сравнения спектров комбинационного рассеяния различных клеток, сбор представитель спектр имеет важное значение, которое трудно получить с небольшой площади фокус. Для решения этой проблемы, мы работаем на процесс автоматизировать сбор сигналов в различных точках внутри клетки (= комбинационного спектроскопических отображение), в результате спектрального усреднения и уступив представителю спектра. Кроме того, этот метод даст общее представление о распределении конкретных полос КР, например, белка распределение внутри клетки.
Biological образцы являются очень сложными и состоят из гетерогенной смеси биомолекул, которые способствуют собранных спектров комбинационного рассеяния. Таким образом, спектральная картина весьма сложных и мониторинга одного типа молекул в спектре комбинационного рассеяния трудно достичь с перекрытием различные сигналы молекулы. Кроме того, собственная флуоресценция образца может скрывать ценную информацию о слабых комбинационного сигналов. Интересно, что в некоторых из наших предыдущих исследований мы выявили флуоресценции в спектрах как основным дифференцирующим фактором между типами клеток (МСК и фибробластов) с помощью соответствующих инструментов анализа. 13 Мы также определили, что изменения в общем комбинационного интенсивность сигнала может служить индикатор состояния коллагена и коллагеновых волокон в ECM аортального клапана листовки 9. Тем не менее, при анализе состояния эластина в этих тканях, мы не смогли обнаружить аналогичные результаты. Как уже упоминалось, в результатесекцией, мы были способны обнаружить изменения конкретной полосы КР в эластазы обработанных образцов по сравнению с родной управления. Мы не видим снижения общего комбинационного сигнала в ферментативно обработанных образцов, как ожидалось. Эти наблюдения привели к счетом сюжет, который не выявил четкое формирование кластера, как показано в предыдущих исследованиях. 9 В отличие от влияния ферментативной обработки был обнаружен в результатах СПС. Мы считаем, что эти расхождения между двумя белками ECM, эластина и коллагена, основанные на морфологических различий и различных ферментативных процессов деградации: в аорте листовка клапана, коллаген богатые зоны (фиброзный) является непрерывным слоем, который становится ослабил связи с ферментативной обработки, в результате чего эластина содержащие зоны (ventricularis) имеет конфигурацию сети, которая появляется после фрагментации воздействие эластазы (рис. 4). Одноместный измерения месте были, следовательно, не соотели обнаружить такие маленькие разрывы в сети эластина. Здесь комбинационного отображение ткани поможет выявить сеть поломок.
Еще одна проблема в спектроскопии комбинационного рассеяния биологических образцов состоит в сокращении времени измерения. Одно из решений заключается в увеличении мощности лазерного излучения, которые можно использовать в качестве тех пор, пока биологические образцы, не влияют на фото-повреждения. Все наши текущие эксперименты доказательством правильности принципа исследований, посвященных фундаментальным исследованиям, однако наша общая цель заключается в реализации спектроскопии комбинационного рассеяния света для клинических применений, включая регенеративной медицине (например, контроль качества тканевой инженерии продуктов), предтрансплантационная трансплантата мониторинга и диагностики рака.
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Мы благодарим Штеффен Коха за его техническую поддержку и Шэннон Ли Layland (как Fraunhofer IGB Штутгарт) за полезные предложения по рукописи. Эта работа выполнена при финансовой поддержке программы привлечения Fraunhofer-Gesellschaft и BMBF (как для KS-л.).
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента | Компания | Номер по каталогу | Комментарии |
| эластазы | Уортингтон | LS006363 | |
| анти-эластиновых антител | Сигма | HPA018111 | 1:75; цитратном буфере |
| PBS | Lonza | 17-512F | |
| блюда со стеклянным дном | Greiner BioOne | 627860 | |
| Unscrambler | CAMO | ||
| Опус | Bruker |
Ссылки
- Chan, J. W., Lieu, D. K. Label-free biochemical characterization of stem cells using vibrational spectroscopy. J. Biophotonics. 2, 656-668 (2009).
- Downes, A., Mouras, R., Elfick, A. Optical spectroscopy for noninvasive monitoring of stem cell differentiation. J. Biomed. Biotechnol. 2010, 101864-101864 (2010).
- Gentleman, E. Comparative materials differences revealed in engineered bone as a function of cell-specific differentiation. Nat. Mater. 8, 763-770 (2009).
- Notingher, I., Hench, L. L. Raman microspectroscopy: a noninvasive tool for studies of individual living cells in vitro. Expert. Rev. Med. Devices. 3, 215-234 (2006).
- Schenke-Layland, K. Optimized preservation of extracellular matrix in cardiac tissues: implications for long-term graft durability. Ann. Thorac. Surg. 83, 1641-1650 (2007).
- Raman, C. V., Krishnan, K. S. A new type of secondary radiation. Nature. 122, 12 (1928).
- Frushour, B. G., Koenig, J. L. Raman scattering of collagen, gelatin, and elastin. Biopolymers. 14, 379-391 (1975).
- Pudlas, M., Koch, S., Bolwien, C., Walles, H. Raman spectroscopy as a tool for quality and sterility analysis for tissue engineering applications like cartilage transplants. Int. J. Artif. Organs. 33, 228-237 (2010).
- Votteler, M. Raman spectroscopy for the non-contact and non-destructive monitoring of collagen damage within tissues. J. Biophotonics. , (2011).
- Wold, S., Esbensen, K., Geladi, P. Principal component analysis. Chemometrics and Intelligent Laboratory Systems. 2, 37-52 (1987).
- Pudlas, M. Raman Spectroscopy: A Noninvasive Analysis Tool For The Discrimination of Human Skin Cells. Tissue Eng. Part C Methods. 10, (2011).
- Movasaghi, Z., Rehman, S., Rehman, I. U. . Raman Spectroscopy of Biological Tissues. Applied Spectroscopy Reviews. 42, 493-541 (1080).
- Pudlas, M. Non-contact discrimination of human bone marrow-derived mesenchymal stem cells and fibroblasts using Raman spectroscopy. Medical Laser Application. 26, 119-125 (2011).
- Mecham, R. P. Methods in elastic tissue biology: elastin isolation and purification. Methods. 45, 32-41 (2008).
- Downes, A., Mouras, R., Bagnaninchi, P., Elfick, A. Raman spectroscopy and CARS microscopy of stem cells and their derivatives. Journal of Raman Spectroscopy. 42, 1864-1870 (2011).
- Krafft, C., Dietzek, B., Popp, J. Raman and CARS microspectroscopy of cells and tissues. Analyst. 134, 1046-1057 (2009).
- Schenke-Layland, K. Non-invasive multiphoton imaging of extracellular matrix structures. J. Biophotonics. 1, 451-462 (2008).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены