Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
В пробирке Электропорация нижней губы Ромбическая эмбрионов мыши середине беременности
В этой статье
Резюме
Данное исследование описывает развитие В пробирке Электропорации метод, который позволяет для манипуляций экспрессии генов в нижней губе ромбической середине беременности эмбрионов.
Аннотация
The rhombic lip is an embryonic neuroepithelium located in the hindbrain at the junction between the neural tube and the roofplate of the fourth ventricle (reviewed in 1). The rhombic lip can be subdivided into the upper rhombic lip (URL) which encompasses rhombomere 1 (r1) and generates neurons of the cerebellum and the lower rhombic lip (LRL) which gives rise to diverse neuronal brainstem lineages 2-4. LRL derivatives include the auditory neurons of the cochlear nuclei and those of the precerebellar nuclei that are involved in regulating balance and motor control 5-8. Neurogenesis from the LRL occurs over a large temporal window that encompasses embryonic days (E) 9.5-16.55, 9. Different neuronal lineages emerge from the LRL as postmitotic cells (or are born) during distinct developmental days during this neurogenic window.
Electroporation of gene expression constructs can be used to manipulate gene expression in LRL progenitors and can potentially change the fate of the neurons produced from this region 10-12. Altering gene expression of LRL progenitors in the mouse via in utero electroporation has been highly successful for manipulating lineages born on embryonic day E12.5 or later 10, 12-14. In utero electroporations prior to E12.5 have been unsuccessful primarily due to the lethality associated with puncturing the fourth ventricle roofplate, a necessary step in delivering exogenous DNA that is electroporated into the LRL. However, many LRL derived lineages arise from the LRL earlier than E12.5 9. These earlier born lineages include the neurons that comprise the lateral reticular, external cuneate, and inferior olivary nuclei of the precerebellar system which function to connect inputs from the spinal cord and cortex to the cerebellum 5. In order to manipulate expression in the LRL of embryos younger than E12.5, we developed an in vitro system in which embryos are placed into culture following electroporation.
This study presents an efficient and effective method for manipulating the gene expression of LRL progenitors at E11.5. Embryos electroporated with green fluorescent protein (GFP) driven from the broadly active CAG promoter reproducibly expressed GFP after 24 hours of culture. A critical aspect of this assay is that gene expression is only altered because of the expression of the exogenous gene and not because of secondary effects that result from the electroporation and culturing techniques. It was determined that the endogenous gene expression patterns remain undisturbed in electroporated and cultured embryos. This assay can be utilized to alter the fate of cells emerging from the LRL of embryos younger than E12.5 through the introduction of plasmids for overexpression or knock down (through RNAi) of different pro-neural transcription factors.
протокол
1. Подготовка Перед Электропорация
- Усилить ДНК для электропорации на макси приготовительный (премьер-It или Qiagen). Концентрация ДНК должна быть не менее 1 мг / мл для эффективного поглощения.
- Удалить 495 мкл ДНК и смешайте с 5 мкл 0,01% Быстрый зеленый в 1 X PBS (фосфатный буферный раствор) в микроцентрифуге трубку.
2. Эмбриональные урожая
- Создание приурочено вязки из CD-1 мышей (Харлан). Проверьте наличие вагинальной пробки и считают датой вагинальный вилка наблюдается эмбриональный день (E) 0.5. Эмбрионы будут собраны 11 дней после визуализации плагин (E11.5).
- Поместите стерилизовать инструменты в 70% этаноле. Лечить капот ламинарного потока УФ-светом, по крайней мере за час до использования. Спрей капюшоном, рассекая лоток и рассекает область с 70% этанола. Разогреть 1 X PBS до 37 ° C.
- На E11.5 усыпить женщина в соответствии с условиями, утвержденными в ИнститутеРациональная Комитета по уходу и использованию животных (ICCUA). Место вскрытия лоток в ламинарном боксе. Спрей вниз живота женщины с 70% этанола.
- Откройте в брюшную полость и прикрепить к стенам рассечения лоток. Вытяните рога матки, так что она покоится в брюшную полость.
- Аккуратно разрезать стену рога матки. Используйте 20 мм ложка (Fine научно Tools), чтобы мягко удалить эмбрион в желточный мешок от плаценты. Место эмбрионов в 100 мм блюдо культуры ткани заполнено 10 мл стерильной 1 X PBS, которая подогревается в 2.2.
- Повторите эти действия для всех эмбрионов настоящее время.
3. Электропорация эмбрионов E11.5 (рис. 1)
- Использование 20 мм ложкой, передавать первый зародыш нового 100 мм блюдо заполнено 10 мл стерильной 1XPBS, который нагревается до 37 ° C.
- Используйте пинцет 11 см с 0,05 х 0,02 мм наконечник (Fine Научные инструменты) тщательно повторнодвигаться и отказаться от желтка.
- Позиция эмбрион так, что его спинной стороной вверх так, что он похож на мультфильм на рисунке 1а. Используйте 7 мм электрод весла (Harvard аппарата) аккуратно провести эмбриона. Электроды должны быть расположены по обе стороны нервной трубки на уровне заднего мозга четвертого желудочка. Желудочек видна невооруженным глазом, но с помощью вскрытия микроскоп может способствовать точного размещения весло. Позиционирование весла имеет решающее значение для определения области, который получает электропорации ДНК. Если нижняя губа ромбическая (НПН) спинного эмбриональных задний мозг желательно, весла должна быть местом, что они непосредственно фланговые самой широкой части четвертой открытия желудочка.
- Используйте 1 мл шприц, чтобы составить плазмидной ДНК смешивается с 0,01% Быстрый зеленый. 500 мкл смеси должна быть достаточной для электропорации по крайней мере, 8-10 эмбрионов (см. 3.5).
- Аккуратно проколите roofplate овerlying четвертого желудочка с 25G 5/8 туберкулин иглы прикреплен к 1 мл шприц и ввести ДНК-краситель смесь в желудочке. Успешное инъекций характеризуется ДНК-краситель смесь заполнение всей системы желудочков (рис. 1в). Количество ДНК-краситель смесь обычно вводят менее 50 мкл. Точные суммы переменных между эмбрионами, так как часть смеси, как правило, утечка из желудочка в PBS окружающих эмбрион. Альтернативный способ доставки ДНК-краситель смесь будет через доступ к желудочковой системы выкалыванием парус покрывающей мозга. Опять же, успешный инъекций характеризуется ДНК-краситель смесь заполнение всей системы желудочков.
- Доставка пяти квадратных импульсов с помощью электрического генератора импульсов (BTX) и 7 лопастей мм электрод. Каждый импульс 50 В длительностью 5 мс на импульс 500 мс между каждым импульсом. Ткани ближе к положительно заряженному электроду будет то TakЕ до плазмиды.
4. Культура эмбрионов
- В ламинарном боксе, заполните внешней лунки 12-луночного культуры блюдо с 2 мл DMEM/F12 среде с добавлением 10% эмбриональной телячьей сыворотки, 5% лошадиной сыворотки, 1% глутамина, 1% пенициллин / стрептомицин, который подогревается до 37 ° C. Культура условия были адаптированы с Диего и его коллеги 15.
- В ламинарного потока капот щепотку эмбрионов на миделе (до сердца) щипцами и удалить задней части эмбриона. Поместите переднюю часть в одном из заполненных ям 12 и культура блюдо.
- Повторите эти действия для всех эмбрионов. Заполните только внешний скважин 12-луночного планшета, чтобы избежать загрязнения культур.
- Культура эмбрионов в 37 ° C инкубатор с 5% CO 2. Выражение электропорации плазмиды должны наблюдаться в течение 24 часов.
- Если больше культуры раз лучшего, заполнить из скважины нового 12-луночный планшет с 2 млсредства массовой информации используются в 4.1. С стерилизованной ложкой передачи эмбрионов и в новой пластинке. Положите обратно в 37 ° C инкубатора. Культуры до 48 часов возможно.
- Когда желаемая культуры время будет достигнута, исправить эмбрионов для анализа (см. ниже).
5. Подготовка эмбрионов для анализа
- Промойте эмбрионы в 1 X PBS при 4 ° С в течение пяти минут. Повторите.
- Исправить эмбрионы на анализ в 2% параформальдегида (PFA) в 1XPBS в течение 2 часов при температуре 4 ° C.
- Промойте эмбрионы в 1 X PBS при 4 ° С в течение пяти минут. Повторите.
- Равновесие эмбрионов в 30% сахарозы в 1 X PBS в течение ночи при 4 ° C.
- Вставить эмбрионов в Оптимальная температура резания (ОКТ) соединения с использованием сухого льда / этанол ванну. Эмбрионы могут храниться при температуре -20 ° C.
- Раздел эмбрионов на криостат (Leica) в 30 мкм разделы и смонтировать на слайдах (VWR, SuperFrost Plus). Хранить при температуре -20 ° C.
6. ИммунитетАнализ nohistochemistry
- Иммуногистохимическое проводили, как описано в 16. Первичное разведение антител для исследования включают кролика α-GFP (Invitrogen) 1:2500; мышь α-Mash1 (BD Biosciences) 1:100; кролика α-Ngn1 (Jane Johnson) 1:5000; кролика α-Ptf1a (Джейн Джонсон ) 1:2500; кролика Math1 (Jane Johnson) 1:100. Инкубировать слайд квартиры, образец вверх на лоток окрашивания при температуре 4 ° С в течение ночи.
- Слайды были проанализированы на сложный микроскоп (Olympus BX51).
7. Представитель Результаты
Схема на рисунке 1а изображен электропорации эксперимента. Рисунок 1B показывает сагиттальный вид эмбриона E11.5 до манипуляции. То же эмбрион после введения плазмиды, содержащей CAG :: GFP в 0,01% Быстрый зеленый показано на рисунке 1С, а также представитель незаписанных эмбриона выставке одностороннем GFPвыражение в спинном задний мозг 24 часа в сутки следующие культура показана на рис 1D. Протяженность области LRL, успешно электропорации является переменной и, похоже, сильно зависит от расположения электродов. В наших исследованиях было установлено, что 52 из 65 (80%) электропорации эмбрионы успешно выразил GFP. Ткань была сочтена успешной электропорации, если он был положительным для GFP в локализованных областях в течение нескольких разделов после записи и иммуногистохимического анализа (см. ниже). Эмбрионы, которые не отвечают этим критериям оценивались как неудачные попытки электропорации.
Дальнейшая оценка эффективности электропорации может быть установлена путем проведения иммуногистохимии против GFP на поперечных сечений электропорации эмбрионов на уровне четвертого желудочка. На рисунке 2 показан представитель серийных срезов из эмбриона отображения односторонниеGFP выражении. Рисунок 2А показывает идеализированную схему, которая иллюстрирует, что в левой части зародыша к положительному электроду. Поперечные сечения (на уровне представлены к середине мультфильма Рисунок 2А) выявить локализованные выражения GFP исключительно на левой стороне заднего мозга ткани (рис. 2С и 2D). Электропорации области LRL не распространяется весь передне-задней оси нервной трубки, как изучение разделов 300 мкм ростральной или больше, показанной на рис 2С не выражает GFP (рис. 2В).
Полезность этого анализа для манипуляций экспрессии генов зависит от стабильности выражения доменов эндогенных белков. LRL был охарактеризован как обладающий уникальными области предшественников характеризуется дифференциальным выражением proneural транскрипционных факторов (см. обзор 1).Некоторых из этих факторов (Mash1, Math1, Ngn1 и Ptf1a) были выбраны для анализа в связи с их предлагаемых и / или характеризуется роль в спецификации precerebellar нейронных подтипов в LRL, предмет будущих исследований 16-18. Все четыре белки имеют очень характерное выражение в области хвостового задний мозг на E11.5 16-18. Мы заметили, что эмбрионы, которые были размещены культуры удалось увеличить в размерах и также не смогли начать производство сосудистое сплетение эпителия и инвагинации LRL и roofplate, морфологических событий, которые происходят между E11.5 и E12.5 5. На основании этих наблюдений было установлено, что нормальное развитие в этих эмбрионов был остановлен или грубой задержкой и сопоставимых управления культурным эмбрионы должны быть некультурным эмбрионов на E11.5.
Для того, чтобы культура и электропорации не беспокоить уровни эндогенных белков, мы проанализировали четыре различных белков immunohistochemistry (IHC) в 34 различных эмбрионов, которые были электропорации и культурный, по крайней мере 24 часов. В таблице приведено количество эмбрионов проанализированы для каждого маркера и процент эмбрионов проанализированы, которые сохранили нормальный уровень белка. На рисунке 3 показан представитель IHC данных из двух белков проанализированы Mash1 (рис. 3A и 3B) и Math1 (рис. 3C и 3D). Мы заметили, что большинство эмбрионов сохранить нормальный уровень экспрессии после электропорации и культуры (рис. 3B и 3D) по сравнению с контролем эмбрионов на E11.5 (рис. 3А и 3С). Важно отметить, что характеристика областей экспрессии этих белков не возмущается.
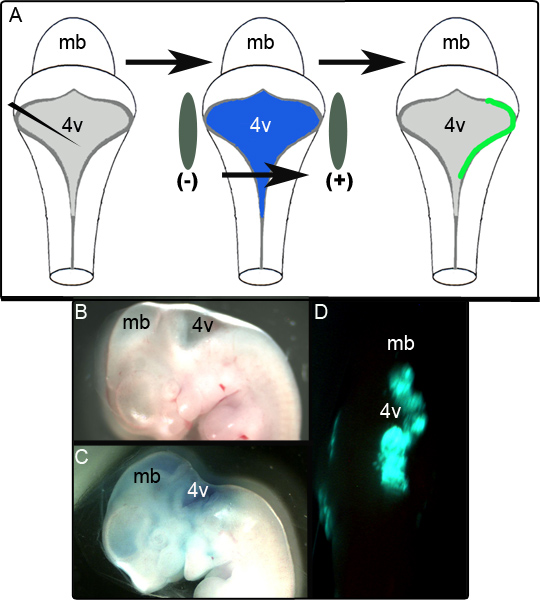
Рисунок 1. Электропорация эмбрионов в E11.5. (А) Схема йЭксперимент электронной электропорации. E11.5 эмбриона выделяют и выражения плазмиды в 0,01% Быстрый зеленый вводится в четвертый желудочек. Эмбрион, то в окружении электрод весла и подвергается 50 V импульса до того, как помещается в культуре (B) Сагиттальный зрения эмбриона E11.5 перед инъекцией. (C) E11.5 же эмбрион после введения плазмиды в 0,01% Быстрый зеленый. (D) Односторонние выражение задний мозг из GFP наблюдали в зародыше E11.5 после 24 часов культуры. MB-мозга; 4v четвертый желудочек.
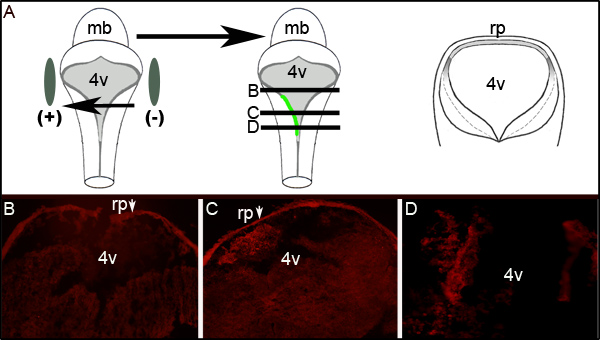
Рисунок 2. Экспрессия GFP в электропорации тканей. (A) мультфильм слева изображен размещения электродов вокруг эмбриона E11.5. Средние мультфильм изображает поглощение и экспрессия GFP плазмида кодирования на левой стороне зародыша. Мультфильм по праву является схема идеализированный поперечного сечения, сделанные через эмбрион на лEvels обозначаются черными линиями в середине мультфильма. (B-D) для иммуногистохимического GFP на поперечных срезах через электропорации эмбриона E11.5 после 24 часов культуры. Стрелки указывают на roofplate (РП), который задерживает вторичными антителами. Изображения, принятые на 10-кратным увеличением. Относительные уровни разделах показано изображены горизонтальные линии через середину мультфильма в (A). MB-мозга; л 4v четвертый желудочек; RP-roofplate.
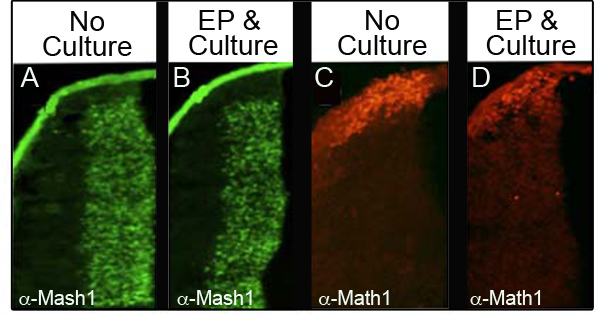
Рисунок 3. Экспрессия эндогенных белков в Нижнем Ромбическая губ Immunohistochemistry для Mash1 (А и В) или Math1 (C и D) по сравнению поперечном сечении эмбрионов E11.5, которые не были культурными (A, C) с эмбрионами, которые были электропорации с CAG.: : GFP и культивировали в течение 24 ч (B и D). Изображения, полученные в 10-кратным увеличением.
| Proneural Transcriptiна фактор Проанализированы | Количество эмбрионов Проанализированы | Процент сохранение нормальной структуре выражения |
| Math1 | 15 | 86,7% |
| Mash1 | 12 | 83,3% |
| Ngn1 | 7 | 71,4% |
| Ptf1a | 6 | 100% |
Таблица I. Процент электропорации и искусственного Эмбрионы сохранение нормального Proneural фактора транскрипции доменов в LRL.
Обсуждение
В пробирке электропорации техники, представленные в данном исследовании является новой методологии, которая может быть эффективно использован для управления экспрессией генов в эмбрионах моложе 12 дней беременности. Размещение эмбрионов в культуре позволяет выражение гена и об?...
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Авторы хотели бы поблагодарить Джейн Джонсон Math1, Ngn1 и Ptf1a антител и Конни Cepko для pCAG :: GFP плазмиды. Эта работа финансировалась NIH R15 1R15HD059922-01.
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента | Компания | Номер по каталогу | Комментарии (опционально) |
| Криостат | Leica | CM-1850 | |
| Biologie кончик Dumoxel лечение DUMONT щипцы | Изобразительное научных инструментов | 11252-30 | |
| 20 мм MORIA перфорированной ложкой | Изобразительное научных инструментов | 10370-17 | |
| ECM 830 квадратных волна Электропорация генератор | BTX (VWR) | 47745-928 | |
| Гарвардский Аппарат 7 мм Tweezertrodes * Электроды | BTX (Фишер) | BTX450165 | |
| Фишер Isotemp CO 2 инкубатор | Рыбак | 1325525 | |
| NAPCO CO 2 газового регулятора | Рыбак | 15497020 | |
| 12 луночных культуры тканей | BD Falcon (Фишер) | 877229 | |
| Hyclone жидких сред DMEM/F-12 (1:1), с L-глютамин и HEPES, 500 мл | Thermo Scientific (Фишер) | SH3002301 | |
| Hyclone * Доноры лошадей сыворотки | Thermo Scientific (Фишер) | SH3007402 | |
| Эмбриональной телячьей сыворотки, квалифицированные, тепло инактивированная | Invitrogen | 16140-063 | |
| CellGro * 10000 МЕ пенициллин, 10000 мкг / мл стрептомицина | Mediatech (Фишер) | MT-30-002-ДИ | |
| Hyclone * L-глютамин L-глютамина, 200mm в 0,85% NaCl | Thermo Scientific (Фишер) | SH3003401 | |
| Быстро-зеленый | Рыбак | AC41053-0250 | 0,01% |
Ссылки
- Ray, R. S., Dymecki, S. M. Rautenlippe Redux -- toward a unified view of the precerebellar rhombic lip. Current opinion in cell biology. 21, 741-747 (2009).
- Machold, R., Fishell, G. Math1 is expressed in temporally discrete pools of cerebellar rhombic-lip neural progenitors. Neuron. 48, 17-24 (2005).
- Wingate, R. J. The rhombic lip and early cerebellar development. Curr. Opin. Neurobiol. 11, 82-88 (2001).
- Wingate, R. J., Hatten, M. E. The role of the rhombic lip in avian cerebellum development. Development (Cambridge, England). 126, 4395-4404 (1999).
- Altman, J., Bayer, S. A. . Development of Cerebellar System: In relation to its evolution, structure, and function. , (1997).
- Farago, A. F., Awatramani, R. B., Dymecki, S. M. Assembly of the brainstem cochlear nuclear complex is revealed by intersectional and subtractive genetic fate maps. Neuron. 50, 205-218 (2006).
- Wang, V. Y., Rose, M. F., Zoghbi, H. Y. Math1 expression redefines the rhombic lip derivatives and reveals novel lineages within the brainstem and cerebellum. Neuron. 48, 31-43 (2005).
- Rodriguez, C. I., Dymecki, S. M. Origin of the precerebellar system. Neuron. 27, 475-486 (2000).
- Taber-Pierce, E. Histogenesis of the nuclei griseum ponitis, corporis pontobulbaris and reticularis tegmenti pontis (bechterew) in mouse. J. Comp. Neurol. 126, 219-240 (1966).
- Dipietrantonio, H. J., Dymecki, S. M. Zic1 levels regulate mossy fiber neuron position and axon laterality choice in the ventral brain stem. Neuroscience. 162, 560-573 (2009).
- Takahashi, M., Sato, K., Nomura, T., Osumi, N. Manipulating gene expressions by electroporation in the developing brain of mammalian embryos. Differentiation. 70, 155-162 (2002).
- Taniguchi, H., Kawauchi, D., Nishida, K., Murakami, F. Classic cadherins regulate tangential migration of precerebellar neurons in the caudal hindbrain. Development (Cambridge, England). 133, 1923-1931 (2006).
- Kawauchi, D., Taniguchi, H., Watanabe, H., Saito, T., Murakami, F. Direct visualization of nucleogenesis by precerebellar neurons: involvement of ventricle-directed, radial fibre-associated migration. Development (Cambridge, England). 133, 1113-1123 (2006).
- Okada, T., Keino-Masu, K., Masu, M. Migration and nucleogenesis of mouse precerebellar neurons visualized by in utero electroporation of a green fluorescent protein gene. Neuroscience research. 57, 40-49 (2007).
- de Diego, I., Kyriakopoulou, K., Karagogeos, D., Wassef, M. Multiple influences on the migration of precerebellar neurons in the caudal medulla. Development (Cambridge, England). 129, 297-306 (2002).
- Landsberg, R. L. Hindbrain rhombic lip is comprised of discrete progenitor cell populations allocated by Pax6. Neuron. 48, 933-947 (2005).
- Hoshino, M. Ptf1a, a bHLH transcriptional gene, defines GABAergic neuronal fates in cerebellum. Neuron. 47, 201-213 (2005).
- Yamada, M. Origin of climbing fiber neurons and their developmental dependence on. Ptf1a. J. Neurosci. 27, 10924-10934 (2007).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены