Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Производство лентивирусов векторов для трансдукции клетки из центральной нервной системы
В этой статье
Резюме
В этом протоколе описываются производства, очистки и титрования лентивирусов векторов. Мы приведем пример того, лентивирусов вектор-опосредованной доставки генов в первичных культивируемых нейронов и астроцитов. Наши методы могут применяться и к другим типам клеток В пробирке И В естественных условиях.
Аннотация
Efficient gene delivery in the central nervous system (CNS) is important in studying gene functions, modeling neurological diseases and developing therapeutic approaches. Lentiviral vectors are attractive tools in transduction of neurons and other cell types in CNS as they transduce both dividing and non-dividing cells, support sustained expression of transgenes, and have relatively large packaging capacity and low toxicity 1-3. Lentiviral vectors have been successfully used in transducing many neural cell types in vitro 4-6 and in animals 7-10.
Great efforts have been made to develop lentiviral vectors with improved biosafety and efficiency for gene delivery. The current third generation replication-defective and self-inactivating (SIN) lentiviral vectors are depicted in Figure 1. The required elements for vector packaging are split into four plasmids. In the lentiviral transfer plasmid, the U3 region in the 5' long terminal repeat (LTR) is replaced with a strong promoter from another virus. This modification allows the transcription of the vector sequence independent of HIV-1 Tat protein that is normally required for HIV gene expression 11. The packaging signal (Ψ) is essential for encapsidation and the Rev-responsive element (RRE) is required for producing high titer vectors. The central polypurine tract (cPPT) is important for nuclear import of the vector DNA, a feature required for transducing non-dividing cells 12. In the 3' LTR, the cis-regulatory sequences are completely removed from the U3 region. This deletion is copied to 5' LTR after reverse transcription, resulting in transcriptional inactivation of both LTRs. Plasmid pMDLg/pRRE contains HIV-1 gag/pol genes, which provide structural proteins and reverse transcriptase. pRSV-Rev encodes Rev which binds to the RRE for efficient RNA export from the nucleus. pCMV-G encodes the vesicular stomatitis virus glycoprotein (VSV-G) that replaces HIV-1 Env. VSV-G expands the tropism of the vectors and allows concentration via ultracentrifugation 13. All the genes encoding the accessory proteins, including Vif, Vpr, Vpu, and Nef are excluded in the packaging system. The production and manipulation of lentiviral vectors should be carried out according to NIH guidelines for research involving recombinant DNA (http://oba.od.nih.gov/oba/rac/Guidelines/NIH_Guidelines.pdf). An approval from individual Institutional Biological and Chemical Safety Committee may be required before using lentiviral vectors. Lentiviral vectors are commonly produced by cotransfection of 293T cells with lentiviral transfer plasmid and the helper plasmids encoding the proteins required for vector packaging. Many lentiviral transfer plasmids and helper plasmids can be obtained from Addgene, a non-profit plasmid repository (http://www.addgene.org/). Some stable packaging cell lines have been developed, but these systems provide less flexibility and their packaging efficiency generally declines over time 14, 15. Commercially available transfection kits may support high efficiency of transfection 16, but they can be very expensive for large scale vector preparations. Calcium phosphate precipitation methods provide highly efficient transfection of 293T cells and thus provide a reliable and cost effective approach for lentiviral vector production.
In this protocol, we produce lentiviral vectors by cotransfection of 293T cells with four plasmids based on the calcium phosphate precipitation principle, followed by purification and concentration with ultracentrifugation through a 20% sucrose cushion. The vector titers are determined by fluorescence- activated cell sorting (FACS) analysis or by real time qPCR. The production and titration of lentiviral vectors in this protocol can be finished with 9 days. We provide an example of transducing these vectors into murine neocortical cultures containing both neurons and astrocytes. We demonstrate that lentiviral vectors support high efficiency of transduction and cell type-specific gene expression in primary cultured cells from CNS.
протокол
1. Упаковка лентивирусов векторов
Лентивирусов векторов производятся котрансфекции из лентивирусов вектор передачи и другие плазмиды, необходимые для упаковки в 293T клеток кальцием метод трансфекции фосфатом. Мы используем 10 100-мм культуры тканей блюда в этом протоколе. Он может быть увеличен или уменьшен в зависимости от приложения. 293T клеточной линии сохраняется в модифицированной орлы Дульбекко среде (DMEM) с высоким содержанием глюкозы (4500 мг / л), с добавлением 10% эмбриональной телячьей сыворотки (FBS), 100 ед / мл пенициллина, 100 мкг / мл стрептомицина в 37 ° C инкубаторе с 5% CO 2.
- Семенной 293T клеток на 30-40 слияния% до 10 100-мм культуры тканей блюд (3 х 10 6 клеток / блюдо) в культуральной среде. Вернуться клетки инкубатора.
- После 20-24 ч культуре, проверьте плотность клеток. Клетки должны быть около 80% слияния во время трансфекции.
- Подготовьте 50 мл трубку. Добавить 4,4 мл TE79/10 (1 мМ TrisHCl, 0,1 мМЭДТА, рН 7,9) за вычетом общего объема следующие плазмидной ДНК. Добавить 100 мкг лентивирусов передача плазмиды (рис. 1), 58 мкг pMDLg / pRRE 31 мкг pCMV-G, 25 мкг pRSV-Rev, 600 мкл 2М CaCl 2. Аккуратно перемешайте.
- Подготовка еще 50 мл трубку. Добавьте 5 мл 2x HBS (0,05 М HEPES, 0,28 М NaCl, 1,5 мМ Na 2 HPO 4, рН 7.12).
- Возьмите ДНК-CaCl 2 смеси 10 мл пипетки и добавить в пробирку с 2 х HBS, по каплям при встряхивая трубку.
- Держите осадков реакции при комнатной температуре (RT) в течение 30 мин.
- Удалить культуры блюда из инкубатора. Смешать осадков реакции хорошо встряхивая. Добавьте 1 мл суспензии на каждые 100 мм блюдо содержащих клетки. Подвеска должна быть добавлена медленно, по капле, осторожно вращая среды в блюдо. Возвращение этих блюд в инкубатор и оставить на 5 часов.
- Удаление среды от культуры. Добавить 6 мл свежей питательной среде, содержащей 6 ммоль натрия буtyrate к каждому блюду. Вернуться культуры в инкубатор. После ночной культуры, если есть люминесцентные репортером в конструкцию, проверьте выражение гена-репортера под флуоресцентным микроскопом. Как правило, более 80% клеток выразить ген-репортер, если это обусловлено повсеместным промоутер (например, ЦМВ промотор).
- Через два дня (40-44 ч) после трансфекции, собирают супернатант из 10 блюд на 2 50 мл пробирки (около 30 мл каждая трубка). Замораживание супернатант в -80 ° C морозильник или перейти к следующему шагу.
2. Концентрация и очистка векторы
- Центрифуга недавно собранных или талой супернатант на 900 г (около 2000 оборотов в минуту) в течение 10 минут, чтобы удалить все клетки мусора в супернатант.
- Прикрепите 60-мл шприц 0,2-мкм фильтр SFCA шприц. Передача супернатант из 50 мл трубки шприц. Фильтр супернатант в пробирку центрифуги polyallomer.
- Возьмите 5 мл 20% сахарозы (подготовлен в PBS) в 5 мл пипетки. Вставитьпипетки на дно пробирки, содержащие центрифуги супернатант. Медленно добавить раствор сахарозы в соответствии с вектором супернатант. Повторите эти действия для супернатант из другой трубы.
- Центрифуга супернатанта в 11 000 оборотов в минуту и 4 ° C в течение 4 часов с Beckman ЮЗ28 качели ротора.
- Удалить супернатант. Добавить 150 мкл 4% лактозы (подготовлен в PBS) для каждой центрифуге трубки. Ресуспендируют гранул.
- Передача концентрированной вектор из всех пробирок на 1,5 мл трубки. Оставьте пробирку на льду в течение 15 мин.
- Смешать вектор подвески с помощью пипетки. Спина с микроцентрифужных на полной скорости (около 16000 г) в течение 1 мин.
- Передача супернатант в новую 1.5-мл трубку. Разделите окончательного образца в 20 мкл аликвоты и хранить их в -80 ° C морозильник.
3. Титрование векторы
- Семенной 5 х 10 4 / лунку HT1080 клеток в 12-луночного планшета в 1 мл DMEM среде с 10% ЭТС.
- После overnigHT культуры, рассчитывать клеток из одной ямы и набрать номер ячейки.
- Сделайте 5 раз серийного разведения (1:5, 1: 25; 1:125 и 1:625) концентрированного вектор с питательной среде. Добавить I мкл каждого разведенного вектор отдельных скважин. Образцы могут быть продублированы для повышения точности.
- Добавить 1 мкл 4 мг / мл Polybrene (Hexadimethrine метила) в каждой лунке, содержащей вектор и в и без вектора. Перемешайте, осторожно встряхивая пластины. Вернуться в инкубаторе в течение 48 часов.
- Удаление среды из скважин культуре клеток. Промыть каждую лунку с PBS. Добавить 250 мкл 1x трипсина-EDTA решение клеток. Когда клетки отделяются (3-5 мин), добавить 1 мл культуральной среды. Ресуспендируют клеток с помощью пипетки. Передача клеточной суспензии в пробирки на 1,5 мл центрифугу.
- Центрифуга в 900 г в течение 6 мин. Для векторов с люминесцентными гена-репортера (например, GFP), переходите к пункту 3.7 для анализа FACS. Для векторов, не репортер, переходите к пункту 3.8 для реального КПЦР времени.
- Для векторов, содержащих флуоресцентныеrescent гена-репортера, удалите супернатант и ресуспендируют осадок 300 мкл 3,7% формальдегида в PBS. Определить процент репортер положительных клеток на основе анализа FACS. Титр будут представлены как трансдукция единиц на миллилитр концентрированной вектор (TU / мл).
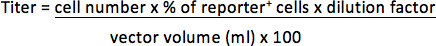
Например, если 1 х 10 5 клеток трансдуцированных с 1/25 мкл (0,04 мкл) вектора и 30% клеток репортер положительный, титр будет:
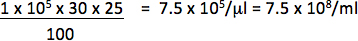
Используйте только разведения попадают в линейной зависимости между процентом положительных клеток и количество векторных добавил рассчитать титр. Окончательный титр должна быть в среднем титр получить преобразователями, по крайней мере 2 различных количеств вектора.
- Для векторов безфлуоресцентный ген репортер, извлечения геномной ДНК из клеток с использованием HT1080 QIAamp ДНК Mini Kit (Qiagen) в соответствии с протоколом производителя. Усиление вектор последовательности геномной ДНК с использованием ABI Prism 7000 Detection System (Applied Biosystems) с праймерами (ВИЧ-1 PBS / дюйм регион 17) 5'-CCGTTGTCAGGCAACGTG-3 'и 5'-AGCTGACAGGTGGTGGCAAT-3 », и TaqMan зонда 5 '-FAM-AGCTCTCTCGACGCAGGACTCGGC-TAMRA-3'. Альбумин ген, который является одним копий гена в геноме (2 экз / клетка) также усиливается с праймерами 5'-TGAAACATACGTTCCCAAAGAGTTT-3 'и 5'-CTCTCCTTCTCAGAAAGTGTGCATAT-3 », и зонд 5'-FAM-TGCTGAAACATTCACCTTCCATGCAGA-TAMRA-3 », как внутренний контроль. Определить копию количество векторных и альбумина методом ПЦР в 96-луночного планшета в соответствии с инструкцией завода-изготовителя со следующей программой: 50 ° C в течение 2 мин, 95 ° С в течение 10 мин, 35 циклов 95 ° C в течение 15 секунд и 60 ° C в течение 2 мин. Десять раз серийные разведения плазмиды с известной концентрацией (представлены в виде копиичисло), содержащий шаблон последовательности должны быть усилены для создания калибровочной кривой для количественного определения неизвестных образцов. Титр будет представлен как интеграция единиц на миллилитр концентрированной вектор (МЕ / мл).
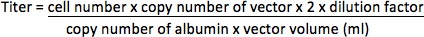
4. Трансдукции неокортекса культур
Неокортекса культур, содержащих как нейроны и клетки глии готовится из коры мыши использованием двухступенчатой процедуры покрытие, как описано выше 18. Neocortices полученные из эмбриональных мышей на 14-16 день беременности высевают на ранее установленные глиальных монослоя в MEM с добавлением 10% FBS, 20 глюкоза мм и 2 мм глютамина в 24-луночного планшета для культуры ткани.
- Через 5 дней в пробирке, добавить 10 мкМ цитозинарабинозид (Ara-C) в neocortical культуру подавлять без нейронов деление клеток. Продолжить культуре клеток в течение 2 дней.
- Теплый питательной среды в 37 ° С на водяной бане 5-10 мин. Замените Ara-C среде, содержащей свежей питательной среды (500 мкл / лунку).
- Добавить вектор желаемого МВД (кратность инфекции; отношение числа векторных частиц с числом клеток-мишеней) к культуре. Продолжить культуры в течение 24 часов. Мы используем МВД 1-10 (обычно 5) в первичных корковых культур.
- Замените культуральной среде со свежей средой. Продолжить культуры. Если есть ген-репортер в векторной конструкции, проверить клетки под флуоресцентным микроскопом через 2 дня после трансдукции. Выражение репортер ген будет виден в нейронах 2-7 после трансдукции, в зависимости от конструкции вектора и дозы используется.
5. Представитель Результаты
Титры лентивирусов векторов производится с этого диапазона протокол 10 8 -10 10 МЕ / мл, whicч предназначены для трансдукции различных типов клеток из ЦНС, как в пробирке и в естественных условиях. таблице 1 и рисунке 2 показано представитель результат с помощью векторов производства этого протокола. Мы трансдуцированных мышиный неокортекса культур лентивирусов векторов выражения зеленый флуоресцентный белок (GFP), контролируемые synapsin (SYN) промоутер или глиального фибриллярного кислого белка (GFAP) промотора. Через семь дней после трансдукции, мы провели иммунной маркировать нейроны и астроциты с анти-NeuN и анти-GFAP антителами, соответственно. Как показано в таблице 1 и на рис. 2А, после трансдукции с вектора, несущего synapsin промоутера, более 90% нейронов (NeuN + клеток), экспресс-GFP и не астроциты (GFAP + клеток) выразить это ген-репортер. Когда GFAP промоутер используется в конструкции вектор (рис. 2В), около 80% астроцитов (GFAP + клеток) выраженияс GFP, все GFP + клеток астроцитов, что подтверждается колокализации с GFAP и отсутствия GFP выражение в NeuN-меченых клеток. Эти результаты показывают, что лентивирусов векторов очень эффективны для доставки трансгенов в клетках центральной нервной системы и клеточной конкретного гена может быть достигнуто при необходимости используются промоутеров.
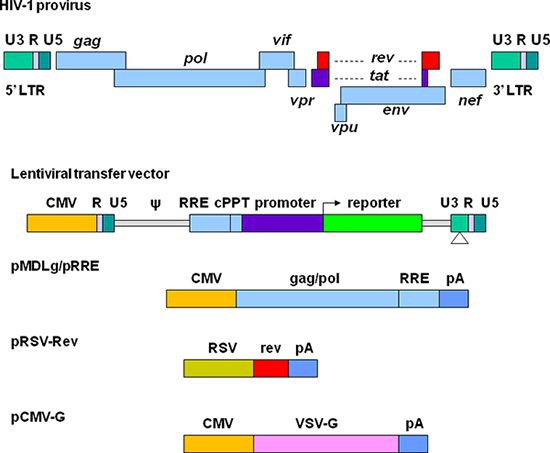
Рисунок 1. Схематическое изображение ВИЧ на основе лентивирусов векторов и упаковка плазмид. ВИЧ-1 провируса показан в верхней части. Элементы вектора производства разделены на четыре различных плазмид. Лентивирусов передачи плазмида содержит гибридный LTR 5 ', в которой U3 область заменяется цитомегаловирус (CMV), промотор упаковки сигнала (ψ), RRE последовательность, центральный тракт polypurine (cPPT), гена (например, люминесцентные репортер) вместе с промоутером выбора, и 3 'LTR, в которомцис-регуляторных последовательностей полностью удаляются из U3 региона. pMDLg / pRRE содержит кляп и пол гены и последовательности РРЭ от ВИЧ-1 под контролем промотора CMV. pRSV-Rev содержит кодирующую последовательность Rev обусловлен промоутер RSV. pCMV-G содержит VSV-G гена белка под контролем промотора CMV. PA указывает на сигнал полиаденилирования от человеческого β-глобина генов.
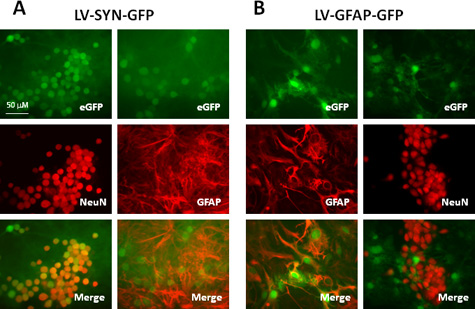
Рисунок 2. Экспрессия генов в репортер мыши неокортекса смешанной культуры трансдуцированных лентивирусов переносчиков клетки определенного типа промоутеров. Культур трансдуцированных LV-SYN-GFP () или LV-GFAP-GFP векторов (B) в МВД 5. Через семь дней после трансдукции клеток immunostained с анти-NeuN или анти-GFAP антителами. Верхняя панель показывает GFP флуоресценции, средней панели показывают, окрашивания и нижняя панели объединены изображения (GFP: зеленый; NeuN или GFAP: красный).
| Вектор | GFP + клеток в нейроны | GFP + в астроциты |
| LV-SYN-GFP | 92,2 ± 7,3 | 0 |
| LV-GFAP-GFP | 0 | 78,3 ± 11,5 |
Таблица 1. Сравнение GFP выражение в мышиных неокортекса культуры трансдуцированных лентивирусов переносчиков различных промоутеров.
мышей неокортекса культур (5 х 10 5 / и в 24-луночного планшета) были трансдуцированных LV-SYN-GFP или LV-GFAP-GFP в МВД 5. Через семь дней после трансдукции, культуры были зафиксированы и immunostained для NeuN или GFAP. Количество GFP и NeuN / GFAP выражения клетки подсчитывали в образах из 10 полей в экспериментальных условиях. Значения представляют собой процент нейронов (NeuN + клеток) илиастроциты (GFAP + клетки), которые также выразили ген GFP репортера. Значения указаны средние значения ± SD из трех независимых экспериментов.
Обсуждение
В этом протоколе, мы показали, производство лентивирусов векторов и применение этих векторов в неокортекса культур. Мы продемонстрировали эффективную и клетки определенного типа трансдукции с векторами производятся с помощью этих методов. Когда промоутер synapsin использовании GFP выраж?...
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Эта работа была поддержана NIH Neuroscience Blueprint Основные гранта (P30 NS057105, BJS) в Вашингтонском университете, Программа гранта NS032636 (BJS) и Надежда Центра неврологических расстройств.
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента | Компания | Номер по каталогу | |
| DMEM | Sigma-Aldrich | D5796 | |
| MEM | Invitrogen | 11090-081 | |
| Эмбриональной телячьей сыворотки | Hyclone | SV3001403 | |
| PBS | Mediatech | 21-040-СМ | |
| Трипсин-EDTA | Sigma-Aldrich | T3924 | |
| Бутират натрия | Sigma-Aldrich | B5887 | |
| Hexadimethrine бромид (Polybrene) | Sigma-Aldrich | H9268 | |
| 293T клеток | ATCC | CRL-11268 | |
| HT1080 клеток | ATCC | CCL-121 | |
| Сокол 100 х 20 мм ткань культурноэлектронной блюдо | BD Biosciences | 353003 | |
| 1 х 3 ½ в трубы центрифуги polyallomoer | Beckman Coulter- | 326823 | |
| 0,2-микронной шприц фильтр | Гранулирование | 431219 | |
| QIAamp ДНК Mini Kit | Qiagen | 51304 |
Ссылки
- Naldini, L. In vivo gene delivery and stable transduction of nondividing cells by a lentiviral vector. Science. 272, 263-267 (1996).
- Zufferey, R. Self-inactivating lentivirus vector for safe and efficient in vivo gene delivery. J. Virol. 72, 9873-9880 (1998).
- Davidson, B. L., Breakefield, X. O. Viral vectors for gene delivery to the nervous system. Nat. Rev. Neurosci. 4, 353-364 (2003).
- Gascon, S., Paez-Gomez, J. A., Diaz-Guerra, M., Scheiffele, P., Scholl, F. G. Dual-promoter lentiviral vectors for constitutive and regulated gene expression in neurons. J. Neurosci. Methods. 168, 104-1012 (2008).
- Hioki, H. Efficient gene transduction of neurons by lentivirus with enhanced neuron-specific promoters. Gene Ther. 14, 872-882 (2007).
- Li, M. Optimal promoter usage for lentiviral vector-mediated transduction of cultured central nervous system cells. J. Neurosci. Methods. 189, 56-64 (2010).
- Naldini, L., Blomer, U., Gage, F. H., Trono, D., Verma, I. M. Efficient transfer, integration, and sustained long-term expression of the transgene in adult rat brains injected with a lentiviral vector. Proc. Natl. Acad. Sci. U.S.A. 93, 11382-11388 (1996).
- Blomer, U. Highly efficient and sustained gene transfer in adult neurons with a lentivirus vector. J. Virol. 71, 6641-6649 (1997).
- Consiglio, A. Robust in vivo gene transfer into adult mammalian neural stem cells by lentiviral vectors. Proc. Natl. Acad. Sci. U.S.A. 101, 14835-14840 (2004).
- Jakobsson, J., Ericson, C., Jansson, M., Bjork, E., Lundberg, C. Targeted transgene expression in rat brain using lentiviral vectors. J. Neurosci. Res. 73, 876-885 (2003).
- Arya, S. K., Guo, C., Josephs, S. F., Wong-Staal, F. Trans-activator gene of human T-lymphotropic virus type III (HTLV-III). Science. 229, 69-73 (1985).
- Sirven, A. The human immunodeficiency virus type-1 central DNA flap is a crucial determinant for lentiviral vector nuclear import and gene transduction of human hematopoietic stem cells. Blood. 96, 4103-4110 (2000).
- Burns, J. C., Friedmann, T., Driever, W., Burrascano, M., Yee, J. K. Vesicular stomatitis virus G glycoprotein pseudotyped retroviral vectors: concentration to very high titer and efficient gene transfer into mammalian and nonmammalian cells. Proc. Natl. Acad. Sci. U.S.A. 90, 8033-8037 (1993).
- Farson, D. A new-generation stable inducible packaging cell line for lentiviral vectors. Hum. Gene Ther. 12, 981-997 (2001).
- Broussau, S. Inducible packaging cells for large-scale production of lentiviral vectors in serum-free suspension culture. Mol. Ther. 16, 500-507 (2008).
- Wang, X., McManus, M. Lentivirus production. J. Vis. Exp. (32), e1499 (2009).
- Sastry, L., Johnson, T., Hobson, M. J., Smucker, B., Cornetta, K. Titering lentiviral vectors: comparison of DNA, RNA and marker expression methods. Gene Ther. 9, 1155-1162 (2002).
- Snider, B. J., Lobner, D., Yamada, K. A., Choi, D. W. Conditioning heat stress reduces excitotoxic and apoptotic components of oxygen-glucose deprivation-induced neuronal death in vitro. J. Neurochem. 70, 120-129 (1998).
- Mazarakis, N. D. Rabies virus glycoprotein pseudotyping of lentiviral vectors enables retrograde axonal transport and access to the nervous system after peripheral delivery. Hum. Mol. Genet. 10, 2109-2121 (2001).
- Kato, S. Neuron-specific gene transfer through retrograde transport of lentiviral vector pseudotyped with a novel type of fusion envelope glycoprotein. Hum. Gene Ther. 22, 1511-1523 (2011).
- Segura, M. M., Garnier, A., Durocher, Y., Ansorge, S., Kamen, A. New protocol for lentiviral vector mass production. Methods Mol. Biol. 614, 39-52 (2010).
- Kutner, R. H., Puthli, S., Marino, M. P., Reiser, J. Simplified production and concentration of HIV-1-based lentiviral vectors using HYPERFlask vessels and anion exchange membrane chromatography. BMC Biotechnol. 9, 10 (2009).
- Laughlin, M. A., Chang, G. Y., Oakes, J. W., Gonzalez-Scarano, F., Pomerantz, R. J. Sodium butyrate stimulation of HIV-1 gene expression: a novel mechanism of induction independent of NF-kappa B. J Acquir Immune Defic Syndr Hum Retrovirol. 9, 332-339 (1995).
- Gasmi, M. Requirements for efficient production and transduction of human immunodeficiency virus type 1-based vectors. J. Virol. 73, 1828-1834 (1999).
- Palsson, B., Andreadis, S. The physico-chemical factors that govern retrovirus-mediated gene transfer. Exp. Hematol. 25, 94-102 (1997).
- Lizee, G. Real-time quantitative reverse transcriptase-polymerase chain reaction as a method for determining lentiviral vector titers and measuring transgene expression. Hum. Gene Ther. 14, 497-507 (2003).
- Lee, J. K., Chung, J., McAlpine, F. E., Tansey, M. G. Regulator of G-Protein Signaling-10 Negatively Regulates NF-{kappa}B in Microglia and Neuroprotects Dopaminergic Neurons in Hemiparkinsonian Rats. J. Neurosci. 31, 11879-11888 (2011).
- Shevtsova, Z., Malik, J. M., Michel, U., Bahr, M., Kugler, S. Promoters and serotypes: targeting of adeno-associated virus vectors for gene transfer in the rat central nervous system in vitro and in vivo. Exp. Physiol. 90, 53-59 (2005).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены