Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Выделение пупочной вены человека эндотелиальных клеток и их использование в изучении нейтрофилов Переселение в проточных условиях
В этой статье
Резюме
Эта статья впервые была описана процедура выделения человеческих эндотелиальных клеток из пуповинной вены, а затем показывает, как использовать эти клетки для изучения нейтрофилов переселение в проточных условиях. При использовании низкого объемного расхода камеры изготовлен из полимера с оптических характеристик стекла, живая клетка флуоресцентных изображений редких клеточных популяций также возможно.
Аннотация
Neutrophils are the most abundant type of white blood cell. They form an essential part of the innate immune system1. During acute inflammation, neutrophils are the first inflammatory cells to migrate to the site of injury. Recruitment of neutrophils to an injury site is a stepwise process that includes first, dilation of blood vessels to increase blood flow; second, microvascular structural changes and escape of plasma proteins from the bloodstream; third, rolling, adhesion and transmigration of the neutrophil across the endothelium; and fourth accumulation of neutrophils at the site of injury2,3. A wide array of in vivo and in vitro methods has evolved to enable the study of these processes4. This method focuses on neutrophil transmigration across human endothelial cells.
One popular method for examining the molecular processes involved in neutrophil transmigration utilizes human neutrophils interacting with primary human umbilical vein endothelial cells (HUVEC)5. Neutrophil isolation has been described visually elsewhere6; thus this article will show the method for isolation of HUVEC. Once isolated and grown to confluence, endothelial cells are activated resulting in the upregulation of adhesion and activation molecules. For example, activation of endothelial cells with cytokines like TNF-α results in increased E-selectin and IL-8 expression7. E-selectin mediates capture and rolling of neutrophils and IL-8 mediates activation and firm adhesion of neutrophils. After adhesion neutrophils transmigrate. Transmigration can occur paracellularly (through endothelial cell junctions) or transcellularly (through the endothelial cell itself). In most cases, these interactions occur under flow conditions found in the vasculature7,8.
The parallel plate flow chamber is a widely used system that mimics the hydrodynamic shear stresses found in vivo and enables the study of neutrophil recruitment under flow condition in vitro9,10. Several companies produce parallel plate flow chambers and each have advantages and disadvantages. If fluorescent imaging is needed, glass or an optically similar polymer needs to be used. Endothelial cells do not grow well on glass.
Here we present an easy and rapid method for phase-contrast, DIC and fluorescent imaging of neutrophil transmigration using a low volume ibidi channel slide made of a polymer that supports the rapid adhesion and growth of human endothelial cells and has optical qualities that are comparable to glass. In this method, endothelial cells were grown and stimulated in an ibidi μslide. Neutrophils were introduced under flow conditions and transmigration was assessed. Fluorescent imaging of the junctions enabled real-time determination of the extent of paracellular versus transcellular transmigration.
протокол
1. Выделение и обеспечение прав сосудистых эндотелиальных клеток
- 2-го уровня биологической безопасности процедуры должны быть использованы при работе с человеческой кровью и тканями. Используя ножницы перерезали шнур из плаценты, а затем внимательно изучить шнур для сгустков крови и повреждения, вызванные пережатие пуповины во время родов. Вырезать и выбросить эти части мозга.
- Подготовить свежий раствор коллагеназы в дозе 1 мг / мл при заливке 50 мл теплой буфер шнур в трубку, которая содержит 50 мг коллагеназы.
- Изменения в стерильных перчатках и открыть лоток автоклавного документ, содержащий стерилизовать тупой канюли, шнур зажимы, ножницы, трехходовой стоп-краны и марли в ламинарном боксе.
- Определить две артерии и одна вена в настоящий мозг. Артерии имеют меньшие размеры и, как правило, плотно суженные, в то время жила большая и легко вводить иглу. Чтобы очистить кровь из вены, аккуратно канюля с двусторонним кран прилагается к нему яНТО один конец вены и местом зажима вокруг канюли, чтобы держать это твердо в позиции. Заливать шнур буфера через вену. Повторяйте, пока поток через ясна, а затем зажать конец шнура.
- Заливать коллагеназы в вену, закройте кран, поставить шнур в стакан с теплой буфер мозга и инкубировать в течение 10 минут. Через 10 минут, снимите шнур и осторожно массировать шнур, чтобы ослабить эндотелиальных клеток из просвета вены. Слейте раствор в пробирку, содержащую клетки эндотелия СМИ (ECM). Промыть шнур буфера в два раза, чтобы удалить оставшиеся клетки. Слейте раствор в этой же трубы.
- Центрифуга клеток в 350 мкг в течение 10 минут в гранулах эндотелиальных клеток.
- Удалить супернатант и добавить 10 мл ECM в осадок. Осторожно ресуспендирования клеток в ECM, а затем перенести клетки T75 колбу предварительно покрытого 0,2% желатина. Предварительное покрытие с желатина было сделано, по крайней мере 1 час при 37 ° C. Рост клеток при 37 ° С и 5% CO 2.
- На следующий день, встряхните колбу выбить любые красные кровяные клетки удалите супернатант и промыть сбалансированный солевой раствор теплой Хэнка (HBSS). Удалить HBSS и кормить клеток по 10 мл теплой ECM. Изучить клетки под микроскопом, чтобы убедиться, что красные кровяные клетки были удалены. Оцените степень слияния и морфологии клеток эндотелия. Эндотелиальных клеток на данном этапе должна быть вытянута без признаков вакуоли.
- Продолжайте менять средства массовой информации каждые три дня, пока клетки достигают слияния, а затем разделить клетки, используя 0.08% раствор трипсина содержащего 1 мМ ЭДТА. Пластина эндотелиальных клеток в нужном блюда предварительно покрытого 0,2% желатина. Клетки должны достичь слияния в 3-6 дней.
- При использовании ibidi камеры предварительного нанесения каждой камеры с 0,2% желатина. Удалите излишки желатина и фибронектина, а затем добавить 1,5 х 10 6 / мл эндотелиальных клеток, взвешенных в ECM в камеру. Изменение средств массовой информации каждый день, пока вonfluent. Клетки должны быть вырожденной в течение 2-3 дней в зависимости от питания.
2. Подготовка Нейтрофилы
- Нейтрофилы выделяли из периферической крови здорового человека добровольцев использованием плотности центрифугирования. Подробный протокол с наглядной демонстрацией выделения нейтрофилов может быть найдено в предыдущем номере журнала 6. После изолированные, нейтрофилы ресуспендируют в концентрации 1х10 6 / мл в HBSS, содержащего 0,5% альбумина человека.
3. Настройка Ibidi палаты
- Рост клеток эндотелия в желатин покрытием камеры ibidi. Проверьте их каждый день, используя микроскопии фазового контраста, пока они не стали сильно вырожденным.
- Стимулирование эндотелиальных клеток увеличить экспрессию адгезии и активации молекул. Для целей настоящего Протокола, эндотелиальные клетки стимулировали 10 нг / мл рекомбинантного ФНО-α в течение четырех часов при температуре 37 ° С и 5% CO 2 до настройки камеры ibidi для работы с изображениями в условиях кровотока.
- Подготовьте микроскоп, и шприцевой насос, как визуально описывается Визе и его коллеги 11 с использованием пустой камере ibidi.
- Основные различия между этим протоколом и Визе процедура включает предварительное заполнение трубы, чтобы предотвратить воздействие на эндотелиальные клетки в воздухе, сохраняя буфера при 37 ° C с помощью водяной бани, используя Pharmed трубку держать буфер от потери температуры и с использованием различных Цели на микроскопе в зависимости от изображения с фазового контраста и флуоресценции.
- После того, микроскоп устанавливается и трубки заполнена HBSS, закройте все краны и удалить пустые камеры ibidi.
- Подключите камеру ibidi содержащих TNF-α стимулировали эндотелиальных клеток в трубки.
4. Нейтрофилов найма и переселение
- Визуализируйте эндотелиальных монослоя клетки в microscОПЕ помощью 10x цель фазового контраста.
- Установить шприцевой насос снять и начать поток HBSS в желаемом напряжении сдвига (обычно от 0,5 до 2 дин / см 2).
- Со стороны входа, переход от HBSS в изолированных нейтрофилов (1х10 6 / мл) путем включения трехходового стоп-кран.
- Начало записи с помощью ПЗС-камеры подключены либо к записи DVD или подключается непосредственно к компьютеру. Запустите таймер, когда нейтрофилы войти в камеру. Заливать нейтрофилов в течение четырех минут. В общей сложности 3 мл нейтрофилов подвески достаточно для одного эксперимента.
- Через четыре минуты, вернуться к HBSS, чтобы предотвратить присоединение новых нейтрофилов. Если данные для общего взаимодействия, прокат и фирмы сцепление желательны, Изображение 6 случайных полей за 10 секунд, каждый из которых использует 10x цель фазового контраста между минуты 4 и 5.
- Переключитесь на 40x цель и записать одно поле зрения от 5 до 10 минут. На 10 минут, собратьмежду 5 и 10 случайных полей зрения.
- Остановить поток и перейти к следующей камере.
5. Флуоресцентные изображения в условиях кровотока Использование Ibidi палаты
- Этикетка как эндотелиальные клетки или нейтрофилов с флуоресцентный зонд интерес. Например, анти-VE-кадгерина антитела, конъюгированные с Alexa-[547] может быть использована для визуализации эндотелиальные клетки узлов.
- Соберите ibidi камеру на микроскопе с дифференциальными интерференционного контраста (DIC) и флуоресцентной возможности. Мы используем FluoView 1000 конфокальной (Olympus) с экологической палаты. Фокус использование цель предназначена для ДВС и люминесцентные работы.
- Получить одновременное ДВС и флуоресцентные изображения с помощью программного обеспечения, поставляемого продавцом в то время как в соответствии с временем Конечно, описанных в разделе 4.
6. Анализ нейтрофилов набор
- Анализ подвижного и взаимодействующих клеток описывается Визе и др. 11.
- Чтобы измерить процент нейтрофилов прокатки на эндотелиальных монослоя подсчета количества нейтрофилов, которые переехали более одной ячейки диаметром в течение 5 секунд. Разделите это число на общее число лейкоцитов в поле, чтобы определить процент подвижного клеток. В более широком смысле, остальные клетки считаются твердо приверженцем.
- Измерить скорость качения нейтрофилов путем вычисления расстояния нейтрофилов ездил в определенный период времени, а затем разделив его к тому времени в секундах.
- Переселение определяется путем подсчета количества нейтрофилов, которые изменили форму и мигрировали под монослой 10. Эти нейтрофилы определяются тем, что они меняются от того этапа, когда ярко поверх монослоя к тому, фаза темно, когда под монослой 10. Число клеток переселился может быть выражена в процентах от общего числа клеток в поле зрения или в качестве сырья онемениеэ переселился из клеток на единицу площади. В этой модели система, как правило, 50% нейтрофилов переселиться после 10 минут.
7. Представитель Результаты
Нестимулированных эндотелиальные клетки не поддерживают нейтрофилов найма. В отличие от этого, стимулируя эндотелиальные клетки с TNF-α приводит к нейтрофилов прокат, сцепление фирмы и переселение. Пример этих данных показано на рисунках 1 и 2. Рисунок 1А показывает нейтрофилов взаимодействия с TNF-α-стимулированных эндотелиальных клеток. Эти взаимодействия могут быть определены количественно, выявление общего числа нейтрофилов взаимодействия с эндотелиальных клеток, а также числа нейтрофилов прокат, твердо сторонником или переселены (рис. 2). Нейтрофилов переселение может произойти в клетке узлов или через эндотелиальные клетки сами. Чтобы различать эти два условия, эндотелиальные клетки помечены анти-VE-с adherin антител и переселение оценивается как происходящие paracellularly или transcellularly (рис. 1B и C). В этой модели, практически все это переселение трансклеточной 7.
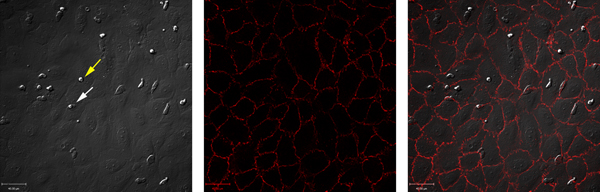
Рисунок 1. Одновременное DIC и флуоресценции в проточных условиях использования камеры ibidi. (A) DIC изображение свежевыделенных нейтрофилов человека мигрирующих через пупочной вены человека эндотелиальных клеток. Желтая стрелка показывает сторонник нейтрофилов, белая стрелка показывает, переселяющимся нейтрофилов. (B) эндотелиальных переходы клетки окрашивали анти-VE-кадгерина антитела, конъюгированные с Alexa-[547] и образ. (C) показывает наложение каналов А и В, показывая, что практически все, переселяющимся в этой модели трансклеточной. Нажмите здесь, чтобы увеличить рисунок .
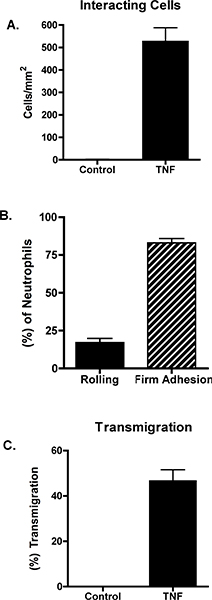
Рисунок 2. Эндотелиальные клетки остались нестимулированных или стимулировали 10 нг / мл TNF-α. Через 4 часа, параллельно камере поток пластина была собрана и нейтрофилов перфузии по состоянию на 1 дин / см 2. (A) нейтрофилов взаимодействия были рассмотрены и измеряется с помощью программного обеспечения ImageJ от НИЗ. Общая клетки взаимодействующих были охарактеризованы как (B) прокат, твердо сторонником или (C) переселяющимся. Данные представляют собой средние + SEM от 3 до 5 экспериментов. Разница между контролем и TNF в панелях и C была значимой (р <0,001).
Обсуждение
Исследователи обычно используют эндотелиальных клеток из различных сосудистых кровати для изучения нейтрофилов найма и переселение. Примеры включают, но не ограничиваясь, кожных клеток эндотелия микрососудов 12, печени синусоидальных эндотелиальных клеток 13 и эндотел...
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Мы благодарим доктора Пина Colarusso и Онлайн фонда изображений Сотовые за их помощь в визуализации и анализа изображений, г-жа Lailey ее технической помощи, а также блок 51 на Предгорья больница в Калгари, AB для обеспечения человеческой пуповины. Д-р К. Пател является Альберта инновационную: Health Solutions Scientist. Эта работа была поддержана грантом от операционной канадского института по научным исследованиям и оборудования и инфраструктуры, гранты от Канадского фонда инноваций и Альберта научно-исследовательский орган.
Материалы
| Name | Company | Catalog Number | Comments |
| Реагенты и оборудование | Компания | Номер по каталогу | Комментарии |
| Коллагеназы тип 1 | Уортингтон | 4197 | |
| Шнур буфер | Состав: 140 мм NaCl 4 мМ KCl 10 мМ D-глюкозы в 1 мМ NaH 2 PO 4 / Na 2 HPO 4 буфере при рН 7,4 | ||
| Эндотелиальная СМИ Cell (ECM) | M199 с солями Орел дополнен с 16% сыворотки крови человека, содержащий 100 единиц пенициллина 100 мкг стрептомицина и 0,3 мг L-glutamine/ml | ||
| M199 | GIBCO | 31100-035 | |
| Пенициллин Стрептомицин Глутамат (100X) | Invitrogen | 10378-016 | |
| Ibidi камеры | Ibidi | 80606 | |
| ФНО-α | Препро Tech | 300-01A | |
| Человеческий альбумин 20% раствор | Близнецы биопродуктов | 800120050 | |
| HBSS без Са 2 + и Mg 2 + | Сигма | H2487-10X | |
| HBSS с Са 2 + и Mg 2 + | Сигма | H1387-10X |
Ссылки
- Nathan, C. Neutrophils and immunity: challenges and opportunities. Nat. Rev. Immunol. 6, 173-182 (2006).
- Diacovo, T. G. Neutrophil rolling, arrest, and transmigration across activated, surface-adherent platelets via sequential action of P-selectin and the beta 2-integrin CD11b/CD18. Blood. 88, 146-157 (1996).
- Ley, K. Getting to the site of inflammation: the leukocyte adhesion cascade updated. Nat. Rev. Immunol. 7, 678-689 (2007).
- Petri, B. Endothelial LSP1 is involved in endothelial dome formation, minimizing vascular permeability changes during neutrophil transmigration in vivo. Blood. 117, 942-952 (2011).
- Chavakis, T. The junctional adhesion molecule-C promotes neutrophil transendothelial migration in vitro and in vivo. J. Biol. Chem. 279, 55602-55608 (2004).
- Oh, H., Siano, B., Diamond, S. Neutrophil Isolation Protocol. J. Vis. Exp. (17), e745 (2008).
- Liu, Y. Regulation of leukocyte transmigration: cell surface interactions and signaling events. J. Immunol. 172, 7-13 (2004).
- Alcaide, P. Neutrophil recruitment under shear flow: it's all about endothelial cell rings and gaps. Microcirculation. 16, 43-57 (2009).
- Jutila, M. A. Measurement of neutrophil adhesion under conditions mimicking blood flow. Neutrophil Methods and Protocols. 412, 239-256 (2007).
- Cuvelier, S. L., Patel, K. D. Studying leukocyte rolling and adhesion in vitro under flow conditions. Basic Cell Culture Protocols. 290, 331-342 (2005).
- Wiese, G., Barthel, S. R., Dimitroff, C. J. Analysis of Physiologic E-Selectin-Mediated Leukocyte Rolling on Microvascular Endothelium. J. Vis. Exp. (24), e1009 (2009).
- Petzelbauer, P. Heterogeneity of dermal microvascular endothelial cell antigen expression and cytokine responsiveness in situ and in cell culture. J. Immunol. 151, 5062-5072 (1993).
- Bonder, C. S., Kubes, P. Modulating leukocyte recruitment to splanchnic organs to reduce inflammation. Am J Phys - Gastrointestinal and Liver Phys. 284, G729-G733 (2003).
- Cuvelier, S. L. Eosinophil adhesion under flow conditions activates mechanosensitive signaling pathways in human endothelial cells. J. Exp. Med. 202, 865-876 (2005).
- Massia, S. P., Hubbell, J. A. Human endothelial cell interactions with surface-coupled adhesion peptides on a nonadhesive glass substrate and two polymeric biomaterials. J. Biomed. Mat. Res. 25, 223-242 (1991).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены