Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Одноместный мутагенеза бисульфит ооцитов
В этой статье
Резюме
Бисульфит мутагенеза является золотым стандартом для анализа метилирования ДНК. Наш модифицированный протокол позволяет для анализа ДНК метилирования на уровне одной клетки и была специально разработана для отдельных яйцеклеток. Она также может быть использован для расщепления стадии эмбриона.
Аннотация
Epigenetics encompasses all heritable and reversible modifications to chromatin that alter gene accessibility, and thus are the primary mechanisms for regulating gene transcription1. DNA methylation is an epigenetic modification that acts predominantly as a repressive mark. Through the covalent addition of a methyl group onto cytosines in CpG dinucleotides, it can recruit additional repressive proteins and histone modifications to initiate processes involved in condensing chromatin and silencing genes2. DNA methylation is essential for normal development as it plays a critical role in developmental programming, cell differentiation, repression of retroviral elements, X-chromosome inactivation and genomic imprinting.
One of the most powerful methods for DNA methylation analysis is bisulfite mutagenesis. Sodium bisulfite is a DNA mutagen that deaminates cytosines into uracils. Following PCR amplification and sequencing, these conversion events are detected as thymines. Methylated cytosines are protected from deamination and thus remain as cytosines, enabling identification of DNA methylation at the individual nucleotide level3. Development of the bisulfite mutagenesis assay has advanced from those originally reported4-6 towards ones that are more sensitive and reproducible7. One key advancement was embedding smaller amounts of DNA in an agarose bead, thereby protecting DNA from the harsh bisulfite treatment8. This enabled methylation analysis to be performed on pools of oocytes and blastocyst-stage embryos9. The most sophisticated bisulfite mutagenesis protocol to date is for individual blastocyst-stage embryos10. However, since blastocysts have on average 64 cells (containing 120-720 pg of genomic DNA), this method is not efficacious for methylation studies on individual oocytes or cleavage-stage embryos.
Taking clues from agarose embedding of minute DNA amounts including oocytes11, here we present a method whereby oocytes are directly embedded in an agarose and lysis solution bead immediately following retrieval and removal of the zona pellucida from the oocyte. This enables us to bypass the two main challenges of single oocyte bisulfite mutagenesis: protecting a minute amount of DNA from degradation, and subsequent loss during the numerous protocol steps. Importantly, as data are obtained from single oocytes, the issue of PCR bias within pools is eliminated. Furthermore, inadvertent cumulus cell contamination is detectable by this method since any sample with more than one methylation pattern may be excluded from analysis12. This protocol provides an improved method for successful and reproducible analyses of DNA methylation at the single-cell level and is ideally suited for individual oocytes as well as cleavage-stage embryos.
протокол
День 1
Подготовьте следующие решения свежий в день яйцеклетки коллекции стерильной дистиллированной воды, таких как вода GIBCO. Чтобы снизить вероятность загрязнения ДНК, изменить перчатки часто и использовать фильтр советы. Хранить трубы под углом же, когда открыты, и резюмировать все трубы, когда они не используются. Мы рекомендуем, что решения принимаются, как N +1.
3% агарозном LMP
30 мг низкую температуру плавления (LMP) агарозном
до 1 мл GIBCO H 2 O
растворяют при 70 ° C
Лизис решения
8 мкл буфера для лизиса
1 мкл протеиназы К
1 мкл 10% Igepal
место на льду, пока готов к использованию
2:01 агарозы: Лизис решения (10 мкл в отдельные ооциты, сумма составляет 3 ооцитов)
20 мкл 3% агарозном LMP
10 мкл Решение Лизис
смешивать при 70 ° C
SDS LySIS буфера (501 мкл на отдельные ооциты)
| 1x TE рН 7,5 | 450 мкл |
| 10% SDS | 50 мкл |
| Протеиназы K | 1 мкл |
| 501 мкл |
1. Коллекция ооцитов
- Поместите мышь расчлененный яйцеводы в М2 средства массовой информации, и разорвать ампулы для извлечения комплекса кучевые клетки.
- Отделите от ооцитов комплекса кучевые ячейки с помощью 0,3 мг / мл в растворе гиалуронидазы 30 мкл капли M2 СМИ. Держите ооцитов в раствор до тех пор, как он принимает, чтобы удалить клетки кумулюса, как длительное воздействие может повредить их. Промойте ооциты 3 раза в 30 мкл капли M2 средств массовой информации, удаление клеток кумулюса периодически.
- Удалить зона pellucida использовании решение кислой Тирода. Поместите ооцитов в одном 30 мкл каплю раствора, а затем передать еще 30мкл капли, как и любые средства массовой информации осуществляется по будет разбавить кислоту и снижая ее эффективность. Держите ооцитов в раствор до тех пор, как он принимает, чтобы удалить зона, так как длительное воздействие может повредить их. Примечание: повышение концентрации раствора кислой Тирода или проназой могут быть использованы для человека образцов, как человеческая зона pellucida более устойчивы к лечению раствором кислого Тирода, чем мышь.
- Промойте ооциты еще раз в 30 мкл капли M2 СМИ.
2. Агарозном вложения и Лизис
- Для выполнения агарозном вложение, поместите лизиса решение на 70 ° C heatblock. Добавить предварительно разогретой LMP агарозном к лизису решение, производя 2:1 агарозы: лизис решение.
- Положите одну яйцеклетку на чистое предметное стекло в минимальных M2 СМИ. Возьмите 10 мкл агарозы: лизис решение в кончике пипетки, и (под микроскопом) мягко исключить небольшое количество (~ 1 мкл или менее) на стекло, что позволяет ему общаться с минимдр. СМИ. Аккуратно поднимите яйцеклетки в кончике пипетки и поставить все 10 мкл в пробирку Эппендорфа 300 мкл минерального масла, так что шарик образует сферу.
Примечание: этот процесс должно быть сделано достаточно быстро, как агароза затвердеет, если температура падает всего на 5 ° C ниже 70 ° С. - Инкубируйте пробирку на льду в течение 10 минут. Для выполнения лизис, удалить 300 мкл минерального масла и добавить 500 мкл буфера для лизиса SDS. Выдержите в течение ночи в 50 ° С на водяной бане.
Примечание: Лизис решения (табл. 1) также может быть использована для этой цели.
ДЕНЬ 2
Подготовьте следующие решения свежий в день бисульфит мутагенеза. Чтобы уменьшить возможность загрязнения ДНК, изменить перчатки часто и использовать фильтр советы. Хранить трубы под углом же, когда открыты, и резюмировать все трубы, когда они не используются. Мы рекомендуем, что решения принимаются, как N +1.
| 3 М NaOH | 2,4 г NaOH в 20 мл автоклавного DDH 2 O |
| 0,1 М NaOH | 0,5 мл 3М в 14,5 мл автоклавного DDH 2 O |
| 0,3 М NaOH | 1,5 мл 3М в 13,5 мл автоклавного DDH 2 O |
2,5 М бисульфит решение
- 3,8 г бисульфита натрия
5,5 мл дистиллированной GIBCO H 2 O
1 мл 3 М NaOH
растворяться @ комнатной температуре - 110 мг гидрохинона
1 мл дистиллированной GIBCO H 2 O
растворяют при 90 ° C (только до тех пор, как это имеет распустить, смешать регулярно)
Когда полностью растворяются, перемешать раствор (а) и (б)
* Хранить вдали от света *
3. Бисульфит мутагенеза
- Полностью удалить 500 мкл лизис SDS буфера и добавить 300 мкл минерального масла (~ 20 часов). Любой лизис буфера остальных будут разводить йэлектронной агарозы, когда он нагревается и шарик будет более восприимчива к растворению в последующих шагах. Продолжайте бисульфит мутагенеза немедленно или хранить при -20 ° C в течение 5 дней.
- Если возможно, удалите ооцитов из морозильной камеры и пусть оттепели (только до агарозном шарика относительно полупрозрачного). Выдержите в течение 2,5 минут на 90 ° C тепла блока, после чего инкубировать на льду в течение 10 минут.
Примечание: Не смешивать или пошевелиться, расширить более 2,5 минут, или колебаться температура. - Для выполнения денатурации, удалить минеральные масла и добавьте 1 мл 0,1 М NaOH в каждую пробирку, фильм и перевернуть 5-6 раза.
- Инкубировать 15 минут при 37 ° С водяной бане, переворачивая каждые 3-4 минут. Бусинка должна плавать в NaOH.
- Для выполнения бисульфит лечения, вращать трубку осторожно, а затем удалить NaOH и добавляют 300 мкл минерального масла и 500 мкл раствора бисульфита. Инкубируйте пробирку в течение 3,5 часов в 50 ° С водяной бане. * Хранить вдали от света *
Примечание: Время инкубации, возможно, придется эмпирически для гена. - Для выполнения desulfonation, инкубировать на льду в течение 3 минут, затем снимите нефтепродуктов и бисульфит решение, спина слегка и добавьте 1 мл 0,3 М NaOH. Флик и перевернуть 5-6 раза.
- Инкубировать 15 минут при 37 ° С водяной бане, переворачивая каждые 3-4 минут. Бусинка должна плавать в NaOH.
- Вымойте образцы, сначала вращается мягко, а затем удалить NaOH и добавляют 1 мл 1x TE рН 7,5. Встряхните в течение 5-10 минут при комнатной температуре (на качалке). Спиновая мягко снова, а затем удалить 1x TE. Повторите этот процесс стирки в два раза.
- Добавить 1 мл автоклавного DDH 2 O. Встряхните в течение 5-10 минут при комнатной температуре (на качалке). Спиновая осторожно, а затем удалить H 2 O. Повторите DDH 2 O мыть два раза.
- Проверьте рН надосадочной, она должна быть рН 5,0. Если еще слишком основной, снова вымыть с H 2 O. Удалите все супернатант, оставив только агарозном бытьобъявление.
4. 1-й и 2-го Круглого ПЦР-амплификации
- Подготовка 1-й раунд ПЦР смесь ** при мытье **
| 10 мкМ Primer вперед космическом | 0,5 мкл |
| 10 мкМ Primer обратной космическом | 0,5 мкл |
| 240 нг / мл тРНК | 1 мкл |
| H 2 O | 13 мкл |
Добавить в Illustra прет-а-К Горячий старт ПЦР бисера
Аккуратно вставьте твердый шарик агарозы в ПЦР-пробирку (~ 10 мкл)
Нагреть до 70 ° C и смесь
Добавить 25 мкл минерального масла
Всего: 50 мкл
- Усиливать
Примечание: например, велосипедного условия для мыши Snrpn является денатурация в течение 2 минут при 94 ° С, после 40 циклов по 30 секунд при 94 ° С, 1 мин при 50 ° С, а 1минут при 68 ° C, а последние 10 минут шаг удлинение при 68 ° C. Отжиг температуре в течение 1-го тура ПЦР для мыши H19 и Peg3 50 ° C. - Подготовка 2-й раунд ПЦР смеси
| 10 мкМ Primer вперед Внутренние | 0,5 мкл |
| 10 мкМ Primer обратной Внутренняя | 0,5 мкл |
| H 2 O | 19 мкл |
Добавить в Illustra прет-а-К Горячий старт ПЦР бисера
Добавьте 5 мкл 1-й Круглый продукт в качестве шаблона. Нагрейте 1-й тур продукта до 70 ° С в течение 1 минуты, чтобы смягчить агарозы. Будьте уверены, чтобы пипеткой под слоем минерального масла.
Добавить 25 мкл минерального масла
Всего: 50 мкл
Примечание: Вложенные последовательности грунт для Snrpn, H19 и Peg3 может быть найдено в Маркет-Velker и др. 1012.
- Усиливать
Примечание: Велоспорт условия для мыши Snrpn является денатурация в течение 2 минут при 94 ° С, после 40 циклов по 30 секунд при 94 ° С, 1 мин при 50 ° С, а 1 минута при 68 ° C, а последние 10 минут удлинение шагом в 68 ° C 10. Мышь H19 и Peg3 требуют 50 ° C температура отжига для 2-го тура ПЦР. - В качестве диагностического теста, второй тур образцы могут быть сокращены с ограничением фермент, который является метилирование или деформации специфичны.
| 2-й Круглый продукт | 4 мкл |
| Рестрикции | 1 мкл |
| Буфер | 1 мкл |
| H 2 O | 4 мкл |
- Electrophorese переваривания продуктов на 8% акриламида гель. Любые гетерогенные группы представляют собой более одного sequeNCE.
5. Т.А. Клонирование и колонии PCR
- Чтобы клонировать 2-го тура продукт, в первую тепла до 70 ° С в течение 1 минуты, чтобы смягчить агарозы, то перевязывать в вектора с использованием Promega pGEM-T векторные системы (Fisher Scientific Cat # A1360).
| 2-й Круглый ПЦР | 1 мкл |
| pGEMT-EASY вектор | 1 мкл |
| Лигазы | 1 мкл |
| H 2 O | 2 мкл |
| 2x буфера лигирования | 5 мкл |
Инкубируйте ночь при 4 ° С в ПЦР машины.
- Таяние компетентных клеток E.coli на льду в течение 15 минут (Zymo Research Corp Cat # T3009). Добавить 3 мкл реакции лигирования до 8 мкл E.coli и инкубировать перевязка на льду в течение 15 минут.
- Теплового шока в течение 40 секунд в 42 ° С водяной бане,и инкубировать на льду в течение 2 минут. Добавить 60 мкл среды SOC и инкубировать при температуре 37 ° С в течение 1 часа (в шейкере).
- Поместите все в реакционной смеси на LB / Агар / IPTG / Xgal / Amp плиты и пластины инкубируют при температуре 37 ° С в течение ночи.
- Подготовить смесь колонии PCR
| 20 мкМ M13 Прямой праймер | 0,7 мкл |
| 20 мкМ M13 обратного праймера | 0,7 мкл |
| 5X Зеленый Go Taq буфер | 7,0 мкл |
| 10 мМ дНТФ | 0,7 мкл |
| Taq ДНК-полимеразы | 0,28 мкл |
| H 2 O | 25,62 мкл |
| 35 мкл Всего |
Добавить 35 мкл колонии PCR Master Mix в ПЦР-пробирку. Выберите белый бактериальных колоний от пластины с кончика пипетки, и закружить в реакции ПЦР.
- Усиление с денатурация в течение 10 минут при 94 ° C, а затем 30 циклов за 45 секунд при 94 ° C, 30 секунд при 57 ° С, а 1 минута при 72 ° С, а последние 10 минут удлинение шагом в 72 ° C. Electrophorese 4 мкл на 1,5% агарозном геле. Отправить ~ 30 мкл продукта ПЦР для секвенирования.
Примечание: Для ооцитов, 5 колонии PCR продукты последовательно. - После секвенирования результаты получаются, метилирования может быть прочитан. Любые оригинальные CG, которые остались в CG был метилированный, и любые оригинальные CG, что в настоящее время TG была неметилированной.
6. Представитель Результаты
В нашей работе мы запечатлены анализа метилирования в отдельных ооцитов и эмбрионов (рис. 1). После вложенный ПЦР использованием бисульфита превращается грунтовки, можно подтвердить успешный переход к визуализации правильный размер фрагмента на агарозном геле (рис. 2). Отдельные яйцеклеткипредставляет собой один родительский аллель, и в теории, имеет один запечатлел метилирования. Таким образом, второй раунд ПЦР-продукты могут быть проверены на непреднамеренного загрязнения. Рестрикции чувствительны к метилирования ДНК (например, HinfI или DpnII) могут быть использованы, чтобы переварить второй раунд ПЦР-продукт оценить, насколько он содержит метилированные или неметилированной аллели (рис. 3). Метилированных C в последовательности ферментов расщепляется признания в то время как неметилированной C, который преобразуется в T больше не признаются фермента и режиссерский. Любой образец MII яйцеклетки, содержащие как метилированные и неметилированной аллелей должны быть отброшены, так как это свидетельствует о кучевых клетки загрязнения (рис. 3). После перевязки и преобразования, успешно колонии ПЦР-амплификации могут быть визуализированы в агарозном геле для обеспечения образцы правильного размера продукта направляются для секвенирования (рис. 4). Наконец, последовательность из пяти отдельных слте из ооцитов MII должны произвести пять одинаковых моделей метилирования и одинаковые nonCpG конверсии (рис. 5а). Любые образцы, которые содержат более чем один шаблон должен быть уничтожен (рис. 5б). С овулировавших ооцитов MII два хромосомы копии или прилагаемой полярное тельце, есть возможность получения двух одинаковых моделей последовательность (рис. 5в). Мы рекомендуем отбросить данные из яйцеклеток, которые имеют весьма разнородные модели метилирование с загрязнением кучевые клетка не может быть исключена.

Рисунок 1. Схема единого анализа бисульфит мутагенеза яйцеклетки.
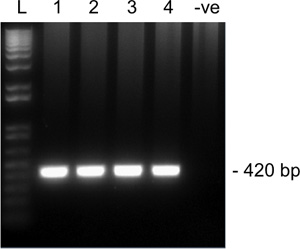
Рисунок 2. Представителю результаты 2-го тура для усиления Snrpn от поютле MII ооцитов на 1,5% агарозном геле. Дорожки 1-4 четырех отдельных ооцитов MII и переулок 5 отрицательного контроля (не яйцеклетки). Ожидаемый размер ампликона Snrpn 420 базисных пунктов. L, лестницы.
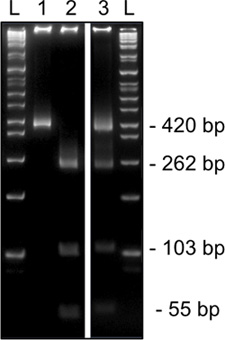
Рисунок 3. Представитель результаты 2-го тура метилирования конкретных ограничений для пищеварения Snrpn из одной яйцеклетки MII на 8% акриламида гель. HinfI диагностических пищеварения ограничение показывает неметилированной ДНК, которые таит в себе т, что отменяет ограничение сайта (420bp, переулок 1) или метилированных ДНК, которая содержится в C сайт узнавания (вырезать, 262, 103 и 54 б.п., дорожка 2). Пищеварение показывая и метилированных и неметилированной сайты рестрикции (сокращения и режиссерский полосы, полоса 3) свидетельствуют о кучевых загрязнения клетки. L, лестницы.
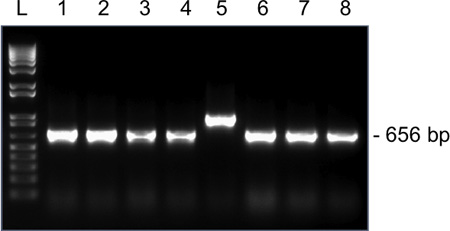
Рисунок 4. Представитель результаты колонии для ПЦР-амплификации Snrpn из одной яйцеклетки MII на 1,5% агарозном геле. Ожидаемый размер ампликонов после перевязки Snrpn в pGEM-T Easy вектор и использовании M13 прямого и обратного праймеров составляет 656 базисных пунктов. Лейн 1-8 ампликонов из клонов 1-8. Клон 5 имеет неправильный размер ампликона и не должны быть направлены для секвенирования.

Рисунок 5. Представитель последовательности результатов Snrpn из одной яйцеклетки MII. Snrpn метилируется в ооциты. Черные кружки метилированных CpGs. Белые кружки неметилированной CpGs. CpG количество и расположение является репрезентативной для B6 деформация женских мыши. а) Ожидаемые результаты секвенирования Snrpn из одной яйцеклетки MII. Только одна нить ДНК должны усилить во всех пяти клонов. Яйцеклетки с одним метилирования и одинаковые, не CpG преобразования скороговоркойп. должны быть включены в анализ (процент конверсии, не CpGs указано право рассчитывался как количество не-CpG цитозина в тимин превращается в процентах от общего числа не-CpG цитозина). б) Последовательность результатов Snrpn из одной яйцеклетки MII с кучевые загрязнения клетки. Обратите внимание на различие между метилирование государства и преобразования модели указывает несколько усиление цепи. в) Последовательность результатов Snrpn из одной яйцеклетки MII с обеих хромосом копии или полярные включения тела.
Обсуждение
Это один анализ ооцитов содержит много шагов, число которые имеют решающее значение и требуют особого ухода. Первый яйцеклетки стирки. Это особенно важно мыть каждую яйцеклетку несколько раз в свежей среде падает после гиалуронидазы лечение, чтобы удалить как многие клетки кучевые на?...
Раскрытие информации
Авторы не имеют ничего раскрывать.
Благодарности
Эта работа была поддержана в Университете Западного Онтарио, кафедра акушерства и гинекологии, а также грант ER06-02-188 от исследований и инноваций Ministryof, ранний премии научный сотрудник. MMD была поддержана Программой CIHR Обучение в репродукции, раннему развитию и воздействие на здоровье (REDIH) Высшее стипендии.
Материалы
Таблица специфических реагентов и оборудования.
| Name | Company | Catalog Number | Comments |
| Название реагента | Компания | Номер по каталогу | Комментарии |
| Коллекция ооцитов | |||
| Гиалуронидаза | Сигма | H4272 | |
| Кислотные Тироде | Сигма | T1788 | |
| Протеиназы K | Сигма | P5568 | |
| 10% Igepal | Bioshop | NON999.500 | |
| Лизис решения | |||
| Трис, рН 7,5 | Bioshop | TRS001.5 | |
| LiCl | Сигма | L9650 | И яBSP; |
| EDTA рН 8,0 | Сигма | E5134 | |
| КРЫШКИ | Bioshop | LDS701.10 | |
| DVB-T | Invitrogen | P2325 | |
| SDS буфере для лизиса | |||
| ТЕ рН 7,5 | Bioshop (Трис) Sigma (ЭДТА) | TRS001.5 E5134 | |
| 10% SDS | Bioshop | SDS001.500 | |
| Бисульфит преобразования | |||
| Едкий натр | Сигма | S8045 | |
| Натрий Hydrogensulfite (бисульфит натрия) | Сигма | 243973 | ; |
| Гидрохинон | Сигма | H9003 | |
| Низкую температуру плавления (LMP) агарозном | Сигма | A9414 | |
| Минеральное масло | Сигма | M8410 | |
| М2 среднего | Сигма | M7167 | |
| GIBCO дистиллированная вода | Invitrogen | 15230-196 | |
| Автоклавного бидистиллированной (день) воды | |||
| ПЦР | |||
| Illustra Hot Start Mix RTG | GE Healthcare | 28-9006-54 | |
| 240 нг / мл дрожжевой тРНК | Invitrogen | 15401-011 | |
| 5x Зеленый Реакция GoTaq буфер | Замега | M7911 | |
| Внутренняя и внешняя вложенных грунтовки | Сигма | ||
| Перевязка | |||
| Promega pGEM-T Easy векторного | Fisher Scientific | A1360 | |
| TA Cloning | |||
| Компетентные клетки E.coli | Zymo исследований корпорации | T3009 | |
| Оборудование | |||
| Препаровальная лупа | |||
| 70 ° C и 90 ° C тепла блоки | |||
| 37 ° C и 50 ° C Waterbaths (42 ° C для преобразования) | |||
| Рокер | |||
| ПЦР машины | |||
Ссылки
- Jaenisch, R., Bird, A. Epigenetic regulation of gene expression: how the genome integrates intrinsic and environmental signals. Nat. Genet. 33, 245-254 (2003).
- Rodenhiser, D., Mann, M. Epigenetics and human disease: translating basic biology into clinical applications. CMAJ. 174, 341-348 (2006).
- Frommer, M. A genomic sequencing protocol that yields a positive display of 5-methylcytosine residues in individual DNA strands. Proc. Natl. Acad. Sci. U.S.A. 89, 1827-1831 (1992).
- Clark, S. J., Harrison, J., Paul, C. L., Frommer, M. High sensitivity mapping of methylated cytosines. Nucleic Acids Res. 22, 2990-2997 (1994).
- Feil, R., Charlton, J., Bird, A. P., Walter, J., Reik, W. Methylation analysis on individual chromosomes: improved protocol for bisulphite genomic sequencing. Nucleic Acids Res. 22, 695-696 (1994).
- Raizis, A. M., Schmitt, F., Jost, J. P. A bisulfite method of 5-methylcytosine mapping that minimizes template degradation. Anal. Biochem. 226, 161-166 (1995).
- Patterson, K., Molloy, L., Qu, W., Clark, S. DNA Methylation: Bisulphite Modification and Analysis. J. Vis. Exp. (56), e3170 (2011).
- Olek, A., Oswald, J., Walter, J. A modified and improved method for bisulphite based cytosine methylation analysis. Nucleic Acids Res. 24, 5064-5066 (1996).
- Mann, M. R. Selective loss of imprinting in the placenta following preimplantation development in culture. Development. 131, 3727-3735 (2004).
- Market-Velker, B. A., Zhang, L., Magri, L. S., Bonvissuto, A. C., Mann, M. R. Dual effects of superovulation: loss of maternal and paternal imprinted methylation in a dose-dependent manner. Hum. Mol. Genet. 19, 36-51 (2010).
- Meng, L. H., Xiao, S. Q., Huang, X. F., Zhou, Y., Xu, B. S. A study on bisulfite sequencing method for methylation status of imprinted genes in single human oocytes. Zhonghua Yi Xue Yi Chuan Xue Za Zhi. 25, 289-292 (2008).
- Denomme, M. M., Zhang, L., Mann, M. R. Embryonic imprinting perturbations do not originate from superovulation-induced defects in DNA methylation acquisition. Fertil. Steril. 96, 734-738 (2011).
- Tahiliani, M. Conversion of 5-methylcytosine to 5-hydroxymethylcytosine in mammalian DNA by MLL partner TET1. Science. 324, 930-935 (2009).
- Hajj, N. E. l. Limiting dilution bisulfite (pyro)sequencing reveals parent-specific methylation patterns in single early mouse embryos and bovine oocytes. Epigenetics. 6, 1176-1188 (2011).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены