Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Оптическая запись запороговой нейронной активности с одноклеточных и одного всплеска резолюции
В этой статье
Резюме
Понимание функции позвоночных центральная нервная система требует записи из многих нейронов корковых функций, потому что возникает на уровне популяций нейронов. Здесь мы опишем метод оптической записи запороговой нейронной активности с одноклеточных и одного всплеска разрешение, сглаживание случайного доступа сканирования. Этот метод записи соматических флуоресценции кальций сигналов от до 100 нейронов с высоким временным разрешением. Максимального правдоподобия алгоритм deconvolves основной запороговой нейронной активности с соматическими сигналы флуоресценции кальций. Этот метод надежно обнаруживает шипы с высокой эффективностью обнаружения и низкий уровень ложных срабатываний и может быть использована для изучения нейронных популяций В пробирке И В естественных условиях.
Аннотация
Сигнализация информации в позвоночных центральная нервная система часто осуществляется по популяции нейронов, а не отдельными нейронами. Также распространения запороговой деятельность включает в себя пики популяций нейронов. Эмпирические исследования решении корковых функций непосредственно, следовательно, требуют записи из популяций нейронов с высоким разрешением. Здесь мы опишем оптического метода и алгоритма деконволюции для записи нейронной активности до 100 нейронов с одноклеточных и одного всплеска резолюции. Этот метод основан на выявлении преходящее увеличение внутриклеточного кальция соматических концентрация, связанная с запороговой электрических шипы (потенциалы действия) в корковых нейронов. Высокое временное разрешение оптической записи достигается за счет быстрого произвольного доступа сканирования технологии с использованием акустооптического дефлектора (AODs) 1. Двухфотонного возбуждения кальций-чувствительных красителей приводит к высоким пространственным разрешением в непрозрачную ткань мозгаСью 2. Реконструкция шипы от флуоресценции записи кальция достигается методом максимального правдоподобия. Одновременное электрофизиологические и оптические записи показывают, что наш метод надежно обнаруживает шипами (> 97% шипованные эффективности обнаружения), имеет низкий уровень ложных срабатываний Обнаружение всплеска (<0,003 шипы / с), а также высокой временной точностью (около 3 мс) 3. Этот оптический метод обнаружения всплеска может быть использован для записи нейронной активности в пробирке и в анестезии животных в естественных 3,4.
протокол
1. Оптическая установка (рис. 1)
- В течение двух-фотонного возбуждения инфракрасной импульсной лазерной системы с фемтосекундных импульсов используется. Высокая выходная мощность лазера (в некоторых случаях> 2 Вт при 890 нм) требует, чтобы компенсировать большие потери, вносимые оптической компонентов системы.
- Prechirper система, состоящая из двух призм придает отрицательной дисперсии групповой скорости (ДГС) на лазерных импульсов до акустооптического дефлектора (AODs) для компенсации временной дисперсии введен AODs 1.
- Два AODs с большими отверстиями (10 мм для 40x цель погружением в воду с NA 0,8) отклонения лазерного луча в двух измерениях.
- Отражающих дифракционную решетку с 100 рощи / мм помещается 13 см за AODs, чтобы компенсировать пространственной дисперсии введен AODs при использовании коротких лазерных импульсов.
- Луч лазера направляется с двумя реле телескопов в камеру, порт вертикально microscoфизическое воспитание
- Ирисы размещены на регулярной основе для выравнивания оптических компонентов.
- Дихроичным светоделителем перед объективной передает инфракрасный свет возбуждения образца и отражает свет флуоресценции от образца на детектор.
- Эпи-и transfluorescence детекторы (ФЭУ, ФЭУ) собирают флуоресцентного сигнала через объектив и - при необходимости - через конденсатор.
- Цветные стеклянные фильтры (BG-39, 3-5 мм) расположены в передней части детекторов, чтобы предотвратить возбуждение света, попадающего на детекторах.
- AOD углы отклонения находятся под контролем компьютера, оснащенного цифро-аналоговый преобразователь платы (156,25 кГц тактовая частота), который, в свою очередь, приводит управляемого напряжением осциллятора.
- Сигнал с ФЭУ передается через низкочастотный фильтр Баттерворта (частота среза 100 кГц) и оцифровывается с помощью аналого-цифрового преобразователя (156,25 кГц тактовая частота) перед сохранением вкомпьютер для анализа.
- Выравнивание и электрических шумов, проверяются записи распределения сигналов флуоресценции и без лазерного света, при низкой и высокой усиления ФЭУ, а также с учетом и без индикатора. Сканер правильно установить и экранированный, когда ширина распределения сигналов флуоресценции на высокий коэффициент усиления и с индикатором гораздо больше, чем ширина другими дистрибутивами сигналов флуоресценции (рис. 2).
2. Экспериментальные процедуры
- Сглаживание случайного сканирования при доступе полагается на обнаружение внутриклеточных увеличение кальция. Большое количество нейронов могут быть окрашены использованием болюсного введения эфира форма кальция индикатора (например Орегон Зеленый 488 ВАРТА-1 AM) в нервной ткани 5.
- Несколько мест от каждого нейрона Сома записывается, каждый в течение короткого времени ("сглаживание", 4 места, 6,4 мкс для каждого места = 25,6 мкс Время записи для электроннойАх нейронов в каждом цикле, рис. 3С). Для выбора нейронов интереса полный кадр, состоящий из 256x256 пикселей приобретает (рис. 3А). В центре каждого нейрона Сома для записи выбирается вручную в этот образ. Управляющее программное обеспечение автоматически добавляет три очка в 2 мкм, расстояние вокруг этого центра.
- В каждом цикле, флуоресцентный сигнал записывается с каждой из 40 нейронов (рис. 3В). Этот процесс повторяется в течение всего срока одной записи (5 секундной записи = 3255 циклов, 1 цикл = 1,536 мс).
3. Интернет программные средства для максимального всплеска эффективности обнаружения
- Спайк обнаружения сигналов флуоресценции от соматических кальция опирается на высоком отношении сигнал-шум (S / N) отношение сигналов соматической флуоресценции кальций. Высокое S / N может быть достигнуто за счет увеличения интенсивности возбуждения. Интенсивность возбуждения, однако, может быть увеличена только до определенного предела из-за фотостарения. Спайк обнаружения высокой в течение очень небольшого Windoш интенсивности возбуждения флуоресценции только там, где сигналы с высоким S / N, но только очень мало фотостарения наблюдается 3. Для того, чтобы убедиться, что записанные сигналы в окне высокой обнаружения всплеска во время записи мы контролируем скорость фотона (см. уравнение 3.2) и снижение базовой флуоресценции с помощью онлайн-анализа.
- Приблизительная скорость фотонов на один нейрон, рассчитывается исходя из короткого временного окна (100-200 мс) базовой шума. Число фотонов (N λ) и фотона скорость (λ = N λ / t) рассчитывается исходя из значения флуоресценции путем подгонки распределения (σ) относительной флуоресценции изменяется по следующей формуле:
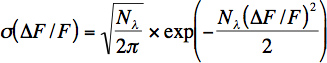
Это уравнение представляет собой распределение Пуассона для фотонного шума выстрела с изменением переменной относительной флуоресценции изменения: f / F = (G * N λ (T)-G * N & бегахBDA, 0) / G * N λ, 0, где G означает совокупный коэффициент усиления ФЭУ и других электронных компонентов. Заметим, что это уравнение не правильно определить число зарегистрированных фотонов в естественных записи, потому что есть другие источники шума (движение артефакты), в дополнение к фотонный шум выстрела. Тем не менее это уравнение полезно для записи в естественных условиях для оценки шума.
- Базовый флуоресценции рассчитывается из того же окна времени и графике как функция времени или испытаний. Среднее снижение базовой сохраняется ниже 0,0002 / сек, регулируя мощность лазера, потому что всплеск обнаружения быстро падает при превышении этого предела.
- Каждые 10-20 минут позиции нейронов somata проверяются снова приобретает полный кадр. При необходимости, запись местах корректируются. Места могут быть скорректированы для всех нейронов сразу, так и для отдельных нейронов.
4. Reconstructioп шипованные таймингами от сигналов флуоресценции (деконволюция)
- Сигналов флуоресценции в результате нейронной активности часто summate во времени, потому что распад кальция переходных длинный (несколько сотен миллисекунд). Деконволюция метод реконструирует шип и шип таймингами от сигналов флуоресценции.
- Чтобы определить наиболее вероятный всплеск поезда, лежащие в основе записанного сигнала флуоресценции, различные модели сравниваются. Здесь мы использовали генетический алгоритм для определения модели - и, таким образом, поезд спайка и спайка тайминги - с максимальной вероятностью.
- В неоднородных популяций нейронов, вызвали всплеск-кальциевый сигнал может варьироваться между нейронами. Для неконтролируемого анализа наборов данных, мы разработали алгоритм, который учитывает изменение вызвало всплеск-кальциевый сигнал от нейрона к нейрону.
- Чтобы избежать большого количества ложных срабатываний полезно сжимать позволило амплитуды и распад постоянной времени тОдел шипа-вызванных кальция сигнала. Совместное распределение амплитуд и постоянная времени спада одно-всплеск вызвала переходных кальция записывается в отдельную серию экспериментов с того же типа нейронов в тех же экспериментальных условиях с использованием одновременной электрофизиологические и оптической записи.
- Чтобы объяснить медленное изменение исходных условий и снизить вычислительные затраты из deconvolving, больше записей делятся на несколько более коротких следов 1-5 секунд.
- Для каждого нейрона и каждая запись, деконволюция алгоритм может протестировать большое количество моделей (до 1 млн различных моделей и более). Чтобы ускорить деконволюции, один эксперимент деконволюции на 10 различных компьютерах в параллель.
- После деконволюции, шипованные данные анализируются и проверяются. Пери-стимул времени гистограммы, шипованные вероятности, и скорострельность (средний шип в нейронах) рассчитываются в автоматическом режиме.
5.Представитель Результаты
Успешное обнаружение всплеска зависит от высокого отношения сигнал-шум записанных сигналов флуоресценции соматических кальция. Просто с использованием высоких скоростей возбуждения (высокая мощность лазера) может привести к негативным воздействием фотоэффекта на биологический материал (фотостарения). В сглаживание случайного сканирования при доступе фотостарения проявляется в виде снижения базовой флуоресценции и уменьшает шипа-вызванных кальция сигналов флуоресценции. Уменьшение пик-сигнал вызывал может быстро привести к неспособности обнаружить шипы. Существует лишь очень небольшое окно, где интенсивность возбуждения шипованные обнаружению сигналов флуоресценции является высокой. На верхнем конце этого окна ограничен фотостарения, на нижнем конце сигналов флуоресценции имеют низкое отношение сигнал-шум. Для корковых нейронов при острой ломтики мы используем мощности лазерного излучения фотона в результате темпы о 400,000-1,500,000 фотонов / с при записи на уровне около 100 мкм ниже поверхности среза. При использовании высокихСродством показатель - здесь Орегон Зеленый 488 BAPTA - 1 - это сигнал достаточно для обнаружения отдельных шипов. Рис. 3E показывает пример сигнала флуоресценции записан на очень низкой скорости возбуждения, одним из примеров записи в обнаружении окна, и один при очень высокой скорости возбуждения.
По сравнению с другими методами для записи нейронной активности с одноклеточных и одного всплеска разрешение, сглаживание случайного сканирования при доступе может записывать с большим количеством нейронов из того же, местное население, и является менее инвазивной, например, по сравнению с тетрод / многоэлектродной записей . Таким образом, сглаживание случайного доступа сканирование может быть использован для записи нейронной активности многих нейронов для измерения взаимной информации сигнализирует запороговой деятельности 6 (рис. 4а), изменения нейронной активности в популяции нейронов (корковой пластичности), а также распространение запороговой деятельности через популяций нейронов 14 (рис. 4В)
ALT = "Рисунок 1" SRC = "/ files/ftp_upload/4052/4052fig1.jpg" />
Рисунок 1. Оптическая конструкция сглаживание-случайной настройки сканирования доступа.
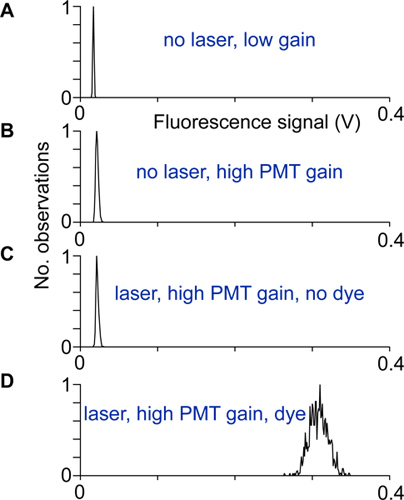
Рисунок 2 Выравнивание и тестирования. Распределение флуоресценции сигналов, записанных в различных условиях. А) Нет лазерного излучения и низкий коэффициент усиления ФЭУ, B) При более высокой PMT прибыль, но не лазерного излучения, распределение шире, в связи с ФЭУ темнового тока. C) С лазером и записал на высокий коэффициент усиления ФЭУ. Разница между распределениями в показаны в B, и это распределение будет означать, что возбуждение свет попадает на ФЭУ детектора. D) распределение флуоресценции сигналы, записанные на высокой прибыли от нейрона somata. Если нет других источников шума способствует, такое распределение возникает из фотонов дробового шума только.
. JPG "/>
Рисунок 3) Полный кадр изображения флуоресценции для обнаружения и выбора позиции нейронов somata, B) Scan путь один цикл, C) Иллюстрация сглаживание принципу;. В каждой сомы (круг) несколько мест регистрируются перед перемещением луча к следующему сомы, D) Иллюстрация выход двух D / A каналов. Для каждого нейрона сома, флуоресцентный сигнал отражается от 4 разных местах в каждом сомы (S1-S4). Размещение каждого пятна задается его х и у позиции. Х и у позиции для всех мест и всех нейронов направляются в цифро-аналогового преобразователя в последовательном порядке. В то время как луч перемещается между двумя somata нейрон, сигнал не приобрел (пустой). E) Примеры сигналов флуоресценции. Заметим, что каждый пример показывает, ответ на один шип (измеряется с электрофизиологические клетки подключенных записи).
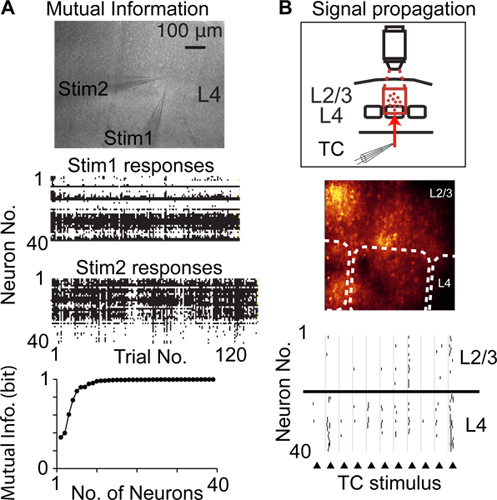
Рисунок 4. Изучение Кортикал функции, используя сглаживание случайного доступа сканирования. A) Измерение взаимной информации сигнализирует популяций нейронов. Верхнее изображение показывает микрофотографию острый срез мозга и два стимуляции пипетки, расположенных в одной корковой колонки в слое 4 (L4). Центр графики показывают нервных реакций для каждого повторения стимула. Нижний график показывает взаимной информации Шеннона сигнализирует записал популяции нейронов. Б) измерение распространения запороговой пики активности (распространение сигнала) между популяциями нейронов коры. Верхний график иллюстрирует экспериментальный дизайн, центр изображения показывает флуоресценцию изображения, пунктирные линии обозначают границы баррель, ниже график показывает обнаружены спайки в ответ на электрическую стимуляцию таламокортикального волокон (треугольники).
Обсуждение
Сглаживание случайного сканирования при доступе косвенно обнаруживает запороговой пики активности с увеличением внутриклеточного кальция соматических, связанные с каждым всплеском somata нейрона. Увеличение внутриклеточного кальция обнаруживаются флуоресцентных красителей кальция...
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Мы благодарим доктора Рэнди Chitwood для критического прочтения рукописи. Эта работа была поддержана фондом Whitehall и Alfred P. Sloan Foundation грантов ХИК.
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента | Компания | Номер в каталоге | Комментарии (по желанию) |
| Оптические компоненты перечислены в порядке, начиная с лазерным | |||
| Титан-сапфирового лазера | Когерентные Инк | Chameleon Ultra 2 | Высокая выходная мощность рекомендуемого (> 2 Вт при 900 нм) |
| Ахроматический объектив F = 30 мм | Thor лабораторий | AC254-030-B | Anti-отражение (AR) покрытия для 650-1050 нм |
| Ахроматический объектив F = 100 мм | Thor лабораторий | AC254-100-B | AR 650-1050 нм |
| Объектив F = 75 мм | Thor лабораторий | LA1608-B | AR 650-1050 нм |
| Объектив F = 175 мм | Thor лабораторий | LA1229-B | AR 650-1050 нм |
| Ахроматический объектив F = 300 мм | Thor лабораторий | AC254-300-B | AR 650-1050 нм |
| Ахроматический объектив F = 100 мм | Thor лабораторий | AC254-100-B | AR 650-1050 нм |
| Ахроматический объектив F = 100 мм | Thor лабораторий | AC254-100-B | AR 650-1050 нм |
| Акустооптические дефлекторы | Intraaction Corp | ATD 6510CD2 | |
| Светоотражающие дифракционной решетки | Newport | 53-011R | 100 штрихов / мм для AODs с 65 МГц полосы пропускания и сканирование под углом 45 мрад |
| 21,6 мм Брюстер призм | Lambda Research Оптика Инк | IBP21.6SF10 | |
| Цветное стекло | Schott | BG-39 | |
| Зеркальные | Chroma Technology Corp | Z532RDC | |
| Модули ФЭУ | Hamamatsu | H9305-03 | |
| ЦАП-АЦП платы | National Instruments | PCI-6115 | |
| Орегон Зеленый 488 ВАРТА-1 утра | Invitrogen | O-6807 |
Ссылки
- Iyer, V., Hoogland, T. M., Saggau, P. Fast functional imaging of single neurons using random-access multiphoton (RAMP) microscopy. J. Neurophysiol. 95, 535-545 (2006).
- Denk, W., Strickler, J. H., Webb, W. W. Two-photon laser scanning fluorescence microscopy. Science. 248, 73 (1990).
- Ranganathan, G. N., Koester, H. J. Optical recording of neuronal spiking activity from unbiased populations of neurons with high spike detection efficiency and high temporal precision. J. Neurophysiol. 104, 1812-1824 (2010).
- Grewe, B. F., Langer, D., Kasper, H., Kampa, B. M., Helmchen, F. High-speed in vivo calcium imaging reveals neuronal network activity with near-millisecond precision. Nat. Methods. 7, 399-405 (2010).
- Stosiek, C., Garaschuk, O., Holthoff, K., Konnerth, A. In vivo two-photon calcium imaging of neuronal networks. Proc. Natl. Acad. Sci. U.S.A. 100, 7319-7324 (2003).
- Pita-Almenar, J. D., Ranganathan, G. N., Koester, H. J. Impact of cortical plasticity on information signaled by populations of neurons in the cerebral cortex. J. Neurophysiol. 106, 1118-1124 (2011).
- Kerr, J. N., Greenberg, D., Helmchen, F. Imaging input and output of neocortical networks in vivo. Proc. Natl. Acad. Sci. U.S.A. 102, 14063-14068 (2005).
- Lin, B. J., Chen, T. W., Schild, D. Cell type-specific relationships between spiking and [Ca2+]i in neurons of the Xenopus tadpole olfactory bulb. J. Physiol. 582, 163-175 (2007).
- Zeng, S., Lv, X., Zhan, C., Chen, W. R. Simultaneous compensation for spatial and temporal dispersion of acousto-optical deflectors for two-dimensional scanning with a single prism. Opt. Lett. 31, 1091-1093 (2006).
- Otsu, Y., Bormuth, V., Wong, J., Mathieu, B. Optical monitoring of neuronal activity at high frame rate with a digital random-access multiphoton (RAMP) microscope. J. Neurosci. Methods. 173, 259-270 (2008).
- Vogelstein, J. T., Watson, B. O., Packer, A. M., Yuste, R. Spike inference from calcium imaging using sequential Monte Carlo methods. Biophys. J. 97, 636-655 (2009).
- Yaksi, E., Friedrich, R. W. Reconstruction of firing rate changes across neuronal populations by temporally deconvolved Ca2+ imaging. Nat. Methods. 3, 377-383 (2006).
- Hendel, T., Mank, M., Schnell, B., Griesbeck, O. Fluorescence changes of genetic calcium indicators and OGB-1 correlated with neural activity and calcium in vivo and in vitro. J. Neurosci. 28, 7399-7411 (2008).
- Ranganathan, G. N., Koester, H. J. Correlations decrease with propagation of spiking activity in the mouse barrel cortex. Front Neural Circuits. 5, 8 (2011).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены