Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Оценка репликации и функции бета-клеток в Adenovirally-трансдуцированных изолированных островков грызунов
В этой статье
Резюме
Этот протокол позволяет выявить факторы, которые модулируют функциональную бета клеточной массы, чтобы найти потенциальных терапевтических мишеней для лечения сахарного диабета. Протокол состоит из обтекаемой метод оценки репликации островок и функции бета-клеток островков в изолированных крыс после манипуляций экспрессии генов с аденовирусов.
Аннотация
Гомеостаза глюкозы в первую очередь контролируется инсулином эндокринных гормонов и глюкагон, который вырабатывается в поджелудочной бета-и альфа-клетки, соответственно. Функциональные клеточной массы бета определяется анатомическими клеточной массы бета, а также способность бета-клеток в ответ на биогенной нагрузки. Потеря функциональной клеточной массы бета занимает центральное место как основные формы сахарного диабета 1-3. В то время как снижение функциональной бета клеточной массы результате аутоиммунной атаки на сахарный диабет 1 типа, при диабете 2 типа, это уменьшение развивается как с неспособностью бета-клетки секретируют инсулин должным образом и разрушения бета-клеток из кадровых механизмов. Таким образом, усилия по восстановлению функциональной бета клеточной массы имеют огромное значение для лучшего лечения и потенциальных методов лечения диабета.
Ведется работа по выявлению молекулярных путей, которые могут быть использованы, чтобы стимулировать репликации и повышению функции бета-клеток.В идеале, терапевтических целей позволит улучшить как бета-клеточный рост и функцию. Возможно, более важно, хотя это определить, является ли стратегия, которая стимулирует рост клеток бета происходит за счет нарушая функцию бета-клетки (например, с некоторых онкогенов), и наоборот.
Путем систематического подавления или гиперэкспрессией выражение целевых генов в изолированных островков крысы, можно выявить потенциальных терапевтических мишеней для повышения функциональной клеточной массы бета 4-6. Аденовирусных векторов могут быть использованы для эффективного гиперэкспрессией или нокдаун белка в изолированных островков крысы 4,7-15. Здесь мы представляем способ манипулировать экспрессии генов использования аденовирусной трансдукции и оценить островок репликации и функции бета-клеток островков в изолированных крыс (рис. 1). Этот метод был использован ранее для определения новых целей, которые модулируют бета репликации клетки или функции 5,6,8,9,16,17.
протокол
1. Аденовирусные трансдукция и культивирования Крысы островков
- Подготовка 6-и не-культуры тканей покрытием пластины, добавив 2 мл среды (RPMI 1640 средах, содержащих 8 мМ глюкозы, 10% эмбриональной телячьей сыворотки, 50 ед / мл пенициллина, 50 мкг / мл стрептомицина) для необходимого количества скважин. Например, типичный эксперимент может потребовать трех скважин - по одной для не-Virus Control, вирус управления (например, GFP-экспрессирующих аденовирус), а в экспериментальной группе.
- Теплые пластины до 37 ° C, поместив его в культуре ткани инкубатор, по крайней мере 30 мин.
- Сразу же после крысы островок изоляции 18,19, место 100-200 островков в отдельных скважинах 6-и не-культуры тканей покрытием пластины. Шестьдесят островки необходимы для секреции инсулина и анализы тимидина. Остальные островки могут быть использованы для изоляции РНК для исследования экспрессии генов или белков изоляции иммуноблоттинга.
[Примечание: Начиная с этого момента, пожалуйста, следуйте институциональных протоколов для обработки, использования и утилизации биологически опасных материалов.]
- Осторожно вращать пластину довести островков в центре колодца.
- Пипетировать аденовирус непосредственно на островки в центре блюда. Используйте 100-500 кратности инфекции (МВД, соотношение клеток-мишеней к вирусным бляшкообразующих единиц).
- Пусть остальные островки в течение 5 мин.
- Поместите пластину в культуре ткани инкубатор (37 ° C, 5% CO 2).
- Через 24 часа, осторожно вращать пластину довести островков в центрах колодцы и передать островки помощью P200 микропипетки на новый и свежий содержащие средства массовой информации. Если островки привязываться к плите, они могут быть слегка выбили с кончика пипетки.
[Примечание: Чтобы убедиться в адекватной эффек трансдукциису, использование контроль вируса выражения GFP выгодно, так как островки могут быть отображены с помощью конфокальной микроскопии для проверки проникновения аденовирус в островок ядра.]
- Культура островки для дополнительных 24-72 ч, в зависимости от желаемых сроков эксперимента в исследованиях оптимизации пилота. Например, индукция пролиферативной реакции могут потребовать раз от 24-72 ч или нокдаун гена может потребоваться 48 или 72 часов. Передача островков на свежий СМИ каждый день.
- Для окончательного 24 часов эксперимента, культуры островков в среде, содержащей 1 мкКи [метил-3 H] -thymidine/ml средства массовой информации (как правило, 1 мкл тимидина / мл среды).
[Примечание: Начиная с этого момента, пожалуйста, следуйте институциональных протоколов для обработки, использования и захоронения радиоактивных материалов.]
2. Анализ секреции инсулина
- Подготовьтесекреции буфером (НКС) 10X маточного раствора (1,14 М NaCl, 47 мМ KCl, 12 мМ KH 2 PO 4, 11,6 мМ MgSO 4) и CaCl 2 100X маточного раствора (0,25 М CaCl 2). Эти растворы можно приготовить заранее и хранить при комнатной температуре.
- Недавно подготовить 50 мл рабочего SAB (5 мл 10X SAB, 1 мл 1 HEPES М, 0,5 мл 100X CaCl 2, 0,28 мл 35% BSA, 0,11 г NaHCO 3, и стерильной водой до 50 мл) 50 мл коническую трубку и теплой до 37 ° С, поставив в 37 ° С водяной бане.
- Внесите 10 мл рабочего SAB в 15 мл коническую трубку и добавьте 66,8 мкл 2,5 М D-глюкозы подготовить высокий уровень глюкозы (16,7 ммоль) SAB.
- Добавить 44,8 мкл 2,5 М D-глюкозы в оставшиеся 40 мл рабочего SAB подготовить низкий уровень глюкозы (2,8 ммоль) SAB.
- Обозначения трех 1,7 мл микроцентрифужных труб для каждой скважины 6-луночного планшета и добавить 1 мл фосфатно-солевом буфере (PBS).
- Место 20 островков в каждом микроцентрифужных трубку. Сделайте все попытки добавить сравнительно размера островков каждого микроцентрифужных трубку. Например, каждая трубка может содержать 5 малых, 10 средних и 5 больших размеров островков (см. Рисунок 1).
- После того, как островки поселились в нижней части трубки под действием силы тяжести (~ 2 мин), аспирацию PBS с микропипетки и выбросить.
- Для предварительной инкубации, добавить 400 мкл низкой Gluудобно расположиться SAB, поместите трубки (с крышками открытые) в культуре ткани инкубатор (37 ° C, 5% СО 2) и предварительно инкубировать 60 мин. Аспирируйте предварительной инкубации низкий уровень глюкозы SAB и брака.
- Для базальной секреции инсулина, добавьте 400 мкл низкий уровень глюкозы в SAB, поместите трубки (с крышками открытые) в культуре ткани инкубатор (37 ° C, 5% CO 2), и выдержать в течение 60 мин. Соберите низкий уровень глюкозы SAB и за исключением инсулина радиоиммунологического.
- Для стимулировать секрецию инсулина, добавить 400 мкл высокий уровень глюкозы в SAB, поместите трубки (с крышками открытые) в культуре ткани инкубатор (37 ° C, 5% CO 2), и выдержать в течение 60 мин. Соберите высокий уровень глюкозы в SAB и за исключением инсулина радиоиммунологического.
- Добавить 1 мл PBS, после того, как островки поселились в нижней части трубки под действием силы тяжести, аспирации PBS с пипетки, отбросить, и повторить этоодин раз.
- Добавить 500 мкл ледяной кислоты трихлоруксусной (ТСА, 10% вес / объем) и инкубировать на льду в течение 30 мин.
- Центрифуга труб на 16 000 мкг в течение 3 мин при 4 ° C.
- Аспирируйте ГТС, добавить 80 мкл 0,3 N NaOH, и инкубировать в течение 30 мин при комнатной температуре. В течение этого времени энергично вихрь образцов в течение 5-10 с каждые 10 мин.
- Добавить 4 мл Econo безопасного подсчета коктейль 7 мл жидкого сцинтилляционного счет трубы.
- Добавить 50 мкл образца сцинтилляционного счет трубы, крышки трубки, встряхните кратко, и рассчитывать на сцинтилляционного счетчика.
- Измерение концентрации белка использованием bicinchoninic кислоты (BCA) Анализ и 10 мкл образца в соответствии с протоколом производителя.
- Выполните следующие инсулина радиоиммунологического протокол производителя.
- Нормализация секреции инсулина и данные тимидина с белком концentration.
[Примечание: Как островки являются радиоактивными, пожалуйста, следуйте институциональных протоколов для обработки, использования и захоронения радиоактивных материалов.]
[Примечание: Островки могут быть визуализированы с помощью либо рассечение стереоскоп или стандартного микроскопа.]
[Примечание: в качестве альтернативы решения под действием силы тяжести, трубы могут быть центрифугировали при 300 мкг в течение 1 мин.]
3. Анализ тимидина
4. Анализ данных
5. Представитель Результаты
Пример эксперимента по оценке островок репликации и функции бета-клеток островков у крыс показано на рисунке 2. Этот пример показывает, что аденовирусная гиперэкспрессия гипотетический "ген № 6" надежно стимулирует островок репликации без изменения функцию бета-клеток. В верхней панели, результаты анализа включения тимидина показали, что увеличение выражения "Gene № 6" увеличивает синтез ДНК, если судить по включению тимидина. Потому что большинство клеток у крыс островок являются бета-клеток, вполне вероятно, что это увеличение тимидина указывает на увеличение бета репликацию клеток. Тем не менее, подтверждающих эксперименты должны быть выполнены, чтобы твердо установить это. В нижней части панели, результаты анализа секреции инсулина показали, что гиперэкспрессия "Gene № 6" не изменили одной из основных функций клетки бета, то есть яnsulin секрецию при низких и высоких глюкозы. Качество изоляции островок и здоровье островков после лечения аденовирусы указывается кратное увеличение секреции инсулина при низких и высоких концентраций глюкозы. Если увеличение выражение "Gene № 6" нарушением функции бета-клетки, это, скорее всего, отражается как уменьшение инсулин выделяется при высоких, стимулирующие концентрации глюкозы (16,7 мм). Кривой доза-реакция для различных концентраций глюкозы также может быть выполнена.
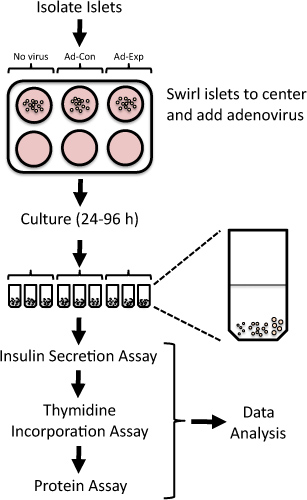
Рисунок 1. Обзор протокола оценки репликации островок и бета-функции клеток в изолированных островков крысы после аденовирусной опосредованных изменений в экспрессии генов. Свежевыделенных островков крысы подвергаются аденовирусов в течение 24 ч, а затем культивировали до 96 час. Тимидина оценивается в финале 24 ч, после чего измерения секреции инсулина внизким и высоким содержанием глюкозы.
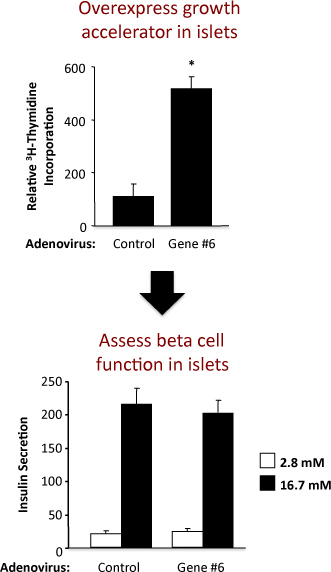
Рисунок 2. Результаты эксперимента с использованием аденовируса контроля и аденовирус гиперэкспрессией гипотетический ген назвали «Гена № 6". На верхней панели отображается тимидина и нижней панели секреции инсулина.
Обсуждение
Создание путей, которые можно модулировать по стимулированию репликации и повышению функции бета-клеток имеют отношение к обоим основные формы сахарного диабета. Поскольку функциональные клеточной массы бета зависит от существования и функционирования инсулин клетки, оценки этих д?...
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Эта работа была поддержана грантом DK078732 из NIH (в ПТФ).
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента | Компания | Номер по каталогу | Комментарии |
| RPMI 1640 средств массовой информации | Гибко | 11879 | |
| Пенициллина / стрептомицина | Гибко | 15140 | |
| 6-луночного планшета | BD-Сокол | 35-1146 | Non-TC лечение |
| [Метил-3 H]-тимидина | Перкин Элмер | NET027Z001MC | 1 мКи / мл |
| Micro-пробирок | Denville | C2170 | 1,7 мл |
| NaCl | Сигма | 59888 | |
| KCl | Acros | 42409 | |
| KH 2 </ SUB> PO 4 | Acros | 20592 | |
| MgSO 4 | Acros | 41348 | |
| CaCl 2 | Acros | 34961 | |
| HEPES | Сигма | H0887 | 1 М раствора |
| 35% BSA | Сигма | A7979 | |
| NaHCO 3 | Acros | 42427 | |
| D-глюкозы | Сигма | G8769 | |
| TCA | Fisher Scientific | SA9410-1 | 10% вес / объем |
| NaOH | Acros | 12426 | |
| Сцинтилляционных счет трубы | Sarstedt | 58,536 | 7 мл, ПП |
| Сцинтилляционных счет трубы колпачок | Sarstedt | 65,816 | |
| Econo-Safe считая коктейль | RPI | 111175 | |
| Инсулин РИА | Сименс | TKIN2 | |
| BCA Анализ Kit | Thermo Scientific | 23250 | |
| Оборудование | |||
| Центрифугировать | Эппендорф | 5415R | |
| Сцинтилляционных счет трубы стойки | Sarstedt | 93.1431.001 | |
| Жидкий сцинтилляционный счетчик | Перкин Элмер | Tri-Carb 2910TR |
Ссылки
- Ferrannini, E. beta-Cell function in subjects spanning the range from normal glucose tolerance to overt diabetes: a new analysis. J. Clin. Endocrinol. Metab. 90, 493-500 (2005).
- Weyer, C., Bogardus, C., Mott, D. M., Pratley, R. E. The natural history of insulin secretory dysfunction and insulin resistance in the pathogenesis of type 2 diabetes mellitus. J. Clin. Invest. 104, 787-794 (1999).
- Keenan, H. A. Residual insulin production and pancreatic ss-cell turnover after 50 years of diabetes: Joslin Medalist Study. Diabetes. 59, 2846-2853 (2010).
- Bain, J. R., Schisler, J. C., Takeuchi, K., Newgard, C. B., Becker, T. C. An adenovirus vector for efficient RNA interference-mediated suppression of target genes in insulinoma cells and pancreatic islets of langerhans. Diabetes. 53, 2190-2194 (2004).
- Fueger, P. T. Trefoil factor 3 stimulates human and rodent pancreatic islet beta-cell replication with retention of function. Mol. Endocrinol. 22, 1251-1259 (2008).
- Schisler, J. C. Stimulation of human and rat islet beta-cell proliferation with retention of function by the homeodomain transcription factor Nkx6.1. Mol. Cell Biol. 28, 3465-3476 (2008).
- Chan, C. B. Overexpression of uncoupling protein 2 inhibits glucose-stimulated insulin secretion from rat islets. Diabetes. 48, 1482-1486 (1999).
- Cozar-Castellano, I., Takane, K. K., Bottino, R., Balamurugan, A. N., Stewart, A. F. Induction of beta-cell proliferation and retinoblastoma protein phosphorylation in rat and human islets using adenovirus-mediated transfer of cyclin-dependent kinase-4 and cyclin D1. Diabetes. 53, 149-159 (2004).
- Icyuz, M. Adenovirus infection activates akt1 and induces cell proliferation in pancreatic islets1. Transplantation. 87, 821-824 (2009).
- Kaneto, H. Activation of the hexosamine pathway leads to deterioration of pancreatic beta-cell function through the induction of oxidative stress. J. Biol. Chem. 276, 31099-31104 (2001).
- Antinozzi, P. A., Berman, H. K., O'Doherty, R. M., Newgard, C. B. Metabolic engineering with recombinant adenoviruses. Annu. Rev. Nutr. 19, 511-544 (1999).
- Newgard, C. B., Becker, T. C., Berman, H. K., O'Doherty, R. M. Regulation of overexpressed hexokinases in liver and islet cells. Biochem. Soc. Trans. 25, 118-122 (1997).
- Becker, T. C., BeltrandelRio, H., Noel, R. J., Johnson, J. H., Newgard, C. B. Overexpression of hexokinase I in isolated islets of Langerhans via recombinant adenovirus. Enhancement of glucose metabolism and insulin secretion at basal but not stimulatory glucose levels. J. Biol. Chem. 269, 21234-21238 (1994).
- Csete, M. E. Adenoviral-mediated gene transfer to pancreatic islets does not alter islet function. Transplant Proc. 26, 756-757 (1994).
- Csete, M. E. Efficient gene transfer to pancreatic islets mediated by adenoviral vectors. Transplantation. 59, 263-268 (1995).
- Meng, Z. X. Activation of liver X receptors inhibits pancreatic islet beta cell proliferation through cell cycle arrest. Diabetologia. 52, 125-135 (2009).
- Ronnebaum, S. M. A pyruvate cycling pathway involving cytosolic NADP-dependent isocitrate dehydrogenase regulates glucose-stimulated insulin secretion. J. Biol. Chem. , (2006).
- Milburn, J. L. Pancreatic beta-cells in obesity. Evidence for induction of functional, morphologic, and metabolic abnormalities by increased long chain fatty acids. J. Biol. Chem. 270, 1295-1299 (1995).
- Szot, G., Koudria, P., Bluestone, J. Murine Pancreatic Islet Isolation. J. Vis. Exp. (7), e255 (2007).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены