Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Multi-параметр измерения проницаемости пор Переход Открытие в изолированном сердце мыши Митохондрии
В этой статье
Резюме
Spectrofluorometric протокол для измерения проницаемости митохондриальной переход пор отверстие в изолированном сердце мыши митохондрий, представленные здесь. Анализ включает в себя одновременное измерение митохондрий Ca 2 + Обработка, мембраны митохондрий и митохондриальной потенциальных объемов. Процедура получения качественных и функциональных митохондрий сердца также описан.
Аннотация
Митохондриальной поры перехода проницаемости (mtPTP) является не определенный канал, который образует на внутренней митохондриальной мембраны для транспортировки растворенных веществ с молекулярной массой менее 1,5 кДа. Хотя окончательное молекулярно личности пор находится в стадии обсуждения, белки, такие как циклофилин D, VDAC и ANT вклад в формирование mtPTP. Хотя участие в открытии mtPTP гибели клеток хорошо известно 1, накапливаются данные свидетельствуют о том, что mtPTP служит физиологическая роль в митохондриальной Ca 2 + гомеостаза 2, биоэнергетика и окислительно-восстановительные сигнализации 3.
mtPTP открытие вызвано матрицы Ca 2 +, но его активность может быть модулированным ряда других факторов, таких как окислительный стресс, аденин нуклеотидных истощение, высокая концентрация Pi, митохондриальной деполяризации мембраны или разобщение, и длинные цепочки жирных кислот 4. в пробирке, mtPTP Открытие может быть ACHieved за счет увеличения концентрации Са 2 + в митохондриях путем добавления экзогенного Ca 2 + (мощность удержания кальция). Когда Ca 2 + уровней внутри митохондрий достигает определенного порога, mtPTP открывает и облегчает Са 2 +, диссипация движущей силой протонов, мембранный потенциал коллапса и увеличение объема митохондриальной матрицы (отек), что в конечном итоге приводит к разрыву внешней митохондриальной мембраны и необратимой потере функции органелл.
Здесь мы опишем флуорометрической анализа, который позволяет всеобъемлющей характеристикой mtPTP открытия в изолированном сердце мыши митохондрий. Анализ включает в себя одновременное измерение от 3 митохондриальных параметров, которые изменяются при открытии mtPTP происходит: митохондриальная Ca 2 + обработка (поглощение и освобождение, измеряемые концентрации Са 2 + в тесте среды), митохондриальный мембранный потенциал, и mitochondrial объеме. Красители, используемые для Ca 2 + измерение в среде анализа и митохондриального мембранного потенциала являются Fura FF, мембранные impermeant, логометрические индикатор, который претерпевает сдвиг длины волны возбуждения в присутствии Ca 2 + и JC-1, катионные, логометрические индикатор, который образует зеленую или красную мономеров агрегатов при низких и высоких мембранного потенциала, соответственно. Изменения в митохондриальной объем измеряется путем регистрации рассеяния света митохондриальной суспензии. С высоким качеством, функциональными митохондрий, необходимых для анализа открытии mtPTP, мы также описываются шаги, необходимые для получения нетронутыми, очень связаны и функциональные изолированного сердца митохондрий.
протокол
1. Выделение митохондрий из сердца мышей
- Для выделения митохондрий сердца, обезболить и пожертвовать мышей в соответствии с процедурами, утвержденными локальной Институциональные уходу и использованию животных комитета.
Примечание: Все шаги митохондрий протокол изоляция должна выполняться на льду. Используйте ледяного буфера и предварительно охлажденные чашки Петри, Falcon труб и Эппендорфа. Объемы приведены в протоколе, для образца, содержащего 2 сердца мыши.
- Удалить сердца, поместить их в холодную Митохондрии буфера изоляции (300 мМ сахарозы, 10 мМ Na-HEPES, 200 мкМ ЭДТА, рН 7,4) и смыть кровь.
Примечание: Для получения оптимальных результатов, рН митохондриальной буферы должны быть скорректированы с КОН и уксусной кислоты.
- Место сердца на холодную чашку Петри, удалить жир и предсердия, и фарша мелко помощью лезвия до полученияING однородного продукта.
- Передача фарш сердца в 50 мл трубки Falcon, добавить 10 мл буфера Митохондрии изоляции с 0,1 мг / мл трипсина и позволяют образца переваривать на льду в течение 10 мин.
Примечание: Трипсин в изоляции процедура увеличивает выход изолированных митохондриях и должна быть постоянной между митохондриальной препаратов. Мы рекомендуем тестирование митохондриальной функции по подготовке изолированы является отсутствие трипсина для того, чтобы фермент не мешает функциональности.
- Добавить 10 мл буфера Митохондрии изоляции с 0,1% жирных кислот BSA и 5 мг ингибитора трипсина (соя) и перемешать путем обращения трубку несколько раз, чтобы нейтрализовать трипсина.
Примечание: Митохондрии буфера Изоляция может быть подготовлен заранее и может храниться при температуре -20 ° C. Проверьте рН при оттаивании. Трипсина, ингибитора трипсина или BSA должны бытьdded в митохондрии буфера изоляции в день эксперимента.
- Восстановление переваривают ткани с низкой и средней скоростью центрифугирования в течение 1 мин при 4 ° C.
- Ресуспендируют ткани в 8 мл Митохондрии буфера изоляции с 0,1% жирных кислот BSA и гомогенизации помощью моторизованного Dounce гомогенизатор с тефлоновым пестиком (4-6 проходов в 1,200-14,00 оборотов в минуту). Храните образцы на льду, в то время как гомогенизации.
- Передача гомогената в 15 мл Сокол трубки и центрифуге при 800xg в течение 10 мин при 4 ° С для осаждения ядер и ткани мусора.
- Восстановление супернатант, содержащий митохондрий в пробирки Eppendorf и центрифуге при 8000 мкг в течение 15 мин при 4 ° C.
- Удалите тщательно верхнего белого слоя и промыть оставшийся темный осадок, содержащий митохондрий в 1 мл буфера Митохондрии изоляции.
- Центрифуга на 8000xg в течение 15 мин при 4 ° C. Удалите супернатант и ресуспендируют митохондрий осадок в 150 мкл митохондриальной Isolaния буфера. Держите митохондрий на льду для дальнейших анализов.
Примечание: Для достижения наилучших результатов при функциональных анализов, используйте митохондрий в течение 4 часов в изоляции.
- Количественная митохондриальных белков с помощью анализа Брэдфорда.
2. Контроль качества изолированных митохондриях
2.1. Измерение дыхательный коэффициент (РКП)
- Калибровка электрода Oxytherm кислорода с насыщенной воздухом воде для установления максимальных линии кислорода. При стабильном уровне кислорода получается добавить 100 мкл свежеприготовленного 10 мМ натрий гидросульфит решение установить нулевую линию кислорода. Выполнить измерения при температуре 30 ° C.
- Добавить 2 мл буфера Дыхание митохондрий (125 мМ КСl, 20 мМ HEPES, 3 мМ MgCl 2, 400 мкМ EGTA, 300 мкм DTT, 5 мМ KH 2 PO 4, рН 7,2) с 1 мкМ ротенон к Oxytherm камеры, уплотнения камеры и начала RecorДин.
- Когда кислород сигнал стабильный, добавить 250 мкг митохондрий и записи базального дыхания в течение 1 мин. Дыхание в этот момент должна быть очень низкой, как митохондрии дышащие на эндогенные субстраты (состояние 1 дыхании).
- Добавить 5 мМ сукцината и запись сигнала в течение 1 мин. Потребление кислорода должно увеличиться в состояние 2 дыхании.
- Вызвать состояние 3 дыхания добавлением 150 мкМ ADP. При этом потребление кислорода точка должна увеличиваться за счет синтеза АТФ путем окислительного фосфорилирования. Запись сигнала, пока дыхание замедляется, указывая ADP потребления и переход в состояние 4 дыхания. Запись Состояние 4 дыхания в течение не менее 1 мин.
- Добавить 1 CCCP мкМ и запись сигнала в течение 1 мин. Несвязанных дыхание должно быть максимальным.
Примечание: эффект CCCP на дыхание митохондрий является дозозависимым: высокая концентрация CCCP может препятствовать потреблению кислорода и поэтому должны быть тщательно тitrated.
- Рассчитать дыхательный коэффициент (РКП), разделив скорость потребления кислорода в состоянии 3 дыхание скоростью потребления кислорода во время состояние 4 дыхания. Целевой RCR должна быть ≥ 4.
2.2. Оценка митохондриальной целостности мембраны (цитохром с тест)
- Тщательно вымойте камеру Oxytherm с 70% этанола и воды и повторите шаги 2.1.2 -2.1.4.
- Добавить 1 мМ ADP и запись потребления кислорода в течение 1 мин.
- Добавить 10 мкМ цитохром с. Так как цитохром с непроницаемой для нетронутыми митохондриальных мембран, увеличение дыхания указывает сломаны или повреждены мембраны митохондрий.
3. Измерение митохондриальной Открытие переходных пор проницаемости
- Установка спектрофлуориметре для многопараметрических измерений открытия mtPTP. Используя программу FelixGx, создать новую конфигурацию оборудования (Quanta мастер устойчивый станциитэ), содержащий источник света, монохроматор возбуждения, образец отсека и два детектора под углом 90 ° и 270 ° по отношению к возбуждению монохроматора (рис. 4). Для достижения максимального разрешения по времени, как эмиссия монохроматоров (90 ° и 270 °) должны быть отключены и выбросов фильтрами на 90 ° и 270 ° в образце отсека включен в меню конфигурации оборудования. Этот шаг будет удалить управления двигателем излучения длиной волны и закрепите каждый монохроматора на определенной длине волны. Если выбросы монохроматоров не отключены, каждый детектор цикл между двумя длинами волн и повторяющиеся измерения будут записаны.
- Создать новый протокол приобретение использованием нескольких типов краски и введите следующие красители:
- Фура (высокая Ca + +): возбуждение 340 нм, излучение 525 нм (детектор 1)
- Фура (низкий Ca + +): возбуждение 380 нм, излучение 525 нм (детектор 1)
- JC1 (складочном): возбуждение 543 нм, Эмиссия 595 нм (детектор 2)
- JC1 (мономера): возбуждение 498 нм, излучение 525 нм (детектор 1)
- Отеки: возбуждение 525 нм, излучение 525 нм (детектор 1)
- Установить возбуждения и излучения щелей до 1 нм и температуре до 37 ° C.
- Для получения логометрические сигнал для Fura и JC-1, генерировать два производных следы: Фура (высокая Ca + +) / Фура (низкий Ca + +) и JC1 (складочном) / JC1 (мономеров).
- Ручная регулировка длины волны излучения детекторов 1 и 2, 525 нм и 595 нм, соответственно.
- Смешайте 1 мл буфера для анализа митохондрий (120 мМ KCl, 10 мМ NaCl, 1 мМ KH 2 PO 4, 20 мМ HEPES-Трис, рН 7,2) с 1 мкМ ротенон, 5 мМ сукцината и 800 нМ Fura FF в одноразовом 4-х сторонняя метакрилата кювет. Добавить 250 мкг митохондрий и место образца в выборке отсека. Убедитесь, что магнитная мешалка включена.
- Начать запись. Через 1 мин, пауза приобретение, добавить 500 нМ JC-1, а затем перезапуститьcquisition. JC-1 отношение сигнал следует увеличить, указав красителя активными митохондриями. Продолжайте запись до JC-1 сигнал достиг плато (обычно в течение 5 мин).
- Добавить 20 мкМ CaCl 2. Мгновенное увеличение соотношения сигнал Fura FF должны соблюдаться увеличился Ca 2 + присутствие в буфере, а затем постепенное снижение в связи с митохондриальной Ca 2 + поглощения. JC-1 отношение сигнал должен обладать краткий переходный снижение свидетельствует о небольшой митохондриальной деполяризации мембраны.
- Подождите, пока фура возвращается FF соотношение сигнал базального уровня перед добавлением другого CaCl 2 импульса (1-1,5 мин). Продолжить пульсирует через фиксированные промежутки времени, пока митохондрии не может накапливаться Ca 2 + и начать освобождение Са 2 + в буфере. mtPTP открытия визуализируется одновременного увеличения соотношения сигнал Fura FF в связи с Са 2 +, снижение JC-1 отношение сигнал в связи с мембранной Потьеntial коллапс, и уменьшение рассеяния света из-за набуханию митохондрий (рис. 5).
- После активации mtPTP, убедитесь, специфика Fura FF, JC-1 и отек сигналы, соответственно, с 1 мМ EGTA, 1 мкМ CCCP и 5 мкг / мл аламетицин.
- Чтобы убедиться в специфике открытия mtPTP, повторите шаги 3,6 - 3,9 в присутствии 1 мкМ ингибитора циклоспорина циклофилин D (циклофилин D является одним из компонентов mtPTP). В присутствии циклоспорина, открытие mtPTP требуется значительно больше CaCl 2 импульсов, чем контрольные образцы (рис. 6).
4. Представитель Результаты
На рисунке 2 показан типичный дыхательного контроля изолированного сердца мыши митохондрий. Состояние 3 дыхания достигается путем добавления АДФ в митохондриях дышащих на сукцинат, и характеризуется значительно увеличилось потребление кислорода по отношению к substraТе в одиночку. Истощение добавил ADP посвященных Состояние 4 дыхания, во время которого потребление кислорода замедляет и сопоставимы с темпами достигнуты до того ADP. RCR получается путем деления скорости потребления кислорода для дыхания, состояние 3 с тем, что государственный 4 дыхания. Тест цитохрома С используется для анализа целостности наружной митохондриальной мембраны: когда цитохрома С добавляют в митохондриях дышащих на сукцинат и ADP, дальнейшее увеличение дыхания наблюдается, что свидетельствует нетронутыми внешней мембраны митохондрий (рис. 3).
Представитель изображения для открытия mtPTP в изолированных митохондриях сердца показано на рисунке 4. В этом случае mtPTP открытие было вызвано добавлением 4 CaCl 2 импульсов (20 мкМ каждый) на 1,5 минутные интервалы. mtPTP открытие очевидно, в ближайшее одновременный выпуск митохондриальной Ca 2 + (увеличение соотношения сигнал Fura FF), развал mitochondриала мембранный потенциал (снижение JC-1 отношение сигнал) и увеличился объем митохондриальной (уменьшение отека сигнала). Когда циклоспорина добавлен, который связывается с компонентом циклофилин D из mtPTP, mtPTP открытия требуется 7 импульсов CaCl 2, а не 4 (рис. 5).
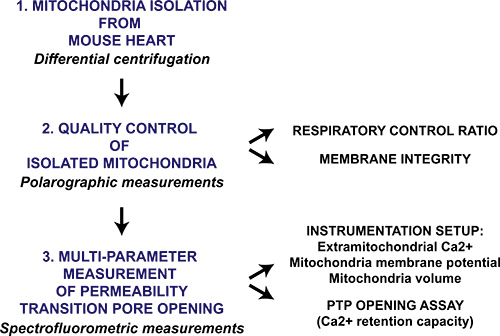
Рисунок 1. Технологическая схема многопараметрического митохондриальной проницаемости переход пор открытие протокола для изолированных митохондриях сердца. Сердце собирается с мышами и митохондрии изолированы посредством дифференциального центрифугирования. Митохондриальных препарат затем качественно оценивать полярографического измерения дыхательный коэффициент и митохондриальной мембраны сохранность в присутствии цитохрома с. Митохондриальной проницаемости переход пор отверстие в изолированных митохондриях вызывается последовательным CaCл 2 дополнения и измеряется с помощью мониторинга спектрофлуориметре Са 2 + из митохондрий, мембранный потенциал коллапс и отек митохондрий.
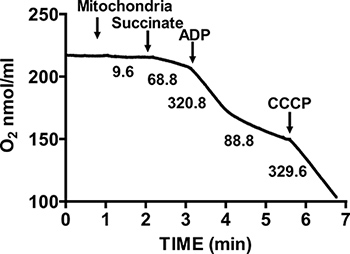
Рисунок 2. Измерение дыхательный коэффициент (РКП) изолированных митохондриях сердца. Потребление кислорода изолированными митохондриями сердца измеряется в состоянии 3 дыхания в присутствии сукцината и ADP, а в State 4 дыхания после употребления ADP. В ответ изолированных митохондрий разобщители измеряется путем добавления CCCP. Цифры на графике являются темпы потребления кислорода изолированными митохондриями в нмоль / мин / мг белка.
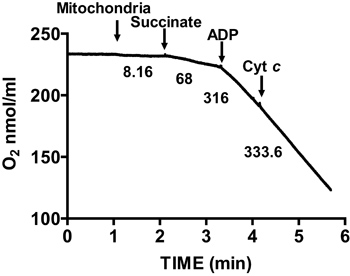
Рисунок 3. Измерение ния мембранной целостности изолированных митохондриях сердца. Митохондриальная целостности мембраны определяется путем измерения потребления кислорода в изолированных митохондрий в присутствии сукцината и ADP и после того цитохрома с. Цифры на графике являются темпы потребления кислорода изолированными митохондриями в нмоль / мин / мг белка.
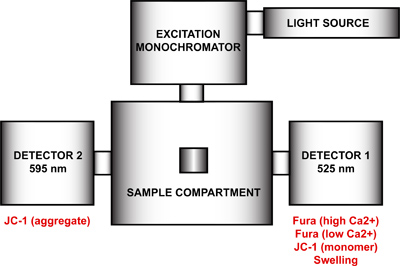
Рисунок 4. Спектрофлуориметре аппаратную конфигурацию для нескольких параметров измерения открытие mtPTP. Аппаратная конфигурация спектрофлуориметре включает в себя источник света, монохроматор возбуждения, образец отсека и двух детекторов с фиксированной длиной волны излучения при 525 нм и 595 нм. Детектор 1 используется для обнаружения сигнала от Fura FF высоким и низким Ca 2 +, JC-1 мономер, и набухание сигнала. Detector 2 измеряет JC-1 совокупный сигнал.
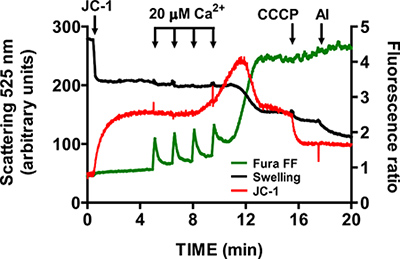
Рисунок 5. Multi-измерения параметров открытия mtPTP в изолированных митохондриях сердца. mtPTP открытие было вызвано последовательным добавлением 20 мкМ CaCl 2 и характеризуется Са 2 + из митохондрий, митохондриальная распада мембранного потенциала и увеличение объема митохондриальной матрицы (отек). Extramitochondrial Ca 2 + и мембранного потенциала были измерены с радиометрические показатели Fura FF (зеленая линия) и JC-1 (красная линия). Набухание митохондрий измерялась по рассеянию света при 525 нм (черная линия). Специфика JC-1 и отек сигналов была протестирована с 1 мкМ CCCP и 5 мкг / мл аламетицин (микробные токсины).
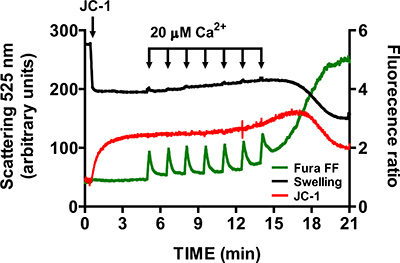
Рисунок 6. Нескольких-Измерения параметров открытия mtPTP в изолированных митохондриях сердца в присутствии циклоспорина А. Циклоспорин (1 мкМ) увеличивает количество CaCl 2 импульсов, необходимых для открытия mtPTP в изолированных митохондриях сердца.
Обсуждение
Протокол, представленные здесь описываются необходимые экспериментальные шаги для оценки проницаемости переход пор открытие в изолированных митохондриях сердца (рис. 1 и 4): процедура выделения мышью митохондрий сердца, дыхательной управления, обеспечения их целост...
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Эта работа была поддержана HL094536 (BJH).
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента | Компания | Номер в каталоге | |
| Трипсин | Sigma-Aldrich | T3030 | |
| Ингибитора трипсина (соя) | Sigma-Aldrich | T9128 | |
| Натрия гидросульфит | Sigma-Aldrich | 71699 | |
| Ротенон | Sigma-Aldrich | R8875 | |
| Цитохром с | Sigma-Aldrich | C7752 | |
| Аламетицин | Sigma-Aldrich | A4665 | |
| CCCP | Sigma-Aldrich | C2759 | |
| Циклоспорин | Calbiochem | 239835 | |
| Фура FF | Invitrogen | F14180 | |
| JC-1 | Invitrogen | T3168 | |
| Ткань мясорубку Поттер Elvehjem с тефлоновым пестиком 15 мл | Уитон Industries | ||
| Накладные мешалкой | Уитон Industries | 903475 | |
| Oxytherm (с контролем температуры кислородного электрода) | Hansatech инструменты | ||
| QuantaMaster 80 двойных спектрофлуориметре выбросов | Фотон Technology International, Inc |
Ссылки
- Kroemer, G., Galluzzi, L., Brenner, C. Mitochondrial Membrane Permeabilization in Cell Death. Physiol. Rev. 87, 99-163 (2007).
- Elrod, J., Wong, R., Mishra, S., Vagnozzi, R. J., Sakthievel, B., Goonasekera, S. A., Karch, J., Gabel, S., Farber, J., Force, T., Brown, J. H., Murphy, E., Molkentin, J. D. Cyclophilin D controls mitochondrial pore-dependent Ca2+ exchange, metabolic flexibility, and propensity for heart failure in mice. J. Clin. Invest. 120, 3680-3687 (2010).
- Hom, J. R., Quintanilla, R. A., Hoffman, D. L., de Mesy Bentley, K. L., Molkentin, J. D., Sheu, S. S., Porter, G. A. The permeability transition pore controls cardiac mitochondrial maturation and myocyte. 21, 469-478 (2011).
- Halestrap, A. P. What is the mitochondrial permeability transition pore. Journal of Molecular and Cellular Cardiology. 46, 821-831 (2009).
- Wei, A. C., Liu, T., Cortassa, S., Winslow, R. L., O'Rourke, B. Mitochondrial Ca2+ influx and efflux rates in guinea pig cardiac mitochondria: low and high affinity effects of cyclosporine A. Biochim. Biophys. Acta. 1813, 1373-1381 (2011).
- Saks, V. A., Kuznetsov, A. V., Kupriyanov, V. V., Miceli, M. V., Jacobus, W. E. Creatine kinase of rat heart mitochondria. The demonstration of functional coupling to oxidative phosphorylation in an inner membrane-matrix preparation. J. Biol. Chem. 260, 7757-7764 (1985).
- Boehm, E. A., Jones, B. E., Radda, G. K., Veech, R. L., Clarke, K. Increased uncoupling proteins and decreased efficiency in palmitate-perfused hyperthyroid rat heart. AJP - Heart. 280, 977-983 (2001).
- Fontaine, E., Eriksson, O., Ichas, F., Bernardi, P. Regulation of the Permeability Transition Pore in Skeletal Muscle Mitochondria. J. Biol. Chem. 273, 12662-12668 (1998).
- Berman, S. B., Watkins, S. C., Hastings, T. G. Quantitative biochemical and ultrastructural comparison of mitochondrial permeability transition in isolated brain and liver mitochondria: evidence for reduced sensitivity of brain mitochondria. Exp. Neurol. 164, 415-425 (2000).
- Panov, A., Dikalov, S., Shalbuyeva, N., Hemendinger, R., Greenamyre, J. T., Rosenfeld, J. Species- and tissue-specific relationships between mitochondrial permeability transition and generation of ROS in brain and liver mitochondria of rats and mice. Am. J. Physiol. Cell Physiol. 292, 708-718 (2007).
- Frezza, C., Cipolat, S., Scorrano, L. Organelle isolation: functional mitochondria from mouse liver, muscle and cultured filroblasts. Nature Protocols. 2, 287-295 (2007).
- Pallotti, F., Lenaz, G. Isolation and subfractionation of mitochondria from animal cells and tissue culture lines. Methods Cell Biol. 80, 3-44 (2007).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены