Method Article
Обратной генетики опосредованного восстановления инфекционных мышей норовирус
* Эти авторы внесли равный вклад
В этой статье
Резюме
Норовирусы являются основной причиной гастроэнтерита еще молекулярных методов для их характеристики все еще относительно новое. Здесь мы сообщаем о двух различных подходах обратной генетики для эффективного восстановления мышей норовирус (МНВ), единственный член этого рода, которые могут быть размножены в культуре клеток.
Аннотация
Норовирусов человека ответственны за большинство случаев человека гастроэнтерит (GE) по всему миру и являются актуальной проблемой в условиях, когда близкий человек к человеку контакта не избежать 1, 2. За последние несколько лет рост заболеваемости вспышек в больнице сообщили, что приводит к значительным сбоям в их оперативных возможностей, а также большие экономические потери. Выявление новых противовирусных подходов был ограничен в связи с неспособностью человека норовирусов завершить продуктивной инфекции в культуре клеток 3. Недавнее выделение мышиных норовирус (МНВ), тесно связаны с человеческой норовирус 4, но которые могут быть распространены в клетках 5, открыл новые возможности для изучения этих патогенов 6, 7.
МНВ репликации приводит к синтезу новых позитивных чувств и геномной subgenomic молекул РНК, последняя из которых соответствует последним Тхим вирусного генома (рис. 1). МНВ содержит четыре различных открытых рамок считывания (ORF,), из которых ORF1 занимает большую часть генома и кодирует семь неструктурных белков (NS1-7), освобождаются от полипротеина предшественника. ORF2 и ОРС3 содержатся в subgenomic региона РНК кодируют белки капсида (VP1 и VP2, соответственно) (рис. 1). Недавно мы определили, что дополнительные ORF4 перекрытия ORF2, но в другом кадре чтение функциональное и кодирует митохондриальную локализованных факторов вирулентности (VF1) 8.
Репликация на положительном смысле РНК-содержащих вирусов, в том числе норовирусы, происходит в цитоплазме в результате синтеза новых раскрытый геном РНК. Чтобы способствовать вирусная перевод, вирусы использовать различные стратегии, направленные на вербовку клеточные механизмы синтеза белка 9-11. Интересно, что норовирус перевод обусловлен многофункциональный вирусный белок-премьера ВПгковалентно связан с 5 'конца и геномной РНК и subgenomic 12-14. Этот сложный механизм перевода, вероятно, будет основным фактором в ограниченной эффективности вирусного восстановления обычной обратной подходы генетики.
Здесь мы приводим две различные стратегии, основанные на генерации мышиных норовирус-1 (именуемые Многовершинном при этом) стенограммы максимум 5 'конца. Одним из методов включает в себя как в пробирке синтеза и укупорки вирусной РНК, в то время как второй подход влечет за собой транскрипцию Многовершинном кДНК в клетках, экспрессирующих Т7 РНК-полимеразы. Наличие этих систем обратного генетики для изучения МНВ и маленькая модель животного предоставил беспрецедентную возможность анализировать роль вирусных последовательностей в репликации и патогенезе 15-17.
протокол
1. Транскрипция РНК и укупорки для восстановления инфекционных Многовершинном
Этот протокол разработан так, чтобы эффективное восстановление инфекционных Многовершинном из кДНК в пробирке с помощью транскрипции и последующей в пробирке укупорки (раздел 1.1). В результате крышками транскрипты то трансфекции в клетки для восстановления инфекционных Многовершинное (разделы 1.2 и 1.3). Такой подход обеспечивает наиболее чувствительным методом для восстановления Многовершинном с типичной урожайности свыше 10 5 инфекционных единиц на 35 мм (в диаметре), блюда из клетки для Многовершинном. Протокол ниже:
Синтез 1,1 инфекционных крышками стенограммы Многовершинном:
- Дайджест плазмиды, содержащей дикого типа Многовершинном кДНК (pT7: Многовершинном 3'Rz) с NHE Я для получения линейной ДНК NHE Я признает уникальный сайт рестрикции после 3 'конца полиА хвост Многовершинном генома (рис. 2).. Линеаризованные плазмид, как правило, очищенныйс использованием кремния столбцов (например, ПЦР ДНК GFX гель группы Очистка Kit от компании GE Healthcare) и элюировали H 2 O.
- В пробирке записать вектор линеаризованной использованием T7 РНК-полимеразы, как описано выше 17. Многие коммерческие наборы для этой цели и обеспечить воспроизводимый метод большого количества РНК, таких как MEGAScript (Life Technologies) и RiboMAX (Promega). Транскрипция реакции, как правило, ДНКазы переваривается до дальнейшего анализа, однако во многих случаях это не требуется, поскольку очищение хлорида лития, как описано ниже, не осаждаются ДНК эффективно.
- Анализ небольшую аликвоту реакции транскрипции РНК, как правило, 0,5 мкл или менее, с помощью электрофореза в агарозном геле для обеспечения транскрипции реакция работала эффективно и РНК полной длины. Хотя многие пользователи предпочитают работать денатурирующих гелях правильно размер РНК, мы обычно используем неденатурирующем агарозном геле electrophorГипотеза, как экспресс-метод для анализа РНК целостности. Геном Многовершинном как производится из инфекционной кДНК клона pT7: Многовершинном 3'Rz будет работать примерно в 3 кб по отношению к лестнице дц на неденатурирующем агарозном геле (рис. 3).
- Учтите, что другие методы доступны в качестве альтернативы для получения быстрого анализа целостности РНК, такие как использование bioanalyser Agilent (рис. 3).
- Следует отметить, что низкое разрешение гель могут возникнуть, если слишком много РНК загружен. Будьте особенно внимательны, чтобы обеспечить агарозном геле готовится с использованием РНКазы без реагентов, чтобы избежать деградации РНК во время электрофореза, которые могут повлиять группа разрешения. Отопление РНК до 65 ° С с последующим охлаждением на льду также может помочь в некоторых случаях.
- Очисти РНК образца для удаления неинкорпорированных нуклеотидов. Имеется много методов для этого в том числе силикагеле основаны подходы, однако в этом протоколе мы обычно используем хлорида лития в качестве экономически эффективной альтернативой. ДляС этой целью, добавьте H 2 O, чтобы достичь конечного объема 100 мкл, а затем добавить 40 мл хлорида лития осадков раствора (7,5 М LiCl, 50 мМ ЭДТА, рН 8,0, Ambion) и хранения образцов при температуре -20 ° С в течение не менее 30 мин.
- Гранул РНК центрифугированием при 12000 х г при 4 ° С в течение 15 мин.
- Удалить супернатант, стараясь не нарушить полупрозрачные гранулы РНК и промойте его в 150 мкл 70% этанола. Центрифуга трубки при 12000 х г при 4 ° С в течение 15 мин.
- Удалить этанола и воздушно-сухой РНК, что позволяет избежать пеллет полностью высохнуть, как это сделает ресуспендирования трудно.
- Затем ресуспендирования Многовершинном стенограммы в 50-100 мкл РНК решение для хранения данных (Ambion). Следует проявлять осторожность, чтобы гарантировать, что все РНК растворенного правильно. В случае РНК появляются трудно растворим в полном объеме, нагревом до 60 ° С может помочь ресуспендируют он. Любой нерастворимый материал должен быть удален бу центрифугирования до РНК количественного. Очищенный транскрипты раскрытый и требуют последующего в пробирке укупорки шаг, чтобы быть инфекционными (ScriptCap m7G укупорки системы, Эпицентр биотехнологии).
- Количественная РНК спектрофотометрии. В зависимости от характера и масштабов транскрипцией реакции, типичные урожайность составляет от 50-150 мкг РНК на 100 мкл реакции транскрипции. Целостность РНК должны быть проанализированы до укупорки реакция уходит 100-300 нг образца в 1% агарозном геле (рис. 3).
- Для повышения эффективности РНК укупорки, тепло от 60 до 70 мкг Многовершинном транскриптов РНК при 65 ° С в течение 10 минут, а затем поместить трубку сразу же на льду. Этот шаг может снизить любой тормозящее влияние структуры РНК на покрытие. Импульсный трубки в охлажденном микроцентрифужную для сбора капель, образующихся при нагревании шаг.
- Подготовить укупорки реакционной смеси, как это предлагается изготовителем (ScriptCap m7GСистема укупорки, Эпицентр биотехнологии). Короче говоря, добавить 60-70 мкг РНК Многовершинном до конечного объема реакции 100 мкл. Укупорки реакционной смеси могут содержать 10 мкл 10 х укупорки буфера (500 мМ TrisHCl рН 8,0, 60 мМ KCl, MgCl2 12,5 мм), 10 мкл 10 мМ GTP, 0,5 мкл 20 мМ S-аденозил метионина, 2,5 мкл Scriptguard (100 единиц), и 4 мкл фермента Scriptcap (40 единиц).
- В ходе реакции настроить, сохранить РНК-транскрипты на лед, чтобы избежать деградации. Хорошо перемешать реакционной смеси, а затем инкубировать ее при 37 ° С в течение 1 часа. Обратите внимание на реакцию размер может масштабироваться в зависимости от количества крышками запись требуется.
- Очисти РНК осадков LiCl, как описано выше (см. пункт 1.1.6). Растворите гранулы в 50-100 мкл РНК решение для хранения данных (Ambion) и определить количество РНК. Как правило, образцы РНК впоследствии нормированы на 1 мкг / мкл. Опять же, проверить все РНК растворенного правильно. Если она не была должным образом растворяются, тепло-тОн образец до 60 ° C, чтобы его расторжения. Удалите с помощью центрифугирования любого нерастворимого материала до РНК количественного.
- Проверьте целостность РНК снова прежде, чем приступить к трансфекции шаг. С этой целью запуска количество 100-300 нг образца в 1% агарозном геле (рис. 3).
Восстановление на 1,2 Neon-опосредованной трансфекции РНК в клетках Raw264.7:
Для восстановления Многовершинном инфекционных вирионов в разрешительной клеточной линии можно electroporate крышками Многовершинном запись в Raw264.7 клеток с использованием системы Neon трансфекции (Invitrogen). Raw264.7 являются клетки восприимчивы к инфекции Многовершинном, поддержку нескольких раундов репликации вируса и последующего повторного заражения. В результате, типичный выход подойдет более 10 5 инфекционных единиц на мл через 24 часа после трансфекции, но пик> 10 7 инфекционных единиц после 48 часов.
- За день до переходаsfection, семена Raw264.7 клетки, по оценкам, 50% слияния. Как правило, две колбы T75 клеток требуется для 3 трансфекции.
- В день трансфекции, очистить клетки монослоя изменения в Орел Дульбекко среде (DMEM), содержащей 10% эмбриональной телячьей сыворотки (FCS), обеспечивая вам создать суспензии отдельных клеток повторным пипетирования.
- Определить концентрацию жизнеспособных клеток в гемоцитометра использованием трипанового синего исключение для обозначения нежизнеспособных клеток.
- Гранул клеток в 1200 г Х в течение 5 минут и ресуспендируют их в DMEM, содержащей 10% FCS в конечной концентрации 8 х 10 6 клеток / мл.
- Незадолго до трансфекции аликвоту 1 мл клеток на трансфекции и гранул их в 1200 г Х в течение 2 мин. Выньте материал и промойте клетки в 500 мкл PBS (без Mg 2 + / Ca 2 +). Спином вниз клетки снова в 1200 г Х в течение 2 мин. Обратите внимание, желательно, чтобы сохранить клетки DMEM для как можно дольшекак хранение в PBS в течение длительного периода времени может поставить под угрозу жизнеспособность клеток и трансфекция ставки.
- Удалить из труб PBS и добавьте 130 мкл ресуспендирования решение (Neon комплект системы трансфекции Invitrogen) до конечной концентрации 6 х 10 7 клеток / мл. Следует проявлять осторожность, чтобы ресуспендирования клеток избегая образования пузырьков, которые будут вызывать искрообразование при трансфекции и выживания компромисс клетки.
- Добавьте соответствующее количество крышками Многовершинном запись в клетки (рис. 2), как правило, 1,3 мкг крышками РНК добавляется до 130 мкл ресуспендированного клеток и смешанных мягко. Затем собрать 100 мкл смеси в 100 мкл наконечник трансфекции Neon. Особое внимание должны быть приняты для обеспечения того, чтобы не было пузырей образуются в электропорации кюветы (Neon комплект системы трансфекции 100 мкл наконечник), поскольку это вызовет провал эксперимента.
- Electroporate клеток с помощью одного импульса при 1700 В в течение 25 мс, анsuring отсутствие искр во время пульсирует которые указывают на наличие пузырьков в пробе. В случае искрения должно произойти, отказаться от образца и повторить трансфекции. Отпустите клеток в пробирку Эппендорфа, содержащий 1 мл антибиотика бесплатно DMEM, содержащей 10% FCS. Обратите внимание, каждый наконечник может быть повторно использовано до трех раз с того же образца РНК, если большее число трансфицированных клеток не требуется.
- После этого, распространение клеток из трубы в независимых скважин содержащих достаточное количество нагретого антибиотик бесплатно DMEM, содержащей 10% FCS. В качестве общего руководства, 150 мкл суспензии клеток, образующихся при шаге 1.2.8 достаточно для одной скважины 24-блюдо пластины, содержащей 0,5 мл предварительно нагретого DMEM, в то время как 300 мкл подходят для хорошо 12-блюдо пластины содержащий в 1 мл нагретого DMEM.
- Инкубируйте клетки при 37 ° С и 10% CO 2 от 24 до 72 часов. Затем отпустите инфекционных вирионов из клеток одного (или более)замораживания и оттаивания и определить титр вируса в образце, используя либо анализ налета или TCID50. Обратите внимание, что лизаты должны быть уточнены путем центрифугирования в течение 1-2 минут на максимальной скорости или их фильтрация через 0,22 мкм фильтр поры до титрования. Как правило, титры Многовершинном достигает примерно 1 х 10 6 TCID50/ml через 24 часа после трансфекции и до 1 х 10 9 на 72 часа после трансфекции.
- Наличие и стабильности мутаций введен в pT7: Многовершинном 3'Rz, как правило, определяется последовательность спас вирусов после 2 до 5 дополнительных мест в Raw264.7 клеток.
Восстановление на 1,3 липофекция в ВНК-21 ячеек:
Более прямой и зачастую более эффективный метод для восстановления инфекционных Многовершинном с крышками протоколов осуществляется через липофекция (липофектамина 2000 Invitrogen). Учитывая, что Raw264.7 клеток трудно трансфекции использованием липидных подходов мы обычно используем др.э легко трансфекции клеточных линий, таких как ВНК-21, который является увековечены линии, полученные из фибробластов ребенка почек хомяка. В стандартный подход в нашей лаборатории мы используем BSR-T7 клеток, производное от ВНК-21 клеточные линии, в то время как эти клетки легко трансфекции и поддерживать Многовершинном репликации, у них нет подходящих рецепторов, чтобы несколько раундов повторного заражения . В результате, вирус выход информации из этой системы является показателем за один цикл репликации вируса. Этот подход особенно полезен при изучении влияния мутации вируса на восстановление, так как позволяет нескольким трансфекции должны быть выполнены при существенно сократить затраты по сравнению с Neon-опосредованной трансфекции, а также не требует специального оборудования. Стоит отметить, что другой доступной клеточных линий, таких как человеческие эмбриональные клетки почек 293T также поддерживает эффективное восстановление Многовершинном однако условия трансфекции сначала должны быть оптимизированы для обеспечения эффективной доставки РНК.
- ТрипсинISE монослоя ВНК-21 клеток (или BSR-T7 клетки), семенной 7,5 х 10 5 клеток на 35 мм в диаметре блюдо антибиотик без питательной среды и инкубировать клетки при 37 ° С с 10% CO 2 в одночасье. Дважды количество клеток в каждую тарелку, если трансфекции планируется в тот же день посева, и позволяют клеткам присоединиться к пластине в течение 2-3 часов при температуре 37 ° С и 10% CO 2. Обратите внимание, что другие клетки, которые подходят для этого подхода включают человека 293T клеток гепатоцеллюлярной карциномы человека Huh7 клеток и африканских зеленых мартышек Cos7 клеток.
- Удалите носитель из клетки и замените 3 мл свежей среды без антибиотиков для обеспечения максимальной эффективности трансфекции.
- Приготовить смесь из 1-2 мкг крышками Многовершинном запись в 100 мкл Opti-MEM (Invitrogen) и смешать его с 4 мкл липофектамина 2000 предварительно смешиваются в 100 мкл Opti-MEM. Смешайте образец тщательно с помощью пипетки его вверх и вниз 15 раз. Оставлятьсмесь при комнатной температуре в течение 20 минут.
- Добавить трансфекции комплексов, содержащих крышками стенограммы Многовершинном в каплям мода на клеточный монослой и встряхните пластины в перпендикулярных направлениях.
- Инкубируйте клетки при 37 ° С и 10% CO 2 от 24 до 72 часов. После освобождения инфекционных вирионов из клетки замораживания и оттаивания и определить титр вируса на анализ налета или TCID50. Типичные дает около 1 х 10 6 TCID50/ml достигнуты.
2. Прямое восстановление инфекционных Многовершинном из кДНК в клетках, экспрессирующих Т7 РНК-полимеразы
Этот протокол разработан так, чтобы восстановление Многовершинном в клетках транскрипция инфекционных плазмиды укрывательство полную геномную последовательность кДНК с помощью полимеразы Т7 выражается в клетках. Различные клеточные линии могут быть использованы для восстановления инфекционных Многовершинном этот подход, хотя мы обычно получают высокие урожаи с ВНК-21 и BSR-T7 сеООО 15. Обычно мы используем BSR-T7 клеток, так как они растут быстрее, чем родительские линии клон ВНК. Клетки, инфицированные fowlpox (FPV) кодировки для Т7 РНК-полимеразы (FPV-T7) 18, которая функционирует в качестве помощника вируса ехать выражение вирусной РНК и последующего восстановления инфекционных вирусов (рис. 4). Хотя BSR-T7 клеток конститутивно экспресс Т7 РНК-полимеразы, это выражение не является достаточным, чтобы спасти инфекционных Многовершинном после трансфекции pT7: Многовершинном 3'Rz в отсутствии вспомогательных FPV-T7. В то время как типичный выход из этой системы, по крайней мере в 10 раз ниже, чем описанные выше, этот подход не обеспечит быстрый метод скрининга мутантов, чтобы идентификация изнурительных мутаций. Обычно этот метод используется в первую очередь для оценки жизнеспособности кДНК конструкции. Если строить или не приводят к инфекционным вирусом или по всей видимости, выход вируса на более низком уровне, чем у дикого типа инфекционного клона, то РНК на основе подхоч описанных выше обязательств.
- Trypsinise монослоя ВНК-21 клеток (или BSR-T7 клеток) и семян 7,5 х 10 5 клеток на 35 мм блюдо к антибиотикам свободных средств массовой информации и инкубировать рост клеток при 37 ° С и 10% CO 2 в одночасье. Добавить в два раза больше клеток в каждую тарелку, если трансфекции планируется в тот же день посева, и позволяют клеткам присоединиться к пластине в течение 2-3 часов при температуре 37 ° C и 10% CO 2.
- Удалить медиа культуре клеток и добавить 700 мкл FPV-T7 в каждую лунку (рис. 4). Множественности заражения (МВД) ~ 0,5 БОЕ на клетку, основанный на титровании на первичные фибробласты эмбриона курицы, как правило, используется. Однако стоит отметить, что новые препараты вспомогательные вируса, выращенного в первичных фибробластов, функционально титровать для определения дозы, необходимые для эффективного восстановления вируса. Протоколы для распространения и титрования FPV-T7 было описано выше 18.
- Вcubate при 37 ° С и 10% CO 2 в течение 1 часа, чтобы FPV-T7, чтобы заразить клетки. Затем добавьте 2 мл антибиотика бесплатно DMEM, содержащей 10% FCS и инкубировать клетки еще на час при 37 ° C и 10% CO 2, чтобы Т7 РНК-полимеразы выражения.
- Чтобы приступить к трансфекции инфекционной плазмиды, в первую очередь удалить средства массовой информации с зараженных клеток, промыть 2 мл средства массовой информации (10% FCS к антибиотикам бесплатно DMEM) и, наконец, покрытие клеточный монослой с 3 мл средства массовой информации. Антибиотики не должны быть добавлены к средствам массовой информации, так как они могут влиять на эффективность липофектамина 2000 (Invitrogen).
- Подготовьте смесь из 1 мкг дикого типа Многовершинном кДНК инфекционных плазмиды (например, pT7: Многовершинном 3'Rz) в 100 мкл Opti-MEM (Invitrogen) и смешать его с 4 мкл липофектамина 2000 (Invitrogen) предварительно смешивают с 100 мкл Opti-MEM (Invitrogen). Смешать реакции тщательно с помощью пипетки его вверх и вниз 15 раз и оставить смесь при комнатной температура в течение 20 минут.
- В результате трансфекции смесь должна быть затем добавляется по каплям на клеточный монослой и пластины следует осторожно встряхивают в перпендикулярных направлениях.
- Инкубируйте FPV-T7 инфицированных, Многовершинном плазмиды трансфицированных клеток при 37 ° С и 10% CO 2 от 24 до 72 часов. Клетки трансфекции плазмиды с инфекционными pT7: Многовершинном 3'Rz обычно оказывают титрами от 1 х 10 4 до 5 х 10 4 TCID50/ml.
3. Представитель Результаты
И обратный подходы генетики являются высокоэффективными для восстановления инфекционных Многовершинном в культуре клеток, как показано на рисунке 5. Инфекционные Многовершинном с титрами превышает 10 5 TCID50/ml будут восстановлены в течение 24 часов после трансфекции крышками Многовершинном РНК в клетках Raw264.7. Кроме того, трансфекции плазмиды инфекционных pT7: Многовершинном 3'Rz в BSR-T7 клетки были ранее инфицированы помощник FPV выражения T7 (FPV-T7) привело к вирусных титров в значительной степени exceeДин 10 4 TCID50/ml (рис. 5). Эти значения титра вирусных получить синтетическим РНК и ДНК молекулы, аналогичные полученным в трансфекции с участием природных ВПГ-связанной РНК, выделенной из инфекционных вирионов в те же ячейки (рис. 5). Эти результаты свидетельствуют о высокой эффективности обратной генетики подходы, описанные здесь, чтобы восстановить генетически определена Многовершинном варианты в культуре клеток.
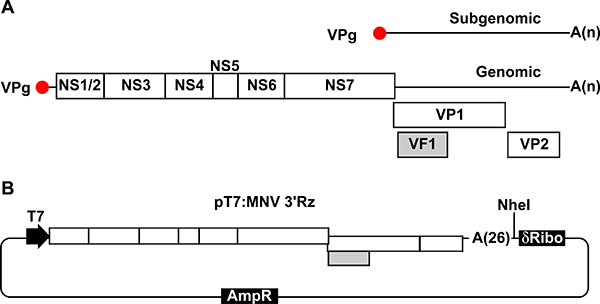
Рисунок 1. Иллюстрация Многовершинном генома и плазмиды для восстановления инфекционного вируса., Схематическое изображение Многовершинном организации генома. Каждый белок кодирующей области показано, как одна белая коробка. ORF1 переведен на 7 различных неструктурных белков (NS1 / 2 NS7), которые освобождены от предшественника полипротеина после самостоятельного протеолитической обработки. ORF 2 кодирует белок капсида основных VP1, ORF 3 кодирует несовершеннолетнего крышкойSID белки VP2 и ORF4 дублирования ORF2 области кодирования кодирует фактор вирулентности VF1. Геномная и subgenomic РНК содержат хвост полиА на концах их 3 'переменной длины. B, плазмиды, содержащей Многовершинном кДНК использовали в нашей обратный генетический подход (pT7: Многовершинном 3'Rz). МНВ кДНК сливается с хвостом полиА 26 остатков в конце своей 3 '. МНВ кДНК находится сразу за усеченной последовательности промотора Т7, чтобы T7 управляемой транскрипции, и перед уникальный NHE Я сайта и последовательности ДНК, кодирующей самостоятельного расщепления рибозима после него. Эти последовательности имеют важное значение для обеспечения терминации транскрипции РНК сразу после геномной хвост полиА присутствовал на 3 'конце.
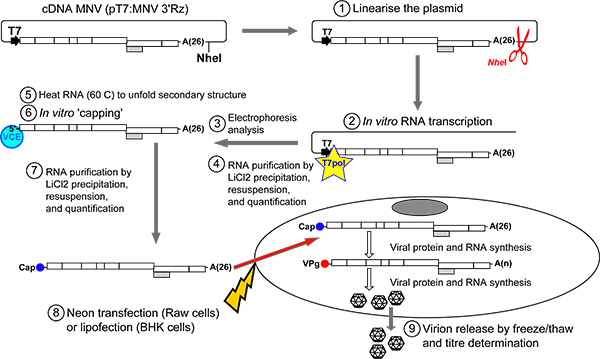
Рисунок 2. Обзор протокола для восстановления инфекционных Многовершинном из РНК транскрибируется, максимум в пробирке плазмиды pT7. Многовершинном 3'Rz линеаризуется непосредственно послепоследовательности геномной Многовершинном использованием NHE Я рестрикции (шаг 1). После очистки ДНК, РНК-транскрипты Многовершинном создаются в пробирке с помощью T7 РНК-полимеразы (шаг 2). Транскрипция продукты обычно работают с явной подвижностью 2,5 3Kb на неденатурирующем 1% агарозном геле (шаг 3, рисунок 3). ДНК-матрицы исключается использование коммерческой РНКазы без ДНКазы. РНК затем очищают от свободных нуклеотидов LiCl осадков (этап 4). Очищенный продукт РНК, затем может быть ограничен в пробирке после того, предварительно нагретую до 65 ° C разворачиваться вторичной структуры РНК (шаги 5-6). После очистки с помощью LiCl осадки, РНК трансфекции в любой Raw264.7 клеток (Neon трансфекции системы, Invitrogen) или BSR-T7 клеток (липофектамина 2000 Invitrogen) (шаги 7-8). Оказавшись внутри клетки, капо транскриптов РНК будут переведены на вирусные белки, которые катализируют репликацию вируса в новые протоколы Многовершинном молекул РНКсодержащие надлежащее молекулы ВПг в конце их 5. Последовательные циклы репликации сопровождается вирусным перевод будет генерировать большое количество вирусных геномов, которые будут генерировать encapsidated инфекционных вирионов. Для облегчения вирус освобождение от клеток, одного или нескольких циклов замораживания и оттаивания выполняется (шаг 9). Вирусный урожайности может быть затем определяется TCID50 или процедур, доска анализа.
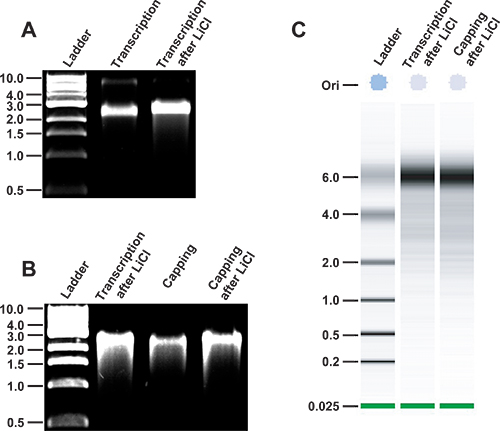
Рисунок 3. Анализ Многовершинном РНК-транскрипты целостности по протоколу., Целостностью Многовершинном РНК синтезируется в лабораторных условиях. Плазмиды pT7: Многовершинном 3'Rz в первую очередь линеаризуется использованием NHE Я рестрикции. После очистки ДНК, РНК-транскрипты Многовершинном создаются в пробирке с помощью T7 РНК-полимеразы (дорожка 2). РНК является то purifi ред из свободных нуклеотидов LiCl осадков (дорожка 3). Транскрипция продукты работают на неденатурирующем 1% агарозном геле параллельно с 1 Kb ДНК лестницы (New England Biolabs, переулок 1). Относительная подвижность вирусных стенограммы, не связанных с денатурирующих условиях похож на продукт дц 2,5-3 Кб. B, целостность Многовершинном транскриптов РНК после укупорки. МНВ стенограммы очищенный ранее LiCl осадков (дорожка 2) подвергается ферментативной укупорки (дорожка 3) и очистки LiCl осадков (дорожка 4). С, анализа в 6000 Agilent РНК Nano чип стенограммы Многовершинное (второй полосе) и крышками Многовершинном транскриптов (третью полосу), которые были ранее осаждается в LiCl. Лестница ssRNA будет выполняться параллельно.
= "Pdflinebreak"> 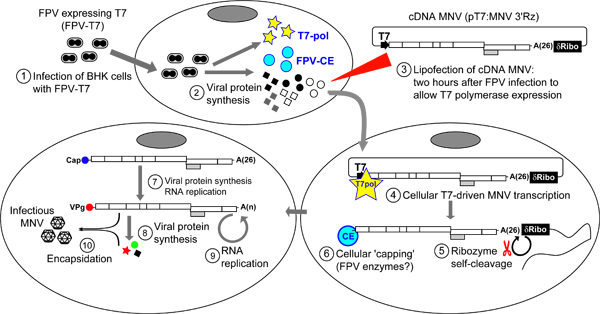
Рисунок 4. Обзор протокола для восстановления инфекционных Многовершинном из кДНК. Первоначально BSR-T7 (или ППА) клеток, инфицированных рекомбинантным вирусом fowlpox (FPV), выражающая бактериофага Т7 РНК-полимеразы (FPV-T7) (шаг 1). Зараженные клетки инкубируют в течение 2 часов перед дальнейшей обработкой, чтобы экспрессия белков FPV которая включает рекомбинантные Т7 РНК-полимеразы (шаг 2). После pT7: Многовершинном 3'Rz трансфицируют в клетки с помощью липофектамина 2000 (Invitrogen) (шаг 3). Оказавшись внутри клетки, pT7: Многовершинном 3'Rz признается T7 РНК-полимераза синтезирует который Многовершинном РНК-транскрипты (этап 4). Наличие самостоятельного раскалывания δ-рибозим последовательности на 3'генома гарантирует запись 3 'тerminus находится сразу после полиА хвост (шаг 5). Некоторые вирусные транскрипты внутриклеточно увенчанные FPV укупорки фермента (шаг 6). В результате Многовершинном крышками стенограммы будут переведены для создания Многовершинном белки, которые будут стимулировать Многовершинном репликации стенограммы. Недавно синтезированные молекулы РНК Многовершинном содержащие надлежащее молекулы ВПг в конце их 5 'будут проходить последовательных циклов репликации сопровождается вирусным перевода, который может в конечном итоге приводят к образованию инфекционных encapsidated вируса. Для облегчения вирус освобождение от клеток, одного или нескольких циклов замораживания и оттаивания выполняется (шаг 7). Вирусный урожайности может быть затем определяется TCID50 или процедур, доска анализа.
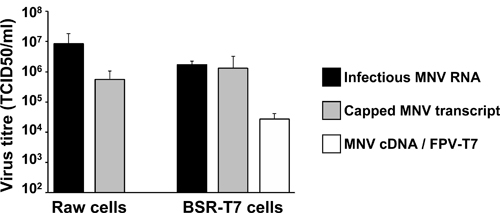
Рисунок 5. Представитель результаты титры вируса, полученные из разных обратной генетики подходов, описанных в тексте. Серые столбики представляют собой вирус титры получить в течение 24 часов после NeonТрансфекции 2 х 10 6 Raw264.7 клетки, или после липосакции трансфекции 2 х 10 6 BSR-T7 клеток в пробирке транскрипции и крышками Многовершинном РНК. Белые бары представляют титр вируса обычно получают после липофекция из pT7: Многовершинном 3'Rz (МНВ кДНК) на 2 х 10 6 BSR-T7 ранее инфицированных клеток в течение 2 часов с fowlpox вирус выражения рекомбинантный полимеразы Т7 (FPV-T7). В качестве положительного контроля для трансфекции в сырье и BSR-T7cells, мы обычно используем 2 мкг РНК, выделенной из клеток, зараженных Многовершинном, которые содержат высокие уровни ВПГ-связанных Многовершинном РНК. Отрицательного контроля были проведены либо Многовершинном РНК или pT7: Многовершинном 3'Rz кодирование со сдвигом рамки мутации (F / S), которая отменяет репликации, в результате чего вирус не обнаруживается (данные не представлены).
Обсуждение
Здесь показаны два разных обратный генетические подходы, которые позволяют восстановления инфекционных Многовершинном в клеточной культуре. Оба подхода эффективно обходить абсолютное требование к ковалентно связь ВПГ на 5 'конце вирусного генома РНК через поколение крышками стенограммы Многовершинном, которые затем признаются сотовые рибосом. В пробирке транскрипции следует ферментативно покрытие является более эффективным в Восстановление инфекционных Многовершинном, чем транскрипции инфекционных плазмиды в клетки, экспрессирующие Т7 РНК-полимеразы, в которой стенограммы может быть ограничен по FPV укупорки ферментов. Вирус титры восстановить с помощью этих систем обратного генетики похожи на эти получены путем трансфекции вирусных ВПГ-связанной РНК очищали от инфицированных клеточных культурах 17 (рис. 5). Трансфекции крышками Многовершинном РНК в клетках разрешительной Raw264.7 оказывает титр вируса только 1-журнала ниже, чем эксперименты с transfectioп суммарной РНК из инфицированных клеток, содержащих вирусные ВПГ-связанной РНК (рис. 5). Этот факт стимулирует дальнейшие исследования, чтобы определить, является ли добавление ВПг молекулы к 5 'концу стенограммы, порожденная этими системами может привести к росту урожайности вирус, который может выявить функциональные аспекты, лежащие в основе Многовершинном инфекционности в клетках, связанных с ВПг. Тем не менее, мы считаем это система обратного генетики как весьма эффективный, сравнимый с другими РНК-содержащих вирусов с помощью обратной генетики систем в настоящее время используется, в котором в пробирке транскрипции РНК позволяет восстановления титры только 10-100 ниже, чем в реальной инфекции с 19 вирионов, 20.
В целом, текущие методологии представляют собой значительный шаг вперед в области норовирус молекулярной биологии и предоставить нам инструменты для исследования функциональной роли белков и консервативных мотивов в РНК норовируса геномов. Эти подходы уже в сочетании с сurrent мышиной модели доступны и показали, что МНВ оправилась от инфекционной кДНК может привести к смертельной инфекции> 80% STAT1-/ - мышей менее чем за 10 дней, 4, 21. Используя эту систему, мы восстановили жизнеспособное мышиных мутантов норовирус в капсид белков и полипиримидиновых путей, участвующих в связывании различных факторов организма (ПТБ и PCBP), которые отображают несколько ослабленный фенотипов в 21 естественных, 22. Кроме того, мы недавно показали, что вирусы не имея возможности выразить VF1 белка из ORF4 эффективно размножаться в культуре клеток, но опять сократили вирулентности у мышей в отношении WT Многовершинном 8. Эти исследования побуждают нас разрабатывать ослабленные версии норовирусов человека на основе исследования Многовершинном, которые могут быть исследованы в качестве потенциальных кандидатов вакцины.
Раскрытие информации
Нам нечего раскрывать.
Благодарности
Это исследование финансировалось Wellcome Trust старший Стипендия присуждается Ян Гудфеллоу, и Мари Кюри Intra европейской стипендии (FP7 Европейский исследовательский совет) присуждена Армандо Ариас. Мы хотели бы поблагодарить Ио Гонконга Чонг, доктор Ребекка Роби и доктор Майк Скиннер за предоставление разрешения на использование их Agilent bioanalyser и помогает с управлением РНК образцов.
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента | Компания | Номер по каталогу | |
| Хлорид лития осадков решение | Ambion | AM9480 | |
| РНК решение для хранения данных | Ambion | AM7000 | |
| MEGAscript T7 сценарий | Ambion | AM1333 | |
| ScriptCap m7G укупорки системы | Эпицентр биотехнологии | SCCE0610 | |
| Neon системы трансфекции | Invitrogen | MPK5000 | |
| Neon комплект системы трансфекции | Invitrogen | MPK1025 | |
| Opti-MEM я | Invitrogen | 31985070 | |
| Липофектамина 2000 Трансфекция реагентов | Invitrogen | 11668-027 | |
| Agilent РНК 600 Nano комплект | Agilent | 5067-1511 | |
| Agilent 2100 биoanalyzer | Agilent | G2939AA | |
| Illustra GFX ПЦР ДНК и гель для очистки группы Kit | GE Healthcare | 28-9034-70 | |
| RiboMAX крупномасштабных РНК Production System-T7 | Promega | P1300 |
Ссылки
- Outbreaks of gastroenteritis associated with noroviruses on cruise ships--United States. MMWR Morb. Mortal. Wkly. Rep. 51, 1112-1115 (2002).
- Lopman, B. A. Epidemiology and cost of nosocomial gastroenteritis, Avon, England, 2002-2003. Emerg. Infect. Dis. 10, 2002-2003 (2004).
- Duizer, E. Laboratory efforts to cultivate noroviruses. J. Gen. Virol. 85, 79-87 (2004).
- Karst, S. M., Wobus, C. E., Lay, M., Davidson, J., Virgin, H. W. T. STAT1-dependent innate immunity to a Norwalk-like virus. Science. 299, 1575-1575 (2003).
- Wobus, C. E. Replication of Norovirus in cell culture reveals a tropism for dendritic cells and macrophages. PLoS Biol. 2, e432(2004).
- Bok, K. Inhibition of norovirus replication by morpholino oligomers targeting the 5'-end of the genome. Virology. 380, 328-337 (2008).
- Kim, Y., Thapa, M., Hua, D. H., Chang, K. O. Biodegradable nanogels for oral delivery of interferon for norovirus infection. Antiviral Res. 89, 165-173 (2011).
- McFadden, N. Norovirus Regulation of the Innate Immune Response and Apoptosis Occurs via the Product of the Alternative Open Reading Frame 4. PLoS Pathog. 7, e1002413(2011).
- Kormelink, R., van Poelwijk, F., Peters, D., Goldbach, R. Non-viral heterogeneous sequences at the 5' ends of tomato spotted wilt virus mRNAs. J. Gen. Virol. 73, 2125-2128 (1992).
- Shuman, S., Hurwitz, J. Mechanism of mRNA capping by vaccinia virus guanylyltransferase: characterization of an enzyme--guanylate intermediate. Proc. Natl. Acad. Sci. U.S.A. 78, 187-191 (1981).
- Jang, S. K., Pestova, T. V., Hellen, C. U., Witherell, G. W., Wimmer, E. Cap-independent translation of picornavirus RNAs: structure and function of the internal ribosomal entry site. Enzyme. 44, 292-309 (1990).
- Chaudhry, Y. Caliciviruses differ in their functional requirements for eIF4F components. J. Biol. Chem. 281, 25315-25325 (2006).
- Goodfellow, I. Calicivirus translation initiation requires an interaction between VPg and eIF 4. E. EMBO Rep. 6, 968-972 (2005).
- Herbert, T. P., Brierley, I., Brown, T. D. Identification of a protein linked to the genomic and subgenomic mRNAs of feline calicivirus and its role in translation. J. Gen. Virol. 78 ( Pt5 ), 1033-1040 (1997).
- Chaudhry, Y., Skinner, M. A., Goodfellow, I. G. Recovery of genetically defined murine norovirus in tissue culture by using a fowlpox virus expressing T7 RNA polymerase. J. Gen. Virol. 88, 2091-20100 (2007).
- Ward, V. K. Recovery of infectious murine norovirus using pol II-driven expression of full-length cDNA. Proc. Natl. Acad. Sci. U.S.A. 104, 11050-11055 (2007).
- Yunus, M. A., Chung, L. M., Chaudhry, Y., Bailey, D., Goodfellow, I. Development of an optimized RNA-based murine norovirus reverse genetics system. J. Virol. Methods. 169, 112-118 (2010).
- Arias, A., Perales, C., Escarmis, C., Domingo, E. Deletion mutants of VPg reveal new cytopathology determinants in a picornavirus. PLoS One. 5, e10735(2010).
- Werf, S. vander, Bradley, J., Wimmer, E., Studier, F. W., Dunn, J. J. Synthesis of infectious poliovirus RNA by purified T7 RNA polymerase. Proc. Natl. Acad. Sci. U.S.A. 83, 2330-2334 (1986).
- Bailey, D., Thackray, L. B., Goodfellow, I. G. A single amino acid substitution in the murine norovirus capsid protein is sufficient for attenuation in vivo. J. Virol. 82, 7725-7728 (2008).
- Bailey, D. Functional analysis of RNA structures present at the 3' extremity of the murine norovirus genome: the variable polypyrimidine tract plays a role in viral virulence. J. Virol. 84, 2859-2870 (2010).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены