Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Постоянное давление контролируемый методом экструзии для приготовления наноразмерных липидных везикул
В этой статье
Резюме
Этот протокол описывает методом экструзии для подготовки липидные пузырьки субмикронных размеров с высокой степенью однородности. Этот метод использует давление управляемая система с регулируемым расходом азота в липосомы подготовки. Липидного подготовки 1,2, Липосомы экструзии, и размер характеристика будет представлена в настоящем документе.
Аннотация
Liposomes are artificially prepared vesicles consisting of natural and synthetic phospholipids that are widely used as a cell membrane mimicking platform to study protein-protein and protein-lipid interactions3, monitor drug delivery4,5, and encapsulation4. Phospholipids naturally create curved lipid bilayers, distinguishing itself from a micelle.6 Liposomes are traditionally classified by size and number of bilayers, i.e. large unilamellar vesicles (LUVs), small unilamellar vesicles (SUVs) and multilamellar vesicles (MLVs)7. In particular, the preparation of homogeneous liposomes of various sizes is important for studying membrane curvature that plays a vital role in cell signaling, endo- and exocytosis, membrane fusion, and protein trafficking8. Several groups analyze how proteins are used to modulate processes that involve membrane curvature and thus prepare liposomes of diameters <100 - 400 nm to study their behavior on cell functions3. Others focus on liposome-drug encapsulation, studying liposomes as vehicles to carry and deliver a drug of interest9. Drug encapsulation can be achieved as reported during liposome formation9. Our extrusion step should not affect the encapsulated drug for two reasons, i.e. (1) drug encapsulation should be achieved prior to this step and (2) liposomes should retain their natural biophysical stability, securely carrying the drug in the aqueous core. These research goals further suggest the need for an optimized method to design stable sub-micron lipid vesicles.
Nonetheless, the current liposome preparation technologies (sonication10, freeze-and-thaw10, sedimentation) do not allow preparation of liposomes with highly curved surface (i.e. diameter <100 nm) with high consistency and efficiency10,5, which limits the biophysical studies of an emerging field of membrane curvature sensing. Herein, we present a robust preparation method for a variety of biologically relevant liposomes.
Manual extrusion using gas-tight syringes and polycarbonate membranes10,5 is a common practice but heterogeneity is often observed when using pore sizes <100 nm due to due to variability of manual pressure applied. We employed a constant pressure-controlled extrusion apparatus to prepare synthetic liposomes whose diameters range between 30 and 400 nm. Dynamic light scattering (DLS)10, electron microscopy11 and nanoparticle tracking analysis (NTA)12 were used to quantify the liposome sizes as described in our protocol, with commercial polystyrene (PS) beads used as a calibration standard. A near linear correlation was observed between the employed pore sizes and the experimentally determined liposomes, indicating high fidelity of our pressure-controlled liposome preparation method. Further, we have shown that this lipid vesicle preparation method is generally applicable, independent of various liposome sizes. Lastly, we have also demonstrated in a time course study that these prepared liposomes were stable for up to 16 hours. A representative nano-sized liposome preparation protocol is demonstrated below.
протокол
1. Подготовка липосом
- Получить 20 мл стеклянный флакон с тефлоновым покрытием крышки.
- Очистите все посуду и шприцы с хлороформом перед использованием, чтобы предотвратить загрязнение.
- Передача 100 мкл реагента хлороформ класса в стеклянном флаконе помощью 250 мкл герметичный стеклянный шприц.
- Добавить 30 мкл реагента метанола класса с тем же флакон стекло с помощью 100 мкл герметичный стеклянный шприц.
- Чтобы подготовить 2 мМ 7:1.5:1.5 фосфатидилхолина (ПОФХ): фосфатидилэтаноламин (Папа Римский): холестерин решение липидов, передачу 216 мкл 10 мг / мл ПОФХ, 42 мкл 10 мг / мл Папа и 20 мкл 11 мг / мл холестерин решения в CHCl 3 до 20 мл флакон стекло.
- Испарение органических растворителей при использовании медленных потоков аргона и азота до тонкой пленки липидов наблюдается на дне флакона.
- Поместите раскрытый флакон стекла в вакуум-эксикаторе, по крайней мере 30 минут для удаления остатков растворителя.
- Трansfer 2 мл буфера, предварительно пропущенные через фильтр 0,2 мкм, в стеклянном флаконе для гидратации липидов.
- Выдержите смесь при температуре 4 ° С в течение ночи и использовать в течение 48 часов.
2. Freeze-и-оттепель: Для липосом размеры 30 - 100 нм только
- Замораживание липосомы суспензии в жидком азоте в течение 15 секунд.
- Таяние липосомы подвески помощью нагревательного блока на 42 ° C температуре ~ 3 минуты.
- Повторите шаги 2.1 и 2.2, в общей сложности 5 циклов.
3. Экструзия
Следуйте инструкциям Авестин правильно собрать Liposofast LF-50 экструдера, используя инструмент контура в путеводителе.
- Положите большой экран поддержки отверстие (с круглыми отверстиями) в поддержку фильтр базы, а затем круговыми спеченных блюдо (без отверстий), одна утечка диска (25 мм в диаметре), и один поликарбонатные мембраны (25 мм в диаметре).
- Поместите маленький, черныйУплотнительное кольцо на верхней части мембраны для обеспечения его поддержки фильтр базы.
- Установите верхний фильтр экструдера, затянув 4 винта в 4 соответствующие отверстия.
- Соберите фильтр экструдера под большим цилиндре экструдера. Добавить липосомы решение цилиндра. Поместите следующий поверх экструзии баррель в порядке: большой круглый уплотнительное кольцо, узкие шапки, большое круглое кольцо, круглые шапки.
- Прикрепите газовый регулятор в начало цилиндра экструдера и закрыть все вентили, чтобы предотвратить утечку воздуха, в том числе клапанов для сброса давления. Поместите 20 мл флакон стекло или 50 мл колбу Эрленмейера под блок экструдера фильтр. Предохранительный клапан подключен к регулятору и выпустит, если давление превышает 600 фунтов на квадратный дюйм. Включите азота и открыть газовый вентиль подключен к экструдера.
- Увеличение давления азота до 25 фунтов на квадратный дюйм на 400 нм, липосомы, 125 фунтов на квадратный дюйм на 100 нм, липосомы, и 400-500 фунтов на квадратный дюйм в течение 30 липосомы нм.
- Смотреть липосомы суспension как он выбрасывает в контейнер в то время толкают на азот. Держите азот течет, пока вы не наблюдается никакой жидкости, проходящей через экструдер фильтр в стеклянном флаконе.
4. Динамическое рассеяние света (DLS) анализ
- Подготовить 50 мкл 20 мкМ липосомы решение.
- Включите источник питания и лампа источника.
- Откройте программу DynaPro.
- Установка программного обеспечения для MS / X алгоритма модели для обнаружения липосомы 30 нм и 100 нм и MS800 алгоритм модели для обнаружения> 100 нм, липосомы.
- Подключение к оборудованию.
- Внесите 14 мкл липосом образец в кварцевую кювету и вставить в ячейку.
- Нажмите кнопку Старт.
- Нажмите останавливается после ~ 20 - 30 приобретений.
- Анализ среднего диаметра липосомы пики записаны на гистограмме.
5. Наночастиц отслеживания анализа (NTA)
- Подготовьте 500 мкл, 0,1 ммоль липосомрешение.
- Промыть образец купе с водой и этанолом.
- Высушите образец купе с безворсовой салфеткой.
- Включите источник мощности лазера и компьютера.
- Доставка 300 мкл 0,1 мкМ липосомы решение образца отсека.
- Откройте панель управления температурой и анализа наночастиц отслеживания программного обеспечения.
- Нажмите кнопку Захват для включения лазера.
- С помощью горизонтальной и вертикальной регулировки двигаться на сцене и настроить фокус микроскопа.
- Установите желаемую температуру (20 ° C) и записи (по крайней мере 30 секунд).
- Нажмите на кнопку записи, чтобы взять несколько кадров картины липосомы частицы в течение определенного периода времени. Анализ пиков, соответствующих размеров диаметра липосом на гистограмме, как отслеживать движение каждой частицы.
6. Представитель Результаты
Схема с изложением методом экструзии рвозмущался на рисунке 1. Для получения оптимальных результатов, подготовка липосом с диаметром 30 нм требует высокого давления ~ 500 фунтов на квадратный дюйм и диаметром 100 нм требуется давление 125 фунтов на квадратный дюйм для достижения быстрого фильтра ставки. Для диаметром 400 нм, низкое давление ~ 25 фунтов на квадратный дюйм рекомендуется для достижения более медленный темп фильтр, который позволяет пузырьки, чтобы удлинить и образуют большие, однородные липосомы. Мы провели серию экспериментов, чтобы определить оптимальное давление для получения последовательной субмикронных размеров пузырьков. Мы варьировали давления, а также число экструзионных проходит через фильтры из поликарбоната с размерами пор 30, 100 и 400 нм и обнаружил, соответствующего давления для каждого нужного размера. В течение 30 нм поры, давление ниже 500 фунтов на квадратный дюйм позволит сократить расход, в результате чего удлинение и, следовательно, больших размеров пузырьков. Для 100 нм поры, постоянный поток был достигнут в 125 фунтов на квадратный дюйм. За 400 нм поры, низкого давления (25 МПа) позволяет пузырьки на удлиненной на больших пузырьков схарактеризует. Медленно по каплям фильтрационного потока оптимальной для создания больших субмикронных пузырьки 13.
Мы провели DLS для определения размера липосом, пропущенное через три различных размеров диаметра, 30 т., 100 и 400 нм. DLS является признанным методом, который собирает рассеянный свет, чтобы определить диаметр частиц. Мы экструдированного гидратированных липосомы 2 мм через поликарбонатные мембраны 30 нм на 500 фунтов на квадратный дюйм с 5 проходит через фильтр пора, 100 нм поликарбонатные мембраны в 125 фунтов на квадратный дюйм с 5 проходит через фильтр поры и 400 нм поликарбонатные мембраны в 25 фунтов на квадратный дюйм 2 проходит через фильтр поры. Диаметр липосом и измеряется DLS 30, 100 и 400 нм размер пор было 66 ± 28, 138 ± 18 и 360 ± 25 нм (рис. 2). Подвеска из 50 бусин нм полистирола был использован в качестве калибровочного стандарта, как показано на рисунке 2, где он записал диаметром 47 ± 16 нм. Процентов polydispersity показывает, что нет никакого дублирования в липосомы размеров. Это характерно для наблюдения диаметром более 30 нм при использовании DLS анализ в связи с известными смещение этот инструмент имеет более крупные частицы к 12. Свет интенсивности рассеяния от крупных и мелких частиц собираются одновременно с одного метода обнаружения и, следовательно, труднее решить липосом в виде суспензии 12. Несмотря на это инструментальных ограничений, калибровочной кривой описывает почти линейной корреляции.
NTA является новой технологией, которая измеряет размер каждой частицы от прямого наблюдения диффузии в жидкой среде, независимо от частиц показателя преломления и плотности. Это высокое разрешение метод может быть использован в дополнение к измерению липосом с DLS. НТА записал диаметром 95 ± 48 и 356 ± 51 нм, два 100 нм и 400 нм решения полистирола были использованы для калибровки. Липидов решения 30 нм и 100 нм наблюдались более Comp пахотных диаметр по сравнению с ДЛС, как показано на рисунке 3, производство средних размеров от 29 ± 14, 95 ± 17 и 359 ± 73 нм. НТА может быть более общую характеристику техники количественного микроскопических частиц, поскольку его чувствительность позволяет измерять частицы 50 - 1000 нм. Калибровочной кривой показана линейная корреляция между мембраной поликарбоната пор против записанного диаметр НТА.
| Размер липосом | Порог обнаружения | Ожидаемый размер минимальных частиц (нм) |
| 30 нм | 11 | 30 |
| 100 нм | 11 | 100 |
| 400 нм | 21 | 400 |
Таблица 1. NanoSight параметров.
ad/4151/4151fig1.jpg "/>
Рисунок 1. Блок-схема методом экструзии, описывая, как давление и поток азота управляет однородности различных диаметров липосомы. После липосомы гидратации, однослойные везикулы разных размеров экструдированного через различные мембраны поликарбоната поры фильтра при различных давлениях.
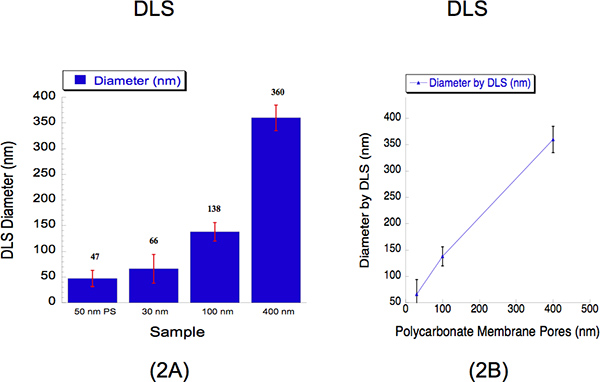
Рисунок 2. Динамического рассеяния света (DLS) данные, характеризующие количественные размеры липосом после экструзии. (А) Гистограммы приведены для описания диаметром три липосомы образцов. Калибровочный стандарт 50 нм полистирола (PS) бисер был использован в качестве ссылки. Средний диаметр липосом указаны выше планку для каждого образца. Оси х описывает пор размеры которых решения были выдавливаются через. Ось у описывает диаметр записан DLS. Несмотря на 30-нм и 100 нм, размер записиред ценит выше, чем их размеры пор пока больше 400 нм, размер записал несколько ниже размеров, калибровочной кривой (б) показывает, рядом линейной корреляции, где ось абсцисс выражает поликарбоната размерами пор мембраны, а ось у описывается записал липосомы диаметром DLS.

Рисунок 3. Наночастиц отслеживания анализа (НТА) данные, характеризующие размеры липосом после экструзии. (А) гистограммы представляют диаметр каждого липосомы образца. Оси х описывает пор размеры которых решения были выдавливаются через. Ось у описывает Диаметр записаны НТА. Средний диаметр липосом обозначены выше каждого образца. (Б) кривая НТА калибровки показывает более линейной корреляции, чем кривая DLS калибровки между мембранный фильтр размером пор в сравнении с записанной диаметре. Оси х описывает поликарбоната размерами пор мембраны. У-ось описывает записанных липосомы диаметром НТА.
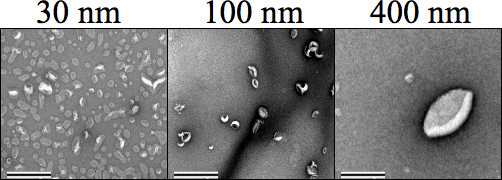
Рисунок 4. Отрицательные пятно просвечивающей электронной микроскопии (ПЭМ) изображения, показывающие каждый липосом размера (500 мкм), а затем методом экструзии. Углерод формвар сетка сетки негативно сбрасываются до окрашивания образцов, где 1% ацетата уранила в воде был использован для окрашивания образцов до сушки и обработки изображений на 34 000-кратном увеличении. Размеры 30, 100 и 400 нм, явно отличаются друг от друга. Увеличение было установлено до 25000 ×. Шкалы составляет 0,5 мкм.
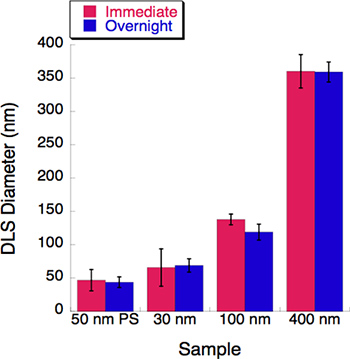
Рисунок 5. Время курс был проведен эксперимент с тремя липосомы размеров. Динамическое рассеяние света (DLS) была измерена для каждого липосомы решение сразу после экструзии. Все липосомы растворы хранились в 4 °С в течение ночи. Их диаметры были записаны DLS после инкубации в течение ночи. Практически не наблюдалось изменение после 16-часового периода инкубации.
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Использование Авестин Liposofast LF-50 Экструдер, мы продемонстрировали, как малогабаритные, синтетических липосом готовы через давление контролируемой системы. Важно отметить, что многослойные пузырьки образуют спонтанно после гидратации липосомы, которые могут привести к производству м?...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Эта работа была поддержана Медицинского института Говарда Хьюза (HHMI) Совместные Innovation Award. LAM был поддержан сигнализации и клеточной регуляции Национального института здоровья подготовки гранта (T32 GM008759) и NIH Рут Л. Kirschstein предварительной защиты докторской диссертации (CA165349-01). Мы хотели бы поблагодарить профессора Майкла Стоуэлл (CU Boulder), профессор Дуглас Риз и профессор Роберт Филлипс (Caltech) за их неоценимую комментариев.
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента | Компания | Номер по каталогу | Комментарии |
| Хлороформ | Sigma-Aldrich | 02432-25МЛ | 95% стабилизаторы |
| Высококачественный метанола | Sigma-Aldrich | 179337-4L | |
| Liposofast LF-50 Экструдер | Авестин, Inc | ||
| Фосфолипиды | Avanti Полярные липиды | ||
| Поликарбонат поры | Авестин, Inc | Диаметром 25 мм | |
| Слейте диски PE | Авестин, Inc | 230600 | Диаметром 25 мм |
Ссылки
- Connor, J., Bucana, C., Fidler, I. J., Schroit, A. J. Differentiation-dependent expression of phosphatidylserine in mammalian plasma membranes: quantitative assessment of outer-leaflet lipid by prothrombinase complex formation. Proc. Natl. Acad. Sci. U.S.A. 86, 3184-3188 (1989).
- Smith, S. A., Morrissey, J. H. Rapid and efficient incorporation of tissue factor into liposomes. J. Thromb. Haemost. 2, 1155-1162 (2004).
- Hui, E., Johnson, C. P., Yao, J., Dunning, F. M., Chapman, E. R. Synaptotagmin-mediated bending of the target membrane is a critical step in Ca(2+)-regulated fusion. Cell. 138, 709-721 (2009).
- Loughrey, H. C., Choi, L. S., Cullis, P. R., Bally, M. B. Optimized procedures for the coupling of proteins to liposomes. J. Immunol. Methods. 132, 25-35 (1990).
- Mui, B., Chow, L., Hope, M. J. Extrusion technique to generate liposomes of defined size. Methods Enzymol. 367, 3-14 (2003).
- Gruner, S. M., Cullis, P. R., Hope, M. J., Tilcock, C. P. Lipid polymorphism: the molecular basis of nonbilayer phases. Annu. Rev. Biophys. Biophys. Chem. 14, 211-238 (1985).
- Guven, A., Ortiz, M., Constanti, M., O'Sullivan, C. K. Rapid and efficient method for the size separation of homogeneous fluorescein-encapsulating liposomes. J. Liposome. Res. 19, 148-154 (2009).
- Zimmerberg, J., Kozlov, M. How proteins produce cellular membrane curvature. Nature Reviews Molecular Cell Biology. 7, 9-19 (2006).
- Chonn, A., Cullis, P. R. Recent advances in liposomal drug-delivery systems. Curr. Opin. Biotechnol. 6, 698-708 (1995).
- Mayer, L. D., Hope, M. J., Cullis, P. R. Vesicles of variable sizes produced by a rapid extrusion procedure. Biochim. Biophys. Acta. 858, 161-168 (1986).
- Matsuoka, K., Schekman, R. The use of liposomes to study COPII- and COPI-coated vesicle formation and membrane protein sorting. Methods. 20, 417-428 (2001).
- Dragovic, R. A., Gardiner, C., Brooks, A. S., Tannetta, D. S., Ferguson, D., Hole, P., Carr, B., Redman, C., Harris, A. L., Dobson, P. J., Harrison, P., Sargent, I. L. Sizing and phenotyping of cellular vesicles using Nanoparticle Tracking Analysis. Nanomedicine. , (2011).
- Hunter, D. G., Frisken, B. J. Effect of extrusion pressure and lipid properties on the size and polydispersity of lipid vesicles. Biophys J. 74, 2996-3002 (1998).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены