Method Article
Модифицированного метода EPA 1623, в котором используются Тангенциальный поток полые волокна ультрафильтрации и тепловой диссоциации шаги для обнаружения водной основе
В этой статье
Резюме
Этот протокол описывает использование тангенциального потока полые волокна ультрафильтрации система концентрации образца и тепло диссоциации в качестве альтернативных шагов для обнаружения водной Cryptosporidium И Giardia Вид с использованием EPA Method 1623 году.
Аннотация
Cryptosporidium and Giardia species are two of the most prevalent protozoa that cause waterborne diarrheal disease outbreaks worldwide. To better characterize the prevalence of these pathogens, EPA Method 1623 was developed and used to monitor levels of these organisms in US drinking water supplies 12. The method has three main parts; the first is the sample concentration in which at least 10 L of raw surface water is filtered. The organisms and trapped debris are then eluted from the filter and centrifuged to further concentrate the sample. The second part of the method uses an immunomagnetic separation procedure where the concentrated water sample is applied to immunomagnetic beads that specifically bind to the Cryptosporidium oocysts and Giardia cysts allowing for specific removal of the parasites from the concentrated debris. These (oo)cysts are then detached from the magnetic beads by an acid dissociation procedure. The final part of the method is the immunofluorescence staining and enumeration where (oo)cysts are applied to a slide, stained, and enumerated by microscopy.
Method 1623 has four listed sample concentration systems to capture Cryptosporidium oocysts and Giardia cysts in water: Envirochek filters (Pall Corporation, Ann Arbor, MI), Envirochek HV filters (Pall Corporation), Filta-Max filters (IDEXX, Westbrook, MA), or Continuous Flow Centrifugation (Haemonetics, Braintree, MA). However, Cryptosporidium and Giardia (oo)cyst recoveries have varied greatly depending on the source water matrix and filters used1,14. A new tangential flow hollow-fiber ultrafiltration (HFUF) system has recently been shown to be more efficient and more robust at recovering Cryptosporidium oocysts and Giardia cysts from various water matrices; moreover, it is less expensive than other capsule filter options and can concentrate multiple pathogens simultaneously1-3,5-8,10,11. In addition, previous studies by Hill and colleagues demonstrated that the HFUF significantly improved Cryptosporidium oocysts recoveries when directly compared with the Envirochek HV filters4. Additional modifications to the current methods have also been reported to improve method performance. Replacing the acid dissociation procedure with heat dissociation was shown to be more effective at separating Cryptosporidium from the magnetic beads in some matrices9,13 .
This protocol describes a modified Method 1623 that uses the new HFUF filtration system with the heat dissociation step. The use of HFUF with this modified Method is a less expensive alternative to current EPA Method 1623 filtration options and provides more flexibility by allowing the concentration of multiple organisms.
протокол
1. Тангенциальный поток полые волокна ультрафильтрации процедур
- Подготовка буферов и решения:
Элюирование Решение (1 л):
Для 1 л воды реагентом класс добавить 0,1 г полифосфат натрия, 0,1 мл Твин-80 и 0,01 мл Y-30 пеногаситель. - Подготовить фильтр в сборе (рис. 1) в биологическом кабинете по безопасности:
- Вставьте Masterflex I / P 73 лаборатории трубы через Masterflex I / P Easy-Load напор насоса подключен к Masterflex I / P диск бесщеточный точности.
- Закрепить трубы на 0-60 бар, заполненный глицерином манометр оснащен ДНЯО филиала T-разъем на входе в насос голову с винтовым зажимом, и HDPE T-разъем на выходе из насоса голову.
- Соберите ретентат бутылку установки Nalgene 53-B заполнения / Вентиляция шапка с Masterflex L / S 15 лаборатории труб и Т-коннектор и обеспечение его 1 л бутылка Nalgene тяжелых полипропилена долг.
- Установите Masterflex L / S 24 т трубго щепотку зажим (зажим щепотку 2) и соедините его с ретентат бутылки HDPE T-разъем.
- Подключите Masterflex L / S 24 лабораторий из трубы манометр для Asahi Kasei Rexeed 25S высокого потока диализаторов с винтовым зажимом, а от диализа в ретентат бутылку. Использование заказных DIN адаптеры предназначены для размещения ¼ "ID трубы для подключения трубки к полые волокна ультрафильтр.
- Установите Masterflex L / S 24 лаборатории трубы с щепоткой зажим (зажим щепотку 1) и подключите его к 10 мл пластиковые пипетки с наконечником и хлопка зажигания в качестве линии поглощения образца, а затем присоединить шланг к HDPE T- разъем.
- Вставьте один конец Masterflex L/S-36 лаборатории трубы с рампой зажим и подключить трубку к стоков порт, расположенный рядом с выходом конце фильтра. Поместите другой конец в контейнер для отходов.
- Добавить 0,01% (вес / объем) полифосфат натрия на 10 л пробы воды и перемешать в течение 3 мин.
- Закрыть щепотку зажим 2и снимите вентиляционные крышки от ретентат бутылку. Все остальные зажимы должны быть открыты.
- Установка насоса направлении, чтобы переместить жидкость из T-разъем датчика давления (справа налево следующий рисунок 1). Регулировка скорости вращения насоса до 25% от максимальной скорости и включить насос.
- Когда ретентат бутылки на 2/3, открытый зажим щепотку 2 и быстро заменить вентиляционную крышку ретентат бутылку. Проверьте все строки и фитингов, чтобы убедиться в отсутствии утечек.
- Медленно увеличивайте скорость насоса к желаемой скорости фильтрации (примерно 1,5 л / мин), проверки на герметичность. Используя мерный цилиндр и таймера или расходомера, проверьте уровень фильтрата воды на выходе из канализационная линия (синяя L / S 36 трубки на рисунке 1). Воздушные пузырьки могут обычно образуются на выходе конце фильтра делает его трудно добиться стабильного давления и скорости фильтрации. Это исправляется, зажимая канализационная линия от руки на мгновение. Это действиеобычно коаксиальный пузырек воздуха в порту фильтрата и выйти через канализационная линия. Повторять по мере необходимости, имея в виду, что горох размер пузырьков воздуха часто неизбежны.
- Мониторинг процесса фильтрации. Измерьте и запишите давления и скорости фильтрации по мере необходимости. Давление не должно превышать 20 фунтов на квадратный дюйм. Рекомендуется, чтобы скорость фильтрации не должна превышать 2,0 л / мин. Важно, что объем воды в бутылке ретентат быть проверены, чтобы гарантировать, что он никогда не впадает. Это нормально, объем можно увеличить или уменьшить немного. Если объем воды в ретентат бутылка падает ниже 1/3, затем снимите вентиляционные крышки и близких щепотку зажим 2 на ретентат линии бутылки. Довести объем обратно около 2/3, откройте зажим и быстро заменить вентиляционные крышки, что обеспечивает плотное прилегание. Если объем в ретентат бутылка падает быстро и непрерывно, то обеспечить ретентат крышка бутылки плотно и вентиляционные крышки надежно встал на место, и что Tubiнг-прежнему находится в контакте с водой образца. Если эти вопросы не происходит, то вполне вероятно, что печать в ретентат крышкой бутылки плохо и должны быть заменены.
- Когда образец контейнер пуст, сразу близкий контакт 1 щепотка, снизить скорость насоса до 20% от своего максимума, удалить вентиляционные крышки от бутылок и ретентат закрыть рампы зажимом.
- Регулировка громкости образца в ретентат бутылку около 200 мл на ужесточение или ослабление рампы зажимом. После того, как объем составляет примерно 200 мл, затяните рампу зажим для элюирования шагов (1.11-1.12).
- Добавить 500 мл элюирования решение образца контейнера и промойте внутри контейнера. Поместите 10 мл пипетки, подключенного к линии поглощения образца в контейнер, содержащий элюирования решение. Убедитесь, что на съезд зажим закрыт. Открытое щепотку зажим 1 и близких щепотку зажим 2 мгновение составить элюирования решение.
- После 500 мл элюирования решение составлен, Близкие зажать зажим 1 и открытым зажимом щепотку 2. Позвольте элюирования решение распространить в течение 5 минут с помощью насоса со скоростью 20% от своего максимума.
- Регулировка громкости образца в ретентат бутылку около 100 мл на ужесточение или ослабление рампы зажим канализационная линия. Затяните зажим и рампы позволяет образца циркулировать в течение 1 минуты. Избегайте потянув воздух в трубы, обеспечивая объем образца в ретентат бутылку достаточно высок, чтобы покрыть L / S 15 трубы ввода ретентат бутылку.
- Обратное направление насос, который заставляет образца в ретентат бутылку. Дайте насосу работать в обратном направлении в течение 20 секунд в результате чего в общей сложности ~ 225 мл в ретентат бутылку. Выключите насос.
- Удалить Masterflex I / P 73 труб из головки насоса и отсоедините манометр. Отключите Masterflex L / S 24 трубы на выходе из полого волокна ультрафильтр. Держите трубку над ретентат бутылку, чтобы заставить оставшихся образца вретентат бутылку.
- Отключите все трубы из бутылки и заменить крышку вентиляции с не-вентиляционные крышки.
- Продолжайте IMS / IFA процедуру с ~ 225 ретентат мл.
2. Процедура разделения иммуномагнитных
- Подготовка буферов и решения:
- Позвольте буферы включены в Dynabeads: Cryptosporidium / Giardia комбинированный комплект до комнатной температуры.
- 1X SL-буфер: Добавить 1 мл 10X SL-буфера до 9 мл воды класса реагентов.
- Передача ~ 225 мл жидкости из бутылки ретентат помечены 250 мл коническую трубку центрифуги. Промойте ретентат бутылку в два раза по 10 мл реагента воды и добавьте полоскания в конической трубе центрифуги. Центрифуга подвески на 1500 мкг в течение 15 мин при 4 ° C, без тормозов.
- Тщательно аспирации супернатант из воздух-вода до 5 мл над упакованы для гранул, каждые 0,5 мл объема гранул (например, аспирация 15 мл над объем гранул 1,3 мл, и аспирата по 5 мл для гранул по 0,5 мл или менее).
- Тщательно ресуспендируют осадок в супернатант встряхивая и / или пипетки смешивания. Передача каждого 5 мл объема жидкости в плоской односторонней Dynal L10 пробирку, содержащую 1 мл каждый из 10х SL-буфер и 10Х SL-буфера B. Промыть конические трубки центрифуги в два раза с 2,5 мл реагента воды и добавьте в полоскание L10 трубы, в результате чего общий объем в L10 трубки 12 мл, в том числе буферов.
- Добавить 100 мкл хорошо перемешанных ресуспендированного против Cryptosporidium и анти-Giardia Dynabeads к L10 трубку. Поверните L10 трубы на 18 мин в течение 1 часа при комнатной температуре на поворотное устройство смесителя.
- Поместите плоскую сторону L10 трубки от MPC-6 магнитов и осторожно рукой рок конца трубы к концу, 180 ° в течение 2 минут.
- Ведение L10 трубки в MPC-6 магнита с магнитом вверх, перелить супернатант от борта / (оо) кисты комплексов бой к магниту. Снимите трубку L10 от магнита и добавляют 0,5 мл 1X SL-буфера к трубе. Передача подвески с использованием двух дополнительных полосканий по 0,5 мл 1X SL-буфер в 1,5 мл микроцентрифужных трубка проходит в MPC-S с магнитом в вертикальном положении.
- Осторожно покачайте трубу в MPC-S магнита 180 ° в течение 1 минуты. С магнитом в месте, аспирации супернатант помощью пипетки Пастера, направленных на дне микроцентрифужных трубку.
- Добавить 1 мл 1X PBS на передней стороне микроцентрифужных трубки, снимите магнит и рок трубку осторожно только до бисер ресуспендировали. Заменить магнит в вертикальном положении и мягко раскачивать трубы на 180 ° в течение 1 минуты. Аспирируйте PBS полоскания, не нарушая шарик шарик, с помощью пипетки Пастера, чтобы удалить как можно больше мусора, как это возможно.
- Удаление магнита и добавить 50 мкл реагента воды в обратную сторону микроцентрифужных трубку. Вихревые трубки на полной скорости в течение 50 секунд,затем инкубировать трубки при температуре 80 ° С в течение 10 минут, затем 30-секундный вихрь. Замена магнита в MPC-S в наклонном положении, связывая бисер с магнитом и оставить (оо) кисты в жидкости. Применить (оо) кисты подвески SingleSpot и слайдов.
- Повторите шаг 2.10, применение жидкого к тому же и содержащий первый диссоциации. Место слайдов на 37 ° C теплее слайд в течение 1 часа, чтобы высушить подвески на слайд хорошо.
3. Окрашивание и экспертиза
- Подготовка буферов и решения:
Рабочие DAPI решение: добавить 25 мкл DAPI маточного раствора (2 мг / мл в метаноле) до 25 мл 1X PBS. Фондовый магазин и рабочих растворов от 1 ° C и 10 ° С в темноте. - Применение 50 мкл метанола в слайд хорошо и дайте ему высохнуть при комнатной температуре.
- Добавить 50 мкл рабочего DAPI решения слайдов и инкубировать в течение 2 минут при комнатной температуре.
- Используйте KimwiPE для отвода DAPI из колодца. Применение 50 мкл EasyStain. Инкубировать при температуре 35 ° С в течение 30 минут.
- Вика пятно от хорошо Kimwipe, а затем медленно добавляют 300 мкл холодного буфера фиксации EasyStain, что позволяет ей течь над колодцем края. Выдержите в течение 2 минут при комнатной температуре.
- Используйте Kimwipe для отвода буфер из колодца и применять 10 мкл EasyStain Монтаж среднего.
- Осторожно применять покровное стекло, удаляя пузырьки, которые происходят. Закройте крышку скольжения с прозрачного лака для ногтей.
- Проверять весь слайд с помощью фильтра FITC, на общее увеличение 200Х, на яйцевидные или сферических яблочно-зеленый флуоресцентный объектов, которые похожи на ооцисты или кисты. Проверьте все такие объекты с фильтром 1000X DAPI на общее увеличение, а затем с ДВС, а также на общее увеличение 1000X. Запишите размер с помощью калиброванного микрометра глаз и морфологических характеристик.
- Документ результаты.
Примечание: Дополнительная информаразмещение информации об оригинальной методике, можно найти в декабре 2005 версия EPA Method 1623 12. Тангенциального потока полые волокна ультрафильтрации процедуру, описанную используется вместо раздела 12,0 из EPA Method 1623 году. Тепло диссоциации изменяется раздел 13.3.3 из EPA Method 1623 году. Эта процедура также описывает дополнительные PBS промыть в процессе IMS, который может быть вставлен в декабре 2005 года версия Метод 1623 после раздела 13.3.2.16. Полный список расходных материалов, реактивов и оборудования, используемых для EPA Method 1623 в том числе эти изменения перечислены в списке оборудования.
4. Представитель Результаты
Cryptosporidium и Giardia ооцист кисты возмещаться за счет процессов фильтрации и разделения иммуномагнитных обнаружен микроскопический анализ. На общее увеличение 200X, каждый организм выставке типичная картина окрашивания, размер и форму, как показано на рисунке 2 следует и далее, наблюдаемые с помощью погружения в масло 1000X общего увеличения. Это позволит для измерения и идентификации либо типичный определяющие черты или атипичных особенностей, которые исключили бы положительной идентификации. Cryptosporidium является яйцевидные, чтобы сферический объект от 4 до 6 мкм в диаметре, обладающего блестящей светло-зеленого цвета флуоресценции FITC с ярко подчеркнул края (рис. 3А ). С DAPI УФ, ооцисты представит одну из следующих категорий типичные функции: голубой внутреннее окрашивание с зеленой оправе и не отдельные ядра (DAPI отрицательный), интенсивный синий внутреннее окрашивание, или до четырех различных, небесно-голубой ядер (DAPI положительный - рис. 3б). Атипичная функции включают в себя отклонения в цвете, структуре, или DAPI флуоресценции (например, слишком много окрашенных ядер, красный флуоресцирующий внутренних структур). Если люминесцентные объекта соответствовали критериям для типичных FITC и DAPI окрашивания, она рассматривается использование кон дифференциальных помехконтраст (DIC). Объект проверяется на атипичные внешних или внутренних морфологических характеристик, таких как клеточная стенка орнаментом, либо один или два больших ядер заполнения ячейки. Если атипичных структур не наблюдается, объект регистрируется в общем количестве IFA и классифицируются как пустой аморфной структурой или с 3:59 спорозоитов настоящее время (рис. 3). Точно так же, как лямблии, объекты рассматриваются в связи с FITC и DAPI окрашивания, а также характеристики ДВС, как axonemes, средний органов, а также ядер Giardia кист раунд яйцевидные блестящей светло-зеленого цвета объектов, 8 -. 18 мкм в длину и 5 - 15 мкм, шириной с ярко подчеркнул края (рис. 3). С DAPI УФ, киста Giardia покажут DAPI-отрицательной окраски, или DAPI-позитивных характеристик (рис. 3Е). Люминесцентные объект рассматривается ДВС для типичных и нетипичных особенностей в том же порядке, как описано для Cryptosporidium.Если атипичных особенностей не наблюдается, объект регистрируется в общем количестве IFA и классифицируются как пустой содержащих аморфную структуру, или с одним или более типов внутренней структуры настоящее время (рис. 3F).
Любой организм, который наблюдается у атипичных особенностей не должны учитываться как (со) кисты. Микроскопический анализ проб окружающей среды, может оказаться сложной задачей, поскольку есть организмы, которые могут автоматически светиться или перекрестно реагируют с FITC-сопряженных против Cryptosporidium и / или анти-Giardia антител 1. Рекомендуется, чтобы аналитик быть знакомы с водной микробов и обзор десятков слайдов, чтобы получить опыт выявления Cryptosporidium и Giardia. По крайней мере, три (со) кисты на положительный слайд контроль окрашивания должна характеризоваться до каждой сессии в микроскоп.
Образцы для контроля качества может быть с шипами (оо) кист, чтобы определить процент RECOvery для каждого использования простейших расчетов:
(Оо) кисты Процент восстановления = ((КК Пример графа - граф из Unspiked Sample) / Spike) х 100.
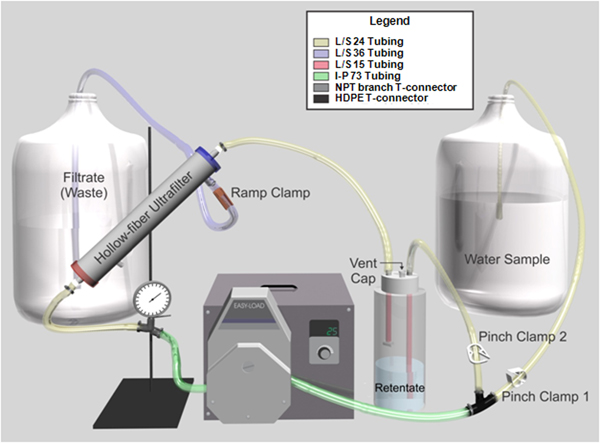
Рисунок 1. Графическое представление тангенциального потока полые волокна ультрафильтрации системы. Трубка имеет цветовую маркировку, чтобы помочь является сборка системы.
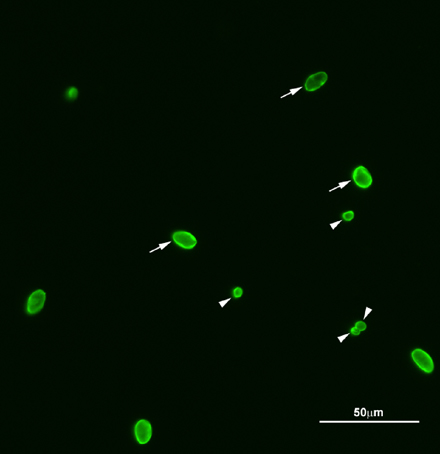
Рисунок 2. Представитель флюоресценции образ Cryptosporidium и Giardia (оо) кист. Ооцист Cryptosporidium и Giardia кист окрашивали FITC меченые анти-Cryptosporidium / Giardia антител. Стрелки, Giardia кист, наконечники стрел, Cryptosporidium ооцист. В общей сложности четыре Cryptosporidium ооцист и шесть Giardia кист были обнаружены в плоскости фокуса. Образцы наблюдаемыхред под 200X увеличения.

Рисунок 3. Представитель микроскопические изображения и ооцист Cryptosporidium Giaridia кист используется для характеристики Cryptosporidium ооцист (А - С).. Блестящий яблочно-зеленый флуоресценции FITC сферические объекты от 4 до 6 мкм в диаметре, с ярко выделены ребра (A), содержащий до четырех различных, небесно-голубой DAPI ядер (B) и 3:59 спорозоитов (S) в ооцисты (C). Giardia кист (D - F). Блестящий яблочно-зеленый флуоресценции FITC раунд яйцевидные объекты 8 - 18 мкм в длину и 5 - 15 мкм, с ярко выделены ребра (D), содержащие до четырех небесно-голубой DAPI ядер (E) и с одним или более заметной внутренней структуры таких в качестве ядра (N), средний тела (M) и axonemes или (A) (F). Белые стрелки, блестящие яблоки зеленая флуоресценция окраски ооцист Cryptosporidium и Giardia кист WЗнайки, белые стрелки, DAPI положительных ядер. Образцы наблюдается при увеличении 1000X.
Обсуждение
Тангенциальный поток полые волокна ультрафильтрации является альтернативным и эффективный метод для начальной концентрации ооцист Cryptosporidium и Giardia кист из воды. Полые волокна ультрафильтрации дешевле, чем традиционные фильтры. Поскольку у него есть способность к концентрации ооцист Cryptosporidium и Giardia кист различных матриц воде является полезной альтернативой современные методы фильтрации для EPA Method 1623 году. Как и в большинстве других методов фильтрации, полые волокна ультрафильтрации подвержены загрязнению с очень мутной образцов. Высокое давление воды может возникнуть в результате загрязнения фильтра, поэтому он рекомендуется для контроля давления при фильтрации перспективе. В дополнение к Cryptosporidium и Giardia ооцист кисты, полые волокна ультрафильтрации было показано, что способен концентрировать бактерии и вирусы 1-3,5,8. Полые волокна ультрафильтрации оutlined в этот метод может быть использован для нескольких организмов концентрировать в одном образце. Стоит отметить, что получение конечного объема от 200 до 250 мл является критической последний шаг в концентрации процедуры, чтобы дополнительные шаги, центрифугирования, которые могут привести к (оо) кисты потери можно избежать (шаг 2.2). Тем не менее, благодаря чему объем в бутылке падает слишком низко может иметь неблагоприятное воздействие на восстановление, так как не будет достаточного объема жидкости, чтобы заставить всех ооцист или кисты в ретентат бутылку. Поэтому рекомендуется поддерживать конечный объем от 200 до 250 мл.
Тепло диссоциации является альтернативой кислоты шаг диссоциации Метод 1623. Этот альтернативный шаг приводит к улучшению восстановления ооцист Cryptosporidium и уменьшить метод изменения, когда изолированы от любой реке или реагентом вода 9. Бок о бок сравнение кислоты и тепловой диссоциации методов показали, что использование тепла диссоциациите организмы из бисера иммуномагнитных производства выше средних возмещений для Cryptosporidium и Giardia. Кроме того, точность Cryptosporidium и Giardia восстановление было лучше в образцах, обработанных с тепловой диссоциации по сравнению с кислотной диссоциации 9.
Включение HFUF как концентрация шаг позволяет более гибко, предоставляя возможность сконцентрироваться нескольких организмов. Кроме того, он является менее дорогой альтернативой текущим Метод 1623 вариантов фильтрации.
Раскрытие информации
Окружающей среды США Агентство по охране через свое Бюро по исследованиям и развитию в сотрудничестве с Управлением грунтовых вод и Центр технической поддержки питьевой воды финансировала исследование описано здесь. Вся работа была поддержана на месте в охране окружающей среды США, Цинциннати, штат Огайо. Хотя информация, описанная в этой статье было профинансировано полностью или частично по охране окружающей среды США Агентство по охране по контракту (контракт EP-C-06-031) Шоу окружающей среды и инфраструктуры, Inc, это не обязательно отражают точку зрения Агентства и не официального утверждения должны быть выведены. Он был подвергнут агентства рассмотрения и одобрен для публикации.
Благодарности
Мы хотели бы поблагодарить Энн и Майкл Гримм Циммерман для критического обзора этой рукописи и Дуг Гамильтон за его техническую поддержку.
Материалы
| Name | Company | Catalog Number | Comments |
| Оборудование / реагент | Продавец | Каталог # | |
| Asahi Kasei Rexeed 25 S / R мокрый полые волокна ультрафильтров | Набор медицинский | REXEED25S / R | |
| I / P 73 (Masterflex R-3603) или эквивалент | Коул Parmer | EW-06408-73 | |
| L / S 24 (Masterflex Платиновый отверждения) или эквивалент | Коул Parmer | EW-96410-24 | |
| L / S 15 (Masterflex Платиновый отверждения) или эквивалент | Коул Parmer | EW-96410-15 | |
| L / S 36 (Masterflex Платиновый отверждения) или эквивалент | Коул Parmer | EW-96410-36 | |
| I / P Precision Drive Brushless | Коул Parmer | EW-77410-10 | |
| I / P Easy насос нагрузки | Коул Parmer | EW-77601-10 | |
| Черный ПНД Тройник 1/4 "х 3/8" х 3/8 " | США пластмасс | 62064 | |
| Masterflex T-разъем L / S 15-25 | Коул Parmer | EG-30613-12 | |
| Nalgene тяжелых стр. 1 л бутылки | Коул Parmer | EW-06257-10 | |
| 10 мл пипетки | Fisher Scientific | 13-678-11C | |
| Nalgene заполнения / Вентиляция колпачок для 1/4 "трубок, 53B | Коул Parmer | EW-06258-10 | |
| Манометр | Коул Parmer | -680-46-10 | |
| Прямой связи, NPT (F), 1/4 " | Коул Parmer | EW-06469-18 | |
| ДНЯО филиал чай, натуральный п.п. | Коул Parmer | A-30610-75 | |
| Pinch зажимы, 1/2 " | Коул Parmer | EW-06833-00 | |
| Cuльзовательская согласно DIN адаптеры | Формованные продукты Corp | MPC-855NS.250 | |
| Кольцо стенд | Fisher Scientific | 14-670B | |
| Зажимы кольцо стенд | Fisher Scientific | 05-769-6Q | |
| Кек рампы зажимом, 14мм | Коул Parmer | EW-06835-10 | |
| Натрия полифосфат | Sigma Aldrich | 305553 | |
| Пентагидрат натрия тиосульфата | Sigma Aldrich | 72050 | |
| Antifoam Y-30, эмульсии | Sigma Aldrich | A5758 | |
| Твин-80 | Sigma Aldrich | P1754 | |
| 10 л складной полиэтилена высокой плотности cubitainer | VWR | IR314-0025 | |
| Центрифуга для бутылок | Fisher Scientific | 05-663-103 | |
| 250 мл конические пробирки | Гранулирование | 430776 | |
| Одноразовые воронки | Коул Parmer | U-6122-10 | |
| Промойте бутылки | Коул Parmer | U-06252-40 | |
| Центрифугировать | Beckman Coulter | Allegra X-15R | |
| Бакет ротор | Beckman Coulter | ОВЕН SX4750 | |
| Центрифуга ведро адаптеры для 250 мл конические пробирки | Beckman Coulter | 349849 | |
| 200 мкл большого диаметра наконечники | Fisher Scientific | 02-707-134 | |
| VacuShield фильтра | Гельман | 629-4402 | |
| 5 мл пипетки | Fisher Scientific | 13-678-11D | |
| Dynabeads: Cryptosporidium / Giardia комбинированный комплект | ЯDEXX | 73002 | |
| 50 мл конические пробирки | Сокол | 352098 | |
| Dynal L10 плоский односторонний труб | IDEXX | 74003 | |
| Таймер | VWR | 23609-202 | |
| Dynal MPC-6 магнит | IDEXX | 12002D | |
| 1 мл пипетки | VWR | 53283-700 | |
| 1,5 мл низкой адгезией труб микроцентрифужных | Fisher Scientific | 02-681-320 | |
| 1000 мкл пипетки и соответствующих советов барьер | Gilson | P1000/DF1000ST | |
| 100 мкл пипетку и соответствующих советов барьер | Gilson | P100/DF100ST | |
| 9-дюймовый пипетки Пастера | VWR | 14672-412 | |
| Dynal MPC-S магнита | IDEXX | 12020D | |
| Вихревой | VWR | 14216-188 | |
| Dynabeads ротатор смесителя | IDEXX | 94701 | |
| Тепло блок | Fisher Scientific | 11-718-2 | |
| Бисер Лаборатории брони | Лаборатория брони | 42370-750 | |
| Цифровой термометр | Fisher Scientific | 15-077-60 | |
| Фосфат-солевой буфер рН 7,4 1X (1X PBS) | Сигма | P4417 | |
| Одноместный слайды пятно | IDEXX | 30201 | |
| Крышка стекла | Гранулирование | 287018 | |
| EasyStain прямой набор | БТФ | - | |
| 10 мкл пипетки и соответствующих советов барьер | Gilson | P10 и DF10ST | |
| 4 ', 6'-Diamidино-2-фенил индол дигидрохлорид (DAPI) | Сигма | D9542 | |
| Снимите лак для ногтей | Fisher Scientific | S30697 | |
| Метанол | Fisher Scientific | L6815 | |
| Kimwipes | Kimberly Clark | 34155 | |
| Инкубатор | Boekel Научные | 133000 | |
| скользить теплее | Fisher Scientific | 11-474-521 | |
| Погружение масла, типа ND = 1,515 | Nikon | MXA20234 | |
| Nikon 90i микроскоп с ДВС возможности | Nikon | MBA 77000 | |
| План APO 100X нефти цель | Nikon | MRD01901 | |
| План Achro 20X | Nikon | MRL00202 | |
| FITC фильтр | Nikon | 96302 | |
| DAPI фильтр | Nikon | 96301 | |
| X-cite флуоресценции осветитель | Nikon | 87540 | |
| Объектив бумаги | Nikon | 76997 | |
| Biohazard одноразовый мешок | Fisher Scientific | 01-829D | |
| Biohazard острых контейнер | Fisher Scientific | 14-827-117 | |
| 3% перекиси водорода | VWR | BDH3540-2 | |
| Отбеливатель | Fisher Scientific | 1952030 | |
| Wypall | Kimberly Clark | 34790 |
Ссылки
- DiGiorgio, C. L., Gonzalez, D. A., Huitt, C. C. Cryptosporidium and Giardia recoveries in natural waters by using Environmental Protection Agency Method 1623. Appl. Environ. Microbiol. 68, 5952(2002).
- Hill, V. R., Kahler, A. M., Jothikumar, N., Johnson, T. B., Hahn, D., Cromeans, T. L. Multistate evaluation of an ultrafiltration-based procedure for simultaneous recovery of enteric microbes in 100-liter tap water samples. Appl. Environ. Microbiol. 73, 4218-4225 (2007).
- Hill, V. R., Polaczyk, A. L., Hahn, D., Narayanan, J., Cromeans, T. L., Roberts, J. M., Amburgey, J. E. Development of a rapid method for simultaneous recovery of diverse microbes in drinking water by ultrafiltration with sodium polyphosphate and surfactants. Appl. Environ. Microbiol. 71, 6878-6884 (2005).
- Hill, V. R., Polaczyk, A. L., Kahler, A. M., Cromeans, T. L., Hahn, D., Amburgey, J. E. Comparison of hollow-fiber ultrafiltration to the USEPA VIRADEL technique and USEPA method 1623. J. Environ. Qual. 38, 822-825 (2009).
- Holowecky, P. M., James, R. R., Lorch, D. P., Straka, S. E., Lindquist, H. D. Evaluation of ultrafiltration cartridges for a water sampling apparatus. J. Appl. Microbiol. 106, 738-7347 (2009).
- Lindquist, H. D., Harris, S., Lucas, S., Hartzel, M., Riner, D., Rochele, P., Deleon, R. Using ultrafiltration to concentrate and detect Bacillus anthracis, Bacillus atrophaeus subspecies globigii, and Cryptosporidium parvum in 100-liter water samples. J. Microbiol. Methods. 70, 484-492 (2007).
- Polaczyk, A. L., Roberts, J. M., Hill, V. R. Evaluation of 1MDS electropositive microfilters for simultaneous recovery of multiple microbe classes from tap water. J. Microbiol. Methods. 68, 260-266 (2007).
- Rhodes, E. R., Hamilton, D. W., See, M. J., Wymer, L. Evaluation of hollow-fiber ultrafiltration primary concentration of pathogens and secondary concentration of viruses from. 176, 38-45 (2011).
- Shaw, N. J., Villegas, L. F., Eldred, B. J., Gaynor, D. H., Warden, P. S., Pepich, B. V. Modification to EPA Method 1623 to address a unique seasonal matrix effect encountered in some U.S. source waters. J. Microbiol. Methods. 75, 445-448 (2008).
- Simmons, O. D. 3rd, Sobsey, M. D., Heaney, C. D., Schaefer, F. W. 3rd, Francy, D. S. Concentration and detection of Cryptosporidium oocysts in surface water samples by method 1622 using ultrafiltration and capsule filtration. Appl. Environ. Microbiol. 67, 1123-1127 (2001).
- Sobsey, M. D., Glass, J. S. Influence of water quality on enteric virus concentration by microporous filter methods. Appl. Environ. Microbiol. 47, 956-9560 (1984).
- USEPA. Method 1623: Cryptosporidium and Giardia in Water by Filtration/IMS/FA. Office of Water. 815-R-05-002, EPA. (2005).
- Ware, M. W., Wymer, L., Lindquist, H. D., Schaefer, F. W. 3rd Evaluation of an alternative IMS dissociation procedure for use with Method 1622: detection of Cryptosporidium in water. J. Microbiol. Methods. 55, 575-583 (2003).
- Zuckerman, U., Tzipori, S. Portable continuous flow centrifugation and method 1623 for monitoring of waterborne protozoa from large volumes of various water matrices. J. Appl. Microbiol. 100, 1220-1227 (2006).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены