Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Оптимизирована процедура для флуоресцентной активированного сортировки клеток (FACS) Выделение вегетативной нервной прародителей из висцеральных органов плода мышей
В этой статье
Erratum Notice
Резюме
Оптимизированные процедуры для очищения нервного гребня, полученные от предшественников нейронов фетальных тканей мыши описано. Этот метод использует выражение из флуоресцентного аллелей репортер, чтобы изолировать отдельные группы по флуоресценции активированной сортировки клеток (FACS). Этот метод может применяться для изоляции нейронов субпопуляции на протяжении всего развития или из взрослых тканей.
Аннотация
During development neural crest (NC)-derived neuronal progenitors migrate away from the neural tube to form autonomic ganglia in visceral organs like the intestine and lower urinary tract. Both during development and in mature tissues these cells are often widely dispersed throughout tissues so that isolation of discrete populations using methods like laser capture micro-dissection is difficult. They can however be directly visualized by expression of fluorescent reporters driven from regulatory regions of neuron-specific genes like Tyrosine hydroxylase (TH). We describe a method optimized for high yields of viable TH+ neuronal progenitors from fetal mouse visceral tissues, including intestine and lower urogenital tract (LUT), based on dissociation and fluorescence-activated cell sorting (FACS).
The Th gene encodes the rate-limiting enzyme for production of catecholamines. Enteric neuronal progenitors begin to express TH during their migration in the fetal intestine1 and TH is also present in a subset of adult pelvic ganglia neurons2-4 . The first appearance of this lineage and the distribution of these neurons in other aspects of the LUT, and their isolation has not been described. Neuronal progenitors expressing TH can be readily visualized by expression of EGFP in mice carrying the transgene construct Tg(Th-EGFP)DJ76Gsat/Mmnc1. We imaged expression of this transgene in fetal mice to document the distribution of TH+ cells in the developing LUT at 15.5 days post coitus (dpc), designating the morning of plug detection as 0.5 dpc, and observed that a subset of neuronal progenitors in the coalescing pelvic ganglia express EGFP.
To isolate LUT TH+ neuronal progenitors, we optimized methods that were initially used to purify neural crest stem cells from fetal mouse intestine2-6. Prior efforts to isolate NC-derived populations relied upon digestion with a cocktail of collagenase and trypsin to obtain cell suspensions for flow cytometry. In our hands these methods produced cell suspensions from the LUT with relatively low viability. Given the already low incidence of neuronal progenitors in fetal LUT tissues, we set out to optimize dissociation methods such that cell survival in the final dissociates would be increased. We determined that gentle dissociation in Accumax (Innovative Cell Technologies, Inc), manual filtering, and flow sorting at low pressures allowed us to achieve consistently greater survival (>70% of total cells) with subsequent yields of neuronal progenitors sufficient for downstream analysis. The method we describe can be broadly applied to isolate a variety of neuronal populations from either fetal or adult murine tissues.
протокол
1. Подготовка Media (все шаги сделал в ткани капот культуры)
- Смешайте следующие: 44 мл L-15 средняя, 0,5 мл 100X пенициллина / стрептомицина (P / S), 0,5 мл 100 мг / мл бычьего сывороточного альбумина (БСА), 0,5 мл 1М HEPES, 5 мл культуры ткани класса воде. Будьте уверены, чтобы смешивать BSA и P / S тщательно, прежде чем добавлять. Эта книга должна быть достаточной для диссоциации до пяти различных типов тканей. Этот носитель будет использоваться в шаге от 3,4 до подготовки тушения решения для использования после ферментативного распада тканей.
- Фильтрующий материал, хотя 0,22 мкм Полиэфирсульфон (PES) фильтр.
- Подготовить сбалансированный солевой 1X Хэнка Решение (HBSS) и 1X фосфатного буфера (PBS) с 10х Акции использованием культуры тканей класса водой. Фильтр по 0,22 мкм PES фильтр. Большие объемы этих реагентов можно приготовить заранее и хранить при температуре 4 ° C, аликвоты меньших объемах в капюшоне культуры ткани по мере необходимости.
- Заполнить несколько 15 мл конические пробирки с 1X HBSS (количество трубок равного количества тканей вы планируете к югу от вскрытия) хранение труб на льду.
2. Рассечение
- Эвтаназии приурочен беременных мышей в соответствии с институциональными ухода за животными и использованию комитет утвердил протоколы и передачи матки в 60 или 100 мм чашки Петри содержащих ледяной 1X PBS.
- Удалить эмбрионов из матки и эвтаназии путем обезглавливания в ледяной 1X PBS. Экран индивидуально под флуоресценции освещение, деление на положительных и трансгенных дикого типа (WT) нетрансгенные бассейнов. Держите эмбрионов в ледяной 1X PBS всей рассечение.
- При вскрытии микроскоп, к югу от рассекать урогенитального тракта. Держите эмбриона в месте в лапы уровня с прекрасным щипцами. Удалите внутренности из печени вплоть до половой бугорок, вставив щипцы на уровне диафрагмы, то бодро тянет внутренних органов вниз и далеко от дорсальной стенки тела.
- Далее к югу от рассекать тканипроценты от окружающих тканей (рис. 1). Поместите каждое в отдельности, к югу от расчлененного типа ткани в 15 мл коническую трубку с ледяной 1X HBSS. Бассейн каждого типа ткани вместе в соответствии с эмбрионом фенотип (то есть все GFP + образцы эмбрионального кишечника объединяются в одну 15 мл коническую трубку).
- Параллельно с этим, анализировать сопоставимые ткани дикого типа эмбрионов использовать для компенсации контроля в проточной цитометрии.
3. Диссоциация Subdissected тканей
- Гранул суб-расчлененный тканей путем центрифугирования при 210 Относительная центробежная сила (RCF), 4 ° C в течение 5 мин. После центрифугирования, аспирации от такого большого HBSS насколько это возможно.
- Ресуспендируют ткани гранул в Accumax (Инновационные технологии Cell, Inc), будучи уверенным, что менять наконечники от каждого образца, чтобы избежать перекрестного загрязнения тканей. Количество Accumax добавленную могут быть расширены для большего или меньшего количества ткани. Обычно в течение 1-5 Плода образцы кишечника, 1 мл Accumax будет использоваться, но больше бассейнов ткани потребуется больший объем для достижения диссоциации.
- Место трубы на 37 ° С на водяной бане 20-45 мин в зависимости от стадии ткани оказаться в изоляции (например, 13,5 DPC кишечника 20 мин, 15,5 DPC кишечника 35 мин). На полпути, хотя время диссоциации, вручную разбить ткани, нокаутировав трубку к стенке водяной бане (или любую твердую поверхность) и "щелкать" трубки (как можно было бы тряхнуть старомодный ртутный термометр). В конце времени диссоциации повторить утрясать процедуру несколько раз, чтобы дальше отмежеваться образца. Для более хрупкие образцы, уменьшить энергичность от дрожания вниз и вместо этого использовать пипетки растирания в шаге от 3,5 до достижения соответствующего уровня диссоциации. Типичное время диссоциации 14,5 и 15,5 DPC DPC LUT на 35 и 45 минут соответственно.
- В то время как ткани инкубации в Accumax, составляют так тушенияРезолюции, называется угашайте и утолить 1:5. Quench производится путем добавления 45 мкл 5 мг / мл ДНКазы I до 6 мл L-15 СМИ. Угашайте 1:05 производится путем добавления 45 мкл 5 мг / мл ДНКазы I до 30 мл L-15 СМИ.
- В конце диссоциации, двигаться 15 мл труб на лед и сразу же добавляют 1 мл Quench в каждую пробирку. Измельченного в порошок каждого образца вверх и вниз, пока ткань почти полностью диссоциированных (рис. 2). Там еще будут небольшие куски ткани, присутствующих в растворе. Достижение полностью однородный образец не является легко достижимым, ни желательным, как это может привести к снижению жизнеспособности клеток.
- Храните образцы на льду как можно больше на оставшуюся часть протокола. Обязательно используйте свежий наконечник пипетки при пипетки до закалочной или угашайте 1:05, чтобы избежать перекрестного загрязнения образцов.
4. Фильтрация суспензии клеток
- Используя щипцы, которые были пропитанной 70% этанолом, поместите 3 см, площадью 38 мкм мембраны нейлоновой сетке (SEFAR Америки) поустья новый 15 мл коническую трубку. Фильтры клеток через сетку с помощью пипетки в центре мембраны использованием малого диаметра советы. Если мембрана становится насыщенным при фильтрации, удалите его, высушить рот трубки с kimwipe, а также использовать новый кусок нейлоновой сеткой для фильтрации остальной части клеточной суспензии. Когда все клетки были отфильтрованы, используя 1 мл угашайте 1:5 до промыть трубы и фильтровать все оставшиеся клетки.
- При фильтрации завершена, или при замене забитый мембраны, использование щипцов, чтобы свернуть стороны сетки и протрите через мембраны верхней части трубки для удаления висящих капель клеток.
- Гранул суспензии клеток путем центрифугирования при 210rcf, 4 ° С в течение 5 мин. Аспирируйте от супернатант и ресуспендируют осадок в 1 мл Quench 1:5.
- Фильтры суспензии клеток через нейлоновую сетку труб на 5 мл полистирола. Промыть 15 мл трубку с 1 мл угашайте 1:5 и фильтр для захвата оставшихся клеток.
5. Подготовка проб для FACS
- При использовании той же ткани для сортировки и компенсации управления, передачи 1/10 до 1/20-го объема образца на новый 5 мл полистирола трубы использовать для компенсации управления. Разделите дикого типа образец ткани на две части. Одна часть будет незапятнанным дикого типа (WT только), а вторая половина будет иметь 7-Aminoactinomycin D (7-AAD, люминесцентные интеркалятора исключены из живых клеток, используемых в качестве "жизнеспособность пятно") добавил к нему (7-AAD только ). Эти отдельные элементы управления необходимо, чтобы для компенсации любого спектрального перекрытия между излучением дискретных флуорофоров на поток сортировщика. Например, для одного репортера, как люминесцентные EGFP, необходимый контроль будет включать: EGFP только безупречной WT клеток, и трубы окрашивают с 7-AAD только (рис. 3).
- Заполните все 5 мл пробирки, содержащие суспензии клеток с Quench 1:5 и центрифуги в 210rcf, 4 ° С в течение 5 мин. Аспирируйте супернатант, в результате чего около 200 мкл жидкостив трубке.
- Развести 7-AAD 1:1000 в Quench 1:5. Добавить 7-AAD окрашивания разбавления до 7-AAD только контроль компенсации и образцов для сортировки. Не добавляйте 7-AAD с EGFP или только WT только контроль компенсации. Объем 7-AAD быть добавлены будет варьироваться в зависимости от количества исходного материала и размера осадок клеток получены. После 7-AAD была добавлена в каждую пробирку, пробы готовы для сортировки.
Ткань Размер образца бассейн Том 7-AAD которые будут добавлены к трубке * 15,5 DPC кишечника 1-5 200 мкл 15,5 DPC LUT 1-5 150 мкл
Таблица 1. Количество 7-AAD добавлены различные распадается ткань * Окончательная общая сумма в каждой трубке будет зависеть от суммы, начиная от 50-100 мкл, поскольку стремление СМИп приблизительно процесса и проводится, чтобы избежать гранул. Окончательные объемы не измеряются таким образом, чтобы свести к минимуму обработку клеток в растворе. - Подготовить набор труб для сбора клеток для выделения РНК путем добавления 0,75 мл TRIzol-LS в пробирки на 1,5 мл микроцентрифужных.
- Если сбор клеток для культуры пробирке, а не РНК изоляции, вид клеток непосредственно в самообновлению СМИ в 6 пластин и культура ткани, покрытой фибронектином и наполнены средства массовой информации, как описано выше. 2,6,7
6. Проточной цитометрии
- В проточной цитометрии, оценить компенсации управления первого, будучи уверенным, что к спине промывать между каждого образца, чтобы избежать загрязнения. С помощью профилей компенсации образцы для установки напряжения / ворота для сортировки. Заметим, что если положительных клеток в ткани желаемого присутствуют в ограничении числа, различные ткани могут быть использованы для установления компенсации настройки до тех пор, как интенсивность флуоресценции и размера ячейкимежду образцами являются сопоставимыми.
- Установите параметры компенсации и ворота, чтобы избежать мертвых клеток, которые занимают 7-AAD красителей и собирают клетки, обладающие высокой интенсивности флуоресценции GFP относительной к неокрашенные элементы управления (рис. 4).
- Сортировка максимально 25000 клеток в каждом микроцентрифужных трубку. Сортировка должна быть выполнена по самым низким давлением с широким отверстием сопла и низкой скоростью потока (например, 17psi, 100 мкм, сопла, 3000 событий / сек), чтобы сохранить жизнеспособность нейронов предшественников. Для видов, чтобы изолировать EGFP + клеток мы выполняем наши изоляции на BD Biosciences FACSAriaII помощью 488nm 20mW лазер для возбуждения EGFP репортера.
- Если образцы содержат высокие концентрации клетки, желательно, чтобы разбавить суспензию клеток дальнейшего использования 1:1000 7-AAD пятно для достижения более высокой эффективности захвата при сортировке.
- Vortex каждую пробирку клеток, захваченных в TRIzol-LS сразу после сортировки.
7. Представитель Результаты
Ткани для производства диссоциации клеточные суспензии для потока сортировки тонкий баланс между адекватной ферментативного пищеварения и избегая чрезмерной пищеварения, что может привести к низкому viabilities клетки. Пример желаемого уровня ткани диссоциации показано на рисунке 2. В надлежащим переваривается ткани перед ручным части растирания к югу от расчлененного органов по-прежнему очевидны (рис. 2б, 2е). В тканях, которые ферментативно лечение слишком длительного периода времени или при слишком высокой концентрации фермента, полученной суспензии не хватает остаточного большие куски ткани (рис. 2-й, 2 часа).
Соответствующие диссоциации и ручной фильтрации производят рода профилей в проточной цитометрии, которые обычно демонстрируют более чем на 90% жизнеспособных клеток и показать высокий уровень экспрессии EGFP (рис. 4). Клеточные популяции, полученные этим методом иллюстрации хорошегожизнеспособность и могут быть записаны для последующей культуры и анализ экспрессии генов путем стробирования для захвата EGFP + нейронных предшественников.
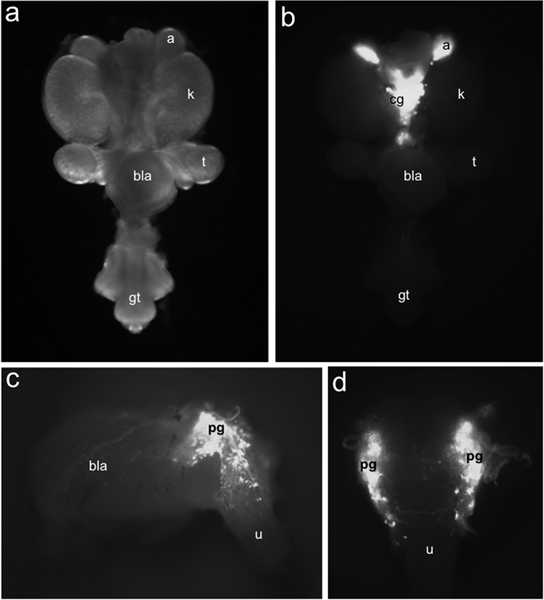
Рисунок 1. Распределение TH-EGFP + предшественники нейронов плода LUT мыши. Всего монтажа урогенитального тракта в 15,5 ЦОД рассматривается вентрально при ярком освещении поля () по сравнению с распределением EGFP + клеток, помеченных TH-EGFP экспрессии трансгена, выявленные в рамках освещения флуоресценции (б). TH-EGFP выражение присутствует в надпочечниках (а) и медиально расположенных целиакией ганглиев (CG). Боковой (с) представление на 15,5 DPC TH-EGFP суб-расчлененный пузыря экспонатов флуоресценции от экспрессии трансгена в тазовых ганглиев (PG), стенки мочевого пузыря (бла) и мочеиспускательного канала (и). В вид сверху (г) EGFP + клеток видны в передней спинной уретры. Другие этикетки: почки (к), семенников (т), мочевого пузыря (бла) и половой бугорок (GT).

Рисунок 2. Светлое изображение 15 DPC плода LUT (а) и кишечника (д), соответственно, отображаемого на полпути через инкубационный период распада, в конце инкубационного диссоциации до разрушения (B, F), после ручной нарушения (с, г) и в образце, который был слишком диссоциированных (д, з).
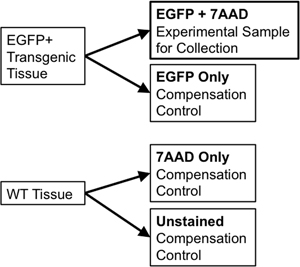
Рисунок 3. Принципиальная схема иллюстрирует компенсации контролирует необходимые для установления строгого стробирования FACS параметров.
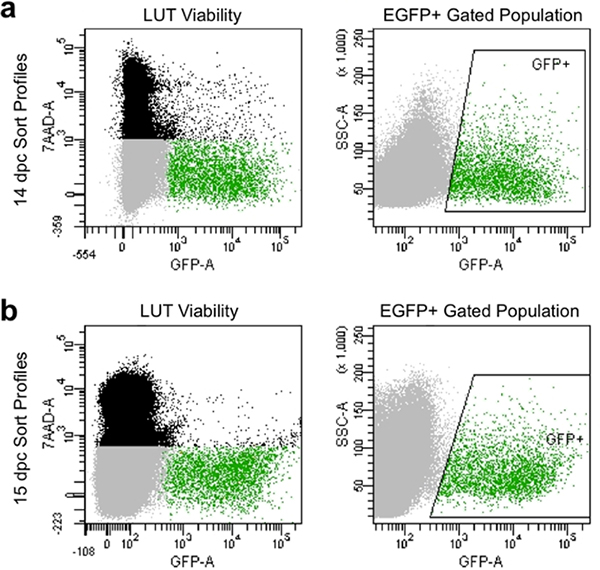
Рисунок 4. Представитель изображение профилей потоком вид на 14,5 ЦОД (а) и 15.5 DPC (б). Черное население состоит из одной клетки на основе прямого и бокового рассеяния, которые мертвы и помечены7-AAD флуоресценции. Серый население состоит из синглетного элементов на основе прямого и бокового рассеяния, которые исключены 7-AAD, и, таким образом, жизнеспособность. Зеленый закрытого населения указывает коробку "GFP +" области и состоит из одной клетки, которые исключены 7-AAD (жизнеспособных) и обладают EGFP флуоресценции.
Обсуждение
Мышь репортер линии, экспрессирующие флуоресцентные журналистам становятся доступными через многочисленные усилия в мышиной генетики сообщество 1,8,9. В результате метод диссоциации показано здесь может широко применяться для изоляции дискретных нейронов подтипы на основе мед?...
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Авторы хотели бы поблагодарить Екатерину за Alford предложения по клеточная диссоциация методы и Кевин Уэллер, Дэвид Флаэрти и Бретани Мэтлок за поддержку в проточной цитометрии общих ресурсов в Университете Вандербильта медицинский центр и Мелисса А. Musser художественного помощь с иллюстрациями. Мы благодарим доктора. Джек Мошер и Шон Моррисон совета по реализации изоляции нейронов прародителей. VMC проточной цитометрии общих ресурсов поддерживается Вандербильта Ingram Cancer Center (P30 CA68485) и пищеварительной Вандербильта болезни Научно-исследовательский центр (P30 DK058404). Эта работа была поддержана финансирование от американского Национального института здравоохранения грантов DK064251, DK086594 и DK070219.
Материалы
| Name | Company | Catalog Number | Comments |
| Реагент Имя | Продавец | Номер в каталоге | Комментарии |
| Accumax | Sigma (МВС: Инновационные технологии Cell) | A7089-100мл | Хранить замороженные в 1 мл аликвоты |
| ДНКазы I | Сигма | D-4527 | Хранят в замороженном виде при температуре -20 ° C 5 мг / мл в 1xHBSS, (Используется в Quench, угашайте 1:5) |
| 10X рН 7,4 PBS | Гибко | 70011-044 | Сделать до 1x с водой ткань класса культуры, то стерильный фильтр |
| 10X HBSS без Ca или Mg | Гибко | 14185-052 | Сделать до 1x с водой ткань класса культуры, то стерильный фильтр |
| L-15 Лейбовиц в среду | Гибко | 21083027 | |
| Пенициллина / стрептомицина 100X | Гибко | 15140-133 | Магазин аликвоты при -20 ° C |
| BSA | Сигма | A3912-100G | Хранить аликвоты при -20 ° С, 100 мг / мл в воде |
| Biowhittaker 1M HEPES в 0,85% NaCl | Lonza | 17-737E | |
| 38 мкм NITEX нейлона Mesh мембранные | SEFAR Америки | 3-38/22 | Нарезать ~ 3 см площади. УФ лечить быстро, чтобы стерилизовать в капюшоне культуре ткани. |
| 7-AAD | Invitrogen | A1310 | 1 мг / мл |
| TRIzol LS | Invitrogen | 10296-028 | |
| 5 мл труб из полистирола | Сокол | 352058 | |
| 15 мл конические пробирки | Гранулирование | 430790 | |
| Изобразительное диссекционные | Изобразительное инструменты науки | 11251-30 | Дюмон # 5 Forcep, Dumoxel, стандартный наконечник 0.1x0.06mm |
| Анатомический ложка | Изобразительное инструменты науки | 10370-18 |
Ссылки
- Gong, S. A gene expression atlas of the central nervous system based on bacterial artificial chromosomes. Nature. 425, 917-925 (2003).
- Morrison, S. J., White, P. M., Zock, C., Anderson, D. J. Prospective identification, isolation by flow cytometry, and in vivo self-renewal of multipotent mammalian neural crest stem cells. Cell. 96, 737-749 (1999).
- Kruger, G. M. Neural crest stem cells persist in the adult gut but undergo changes in self-renewal, neuronal subtype potential, and factor responsiveness. Neuron. 35, 657-669 (2002).
- Bixby, S., Kruger, G. M., Mosher, J. T., Joseph, N. M., Morrison, S. J. Cell-intrinsic differences between stem cells from different regions of the peripheral nervous system regulate the generation of neural diversity. Neuron. 35, 643-656 (2002).
- Walters, L. C., Cantrell, V. A., Weller, K. P., Mosher, J. T., Southard-Smith, E. M. Genetic background impacts developmental potential of enteric neural crest-derived progenitors in the Sox10Dom model of Hirschsprung disease. Human Molecular Genetics. , (2010).
- Corpening, J. C. Isolation and live imaging of enteric progenitors based on Sox10-Histone2BVenus transgene expression. Genesis. 49, 599-618 (2011).
- Morrison, S. J. . Isolation of fetal rat neural crest stem cells (NCSC) from gut and sciatic nerve. , (2012).
- Skarnes, W. C. A conditional knockout resource for the genome-wide study of mouse gene function. Nature. 474, 337-342 (2011).
- Harding, S. D. The GUDMAP database--an online resource for genitourinary research. Development. 138, 2845-2853 (2011).
- Joseph, N. M. Enteric glia are multipotent in culture but primarily form glia in the adult rodent gut. J. Clin. Invest. 121, 3398-3411 (2011).
- Newgreen, D. F., Murphy, M. Neural crest cell outgrowth cultures and the analysis of cell migration. Methods Mol. Biol. 137, 201-211 (2000).
Erratum
Formal Correction: Erratum: An Optimized Procedure for Fluorescence-activated Cell Sorting (FACS) Isolation of Autonomic Neural Progenitors from Visceral Organs of Fetal Mice
Posted by JoVE Editors on 10/01/2012. Citeable Link.
The authors middle initials were omitted from the publication of An Optimized Procedure for Fluorescence-activated Cell Sorting (FACS) Isolation of Autonomic Neural Progenitors from Visceral Organs of Fetal Mice.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены