Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Ремонт критического размера дефекта свода черепа Модель Используя полученные из жировой ткани стромальных клеток, полученных из Lipoaspirate
* Эти авторы внесли равный вклад
В этой статье
Резюме
Этот протокол описывает выделение жировой ткани стромальных клеток, полученных из lipoaspirate и создание 4 мм критического размера дефекта свода черепа для оценки скелетных регенерации.
Аннотация
Черепно-лицевой скелет ремонт и восстановление открывает перспективы De Novo ткани образование через ячейку подход, основанный на использовании стволовых клеток. Жировая стромальных клеток, полученных (ИСС) оказались богатым источником мультипотентных стволовых клеток, способных к остеогенной, хондрогенной, адипогенной, и миогенной дифференциации. Многие исследования изучили остеогенных потенциал этих клеток в естественных условиях с использованием различных биоматериалов леса для сотовых доставки. Было показано, что, используя остеокондуктивные, гидроксиапатит покрытые поли (молочной-со-гликолевой кислоты) (HA-PLGA) эшафоте семенами с ИСС, критический размер дефекта свода черепа, дефект, который определяется его неспособностью спонтанному исцеление в течение всего срока животного, могут быть эффективно показать надежные костной регенерации. Это, в естественных условиях модель демонстрирует основы поступательного подходов, направленных на регенерацию костной ткани - сотовыйкомпоненты и биологические матрицы. Этот метод служит моделью для окончательного клинического применения клеток-предшественников к ремонту конкретного дефекта ткани.
протокол
1. Изолятор и расширения
- Все согласия пациента и экспериментальные протоколы были рассмотрены и одобрены Стэнфордского университета Институциональные Review Board (протокол № 2188 и № 9999).
- Получить человека подкожной жировой ткани от выборных процедур липоаспирация под местной / общей анестезии.
- Там будет два слоя в lipoaspirate (рис. 1А). Супернатант содержит подавляющее большинство обработанных клеточного материала. Нижний слой правило, инъекции физиологического раствора. Полученные из жировой ткани стромальные клетки могут быть собраны из любого слоя, но доходность значительно больше, из супернатанта.
- Для выделения стромальных сосудистой фракции (НВФ), мыть lipoaspirate экстенсивно с равными объемами 1X фосфатным буферным раствором (PBS), содержащего 2,5% бетадин (x2), а затем равный объем 1X PBS (x1) без бетадин. Разрешить стирки выпадать в осадок.
- Будьте осторожны, чтобы поддерживать стерильную тэchnique на протяжении всего процесса как загрязнение обработанной ткани человека может случиться.
- Аспирируйте нижний слой и выбросить после каждого мытья.
- Алиготе 15 мл жировой ткани в 50 мл BD Falcon трубы конической.
- Дайджест жировой ткани с равным объемом (15 мл) фильтруется 0,075% Type II коллагеназы в сбалансированном солевом растворе Хэнка (HBSS) при 37 ° С на водяной бане в течение 60 мин при постоянном перемешивании (около 180 коктейлей / мин) - проветрить каждую пробирку каждые 15 мин.
- Нейтрализовать активности фермента с 15 мл PBS, содержащего 10% (фетальная бычья сыворотка), FBS, и центрифуге при 1000 оборотов в минуту в течение 5 мин при 4 ° С для получения высокой плотности SVF гранул. Осадок будет смесь из жировой ткани стромальные клетки и эритроциты.
- Удалите супернатант, не нарушая гранул.
- Ресуспендируют гранул в 10 мл традиционных СМИ роста (Дульбекко изменения Eagle Средний [DMEM] / 10% FBS / 1% пенициллина-стрептомицина раствора).
- Фильтр суспензии ния через 100 мкм нейлон клетки сито, чтобы удалить продукты распада клеток.
- Объединение 3 труб в один чистый 50 мл коническую форму. Центрифуга при 1000 оборотов в минуту в течение 5 мин при 4 ° C.
- Удалите супернатант, не нарушая гранул.
- Ресуспендируют гранул в 5 мл традиционных СМИ роста
- Объединение двух 50 мл conicals на одну пластину 10 см или пяти 50 мл conicals для одного 15 см тарелку.
- Создание первичных культур в течение ночи при 37 ° C/21% O 2, 5% CO 2.
- После инкубации в течение ночи, мыть пластины с широко PBS для удаления остатков не соблюдают красных кровяных клеток. В результате клеточных популяций являются полученные из жировой ткани стромальных клеток.
- Поддерживать клетки на суб-вырожденная уровнях для предотвращения спонтанной дифференцировки при 37 ° C/21% O 2, 5% CO 2 в питательной среде. Клетки в целом должны быть разделены каждые три-четыре дня в регулярном питательной среды при посеве на 50% слияния.
- Строительные леса выступили д-р Мин Ли из Калифорнийского университета, Лос-Анджелес - Школа Стоматологии.
- PLGA леса были изготовлены из 85/15 поли (молочной-со-гликолевой кислоты) (характеристической вязкостью = 0,61 дл / г, Бирмингем полимеров) растворителя литья и процесс выщелачивания частиц.
- PLGA / хлороформ растворы смешивают с 200-300 мкм сахарозы диаметра для получения 92% пористостью (объемная доля), и прессуют в тонкие листы в форме тефлона.
- После сублимационной сушки в течение ночи, леса были погружены в три смены двойной перегонки (DD) H 2 O для растворения сахарозы, и осторожно снимают с пластинки тефлоновой с тонким наконечником шпателя.
- После вымывания частиц, все леса были вылечены путем погружения в 50%, 60% и 70% этанола в течение 30 минут каждый, за которым следуют три полоскания из DDH 2 O.
- Все леса сушили под капотом ламинарного потока.
- После эшафот изготовления, сcaffolds были покрыты апатита.
- SBF (симуляция жидкости тела) решения был подготовлен при концентрации ионов, которые были в 5 раз, что из плазмы крови человека. Все решения были стерильно фильтровали через 0,22 мкм PES мембраной (Nalgene). Сразу же после процесса нанесения покрытия, сушат PLGA леса подвергались тлеющий разряд, аргон-плазменного травления (Harrick Scientific) для улучшения смачивания и равномерность покрытия.
- Etched PLGA леса затем инкубировали в SBF при 37 ° C в водяной рубашкой инкубаторе в течение 12 ч, затем Mg 2 + и HCO 3 - бесплатная SBF 2 для еще 12 ч при 37 ° C при осторожном помешивании.
- Покрытые лесом PLGA промывают осторожно стерильной DDH 2 O, чтобы смыть избыток раствора хлорида натрия, сушат в ламинаре и дезинфицировать с 70% этанола.
- Целостность покрытия апатитового была проанализирована с помощью сканирующего электронного микроскопа (SEM). Апатит покрытием SCAffolds были установлены на заглушки SEM (Ted Пелла) и покрыты углерода для улучшения проводимости. Вторичных электронов режим был применен во время SEM (FEI / Phillips XL-30) наблюдений. Дисперсия энергии рентгеновского спектра было получено для подтверждения элементного состава апатита структур.
3. Сотовые Сеялки
- По достижении югу от слияния уровней, мыть клетки с PBS (x2) и trypsinize.
- Подсчет клеток в количественном для посева
- Семенной на нарезанные 4,0 мм диаметром леса с 1,5 х 10 5 клеток.
- Место отдельных лесов в лунку 96-луночный планшет
- Повторное приостановить клеток в обычных питательных сред с концентрацией примерно 1,5 х 10 5 клеток на 20 мкл СМИ
- Внесите 20 мкл непосредственно на эшафот и место в культуре клеток инкубаторе в течение 30 мин.
- Через 30 мин, добавить 200 мкл среды и позволяют клеткам инкубироватьна эшафот ночь перед операцией
- Это не необходимо для обеспечения адгезии клеток на эшафот семян, достаточное количество клеток будет гарантировать, что большинство будет приложить на эшафот. Это было подтверждено в нашей лаборатории в естественных условиях с биолюминесценции и гистологического анализа.
4. Создание свода черепа дефекты и в естественных условиях имплантации
- Anesthetize взрослых (60 дневных) CD-1 голых мышей с коктейлем анестезии. (Кетамин / ксилазина / Ацепромазин) при 50%-ной концентрации (1:1 разбавление 0,9% NaCl) или по рекомендуемой схеме анестетика в протоколах учреждения. Эти мыши бестимусным так hASCs не будет вызывать иммунную реакцию.
- Дозировка: кетамина гидрохлорид (80 мг / кг), Ксилазин (2,5 мг / кг) Ацепромазин (2,5 мг / кг)
- Длительность действия: около 30 мин
- Хирургическим драпировка животных и стерилизовать хирургическиесайт с бетадин и алкоголь (x3) и покрывают мыши глаза с мазью до принятия средней линии сагиттального разреза в волосистой части головы животного, чтобы разоблачить правой теменной кости. Снимите череп с правой теменной кости с тупым скребком (рис. 1б).
- Создание одностороннего 4-х мм на всю толщину дефект в правом без шва связанных теменной кости с помощью стерильного алмазным покрытием трепана сверло. Особую осторожность должны быть приняты, чтобы не нарушить основной мозговой оболочки (рис. 1б), как мышь свода толщиной составляет <0,3 мм.
- Перед имплантацией, промыть леса стерильной PBS, чтобы предотвратить передачу средних факторы роста.
- Поместите на эшафот в дефект.
- И, наконец, сшить кожу закрыты и мониторинга животного в установленном послеоперационных протоколов.
- Использование установленных обезболивания в соответствии с указаниями по уходу за животными протоколов по мере необходимости после операции, например. бупренорфина 0,1 мг / кг.
5. Количественное остеоида Формирование
- После MicroCT проводили на мышах, трехмерное изображение было реконструировано использованием MicroView программное обеспечение, как описано ранее 1.
- Использование Adobe Photoshop, изображения были размером со стандартной высотой.
- С помощью магии функция Wand, пиксели были измерены из свода дефектов.
- Процент заживления дефекта определяется последующим КТ измерения свода область дефекта и определения количества пикселей и поделив ее на количество пикселей оригинальный дефекта
- Следовательно, если MicroCT недоступны, альтернативой является использование Adobe Photoshop и уборки черепа в определенные моменты времени для гистологии.
- Использование гистологического пятна, как анилин синий и Pentachrome, которые обозначают остеоида образование, несколько секций по размаху дефекта должны быть окрашенные
- Использование Adobe Photoshop, урожай из всех областей, которые не являютсяВ дефекта свода черепа
- Используйте магию функцию палочки и определить количество пикселей De Novo формирование кости в области дефекта и сравнить с контрольной или других переменных.
6. Представитель Результаты
Жировая ткань имеет потенциал, чтобы служить жизненно важную роль в генерации клеток-предшественников для клинического применения. Жировая ткань имеет уникальное преимущество в том, что есть доступными питания, который может быть собран в относительно простая процедура, которая включает в себя минимальное заболеваемости и смертности. Как только ткань собирают и собирают, наши протокола указаны на рисунке 2. Полученные из жировой ткани стромальные клетки выделяют через ряд этапов промывки, коллагеназы пищеварение, и центрифугирования. Как только клетки высевают в культуру, они могут быть расширены, расположенных в различных протоколах дифференциации в пробирке, или помещены непосредственно в живом организме.
Создание 4 мм критического размера дефекта свода черепа представляет собой легко доступный и воспроизводимый в естественных условиях модель для тестирования остеогенной возможность дифференциации наша полученные из жировой ткани стромальных клеток. Благодаря использованию MicroCT, мы можем следить за формирование скелетной ткани в естественных условиях и отслеживать прогресс нашего вмешательства (рис. 3). Критического размера дефекта свода черепа не заживают в течение жизни животного, и мы видим примерно 90% дефектов остаются патент около 8 недель. Эшафот себя (см. обсуждение) имеет остеогенной индуктивных свойств и показали способность индуцировать некоторые костной регенерации. Типичные результаты размещения эшафот без клеток показывает, что около одной трети дефект будет иметь De Novo формирование кости на 8 недель. С увеличением жировой ткани стромальные клетки, полностью две трети или более дефектов покажет костной регенерации около 8 недель, хотя есть variability между животным и хирургии. Формирование скелетных тканей может быть определена количественно путем гистологии и типичные результаты показывают, увеличилось остеоида образование в образцах с ИСС через анилин синий и Pentachrome окрашивания (рис. 3). Кроме того, мы покажем, что имплантированные клетки человека вносят вклад в основные De Novo костного формирования с помощью GFP-меченых hASCs, которые показывают, окрашивание в естественных условиях в течение 2 недель около области De Novo формирования костей свода черепа в дефект (рис. 3D) . Кроме того, мы используем иммуногистохимии с человека специфических антител, чтобы показать человеческое выживание клеток и вклад в области дефекта (рис. 3E).
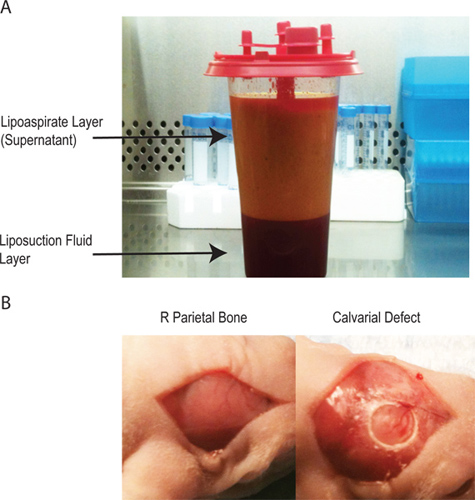
Рисунок 1 -. Lipoaspirate имеет два слоя. Верхний слой содержит адипоцитов и большинство пр.ocesses клеточного материала, в то время как нижний слой содержит солевых использоваться во время липоаспирация процедуры. B - создание свода дефекта через срединный разрез через череп, чтобы изолировать правой теменной кости, последующее создание 4 мм критического размера дефекта свода черепа без нарушения основных твердой мозговой оболочки.
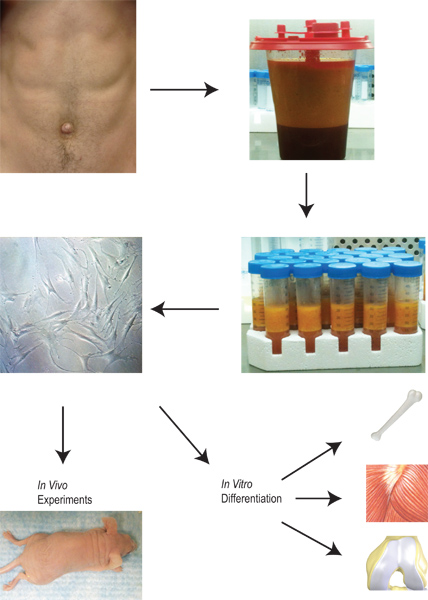
Рисунок 2. Общие сведения о заготовке и применению lipoaspirate с изоляцией из жировой ткани стромальные клетки к их расширению, дифференциации и использования в пробирке и в естественных условиях.
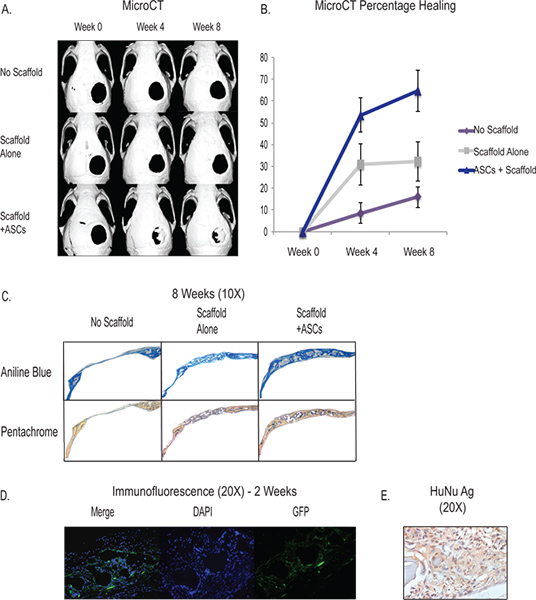
Рисунок 3. MicroCT-показывающий в естественных условиях заживления критический размер дефекта свода черепа с применением ИСС через гидравлическиеroxyapatitie леса (нижний ряд). Система контроля предусматривает не эшафот и дефект (верхний ряд) и дефект с размещением на эшафот без клеток (средний ряд) B - Количественное костная исцеление от MicroCT показывает значительно увеличилось исцеления в группе ASC. C - Гистология проявляют повышенный остеоида формирования ASC группы (нижний ряд) через анилин синий и Pentachrome окрашивания. Для Анилин Blue, остеоида пятна темно-синий и Pentachrome, остеоида пятна желтого цвета. D - hASCS помечены GFP высевали на эшафот и помещают в дефект свода черепа и пожертвовал на 2 недели. Окрашивание было сделано с GFP меченых антител, чтобы показать человеческие клетки способствуют регенерации в области дефекта. E -. Человека ядерное иммуногистохимии антигена показывает распространенность человеческих клеток в зоне дефекта в течение 2 недель Нажмите здесь, чтобы увеличить показатель .
Обсуждение
С изоляцией из жировой ткани стромальные клетки 2 от lipoaspirate, эти клетки были дифференцированы на широкий спектр клеточных линий. Жировая ткань из мезодермальных происхождение и, следовательно, мультипотентных полученных из жировой ткани стромальные клетки, вероятно, будет наибо...
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Мы хотели бы поблагодарить д-р Джордж общин и доктор Дин Vistnes за их поддержку и сотрудничество наших исследований. Работа выполнена при поддержке Национального института стоматологических и черепно-лицевых исследований дает 1 DE019274 R21-01, R01EB009689 и RC2 DE020771-02, Oak Foundation и Hagey лаборатории детской регенеративной медицины в MTL д-р Хен поддерживается Saint Joseph Mercy Hospital GME .
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента: | Компания | Номер в каталоге | Комментарии (по желанию) |
| Lipoaspirate Harvest | |||
| PBS | Gibco | 10010-023 | |
| Сбалансированный солевой Хэнка решение | Cellgro | 21-023-CV | |
| Коллагеноз | Сигма | C6885-500мг | |
| Сотовый фильтр 100 мкм | BD Falcon | 352360 | |
| Steri-топ-500 мл 0,22 мкм фильтр | Millipore | SCGPT05RE | |
| Дефект свода черепа | |||
| Z500 безщеточный MicromotorsUM50C | NSK | NSKZ500 | |
| Циркулярный нож 4,0 мм | Xemax хирургические | CK40 |
Ссылки
- Levi, B., James, A. W., Nelson, E. R. Human adipose-derived stromal cells heal critical size mouse calvarial defect. PLoS One. 5, (2010).
- Zuk, P. A., Zhu, M., Ashjia, P. Human adipose tissue is a source of multipotent stem cells. Mol. Biol. Cell. 13, 4279-4295 (2002).
- Keefe, M. S., Keefe, M. A. An evaluation of the effectiveness of different techniques for intraoperative antibiotics into alloplastic implants for use in facial reconstruction. Arch Facial Plastic Surg. 11, 246-251 (2009).
- Mitchell, J. B., McIntosh, K., Zvonic, S. Immunophenotype of human adipose-derived cells: Temporal changes in stromal-associated and stem cell-associated markers. Stem Cells. 24, 376-385 (2006).
- Dominici, M., Blanc, K. L. e., Mueller, I. Minimal criteria for defining multipotent mesenchymal stroma cells. The International Society for Cellular Therapy position statement. Cytotherapy. 8, 315-317 (2006).
- Cowan, C. M., Shi, Y. Y., Aalami, O. O. Adipose-derived adult stromal cells heal critical-size calvarial defects. Nat Biotechnol. 22, 560-567 (2004).
- Levi, B., Nelson, E. R., Li, S. Dura mater stimulates human adipose-derived stromal cells to undergo bone formation in mouse calvarial defects. Stem Cells. 29, 1241-1255 (2011).
- Phipps, M. C., Clem, W. C., Catledge, S. A. Mesenchymal stem cells responses to bone-mimetic electrospun matrices composed of polycaprolactone, collagen I and nanoparticulate hydroxyapatite. PLoS One. 6, (2011).
- Yuan, H., Zang, Z., Li, Y. Osteoinduction by calcium phosphate biomaterials. J. Mater. Sci. Mater. Med. 9, 723-726 (1998).
- Wei, G., Jun, Q., Giannobile, W. V. The enchancement of osteogenesis by nano-fibrous scaffolds incorporating rhBMP-7 nanospheres. Biomaterials. 28, 2087-2096 (2007).
- Li, C., Verpari, C., Jin, H. J. Electrospun silk-BMP-2 scaffolds for bone tissue engineering. Biomaterials. 27, 3115-3124 (2006).
- Zhang, Y., Fan, W., Nothdurft, L. In vitro and in vivo evaluation of adenovirus combined silk fibroin scaffolds for bone morphogenetic protein-7 gene delivery. Tissue Eng Part C Methods. 17, 789-797 (2011).
- Levi, B., Hyun, J. S., Nelson, E. R. Non-integrating knockdown and customized scaffold design enhances human-adipose-derived stem cells in skeletal repair. Stem Cells. 29, 21028-21029 (2011).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены