Method Article
Бляшек на мышиной норовирус
В этой статье
Резюме
Здесь мы опишем метод количественной инфекционных частиц мышиных норовируса (МНВ), которое является единственным норовируса, который эффективно размножается в культуре клеток. Бляшек использует тропизм Многовершинное для мышиных макрофагов и может быть адаптирован для использования с биологической или экологической образцов, содержащих МНВ.
Аннотация
Murine norovirus (MNV) is the only member of the Norovirus genus that efficiently grows in tissue culture 1, 2. Cell lysis and cytopathic effect (CPE) are observed during MNV-1 infection of murine dendritic cells or macrophages 1. This property of MNV-1 can be used to quantify the number of infectious particles in a given sample by performing a plaque assay 1. The plaque assay relies on the ability of MNV-1 to lyse cells and to form holes in a confluent cell monolayer, which are called plaques 3.
Multiple techniques can be used to detect viral infections in tissue culture, harvested tissue, clinical, and environmental samples, but not all measure the number of infectious particles (e.g. qRT-PCR). One way to quantify infectious viral particles is to perform a plaque assay 3, which will be described in detail below. A variation on the MNV plaque assay is the fluorescent focus assay, where MNV antigen is immunostained in cell monolayers 4. This assay can be faster, since viral antigen expression precedes plaque formation. It is also useful for titrating viruses unable to form plaques. However, the fluorescent focus assay requires additional resources beyond those of the plaque assay, such as antibodies and a microscope to count focus-forming units. Infectious MNV can also be quantified by determining the 50% Tissue Culture Infective Dose (TCID50) 3. This assay measures the amount of virus required to produce CPE in 50% of inoculated tissue culture cells by endpoint titration 5. However, its limit of detection is higher compared to a plaque assay 4.
In this article, we describe a plaque assay protocol that can be used to effectively determine the number of infectious MNV particles present in biological or environmental samples 1, 4, 6. This method is based on the preparation of 10-fold serial dilutions of MNV-containing samples, which are used to inoculate a monolayer of permissive cells (RAW 264.7 murine macrophage cells). Virus is allowed to attach to the cell monolayer for a given period of time and then aspirated before covering cells with a mixture of agarose and cell culture media. The agar enables the spread of viral progeny to neighboring cells while limiting spread to distantly located cells. Consequently, infected cells are lysed and form holes in the monolayer known as plaques. Upon sufficient spread of virus, plaques become visible following staining of cells with dyes, like neutral red, methylene blue, or crystal violet. At low dilutions, each plaque originates from one infectious viral particle and its progeny, which spread to neighboring cells. Thus, counting the number of plaques allows one to calculate plaque-forming units (PFU) present in the undiluted sample 3.
протокол
1. Культивирование линии макрофагов RAW 264.7 сотовых
- Поддерживать RAW 264.7 клетки (АТСС, каталог # TIB-71) в DMEM-10 средств массовой информации, который состоит из DMEM с высоким содержанием глюкозы с 10% (V / V) низкого эндотоксина эмбриональной телячьей сыворотки (<10 КОЕ / мл), 10 мМ HEPES , 100 ед / мл пенициллина, 100 мкг / мл стрептомицина, 1 мМ не-незаменимых аминокислот, 2 мМ L-глутамина. Клетки обычно поддерживают в 175 см 2 культуре ткани колбах, содержащих 35 мл среды в колбе и инкубировали при 37 ° C и 5% CO 2 в культуре ткани инкубатора. Тем не менее, любой размер колбы могут быть использованы с объемом средств массовой информации, соответствующий по размеру колбы.
- Чтобы разделить клеток: аспирации от старых средств массовой информации, добавить 10 мл свежей DMEM-10 средств массовой информации в клетки, а затем очистить клетки от дна колбы, с помощью мобильного скребком. Далее, ресуспендирования клеток в гомогенный раствор путем составления клеток в 10 мл пипетки и с силой сжимая клеток через пипетку пр.Essed на дно колбы. Повторите эти действия не менее 3 раз, так что клетки больше не слипаются. Проверьте с помощью световой микроскопии, что суспензии отдельных клеток был создан. Затем перенесите 1 мл (1:10 разбавление или ~ 1х10 7 клеток) - 2 мл (1:5 разбавление или ~ 2х10 7 клеток) клеточной суспензии в новый 175 см 2 колбы, и принести окончательный объем носителей до 35 мл.
- Сплит клетки, когда они почти сливающийся (~ 1x10 8 клеток total/175 см 2 колбы): каждые три дня, если, начиная с разведении 1:10 или раз в два дня, если, начиная с разведения 1:5. Используйте световой микроскопии, чтобы проверить морфологии клеток до разделения клеток. Большинство клеток следует осмотреться и не активирован. Активированные клетки имеют гранул и / или расширенный, тонкие морфологии с придатками. Не позволяйте клетки разрастаются, как те клетки, как правило, не образуют бляшки. Следите за пассаж и часто начать таянием ниже отрывок аликвоты клеток. (Мы используем проход 30, как отсечения).
2. Infect RAW 264.7 Клетки с МНВ посевной
- Семенной RAW 264.7 клеток в 6-луночные планшеты (3,5 см в диаметре) при плотности 1x10 6 жизнеспособных клеток / мл в DMEM-10 средств массовой информации, и добавить 2 мл этой суспензии в каждую лунку. Важно, чтобы распространять клетки равномерно в скважинах либо качания пластин вручную по крайней мере, 10 раз или с помощью аппарата для качания ~ 10 мин. Не вихрем пластин, так как это приведет к клеткам кластера в центре колодца. Место плит в культуре ткани инкубатора (при 37 ° C и 5% CO 2). Разрешить клетки приложить на ночь или по крайней мере 4 часа при 37 ° C. Клетки должны быть 60 - 80% вырожденная для бляшек и равномерно распределяется по всему хорошо.
- На следующий день, подготовка посевного вируса, который может быть от МНВ-инфицированных клеток в культуре ткани или из ткани гомогенизированный или фекальных образцов МНВ-инфицированных мышей. При использовании образцов ткани, размером с горошину пирасширения ECE ткани гомогенизируют в 2 мл завинчивающейся крышкой стерильные пробирки, содержащие диоксид кремния бисера в 1 мл DMEM-10 помощью гомогенизатора тканей (например, MagnaLyser; Roche). Для образцов фекалий, не более 3 фекальные шарики следует перемешать в 1 мл среды. Все образцы затем замораживают (при -80 ° С) и размораживать один раз перед выполнением бляшек.
- Подготовка 10-кратные разведения вируса посевной в полной DMEM-5 средой, которая состоит из DMEM / High глюкозы, 5% (объем / объем) низкого эндотоксина эмбриональной телячьей сыворотки (<10 КОЕ / мл), 10 HEPES мм, 100 Ед / мл пенициллина, 100 мкг / мл стрептомицина, 1 мМ не-незаменимых аминокислот, 2 мМ L-глутамина.
- Десять-кратные серийные разведения готовятся в 24-луночные планшеты: повторитель пипетка используется для дозирования 1,35 мл средства массовой информации в нескольких скважинах, 10 -1 разбавления производится путем смешивания 1,35 мл СМИ и 0,15 мл, содержащих вирус образца, а затем 0,15 мл 10 -1 разведения добавляют 1,35 мл СМИ, чтобы сделать 10 -2 dilutioп и так далее. Важно, чтобы изменить советов каждый раз при новом разбавлении. Многоканальной пипетки может быть использован для разведения несколько образцов одновременно с двумя советами установки в одну лунку в 24-луночный планшет передачи общим объемом 0,15 мл на лунку (рис. 3А).
- Типичный диапазон разбавления для гомогенатах тканей и кала содержание является 10 -1 до 10 -3. Тем не менее, таблички из этих образцов, как правило, меньше по сравнению с теми из образцов ткани культуры. Кроме того, в некоторых случаях 1:100 разведение образцов фекалий необходимо для достаточно разбавленных любые токсичные компоненты кала, которые могут нарушить монослоя клеток, препятствуя тем самым возможность рассчитывать бляшек. Разбавления диапазоне лизатов культуре ткани зависит от времени достопримечательности во время жизненного цикла вируса. Растворы, которые идут до 10 -9 могут быть необходимы на пике инфекции.
- После того, последовательные разведения готовятся, маркировать 6-луночный планшеты содержащие RAW 264.7 монослоев (из раздела 2.1) с именем образца и разведения бытия покрытием. Одна пластина в то время, удалить все средства массовой информации, щелкая его или аспирационной его. Сразу же после этого добавляют 0,5 мл разведенного образца в колодец, а затем повторите с дубликатом хорошо, прежде чем перейти к следующему разведения. Как только все 3 разведения добавляют в одну пластину, наклоном пластины вперед и назад вручную, чтобы убедиться, что все клетки были покрыты. Ручка одной пластины на время, чтобы убедиться, что клетки не будут высыхать.
- После добавления 0,5 мл разведения в каждую лунку, стек пластины вертикально и инкубировать их в течение 1 часа при комнатной температуре. Поскольку объем в каждую лунку добавляют не является достаточным для покрытия монослоя полностью, пластины должны быть слегка наклонена вперед и назад вручную каждые 10-15 мин или разместить на аппарате качалка (~ 18 колебаний в минуту). Это предотвращает клетки от высыхания.
3. Низкой температурой плавления агарозы (легкоплавкий) Overlay подготовка
Примечание: целесообразно иметь несколько бутылок с автоклавного легкоплавкий агарозном подготовлены заранее. Агарозы может быть повторно расплавляют в микроволновой печи перед использованием.
- Рассчитайте количество необходимого для наложения общего объема пластины до 1 часа инкубации завершена. Объем необходимых составляет 2 мл / лунку или 12 ml/6-well пластины. Подготовить агарозный (см. раздел 3.2) и СМИ (см. раздел 3.3) в отдельности.
- Для получения агарозы, приостановить 3 г легкоплавкий агарозы в общем объеме 100 мл дистиллированной воды (3% вес / объем) в стеклянной бутылке. Автоклаве в течение 20-30 мин. (Если агарозном был уже подготовлен, прежде чем руки, переплавить агарозы в микроволновой печи.) Важно, чтобы уравновесить легкоплавкий агарозы до 42 ° С на водяной бане перед использованием, потому что если агарозном слишком жарко, он будет убивать клетки. Убедитесь, что уровень воды равен или выше уровня агарозы, чтобы избежать нежелательной кристаллизации.
- Для приготовления средства массовой информации: сделать 100 мл 2x MEM средств массовой информации, который состоит из2x MEM, 10% (V / V) низкого эндотоксина эмбриональной телячьей сыворотки (<10 КОЕ / мл), 10 мМ HEPES, 100 Ед / мл пенициллина, 100 мкг / мл стрептомицина, 4 мМ L-глутамина. Уравновесьте средствах массовой информации до 37 ° С на водяной бане.
- Смешать оба легкоплавкий агарозы и 2x СМИ MEM вместе в стерильный флакон в соотношении 1:1 непосредственно перед наложением зараженные монослоя клеток. Если более, чем 200 мл наложения необходимо, сплит объемом в несколько бутылок и хранить в 37 ° С водяной бане, пока готов к использованию.
- В конце 1 ч инкубации (см. раздел 2.7), аспирацию посевного от каждой скважины. Постепенно добавить 2 мл наложения на краю каждой лунки путем размещения пипетки к стенке каждой лунке. До 5 пластин могут быть обработаны одновременно без клетки высыхания.
- Разрешить наложение укрепить примерно на 10 мин при комнатной температуре перед размещением пластин вертикально в культуре ткани инкубатора. Инкубируйте пластины в течение 48 ч при 37 ° С в 5% СО 2.
- ПослеИнкубационный период, бляшки слабо видимых невооруженным глазом, так что проверить неокрашенных пластин на наличие бляшек. Если нет бляшки видны, инкубировать в течение 4 дополнительных часа и проверьте еще раз. Однако, максимальное время инкубации не должен превышать 72 часов.
4. Визуализация Бляшки по нейтрального красного окрашивания
- Для визуализации бляшки, нейтральный красный красящий раствор готовится путем добавления 3 мл нейтрального красного (0,33% вес / объем в DPBS, Sigma, каталожный номер N2889) в каждом 97 мл 1x PBS (культуры тканей класса, Mg 2 + -, Ca 2 + - бесплатно; Gibco, каталожный номер 10010). Рассчитайте объем нейтральный красный красящий раствор, необходимых для эксперимента: 12 мл нейтрального раствора красного цвета окраски требуются для каждого 6-луночный планшет. Затем добавьте 2 мл в каждую лунку. Хотя некоторые протоколы бляшек требуется плагин агарозном быть удалены из скважин, в этом протоколе нейтральный красный красящий раствор добавляют непосредственно на перекрытия.
- После одного часа винкубации при температуре 37 ° C, проверьте, если бляшки видны с нейтральным красным окрашиванием решение еще в скважинах. Если бляшки не являются очевидными, позволяют окрашивания продолжить еще на час. Продолжайте инкубацию до бляшки видны. (Примечание:. Окрашивания более чем на 3 часа не является оптимальным, и если нет бляшки видны в положительном контрольном образце после 3 часов окрашивания, бляшек не работает должным образом) После окрашивания завершен, аспирации нейтральный красный красящий раствор , обеспечение вилку агарозном не нарушается, а затем приступить к подсчету бляшек.
- Граф бляшки, помещая пластину вверх дном на светлом окне и маркировки считается точка на бляшках, чтобы избежать дублирования пунктам. Выберите разбавления для подсчета бляшек в скважинах, где бляшки четко разделены (т.е. без визуального доказательства слияния бляшек вместе). Если это возможно, рассчитывать бляшки в двух разведениях. Важно отметить, что налет размер может варьироваться в зависимости от штамма МНВ, вирус посевной, и зависит отСостояние RAW 264.7 клетках во время бляшек.
- Если нет бляшки видны в колодец, либо не было вируса, присутствующего в образце или количество вируса была ниже предела обнаружения бляшек. В этом случае красные пятна скважин с подобным цветом, как другие доски содержащих скважин. Кроме того, отсутствие бляшек наблюдается, когда есть слишком много вирусных частиц, присутствующих в данной разведения. Это приводит к лизису всего монослоя и колодцы появляются оранжевый / желтый цвет.
- Рассчитать вирусные титры. Добавить числа бляшек в обеих скважинах в одном разведении и умножить на коэффициент разбавления (т.е. 1 мл 2 скважины, если инфицированы 0,5 мл). Это даст количество бляшкообразующих единиц (БОЕ) в посевной объемом 1 мл. Например, на рисунке 4 на 10 -2 разведения, одной скважины (с пометкой «II») имеет 14 мемориальные доски и другие хорошо (с пометкой "V") имеет 17 мемориальные доски. Таким образом, титр вируса будет 14x10 2 + 2 = 17x10 3100 (3.1x10 3) БОЕ / мл.
5. Представитель Результаты
Инфекционные МНВ-1 частиц могут быть количественно с помощью бляшек, как указано схематически на рисунке 1. Рисунок 2А показывает, а с монослоем RAW 264.7 клетками непосредственно перед инфекцией, а на рисунке 2B показаны три видимые таблички указывается римскими цифрами I, II и III в скважине. Индивидуальные шаги анализа показаны на рис 3А-3А F. показывает подготовке 10-кратное разбавление серии вирус-содержащих образцов. 3В показана передача разведения дублировать скважины 6-луночный планшет. Рис 3C показывает качалки аппаратов, используемых для инкубации RAW 264.7 клетках с посевной при комнатной температуре в течение 1 ч. Рис 3D показывает клеток, которые накладываются с легкоплавкий. MEMсмеси. рис 3E показывает планшет при комнатной температуре, чтобы наложение укрепить, а на рис 3F показывает клеток, которые окрашивали 0,01% раствор нейтрального красного 48 час позже. После окрашивания клеток в течение 1-3 ч и аспирационных нейтральный красный красящий раствор, бляшки видны и могут быть подсчитаны (рис. 4).
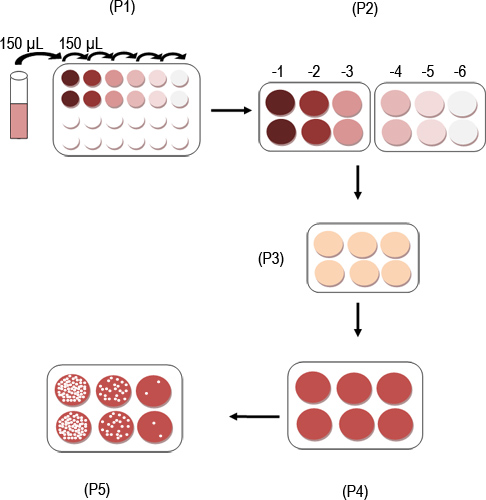
Рисунок 1. Схема анализа протоколов доска МНВ.
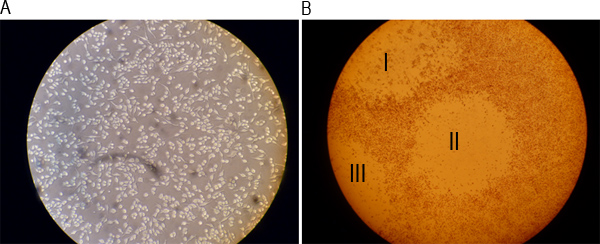
Рисунок 2. Представитель изображения и монослоя до заражения и после образования бляшек. A) RAW 264.7 клетки культивировали в течение ночи и отображаемого под световым микроскопом при увеличении 20x. B) Клетки окрашивали 0,01% раствор нейтрального красного после 48 чГ инфекции и визуализировать под световым микроскопом при увеличении 4x. Римские цифры I, II, III и указать три видимых бляшек.
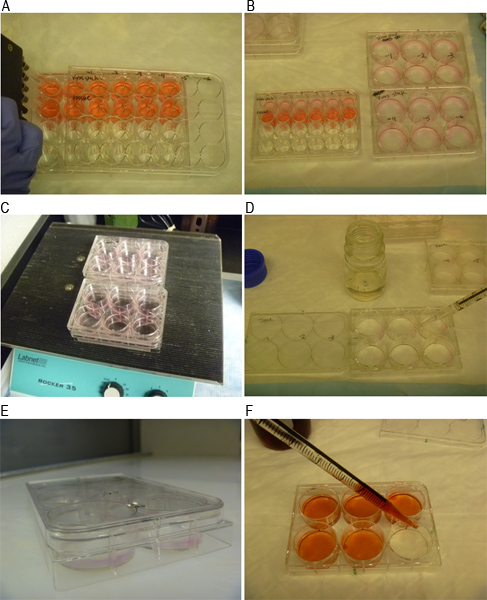
Рисунок 3. Представитель изображений различных этапов анализа налета. A) MNV-1 посевной готовят в 10-кратном разведении. B) Посевной добавляется в ячейку монослоев в двух экземплярах скважин. C) элементы и посевной насиживают качалки в течение 1 часа при комнатной температуре. D) Клетки обложил смеси 1:1 легкоплавкий агарозы и 2x MEM СМИ. E) Планшеты инкубировали в течение 10 мин при комнатной температуре, чтобы наложение чтобы затвердеть. F) окрашивания клеток с нейтральным красным красящий раствор 48 часов после инфицирования.
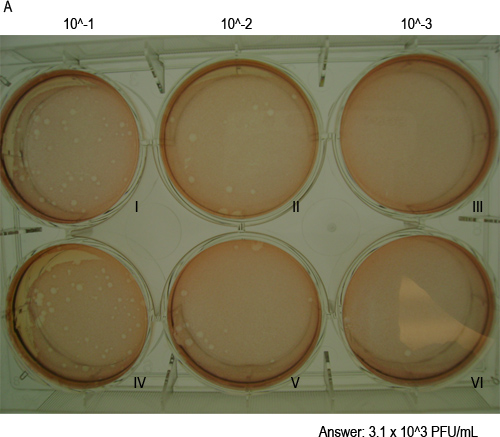
Рисунок 4. МНВ-1 формы бляшек в клетке monolAyers. Показаны здесь является представителем пластины теста налет 48 часов после заражения, показывая бляшек окрашивали нейтральный красный красящий раствор после 1 часа инкубации. Пластине показывает дубликат скважин из трех 10-кратные разведения. Wells помечены римскими цифрами I и IV соответствуют 10-1 разведения, II и V соответствуют 10-2 разведения, III и VI соответствуют 10-3 разведения. Титр вируса образца указано ниже (см. раздел 4.5 для получения информации о расчете).
Обсуждение
Метод бляшек для МНВ-1, представленная здесь, способ количественной инфекционных частиц МНВ. Следуя анализ шаги показано на рисунке 3, можно получить воспроизводимые вирусные титры. Предел обнаружения анализа зависит от исходного разведения используются. Когда, начиная с 1:10 разведение образца, как описано выше, предел обнаружения бляшек составляет 10 БОЕ (например, 1 налет виден в разведении 10 -1). Так как каждая доска представляет собой один вирус, бляшек также может быть использован для очистки клональной популяции МНВ, выбирая изолированные бляшки и распространения их, как описано ранее 1. Кроме того, налет очищений также может быть использован для разделения отдельных популяции вируса от смешанных популяций вируса. Ограничение использования доски тест для обнаружения инфекции МНВ, что не все МНВ штаммы образуют бляшки 4. Тем не менее, это может быть возможным, чтобы преодолеть inabiliти некоторых штаммов МНВ, выделенных из животных, с образованием бляшек на серийно пассажи этих вирусов в культуре ткани 7. Альтернативой бляшек является измерение инфекционных частиц через TCID 50 Техника 3, 4. Этот анализ количественно количество вируса, необходимых для производства CPE у 50% привитых культуре ткани клеток после конечной точки разведения и занимает 1 неделю, чтобы закончить на Многовершинном 4. В дополнение к тому медленнее, чем бляшек, TCID 50 Анализ также не столь чувствительны (предел обнаружения = 200 TCID 50 / мл) в связи с токсичностью образцы тканей для RAW 264.7 клетках 4.
Несмотря на критические шаги в протоколе были описаны всей протокол, в следующем разделе приводится краткая информация для облегчения поиска и устранения неисправностей. Наиболее важным шагом в протокол, чтобы RAW 264.7 клетки остаются жизнеспособными во всем анализе поддерживать репликацию вируса. Это можетконтролировать на каждом этапе анализа с помощью световой микроскопии. Жизнеспособность клеток обеспечивается двумя способами. Прежде всего, следует позаботиться, чтобы не позволить клетки высыхают при работе с плитами. Таким образом, плиты засевают по одной за раз, качали при заражении период, и должны оставаться закрытыми, когда они не решаются. Во-вторых, решение добавить на клетки должны быть доведены до ~ 37 ° C. Кроме того, это жизненно важно для общего состояния здоровья RAW 264.7 клетками для поддержания их в средах, содержащих низкое эндотоксина сыворотки (<10 КОЕ / мл), что ограничивает активацию клеток. Кроме того, мы наблюдали более высокий процент неудач бляшек при использовании клеток от прохождения 30 или выше. Хотя это, скорее всего, зависят от лаборатории до лаборатории, важно, чтобы включить положительный контроль (например, образца с известным титр вируса) для обеспечения воспроизводимых титры, особенно при использовании выше отрывок RAW 264.7 клетках. Чтобы ограничить использование клетках высших проход, желательно, чтобы заморозить флаконов рано пассаGE клеток после получения RAW 264.7 клетках и создать новую культуру из замороженных флаконов часто. Начиная с более низкими культурами клеток прохождение также будет полезным, когда клетки обладают изменены характеристики, такие как несоблюдение, изменения в морфологии клеток (например, от круглой до тонких и выкладывается), или когда микоплазмы загрязнения не обнаружено. Еще один важный момент обратить внимание на это, чтобы наконечники меняются между образцами и во время разведения. Это позволит обеспечить точное серийные разведения и предотвращения перекрестного загрязнения между образцами. Один шаг в протоколе, где же кончика пипетки можно использовать снова, когда серийных разведений того же образца добавляют в лунки. В этом случае следует исходить из самых разбавленных посевной к мере, и энергично пипетки вверх и вниз при составлении нового разведения.
Протокол бляшек является исправимый в нескольких модификациях. Одна из модификаций, которые могут быть сделаны, когда тЗдесь не хватает клеток для посева скважин в двух экземплярах, чтобы привить только одной скважины для каждого разведения. Однако, начиная с посевной объем 0,5 мл, количество бляшек, то должно быть умножено на коэффициент от 2 до нормализовать БОЕ / мл. Бляшек также может быть адаптирована для использования с любым другим сторонником клеточной линии, которая может поддерживать репликацию МНВ, и это было описано для мышиных микроглии BV-2 клеточной линии 8. Другие изменения, которые могут быть реализованы являются адаптациями, которые были описаны для бляшек протоколы, разработанные для других вирусов. В случае МНВ, следующие изменения уже были успешно реализованы, использования метилцеллюлозы вместо моря налет агарозном 9 и окрашивания клеток с кристаллом фиолетового или метиленового синего, а не нейтральный красный 10, 11.
В целом, этот протокол может быть легко адаптирована как необходимая для определения других бляшкообразующих вирусы или используются для др.э вирусов, которые вызывают литические инфекции в RAW 264.7 клетках, что делает его полезным инструментом для количественного инфекционных вирусных частиц в целом.
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Мы благодарим членов Wobus лаборатории для критических замечаний и предложений. Работа в лаборатории CEW было профинансировано запуска средства из Мичиганского университета, гранты развитие карьеры от NIH / NIAID регионального центра передового опыта в области био-защиты и новым инфекционным болезням исследований (RCE) Программа, Область V «Великий Озера "RCE (NIH награду 1-U54-AI-057153) и NIH R01 AI080611. MBG-H. было профинансировано экспериментальной иммунологии (NIH T32 A1007413-16) и молекулярных механизмов в патогенезе микробной (NIH T32 A1007528) обучение грантов в Университете штата Мичиган. JBC была профинансирована Coordenação де Aperfeiçoamento-де-де Pessoal Nivel Superior (CAPES), Бразилиа, Бразилия.
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента | Компания | Номер в каталоге | |
| DMEM / High глюкозы | Hyclone | SH30243.02 | |
| 2x MEM | Gibco | 11935 | |
| 100x пенициллина и стрептомицина | Hyclone | SV30010 | |
| 10 мМ Номера для незаменимых аминокислот | Hyclone | SH30238.01 | |
| 1M HEPES | Hyclone | SH30237.01 | |
| 200 мм (100x) L-глютамин | Hyclone | SH30034.01 | |
| Плод бычьего сывороточного | Gibco, Hyclone | 10437, SH30070.02 | |
| Море налет Агароза | Lonza | 50100 | |
| Нейтральный красный 0,33% | Сигма | N2889 | |
| 1x PBS | Gibco | 10010 | |
| 1,0 мм циркония / Silica бисера | BioSpec продукты | 11079110z | |
| Модель 35 Скорость Rocker | Labnet | S2035 | |
| Magna инструмента Lyser | Roche | 03358968001 | |
| Сырье 264,7 клеточной линии | ATCC | TIB-71 | |
| Культура ткани инкубатора | Sanyo | MCO-18AIC |
Ссылки
- Wobus, C. E. Replication of Norovirus in cell culture reveals a tropism for dendritic cells and macrophages. PLoS Biol. 2, e432 (2004).
- Wobus, C. E., Thackray, L. B., Virgin, H. W. Murine norovirus: a model system to study norovirus biology and pathogenesis. Journal of virology. 80, 5104-5112 (2006).
- Condit, R. C., Knipe, D. M., Howley, P. M. Ch. 2. Fields Virology. 1, 25-58 (2007).
- Thackray, L. B. Murine noroviruses comprising a single genogroup exhibit biological diversity despite limited sequence divergence. Journal of virology. 81, 10460-10473 (2007).
- Reed, L. J., Muench, H. A simple method for estimating 50% endpoints. American Journal of Hygiene. 27, 493-497 (1932).
- Chachu, K. A. Antibody is critical for the clearance of murine norovirus infection. Journal of virology. 82, 6610-6617 (2008).
- Barron, E. L. Diversity of murine norovirus strains isolated from asymptomatic mice of different genetic backgrounds within a single U.S. research institute. PLoS ONE. 6, e21435 (2011).
- Cox, C., Cao, S., Lu, Y. Enhanced detection and study of murine norovirus-1 using a more efficient microglial cell line. Virology journal. 6, 196 (2009).
- Cooper, P. D. The plaque assay of animal viruses. Adv. Virus Res. 8, 319-378 (1961).
- Hyde, J. L. Mouse norovirus replication is associated with virus-induced vesicle clusters originating from membranes derived from the secretory pathway. Journal of virology. 83, 9709-9719 (2009).
- Simmonds, P. Bioinformatic and functional analysis of RNA secondary structure elements among different genera of human and animal caliciviruses. Nucleic acids research. 36, 2530-2546 (2008).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены