Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Bioluminescent Бактериальные изображений
В этой статье
Резюме
В этой статье описывается управление Люкс-отмеченных Бактериями мышей и последующее В естественных условиях Анализ с использованием ИВИС биолюминесценции изображений.
Аннотация
Это видео описывает использование всего тела bioluminesce томография (BLI) для изучения бактериальных торговле живыми мышами, с акцентом на использовании бактерий в генной и клеточной терапии рака. Бактерии, присутствующие привлекательной класс вектор для лечения рака, обладающие природной способностью расти преимущественно в опухоли после системного введения. Бактерии инженерии, чтобы выразить кассеты люкс гена разрешения BLI обнаружения бактерий и одновременно опухоли сайтов. Расположение и уровень бактерий в опухоли с течением времени могут быть легко рассмотрены, визуализировали в двух или трех измерениях. Метод применим для широкого спектра бактериальных видов и типов опухолей ксенотрансплантата. В данной статье описывается протокол для анализа биолюминесцентного бактерий в подкожной опухоли мышей подшипника. Визуализация синантропных бактерий в желудочно-кишечном тракте (ЖКТ) от BLI также описан. Это мощный и дешевый, изображений в реальном времени стратегия предTS идеальный метод для изучения бактерий в естественных условиях в контексте исследования рака, в частности генной терапии и инфекционных заболеваний. Это видео описывает процедуру для изучения люкс с метками E. палочки в живых мышей, что свидетельствует о пространственной и временной отсчет достижимо использованием BLI с системой ИВИС.
протокол
1. Опухоль индукционные
- Для обычных индукции опухоли, минимальная доза онкогенных клеток суспендируют в 200 мкл бессывороточной культуральной среде вводили подкожно (п) во фланг инфекцию бесплатный 6-8 недельных самок BALB / C или бестимусным MF1-nu/nu мышей п = 6 (Harlan, Оксфордшир, Великобритания) (1 х 10 6 клеток 4T1) с использованием 21-калибровочного иглы шприца. Жизнеспособность клеток, используемых для посева было больше, чем на 95%, как это определено количество визуальных использованием гемоцитометра и Трипановый Синяя краска исключения (Gibco).
- После создания опухоли, опухоли было позволено расти и развиваться и наблюдали дважды в неделю. Объем опухоли вычисляли по формуле V = (AB 2) Π / 6, где находится самый большой диаметр опухоли и B является самой длинной диаметра, перпендикулярного диаметра.
2. Бактериального препарата
- Бактериальный штамм, используемый в этом protocoЯ был E. соН К-12 MG1655, небелковой-токсин, экспрессирующих штамм, укрывательство luxABCDE кодирования плазмиды, которая позволяет бактериям быть обнаружены BLI. E. палочки MG1655 содержащие интегрированный luxABCDE был выращен в аэробных условиях при 37 ° С в среде LB (Sigma-Aldrich, Ирландия) с добавлением 300 мкг / мл эритромицина (Em). Биолюминесцентного производной MG1655 был создан с помощью плазмиды p16S люкс, который содержит учредительные HELP P luxABCDE оперона 1.
- Для подготовки введения мышам, культуры инкубировали в среде LB при 37 ° C в шейкере со скоростью 200 оборотов в минуту до середины логарифмической фазы (оптической плотности при 600 нм). Бактерии собирают центрифугированием (6000 х г в течение 5 мин), промывают PBS (Sigma), и разводят в PBS 1 × 10 7 колониеобразующих единиц (КОЕ) / мл для внутривенного введения, или 1 х 10 10 для принудительного кормления.
3. Бактериальные администрацииния
- Мыши были произвольно разделены на экспериментальные группы, когда опухоль достигает примерно 100 мм 3 объема. Для внутривенного введения, сдержанный мышей каждый получил 10 6 клеток в 100 мкл, вводится непосредственно в латеральную хвостовую вену помощью 28G иглу шприца. Количество жизнеспособных каждой посевной определяется ретроспективным покрытием.
- Для исследования желудочно-кишечного тракта колонизации, 10 9 бактериальных клеток вводили перорально в 100 мкл на мышь через желудочный зонд, три дня подряд. Ранее существовавшие комменсальной бактериальной уровни снизились до подачи добавлением 5 мг / мл стрептомицина в мышь питьевой воды в течение 7 дней до начала желудочный зонд 1.
4. Биолюминесценции изображений
- 2D в естественных условиях BLI изображений проводили с использованием IVIS100 (суппорт). В определенных временных точках сообщение бактериальной администрации, мышей анестезировали использованием XGI-8 суппорт газа анестезииСистема с 3% Isofluorane, и все тело изображение анализ был проведен в ИВИС 100 система в течение 2-5 мин при высокой чувствительности.
- Для визуализации 3D, анестезированных мышей были помещены в трансфера мыши изображений внутри оптической системы визуализации для спины томография (ИВИС Spectrum, суппорт). Для получения изображения бактериальной люциферазы сигнала для 3D-оптических реконструкции, фильтр твердых диапазоне длин волн 500-580 нм были использованы с бен приобретение 16 раз по 3-4 мин на фильтр, чтобы максимизировать отношение сигнал-шум. В рамках этой последовательности захвата изображений, структурированные изображения света было получено для определения высоты карте. Эта карта была введена рассеянный свет томографии (DLIT) реконструкций алгоритмов, которые были использованы для формирования 3D-изображения с помощью оптического неотрицательных наименьших квадратов оптимизации 2.
- Анализ изображений: Регионы интересов были определены и количественно, используя программное обеспечение Живые изображения (суппорт).
5. ПредставительРезультаты
В этом исследовании, непатогенные синантропных бактерий E.coli K-12 MG1655 выражения luxABCDE оперона была IV вводили мышам подкожно опухолями 4T1 ксенотрансплантата. Бактериальные люкс сигнал был обнаружен в частности, в опухоли мышей сообщению IV-администрирования (рис. 2). Культура восстановления бактерий из образцов мышей подтверждает существование линейной зависимости между жизнеспособных бактерий номера и количество света обнаружено (рис. 3). В естественных изображений перорального синантропных бактерий в ЖКТ достигается также с помощью 3D BLI.
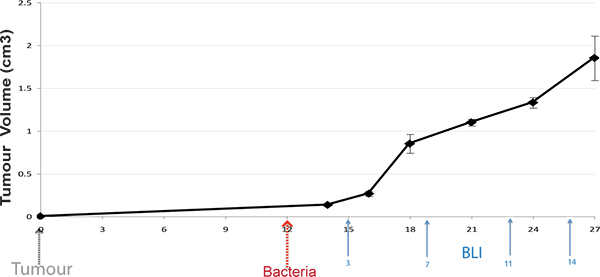
Рисунок 1. Протокол Timeline. Подкожные опухоли индуцированные у мышей и бактерий вводили при развитии опухоли (100 мм 3). Онлайн мышей BLI имв возрасте в различных временных точках сообщение бактериальной администрации (стрелки отображения типичных раза).

Рисунок 2. Администрация E. палочки MG1655 luxABCDE опухоли мышей подшипника. Подкожный 4T1 опухоли индуцированные в MF1 Nu / Nu мышей и E. палочки MG1655 luxABCDE вводить на развитие опухоли. Каждое животное получало 10 6 клеток вводится непосредственно в боковую хвостовую вену. Мыши были обследованы в четырех временных точках в ходе исследования (черные точки оси и изображения) с последующей восстановление жизнеспособных бактерий (КОЕ) из опухолей образца жертву мышей (гистограмма). Увеличение числа и бактериальные плазмиды экспрессии генов, в частности, в опухолях наблюдалась в течение долгого времени (представительных мышей показано на момент времени). Нажмите, чтобы увеличить показатель .
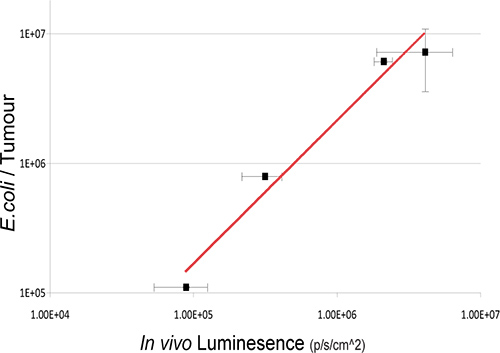
Рисунок 3. Отношения между внутриопухолевые бактериального числа и биолюминесценции. Жизнеспособных бактерий в опухоли были перечислены экс естественных условиях бактериальные культуры от опухоли после BLI в различные моменты времени пост IV администрации. Вход значения бактериального числа (КОЕ) по отношению к bioluminesce в естественных единицах на графике. Надежная корреляция между бактерий и бактериальных сигналы биолюминесценции наблюдаются R 2 = 0,9717 1.
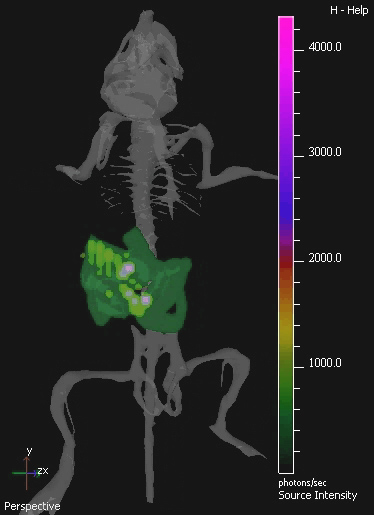
Рисунок 4. 3D ИВИС изображения мышиного желудочно-кишечного тракта колонизирована E. палочки MG1655. GIT мышей была колонизирована перорального введения 10 9 КОЕ E. палочки в течение трех дней подряд. Пример изолированного изображения с 3D-томографии колонизировали мышь показано на рисунке.3D-изображения показывают цифровой атлас мыши скелета обеспечить анатомическую регистрации. E. палочки MG1655 биолюминесценции видна в зеленый при более низких, и фиолетовый на более высоких уровнях.
Обсуждение
В контексте генной терапии, использование биологических агентов для доставки терапевтических генов для пациентов показало большие надежды 3-5. Подобно вирусам, врожденные биологические свойства бактерий условия для эффективной доставки ДНК в клетки или ткани, особенно в контек?...
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Авторы хотели бы отметить поддержку, относящиеся к этой рукописи от Европейской комиссии Седьмой Рамочной Программы (PIOF-GA-2009-255466) и Ирландский совет по исследованиям в области здравоохранения (HRA_POR/2010/138). Lux-отмеченных E. палочка была своего рода подарок от доктора Кормак Гаан, University College Cork.
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента | Компания | Номер в каталоге | Комментарии |
| 4T1 клеточной линии | ATCC | CRL-2539 | Сингенных модели рака молочной железы, полученных от спонтанно возникающих BALB / C опухоли молочной железы |
| DMEM | Sigma-Aldrich | D6429 | Дульбекко изменения Орла Средний |
| PBS | Sigma-Aldrich | D8537 | Фосфатным буферным раствором |
| Xenogen ИВИС | Суппорт Life Sciences | ИВИС 100 для 2D изображений; ИВИС Spectrum для 3D. | |
| Лурия бульон Миллер (LB) | Sigma-Aldrich | L2542 | Рост средой для E. палочки |
| Эритромицин | Sigma-Aldrich | E5389 | Антибиотик |
| Стрептомицин | Sigma-Aldrich | S9137 | Антибиотик |
| MF1nu/nu мышей | Харлан (UK) | 069 (ню) / 070 (Nu / +) | Hsd: Бестимусным Nude-Foxn1nu |
| BALB / C мышей | Харлан (UK) | 066 | Гаплотипа: H-2 D |
| Желудочный зонд иглы | Vet-Tech Solutions (UK) | DE009 | 22G х 38 мм прямой зонд иглы |
| Шприц для инъекции IV | BD Biosciences | 309309 - 1 мл | Инсулиновый шприц с 28 х G ½ дюйма микро-тонкой иглой IV. |
| Шприц для инокуляции опухоли | Braun | 9161376V | Omnifix 26 G х иfrac12; дюймовые иглы |
Ссылки
- Cronin, M., et al. High resolution in vivo bioluminescent imaging for the study of bacterial tumour targeting. PLoS One. 7, e30940 (2012).
- Kuo, C., Coquoz, O., Troy, T. L., Xu, H., Rice, B. W. Three-dimensional reconstruction of in vivo bioluminescent sources based on multispectral imaging. J. Biomed. Opt. 12, 024007 (2007).
- Tangney, M., Ahmad, S., Collins, S. A., O'Sullivan, G. C. Gene therapy for prostate cancer. Postgrad Med. 122, 166-180 (2010).
- Morrissey, D., O'Sullivan, G. C., Tangney, M. Tumour targeting with systemically administered bacteria. Curr. Gene Ther. 10, 3-14 (2010).
- Collins, S. A., et al. Viral vectors in cancer immunotherapy: which vector for which strategy. Curr. Gene Ther. 8, 66-78 (2008).
- Yu, Y. A., Zhang, Q., Szalay, A. A. Establishment and characterization of conditions required for tumor colonization by intravenously delivered bacteria. Biotechnol. Bioeng. 100, 567-578 (2008).
- Baban, C. K., Cronin, M., O'Hanlon, D., O'Sullivan, G. C., Tangney, M. Bacteria as vectors for gene therapy of cancer. Bioeng. Bugs. 1, 385-394 (2010).
- Cronin, M., et al. Orally administered bifidobacteria as vehicles for delivery of agents to systemic tumors. Mol. Ther. 18, 1397-1407 (2010).
- van Pijkeren, J. P., et al. A novel Listeria monocytogenes-based DNA delivery system for cancer gene therapy. Hum. Gene Ther. 21, 405-416 (2010).
- Ahmad, S., et al. Induction of effective antitumor response after mucosal bacterial vector mediated DNA vaccination with endogenous prostate cancer specific antigen. J. Urol. 186, 687-693 (2011).
- Riedel, C. U., et al. Improved luciferase tagging system for Listeria monocytogenes allows real-time monitoring in vivo and in vitro. Appl Environ Microbiol. 73, 3091-3094 (2007).
- Cheng, C. M., et al. Tumor-targeting prodrug-activating bacteria for cancer therapy. Cancer Gene Ther. 15, 393-401 (2008).
- Foucault, M. L., Thomas, L., Goussard, S., Branchini, B. R., Grillot-Courvalin, C. In vivo bioluminescence imaging for the study of intestinal colonization by Escherichia coli in mice. Appl. Environ. Microbiol. 76, 264-274 (2010).
- Collins, S. A., Hiraoka, K., Inagaki, A., Kasahara, N., Tangney, M. PET Imaging For Gene & Cell Therapy. Curr. Gene Ther. , (2012).
- Tangney, M., Francis, K. P. In vivo Optical Imaging in Gene & Cell Therapy. Curr. Gene Ther. , (2012).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены