Method Article
Neo-Иле формирования в печени мышей с диабетом по Helper-зависимых Аденовирусные Vector-опосредованного переноса генов
В этой статье
Резюме
Мы описываем печеночной нео-островок образование в СТЗ (стрептозотоцина)-индуцированных диабетических мышей ген передачи Neurogenin3 (Ngn3) и Betacellulin (БТД) с использованием вспомогательных зависит от аденовирусной вектора (HDAd) и разворот гипергликемии. Наш метод имеет преимущества помощник зависит от аденовирусных векторов с их высокой эффективностью в естественных условиях трансдукции и длительный экспрессии генов.
Аннотация
Сахарный диабет 1 типа вызвана Т-клетками аутоиммунной деструкции инсулин-продуцирующих клеток в поджелудочной железе. До сих пор инсулин замена прежнему является основной терапии, потому трансплантации островков была ограничена доноров наличия и необходимости долгосрочного иммунитета. Индуцированные островок регенерации генной передачи Neuogenin3 (Ngn3), островок линии определяющих специфический фактор транскрипции и Betacellulin (БТД), островок фактор роста имеет потенциал для лечения диабета типа 1.
Аденовирусные вектора (объявления) являются высокоэффективными вектор переноса генов, однако, рано объявления поколения имеют ряд недостатков в естественных использование. Помощник-зависимых объявления (HDAds) являются самыми передовыми объявления, которые были разработаны для улучшения профиля безопасности раннее поколение объявлений и продлить экспрессии трансгенов 1. Они не имеют хроническую токсичность, потому что им не хватает вирусных последовательностей, кодирующих 2-5 и оставить только объявления цис-эль-ВЫРАЖЕНИЕ необходимые для репликации вектора и упаковки. Это позволяет клонирования до 36 кб генов.
В этом протоколе, мы опишем метод для создания HDAd-Ngn3 и HDAd-Btc и доставить эти векторы в СТЗ-индуцированной диабетической мышей. Наши результаты показывают, что совместное введение HDAd-Ngn3 и HDAd-Btc индуцирует «нео островки» в печени и меняет гипергликемии у больных сахарным диабетом мышей.
протокол
1. Клонирование терапевтических генов в HDAd векторного Трансфер
- Клонов мыши Ngn3 и Btc кДНК в pLPBL1 плазмиды вектор, который содержит повсеместно фактор элонгации-1 промотор (BOS) и поли сигнала. После завершения проверки векторов на анализе последовательности, а затем субклона эти кассеты экспрессии в pΔ28 HDAd трансфер плазмиды 6.
- Дайджест HDAd трансфер векторов PmeI, чтобы освободить плазмиды позвоночник, очистить ДНК фенол / хлороформ / изоамиловый спирт добычи с последующим осаждением этанолом и восстановить с трансфекции класса воде.
2. Помощник-зависимых Аденовирусные производства векторного
HDAd вектор производство включает в себя несколько шагов, которые необходимо тщательно соблюдать для достижения оптимального результата.
2,1 Трансфекция
- За два дня до трансфекции, семена 116 клеток 7 в 6-см блюдо, чтобы достигать 70-80% сливающийся в день трансфекции.
- За три часа до трансфекции, удалить средних и добавляют 5 мл свежей питательной среде [MEM с добавлением 10% FBS и 1% ПСЖ (пенициллин, стрептомицин и глутамин), Invitrogen].
- Трансфекции 116 клеток с 10 мкг ДНК из Шаг 1,2), используя ProFectionR млекопитающих комплект Трансфекция от Promega в соответствии с инструкцией завода-изготовителя.
- На следующий день, мыть клетки с 1 мл ростовой среды, в 2 раза. Добавить вируса-помощника (HV) в 500 векторных частиц (VP) / ячейки 0,1 мл PBS, содержащие кальций и магний (PBS + +) и наложения к клеткам. Осторожно покачайте блюда, чтобы равномерно распределить HV каждые 10 мин.
- Через 60 мин добавляют 1,5 мл обслуживание среде (MEM, 5% FBS, 1% PSG).
- Добавить еще 1 мл поддерживающую среду на следующий день.
- Соблюдайте клеток для CPE (цитопатического эффекта - клетки становятся округлыми и отделен). Больше чем 80% клеток должны показать CPE 2 дня после заражения.
- Сбор сырья лизат клеток (CVL, клеток и среды),дд 10% объема 40% сахарозы и хранят при температуре -80 ° C. CVL обозначена как переход 0 - (CVL-P0).
2,2 векторного усиление
- Замораживание (-80 ° C, 3-5 мин) / оттаивания (37 ° C, 1-2 мин) 3 раза.
- Наложение 0,5 мл CVL дополнить HV на 200 VP / ячейку вырожденная 116 клеток в 6-см блюдо, и рок блюдо аккуратно каждые 5 мин. Через 30 мин добавляют 1 мл обслуживание среде.
- Добавить 1 мл поддерживающую среду на следующий день. 2 дня спустя, большинство клеток должны показать CPE.
- Сбор CVL и хранят при -80 ° C (ЛПМ-P1), как описано в шаге 2.1.8).
- Повторите процедуру 3 раза, чтобы получить CVL P2-P4.
- Извлечение ДНК (DNeasy крови и тканей Kit, Qiagen) с 0,2 мл CVL, собранные на P1-P4 и анализировать вектор усиления по КПЦР использованием HV-и HDAd-специфических праймеров (табл. 1). Используйте отрывок, в котором HDAd усиливается в геометрической прогрессии по отношению к HV (P3 на рисунке 2) для subsequenт процедуру.
- Сотрудничество заразить 90% вырожденная 116 клеток в 15 см блюдо с 0,5 мл CVL и HV на 200 VP / ячейку. Рок блюдо аккуратно каждые 5 мин. Через 30 мин добавляют 10 мл обслуживание среде.
- Добавить 5 мл обслуживание среду после 24 часов.
- Сбор клеток путем центрифугирования при 1500 мкг в течение 5 мин ровно 48 часов после заражения.
- Повторное приостановить клеток в 1 мл PBS + +, содержащий 4% сахарозы (P5) и заморозить при температуре -80 ° C.
2,3 Большие масштабы производства HDAd
- Для подготовки 116 клеток на инфекцию в виде суспензии культуры клеток, передавать вырожденная 116 клеток в 8 х 15-см блюдо в 3 л счетчика колбу и добавляют среднего роста подвески (Joklik изменения MEM с добавлением 5% FBS, 0,1 мг / мл гигромицину и 1% PSG) для окончательной 1 л, и инкубировать в CO 2 инкубаторе со спиннингом на 60 оборотов в минуту 8.
- Добавить 0,5 л свежей среды, каждый день в течение 2 дней (всего 2 л).
- Граф клеток на третий день. Клетки готовы к использованию, если достижении тO общего числа клеток 1х10 9.
- Замораживания / оттаивания P5 3 раза.
- Сбор клеток из 3 L счетчик колбу центрифугированием при 1000 х г в течение 5 мин. Сохранить 100 мл супернатанта повторно приостанавливать клеток.
- Передача клеток к 250-мл колбу счетчика. Добавить P5 и HV на 200 VP / ячейку клетки и инкубировать в течение 1 часа при 37 ° C при 60 оборотах в минуту.
- Передача клетки и средних до 3 л счетчика колбу, добавить 2 л Подвеска питательной среды. Передача 1 мл клеточной суспензии и в 12-луночный планшет для наблюдения за клетками для CPE.
- Инкубировать клетки в счетчик колбу в течение 2 дней в CO 2 инкубаторе при 60 оборотах в минуту.
- Сбор клеток путем центрифугирования и вновь приостановить с 15 мл 100 мМ Трис-HCl (рН 8,0) и хранят при температуре -80 ° C (P6) до очистки.
2,4 векторного очистки
- Добавьте 1,0 мл 5% раствора натрия дезоксихолата на P6. Осторожно перемешать и выдержать в течение 30 мин при комнатной температуре.
- Добавить 400 мкл 2 М MgCl 2, 300 μл РНКазы (10 мг / мл) и 300 мкл ДНКазы I (10 мг / мл) и инкубируют при 37 ° С в течение 1 часа.
- Центрифуга при 6000 х г в течение 10 мин при комнатной температуре, чтобы собрать супернатант.
- Стерилизовать NVT 65 ультрацентрифуге труб (Beckman) под воздействием ультрафиолетового излучения в течение 1 часа в тканях капот культуры.
- Добавить 2,8 мл низкой плотности CsCl решение (1,25 г / мл), прокладка 2,8 мл высокой плотности CsCl плотности раствора (1.41g/ml), а затем наложение 5-6 мл супернатанта, чтобы заполнить трубу на шею. Используйте 100 мМ Трис-HCl (рН 8,0), чтобы заполнить трубу в случае необходимости.
- Центрифуга при 10 ° С в течение 30 мин при 50000 оборотов в минуту при 10 ° C с Beckman LE-80K использованием NVT-65 ротора.
- Протрите область с 70% этанола для прокола иглой, и собирать нижнюю опалесцирующий группы с 3-мл шприц оснащен 22-G иглу сторону прокола (рис. 3а). Иногда очень слабый помощник группу можно увидеть ниже более заметным вектором группы. Постарайтесь получить как можно больше говектор е группой насколько это возможно, без помощников группы. Это приемлемо на данном этапе даже если некоторые из помощников группы всасывается, как будут разделены на последующие ночи центрифугирования, следующим образом.
- Поместите собранный полос в новом стерилизованные труб ультрацентрифуге. Заполните трубы на шее, накладывая 1,35 г / мл CsCl плотности раствора.
- Центрифуга при 10 ° C при 50000 оборотов в минуту в течение ночи. Сбор опалесцирующий полосы (рис. 3б).
- Трансфер группы в диализе кассеты (Слайд-а-анализатора, 10.000 MWCO, термо-научному).
- Диализ против 3 л автоклавного 10 мМ Тис-HCl, рН 7,2, содержащего 2 мМ MgCl 2 и 4% сахарозы при 4 ° С в течение ночи.
- Снимите HDAd вектор от диализа кассеты. Алиготе 20 мкл для физических титра и 50 мкл ДНК-характеристику. (Примечание: Для Ngn3 вектор, повторить "P6" три раза, чтобы получить достаточное вектор с выходом HDAd-Ngn3 плохой по сравнению с HDAd-Btc или HDAd пустым.)
2,5 Характеристика HDAd векторы
- Определить физические титр (VP / мл) с использованием оптической плотности (ОП). Добавить 20 мкл вектора или 20 мкл буфера для диализа до 380 мкл буфера ТЕ, содержащего 0,1% SDS и инкубировать при 56 ° С в течение 20 мин. Измерьте оптическую плотность при 260 нм. Физические титр = OD260 х 1,1 х 10 12 х 20 (VP / мл).
- Анализ HV загрязнения КПЦР. Используйте 50 мкл аликвоты для извлечения ДНК с использованием DNeasy ткань / кровь экстракции ДНК (Qiagen). Развести ДНК 1000-кратного и принять 5 мкл для анализа КПЦР использованием помощника и вектор-специфических праймеров (табл. 1). Помощник загрязнения должно быть не менее 1%, как показано на рисунке 4а.
- Используйте Саузерн-блот анализ векторной структуры. Выполните Саузерн-блот анализа 10 с помощью зонда для перевернутого концевой повтор (ITR). Представитель результат показан на рисунке 4В.
- Определить в пробирке эффективности. Infect известныЧисло 116 клеток в 12-луночный планшет с HDAd вектора в 1000 VP / ячейки в четырех экземплярах. Урожай клеток после 48 часов и извлечь РНК, чтобы определить выражение Ngn3 и Btc мРНК путем QRT-PCR (табл. 1). Представитель результаты показаны на рисунке 5.
3. Лечение мышей с диабетом по HDAd Ngn3-и-Btc
3,1 Индукция диабета у мышей и введение HDAd векторы
- Подготовка STZ: Подготовка 0,1 М цитрат буфер, и отрегулировать рН до 4,3-4,5. Фильтр этом через 0,22 мм шприц фильтр. Использование стерильной водой разбавлять это 0,01 М цитрата натрия рН 4,2-4,5. Растворите необходимое количество СТЗ (Sigma) в этом растворе для достижения конечной концентрации 12,5 мг / мл. При такой концентрации нет осадков. Имейте это решение СТЗ при 4 ° С до использован. Доведите температуру инъекционного раствора до комнатной температуры непосредственно перед инъекцией. Shoul СТЗ решениемD быть готовым свежим каждый день и вводят в течение 5-10 мин в стадии ликвидации.
- Inject это решение STZ внутрибрюшинно (10 мкл / г до достижения дозы 125 мкг / г веса тела), вечером между 5-7 вечера (до того, как огни были выключены в мыши объект и начать кормить мышей активно), два дня подряд 9.
3.2 Мониторинг мышей глюкозу и инъекции HDAd векторов.
- Быстрый мышей в течение 6 часов и мера веса тела и глюкозы в крови еженедельно, пока у мышей гипергликемию (≥ 250mg/dl). С помощью глюкометра One Touch для крови, собранной по СНиП хвост. Как только уровень глюкозы в крови ≥ 250 мг / дл, проверьте уровень глюкозы в крови снова через 48 часа после 6 часов быстро, чтобы обеспечить постоянный гипергликемии и уровень глюкозы в крови в пределах целевого диапазона для лечения: 250-500 мг / дл.
- Лечение мышей с постоянной гипергликемией одной внутривенной инъекции HDAd векторов через хвостовую вену. Общая доза вектор 6x10 11 о.п.для всех групп лечения (в 0,25 мл): 5x10 11 В. П. Ngn3 +1 x10 11 В. П. Btc для комбинированной группы; 5x10 11 В. П. Ngn3 + 1x10 11 вице-президент по Ngn3 группу и 1x10 11 В. П. Btc 5x10 + 11 В. П. пустой вектор для группы БТД и 6x10 11 В. П. пустой вектор для контрольной группы.
- Инъекций хвостовую вену. Положить мышей в Tailveiner фиксатор (TV-150, Braintree Научно Inc), а также использовать теплую воду, чтобы расширить вены хвоста, очистить хвост с 70% спиртом. Держите хвост ниже места инъекции между большим и указательным пальцами руки, используйте другую руку для инъекций. Перед инъекцией убедитесь, что нет пузырей в шприце (с использованием 30 1/2 G иглу и шприц 1 мл). Вставьте иглу и вводят вектор медленно. Если игла находится в вене, вспышка крови можно увидеть в центр иглы, а также нет никакого сопротивления во время инъекции. После удаления игл, удерживая в месте инъекции марлей, чтобы остановить кровотечение до возвращения мышей то клетке.
Если игла не в вене имеется значительное сопротивление инъекции и маленькие подкожные волдыри возникает. В это время извлеките иглу и попробуйте еще раз в другом месте.
3.3 Анализ последствий HDAd-Ngn3 + HDAd-Btc лечения.
- Монитор 6 часов глюкозы натощак и массы тела еженедельно после вектор лечения.
- Сбор крови из подкожной вены или хвостовую вену в ноге каждые 2 недели для анализа инсулина (инсулин мышь ИФА, Mercodia) и печеночных ферментов (АЛТ и АСТ бесконечность реагенты, Thermo Scientific) с использованием коммерческих наборов.
- Поместите мышь в раскрытый 50 мл трубки сокола с отверстиями сделаны в закрытом конце.
- Голова мыши находится на закрытом конце трубы и ноги и хвост на открытой стороне трубки. Для сбора крови из левой ноге, продлить левую ногу снаружи трубки и слегка ущипнуть кожу на бедре между большим и указательным пальцами, чтобы обездвижить ногу.
- ИспользоватьБритва для удаления волос с голеней / голени области, чтобы разоблачить подкожной вены, которая присутствует на боковой стороне голени. Очистите кожу с бритой 70% спирта и дайте ему высохнуть.
- Прокол подкожной вены с 25-иглы, сбор крови с Microvette CB300 трубки (Sarstedt) и поставить трубы на льду.
- Нажмите месте прокола марлей, чтобы остановить кровотечение до возвращения мышей к клеткам.
- Центрифуги трубы при 3000 мкг в течение 5 минут, принимать супернатант и хранят при температуре -20 ° C для дальнейшего анализа.
3,4 выполните тест толерантности к глюкозе (GTT) в течение 6 недель после лечения.
- Растворенный D-глюкозы (Sigma) в дистиллированной воде, чтобы сделать 15% глюкозы (15 г / 100 мл) и стерильный фильтр глюкозы.
- Быстрый мышей в течение 6 часов. Используйте теплую площадку, чтобы согреть мышей и собирают кровь (0 мин момент времени). Затем вводят 1,5 г / кг D-глюкозы IP (10 мкл / г 15% раствора глюкозы).
- Седлолов и выберите крови через 15, 30, 60, 120 мин.
- Измерение уровня глюкозы и инсулина во всех этих образцах.
3,5 Ткань анализа для оценки выражения векторов и оценки индукции регенерации островков.
Во всех этих шагов управления, которые необходимы для надежной интерпретации результатов включают: (1) пустой вектор лечение диабетических мышей (2), не страдающих диабетом мышей и (3) не страдающих диабетом, поджелудочная железа, выступающей в качестве положительного контроля для выражения островок конкретных гормонов и факторов транскрипции.
- Печень и поджелудочная железа Harvest через 3 и 6 недель после лечения. Разделить на 2 части, первая оснастка для замораживания в жидком азоте и хранение при температуре -80 ° С в течение РНК и белка добычу, а второй, чтобы исправить с 10%-ного формалина на ночь для иммуногистохимического анализа.
- Извлечение РНК стандартных протоколов и анализировать выражение островок конкретных гормонов и транскрипционные факторы, наряду с Ngn3 и БТД в подтверждениим вектора экспрессии, в печени путем QRT-PCR с использованием специфических праймеров 9, 10.
- Извлечение инсулина и С-пептида из печени, кислотно-спиртовой метод извлечения и количественно коммерческим ИФА (ультра чувствительный тест инсулина, Mercodia, С-пептид ИФА, Вако).
- Выполните иммунной островок для конкретных гормонов (инсулин, глюкагон, PP, SST) вместе с островком специфических факторов транскрипции в парафин 9 секций, 10. Выражение Ngn3 и БТД может быть также подтвержден иммуноокрашивания.
4. Представитель Результаты
Мы клонировали Ngn3 и Btc кДНК в pΔ28 векторы обусловлен повсеместным промоутер eIF2a (BOS) и генерируется HDAd-Ngn3 и HDAd-БТД. Как показано на рисунке 2, относительная HV загрязнения значительно снизилась (что предполагает более усилении вектора и меньше помощник усиления) при прохождении 3. Поэтому мы использовали P3 для последующего производства вектор. После первогоCsCl разрывным градиентом и ультрацентрифугирования, мы собрали младший вектор группы, а затем собрал опалесцирующий полоса, соответствующая HDAd вектор во второй ультрацентрифугирования (рис. 3). Вектор очищенный HDAd было меньше, чем 1% от HV загрязнения (рис. 4а) по КПЦР и не имел никаких видимых загрязнений помощник на южном блоттинга (рис. 4В), что указывает на достаточное качество для векторных вливания в мышах. Дальнейший анализ включены экспрессии трансгенов инфекцией из 116 клеток. Экспрессия мРНК уровнях Ngn3 и БТД был выше в векторе инфицированных клеток более 10000 раза по сравнению с теми, в незараженных клеток (рис. 5).
HDAd Ngn3-и-Btc затем вводят СТЗ-индуцированных диабетических мышей через хвостовую вену инъекцию с пустой вектор вводят и HDAd-Btc вводили мышей с диабетом, выступающей в качестве отрицательного контроля. Гипергликемия было отменено, и глюкозо-стимулированной секреции инсулинабыл восстановлен у мышей, получавших оба HDAd-Ngn3 и HDAd-Btc, но не у мышей, получавших один вектор гена или поле пустым вектором (рис. 6). HDAd-Ngn3-Btc лечении индуцированных островок регенерации, и это было количественно путем анализа общего содержания инсулина и С-пептида (рис. 6E) с не страдающих диабетом, диабетической пустой вектор мышей, выступающей в качестве контроля. Наличие С-пептида и инсулина в эквимолярного соотношения подтверждает, что инсулин обнаружении в печени действительно синтезируется в печени. RT-КПЦР подтвердили, что печень HDAd-Ngn3-BTC мышей выразил все островок конкретных гормонов и факторов транскрипции 9. Иммуногистохимия показал, инсулин-положительных клеток в печени мышей, получавших HDAd-Ngn3 и HDAd-Btc, но не инсулин-положительных клеток наблюдали у мышей, получавших с векторным управлением (рис. 7). Мы также подтвердил, что не было никаких остаточных островков в поджелудочной железе Ngn3-Btc treateD мышей по сравнению с многочисленными островками без диабета поджелудочная железа. Vector (Ngn3 и БТД) вместе с островком специфический фактор транскрипции линии (PDX-1 и Nkx6.1) выражение также методом иммуногистохимии печени (рис. 7).
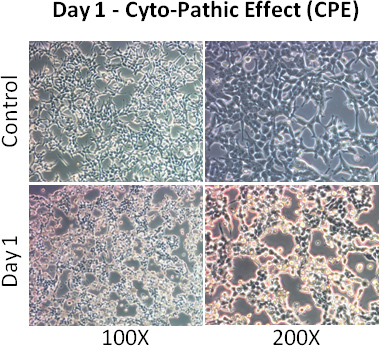
Рисунок 1. Технологическая схема генной терапии диабетических мышей, используя вспомогательные зависит от вируса системы. Во-первых, Ngn3 и БТД, в кассете обусловлено повсеместным промоутер BOS, клонируют в HDAd трансфер (pΔ28) векторов. HDAd производится в несколько этапов, включая трансфекции, последовательных пассажей усиления, и большая инфекции шкале следуют вектор очистки. После того, характеризующих качество, HDAds вводят внутривенно в СТЗ-индуцированных диабетических мышей через хвостовую вену. Эффект лечения оценивали путем измерения глюкозы, масса тела, GTT и анализа экспрессии геновв печени.
Рисунок 2. Определение HDAd вектор усиления. ДНК, извлеченные из прохождения P0 до P4 использованием экстракции ДНК комплекты (Qiagen). ДНК разводили в 1000 раз, и 5 мкл ДНК используется для ПЦР в реальном времени (КПЦР). Помощник и вектор-специфических праймеров используются. Стандартные кривые создаются серийные разведения (10 -5 до 1 нг / мл) HDAd челночного вектора плазмиды и HV плазмиды (верхняя панель). Используя стандартные кривые и Ct значения для числа копий вируса вектора и помощник рассчитывается и отношение HDAd / HV построена в процентах от общего вируса (помощник + HDAd). Таким образом, относительное усиление вектора рассчитывается по формуле: [вектора количества копий / (вектор + вспомогательный вирус число копий)]. В приведенном примере (нижняя панель) HDAd усиления вектора плато на P4, а относительная HDAd / HV растет на P3. Таким образом, P3 выбран для последующего шага.
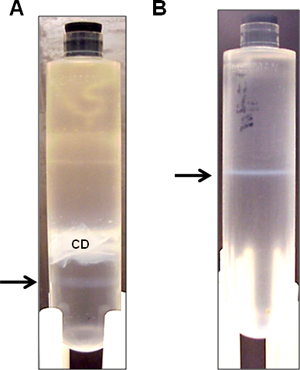
Рисунок 3. Представитель группы HDAd вектора после разрывных CsCl ультрацентрифугирования плотности. HDAd вектор очищают от 3L культуры счетчик более последовательным градиент плотности CsCl. (А) После первой ультрацентрифугирования градиента плотности, одного опалесцирующий группа вектор видна (стрелка) ниже непрозрачной мусора клеток (CD). Опалесцирующий группы (стрелка), собранных для второго центрифугирования в градиенте плотности. (B) После второго центрифугирования в градиенте плотности, опалесцирующий группы (стрелка), собранных для диализа.
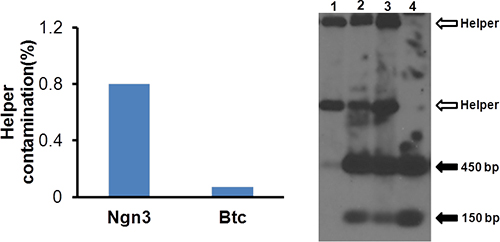
Рисунок 4. Анализ помощник загрязнения вируса. ДНК, извлеченные из 50 мкл очищенного вируса и помощник загрязненияssessed как показано на рисунке 2. На рисунке показан вспомогательный загрязнения HDAd-Ngn3 и HDAd-BTC составляет менее 1%.
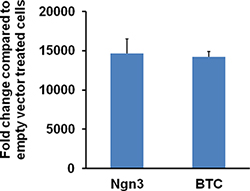
Рисунок 5. Анализ структуры HDAd вектор. Саузерн-блот выполняется, как описано ранее (Ока K, и др..). Полоса 1: ДНК вируса помощник; Lane 2: ДНК из P3; переулок, дом 3: ДНК-4; Lane 4: очищенный vectopr. Открытое стрелки указывают вируса-помощника, полученные полосы и заполнены стрелки указывают ITR группы происходит от HDAd вектор.
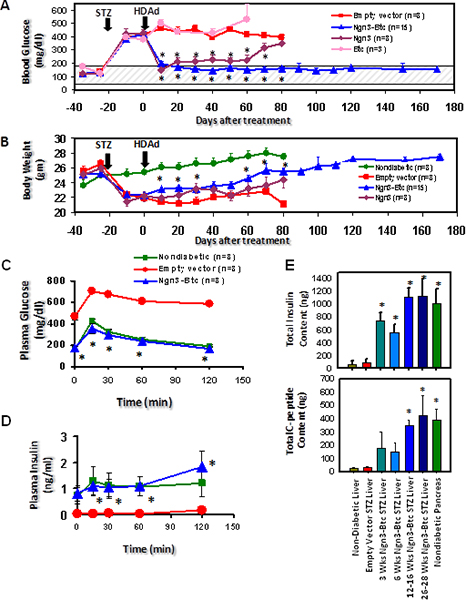
Рисунок 6. Уровень экспрессии Ngn3 или Btc в 116 клетках, инфицированных HDAd-Ngn3 или HDAd-Btc вектор. 116 клеток в 12-луночные планшеты инфицированных HDAd-Ngn3 или HDAd-Btc или пустым вектором в 1000 VP / ячейку в течение 2 дней. CeООО собирают и общей РНК экстрагируют Trizol реагента. QRT-PCR осуществляется с помощью Ngn3 или BTC-специфических праймеров. Относительная Ngn3 или Btc экспрессию мРНК увеличился на более чем 10000 раз в клетках, инфицированных HDAd-Ngn3 или HDAd-БТД. На рисунке перепечатана из Dev.Cell 2009 Mar; 16 (3): 358-73; Yechoor и др.. ал., с разрешения Elsevier.
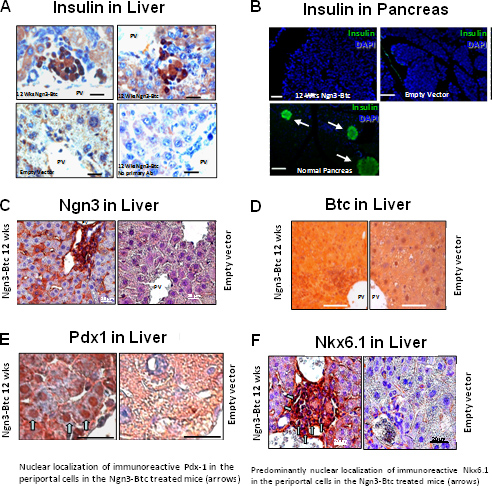
Рисунок 7. Перенос гена из HDAd-Ngn3 и HDAd-Btc в СТЗ-индуцированных диабетических мышей приводит к смене диабета и индукции островок регенерации в печени. (А) глюкозы в плазме и (Б) масса тела СТЗ-индуцированных диабетических мышей, получавших HDAd-Ngn3 и HDAd-БТД. (C) Плазменные глюкозы и инсулина в IP-GTT через 6 недель после лечения. (D) представитель инсулина окрашивания в печени через 12 недель после лечения. * Р <0,05 (по сравнению с пустой группы вектора). На рисунке перепечатана из Dev. CelП 2009 Mar; 16 (3): 358-73; Yechoor и др., с разрешения Elsevier..
| имя | Прямой праймер | Обратный праймер | |
| помощник | GACCATCAATCTTGACGACC | ATGTCGCTTTCCAGAACCC | |
| вектор | TTGGGCGTAACCGAGTAAG | ACTTCCTACCCATAAGCTCC | |
| Ngn3 | AAGAGCGAGTTGGCACTCAG | TCTGAGTCAGTGCCCAGATG | |
| Btc | GCACAGGTACCACCCCTAGA | TGAACACCACCATGACCACT | |
Таблица 1. Primer последовательности.
Обсуждение
HDAds была разработана для преодоления слабости раннего объявления поколения и использовать для генной терапии приложений. Тем не менее, технические проблемы остаются нерешенными. Например, HDAd требует HV для упаковки HDAd и вектор усиления не так эффективно, как рано объявления поколения. HV является первым поколением объявлений и любые загрязнения HV компромисс эффективности HDAd. Таким образом, высокоэффективные трансфекции и оптимальные условия для каждого последовательного прохождения являются критическими. Другим важным параметром для векторного производство которых проход (P1-P4) должны использоваться для последующего прохождения 5, которая непосредственно используется в качестве инокулята для суспензии клеток. Чтобы наш опыт, наилучшие результаты достигаются при использовании прохождение которых HDAd вектор доля резко возрастает в следующем отрывке (P3 на рисунке 2). Выход HDAd векторов зависит от трансгенных кассет. В векторе продукции, как трансгены выразил потому, что оба гена находятся подвездесущий промоутер. Ngn3 является фактором транскрипции и БТД является фактором роста, который предполагает, что HDAd вектор выразить транскрипционных факторов, которые могут повлиять клеточной линии тормозит вектор усиления в то время как выражение гормона роста, помогает в репликация вектора и упаковки.
При диабете предполагая, эпидемии, новые подходы к восстановлению B-клеточной массы необходимы. В этом докладе мы опишем методы, чтобы использовать преимущества HDAd векторов для осуществления переноса генов из островков линии определяющих фактора транскрипции, Ngn3 вместе с островком фактор роста, betacellulin, чтобы вызвать регенерацию островок в перипортальный регионов печени. Для оценки эффективности этого, важно выбрать мышей с устойчивой гипергликемии и убедиться, что соответствующие элементы управления всегда включен. Для этого эксперимента перенос генов, пустой вектор лечение диабетических мышей всегда должна быть использована. Кроме того, используя HDAd-Ngn3 и HDAd-Btc индивидуально рассматривать диабетической мильCE служит для проверки индивидуального вклада этих двух генов в островок регенерации. Поскольку наши данные показывают, что Ngn3 уже достаточно, чтобы вызвать регенерацию островок, но помимо фактора роста, BTC, служит для усиления ответа приводит к надежной индукции регенерации островков. Важно также проверить, что вектор экспрессии, действительно, достигнутые в ткани-мишени, печени, а также продемонстрировать, что инсулин анализировали в плазме мышей исходит не от остаточных островков в поджелудочной железе, демонстрируя отсутствие поджелудочной железы островков в диабетических мышей.
Таким образом, преимущество HDAd-векторной системы для переноса генов заключается в его высокой производительности клонирования, эффективной трансдукции и длительный экспрессии генов в печени с минимальной хронической токсичностью, а также его характер не-интеграция вектора генома в принимающей хромосомы. Основными ограничениями являются сложные этапы в своем поколении и егоВ приложении естественных условиях в первую очередь ограничивается печени с самых популярных объявлений серотипа 5. Островок регенерации могут быть вызваны для полного восстановления инсулина в плазме крови и толерантность к глюкозе у диабетических мышей, вызывая островок регенерации в печени путем переноса генов из островков линии, определяющим фактором транскрипции, Ngn3 вместе с островком фактор роста, betacellulin. В этом докладе мы показываем оптимальный протокол для получения высокого качества HDAd-Ngn3 и HDAd-BTC, а также продемонстрировать методы, чтобы вызвать и оценки островок регенерации в печени мышей с диабетом отменить гипергликемии.
Сноска: вирусные векторы и клеточных линий, описанных здесь, доступны из основного векторного производственная лаборатория, диабета исследовательский центр Медицинского колледжа Бэйлора ( http://www.bcm.edu/mcb/index.cfm?pmid=7731 ). Некоторые коммерческие наборы, также доступны для генерации HDAd вирусов (например, Microbix biosystEMS Inc.)
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Эта работа была поддержана грантами NIH: R03 DK089061-01 (ВКЕ); NIH: K08 DK068391 (ВКЕ); Диабет и Эндокринологический научный центр-(DERC - P30DK079638) Бейлор медицинского колледжа, пилотом и технико-экономическое грант DERC (ВКЕ); детского диабета исследовательский фонд: JDRF Award # 5-2006-134 (ВКЕ).
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента | Компания | Номер в каталоге | |
| ProFectionR млекопитающих комплект Трансфекция | Promega | E1200 | |
| DNeasy Kit крови и тканей (50) | Qiagen | 69504 | |
| Perfecta SYBR Green Supermix, ROX | Quanta Biosciences | 95055-500 | |
| Натрий дезоксихолата | Сигма | D6750-25G | |
| MEM порошок | Invitrogen | 61100087 | |
| Пенициллина стрептомицин | Сигма | 15140122 | |
| FBS | Атланта биологические | S11150 | |
| L-глютамин | Invitrogen | 25030-081 | |
| Гигромицина | Сигма | H0654-1G | |
| MEM EAGLE JOKLIK | Сигма | M0518-10L | |
| РНКазы | Roche | 10109169001 | |
| ДНКазы I, II сорт | Roche | 10104159001 | |
| Streptozocin | Сигма | s0130 | |
| Стеклянные колбы счетчик | Гранулирование | 4500-3L | |
| Стеклянные колбы счетчик | Гранулирование | 4500-250 | |
| Слайд-анализатора Casset | PIERCE CH | PI66380 | |
| Труба optiseal поли allomer, 11,2 мл | Beckman Coulter | 362181 | |
| Цезий хлорид 1 кг | JT4042-2 | VWR | |
| Beckman LE-80K | Beckman Coulter | Оптимальное LE-80K ультрацентрифуге | |
| Фильтр | VWR | 28143-338 | |
| центрифужные пробирки 500 мл | Гранулирование | 431123 | |
| tailveiner фиксатор | Braintree научной, INC | ТВ-150 | |
| Инсулин, мышь ELISA | Mercodia | 10-1247-01 | |
| microvette CB300 | Sarstedt | 16.443.100 | |
| D-глюкозы | Сигма | G8270 | |
| Мышь С-пептида ELISA Kit | Wako Pure Chemical Industries, Ltd | # 631-07231 | |
| морская свинка анти-антител к инсулину | Abcam | ab7842 | |
| козьего анти-антитело Pdx1 | подарок от доктора Кристофера Райта | ||
| мышиного анти Ngn3 антител | Бета консорциума клеточной биологии, Университет Пенсильвания | AB2013 | |
| мышиного анти Nkx6.1 антител | Бета консорциума клеточной биологии, Университет из Pennsylvania | F64A6B4 | |
| анти-антитело betacellulin | Сотовые наук | PAAQ1 | |
| ALT (SGPT) цвет реагента SET. | Teco Diagnostics | A526 - 120 | |
| АСТ / (SGOT), Цвет Endpoint реагентов Set | Teco Diagnostics | A561-120 |
Таблица 2. Специфических реагентов и оборудования.
Ссылки
- Parks, R. J. A helper-dependent adenovirus vector system: removal of helper virus by Cre-mediated excision of the viral packaging signal. Proc. Natl. Acad. Sci. U. S. A. 93, 13565-13570 (1996).
- Kim, I. H., Jozkowicz, A., Piedra, P. A., Oka, K., Chan, L. Lifetime correction of genetic deficiency in mice with a single injection of helper-dependent adenoviral vector. Proc. Natl. Acad. Sci. U.S.A. 98, 13282-13287 (2001).
- Belalcazar, L. M. Long-term stable expression of human apolipoprotein A-I mediated by helper-dependent adenovirus gene transfer inhibits atherosclerosis progression and remodels atherosclerotic plaques in a mouse model of familial hypercholesterolemia. Circulation. 107, 2726-2732 (2003).
- Oka, K. Long-term stable correction of low-density lipoprotein receptor-deficient mice with a helper-dependent adenoviral vector expressing the very low-density lipoprotein receptor. Circulation. 103, 1274-1281 (2001).
- Nomura, S. Low-density lipoprotein receptor gene therapy using helper-dependent adenovirus produces long-term protection against atherosclerosis in a mouse model of familial hypercholesterolemia. Gene Ther. 11, 1540-1548 (2004).
- Ng, P. A high-efficiency Cre/loxP-based system for construction of adenoviral vectors. Hum. Gene Ther. 10, 2667-2672 (1999).
- Palmer, D., Ng, P. Improved system for helper-dependent adenoviral vector production. Mol. Ther. 8, 846-852 (2003).
- Oka, K., Chan, L. Helper-Dependent Adenoviral Vectors. Current Protocols in Molecular Biology. , 16.24.1-16.24.23 (2005).
- Yechoor, V. Neurogenin3 is sufficient for transdetermination of hepatic progenitor cells into neo-islets in vivo but not transdifferentiation of hepatocytes. Dev. Cell. 16, 358-373 (2009).
- Yechoor, V. Gene Therapy with Neurogenin 3 and Betacellulin Reverses Major Metabolic Problems in Insulin-Deficient Diabetic Mice. Endocrinology. , (2009).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены