Method Article
Генерация Тематически трансгенных крыс
В этой статье
Резюме
Гены можно манипулировать во время развития мозга или гиппокампа крысы через внутриутробно электропорации (ИЭГ) на E16, для того, чтобы быстро и целевые изменения в нейронной связи для более поздних исследованиях поведения или невропатологии у взрослых животных. Послеродовая в естественных изображений для управления ИЭГ успеха осуществляется биолюминесценции активации котрансфицируют люциферазу.
Аннотация
Внутриутробное электропорации (ИЭГ) представляет собой метод, который позволяет генетической модификации клеток в головном мозге за расследование нейронов развития. До сих пор использование ИЭГ для исследования поведения или невропатологии в взрослом мозге была ограничена недостаточным методов мониторинга ИЭГ успеха трансфекции по неинвазивных методов в послеродовых животных.
Для настоящего исследования, E16 крысы были использованы для МСЭ. После внутрижелудочкового введения нуклеиновых кислот в эмбрионах, позиционирование пинцета электродов имеет решающее значение для ориентации либо развивающуюся кору или гиппокамп.
Желудочков со впрыском и электропорации гена люциферазы позволило мониторинга трансфицированных клеток постнатально после внутрибрюшинного введения люциферин в наркозом жить P7 щенка по в естественных условиях биолюминесценции, используя устройство IVIS Spectrum с 3D программного обеспечения количественного. DISC1 человека в крысиной коры привели к амфетамина гиперчувствительности. Котрансфицируют GFP могут быть обнаружены в нейронах по Post Mortem флуоресцентной микроскопии в криосрезов указанием экспрессию гена присутствующую в ≥ 6 месяцев после рождения.
Мы пришли к выводу, что послеродовая изображений биолюминесценции позволяет оценить успех временных трансфекций с ИЭГ у крыс. Исследования по влиянию актуальных генных манипуляций во время neurodevelopmenт на взрослом мозге и его соединения являются значительно облегчается. Для многих научных вопросов, эта техника может дополнить или даже заменить использование трансгенных крыс и обеспечивают технологии нового для поведенческой неврологии.
Введение
Развитие электропорации внутриутробно метода (ИЭГ), которая позволяет модуляцию экспрессии генов в развивающемся мозге, был прорыв, поскольку он включен изучения развитие нервной системы с относительной легкостью. 1-7 Изменения в уровнях экспрессии гена-мишени в конкретный отдел головного мозга во время эмбрионального и / или перинатальной развития у грызунов были продемонстрированы критически влияние нейронов пролиферацию, миграцию, разветвление и подключение. 8-10
Шизофрения является сложным психическим заболеванием с острыми и хроническими симптомами, которые были, связанных с развитием нервной системы аномалий 11, 12 и, следовательно, многие из выявленных генов-кандидатов для шизофрении исследуются Возможное воздействие на модулирующих на развитие нервной системы, как, например, для нарушается-в-шизофрении -1 (DISC1) гена 13-15.
Развитие мозга является регулиред генетическими факторами и их взаимодействия с окружающей средой, которые играют роль в пре-, пери-и постнатальный периоды развития. Одним из основных факторов генетического риска для различных поведенческих расстройств является DISC1 16 ген. DISC1 нокдаун приводит к миграции дефектов в мышах 13, 17, и манипулирование DISC1 выражения в развивающихся коры по ИЭГ было показано, что влияние поведение мышей взрослых 18.
Манипулирование экспрессию генов мозга на МСЭ имеет ряд преимуществ 19 по генерации трансгенных линий животных. Во-первых, экспрессия гена в областях, представляющих интерес достигается в течение нескольких недель до нескольких месяцев, а не нескольких поколений разведения трансгенных линий грызунов. Во-вторых, компенсаторные механизмы на ранних стадиях развития, которые могут оградить фенотипы в зародышевой линии инженерии животных 20 можно избежать. В-третьих, через ориентация только конкретный население клеток или определенную область мозга, migratiили различия распространения можно напрямую сравнивать с не-мутанта или контролировать противоположной стороне, если односторонние electroporations выбраны. С другой стороны, МСЭ не имеет точность промотора приводом CRE / LOX-индуцированной экспрессии времени и только субпопуляции клеток в определенной области целевой ведет к мозаичного вида паттерна экспрессии генов.
Для многих применений в экспериментальных взрослых грызунов, кратковременной трансфекции ограниченного числа клеток в области мозга может быть недостаточно, или даже желательно, так что основным преимуществом стабильных, зародышевой линии трансгенных грызунов-незначительна. На самом деле, ИЭГ полезно исследовать ли некоторые аномально развитые клетки могут повлиять целую сеть ячеек или схемы. Еще одно преимущество может быть способность демонстрировать не являющихся клеточно-автономной эффекты гена связано с мозаичным характером хит. Кроме того, поколение трансгенных и нокаут крыс все еще находится в зачаточном состоянии и использованиеиз ИЭГ у этого вида для изучения аномальным последствия развития мозга представляет большой интерес.
До сих пор основным препятствием использования ИЭГ для исследования последствий вмешательства в тех животных, что и взрослые, является отсутствие успеха мониторинг электропорации. До сих пор GFP-котрансфицируют флуоресцентные нейронов в живых новорожденных детенышей крыс не могли быть обнаружены при подходящем бинокулярного флуоресцентного микроскопа или с флуоресцентной визуализации с IVIS Spectrum.
Чтобы преодолеть это препятствие, мы котрансфицируют люциферазы ген-репортер и выполняется биолюминесценции Живая съемка щенков от 3-х мерные (3D) количественным определением ИЭГ области мозга.
В качестве примера для демонстрации применимости этого метода в более поздней функциональном анализе тестирования развития нервной системы генетические манипуляции, cо-инъекцию плазмиды, содержащие человеческую DISC1, люциферазу и GFP в боковой желудочек эмбрионов крыс 3 с последующим электропорации с пинцета электрода была выполнена. В то время как флуоресцентные сигналы не могли быть обнаружены в постнатальном этапах в естественных условиях, твердый биолюминесценции сигнал получают из люциферин метаболизма путем совместной трансфекции гена люциферазы детектировали до пяти недель после рождения. 3D-измерения электропорации области мозга позволило количественного которой щенки с недостаточным или неуместной электропорации были определены с самого начала, тем самым, позволяя назначение ИЭГ животных (генных интерес и яичницы контроль) в экспериментальных группах с согласованными электропорации областях мозга низкой изменчивости . Использование взрослых крыс ИЭГ в поведенческих парадигм была продемонстрирована в качестве примера полезности этого протокола.
протокол
В соответствии с национальной и европейской законодательства; Все эксперименты на животных были уполномочены ответственным Landesministerium für Natur, Umwelt унд Verbraucherschutz (87-51.05.2010.A301 LANUV NRW).
1. Внутриутробно электропорации
Этот метод был подробно описан в JOVE для крыс по Walantus соавт. 3, а также риса и соавт. 4 и здесь приведены лишь вкратце. Размер помета из 6-8 щенков дает хороший результат. Там должно быть по крайней мере два не-электропорации эмбрионов с целью повышения общей выживаемости (см. ниже).
- Подготовка ДНК-смесь, которая содержит 1,5 мкг / мкл целевой плазмиды (shRNA: pENTR-U6; Invitrogen, Юджин, Орегон / DISC1 избыточная экспрессия: pCAX 21), 0,5 мкг / мкл люциферазы содержащей плазмиды (pCAX), 0,5 мкг / мкл GFP содержащей плазмиды (pCAGGS 22) в 1x PBS раствора окрашенные светло Bluэ с Fast Зеленая краска.
- Подготовка инъекционных игл из стеклянных капилляров с иглой пипеток Пуллера. И стерилизовать хирургические инструменты либо в автоклаве или инкубации с дезинфицирующим средством на спиртовой основе (Kodan Tinktur форте).
- Администрирование дооперационную дозы бупренорфина (0,05 мг / кг) за 15 мин до операции на беременных крыс через 16 дней после оплодотворения (E16). Тогда обезболить животное в изофлурана камеры.
- По анестезии, поместите крысу в лежачем положении на 37 ° C-подогреваемой таблице операции с дыхательной маской, подключенного к анестезии устройства, используя настройки кислорода на 0,4 л / мин и изофлураном на 1,8%.
- После бритья живот, дезинфекции бритыми площадь три раза Kodan Tinktur Forte (дезинфицирующим спиртовой основе).
- Накройте крысу с стерильных тканей, выставляя только бритая поле работы.
- Выполните внутриутробное электропорации.
- Разрежьте брюшко с scissoг вдоль белой линии (~ 2 см).
- Expose рогов матки тщательно с кольцом щипцами.
- Следите, чтобы стенки матки мокрые с подогреваемой стерильной PBS в течение всего операции.
- Введите раствора ДНК с тонким стеклом иглу в одно из бокового желудочка эмбрионов.
- Поместите 7 мм электрод вокруг головы эмбриона. Чтобы попасть популяции клеток верхних слоев коры, выполните ИЭГ на E16 23 и расположите положительный электрод по указанным выше введенного желудочка полушарии с небольшим спинной / боковой тенденции. Для целевой клетки гиппокампа изменить размещение положительного электрода к противоположной стороне, чем впрыскиваемого желудочка с боковой слегка спинной направлении (рис. 1).
- Выполните электропорации пятью 50 мс импульсов при 55 V с 950 мс порывает с квадратной электропоратора пульсовой волны.
- Запасные первый эмбрион в вагинальной конце каждого матки рога для повышения тон шансы на выживание всех эмбрионов.
- Положите матки рога обратно в родном крысы.
- Стич брюшную стенку с абсорбируемого викрил хирургического шовного материала.
- Закройте кожу шовного материала викрил или с шовных клипов.
- Поместите мать крысу обратно в домашнюю клетку и держать его теплым в течение 2-3 часов.
- Держите в одиночку крыс в клетках, где их в комнате вивария и кормить вволю. Они рожают между E22-24.
- Держите крысят с матерью в течение трех недель и отделить их потом по полу.
2. Биолюминесценция Живая съемка ферментативной реакции люциферазы
Этот метод используется для анализа положение в утробе трансфицированных клеток. Со-электропорации люциферазы светляков кДНК переводится в активную люциферазы, которая после метаболизм D-люциферин в оксилюциферин, испускает фотон (рис. 2 ). В результате люминесценции могут быть обнаружены в мозге положительных электропорации молодых крыс в IVIS Spectrum до возраста около 35 дней после рождения (рис. 4).
В настоящем исследовании, изображений люциферазы анализа и биолюминесценции проводили начиная с Р7. На этот раз точка была выбрана, чтобы позволить матери и щенков, чтобы оправиться от родового стресса. При первоначальном работы с щенками на P0, щенок выживания серьезно пострадала в том, что щенки были найдены мертвыми или съедены матери.
Первоначально крысят с успешной электропорации идентифицируются по 2D-биолюминесценции картины с временем экспозиции трех минут. Впоследствии положительные щенки используются для создания 3D-изображений с целью уточнения местоположения электропорации области.
- Развести D-люциферин натриевой соли в PBS до концентрации 15 мг / мл и стерилизовать путем фильтрации через стерильный шприцевой фильтр.
- Взвесьте щенков.
- Возьмите щенка в одной руке с живота на вершине и растянуть живот слегка. Введите 10 мкл / г массы тела внутрибрюшинно люциферин раствора. Для более старых и более гибких те, предварительно анестезировать щенков изофлураном в индукции камеры перед инъекцией люциферин.
- Включите изофлурана притоком XGI-8 газ анестезии системы в рамках IVIS Spectrum с 3% изофлуран.
- Положите морду животного в стекло нос конусов анестезии системе.
- Держите животное в положении лежа, пока не находится в глубоком наркозе (2-3 мин). Затем уменьшите ИФ приток до 1,5%.
- Выберите измерение 2D-биолюминесценции, чтобы выбрать положительные щенков от всей помета. Используйте следующие настройки
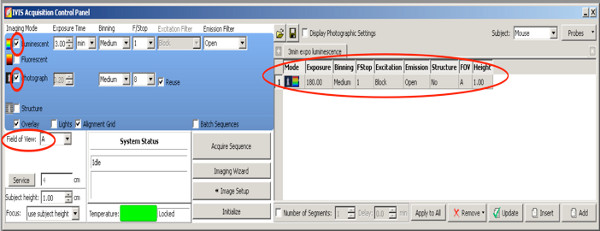
Нажмите здесь, чтобы увеличить рисунок .- Установите CHECkmark на Фотография со средней биннинга и F / Stop на 8, камера делает фото сверху после начала измерения.
- Установите Возбуждение фильтр: блок.
- Установить фильтр выбросов: открытым.
- Установите Биннинг к среде.
- Установите F / Stop на 1.
- Установите уровень Стадия А.
- Установите время экспозиции люминесценции до 180 сек.
- Для создания 3D изображений с целью более точной количественной оценки электропорации область из положительных щенков, используйте следующие настройки DLIT для люциферазы светляков.
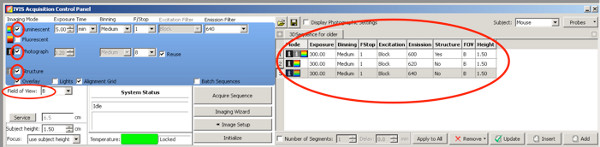
Нажмите здесь, чтобы увеличить рисунок .- Установите галочку на Фотография; камера сделает снимок сверху после начала измерения.
- Установите галочку на структуру, поверхность животного сканируется ИВИС до измерение биолюминесценции.
- Uсебе следующая фильтры выбросов и настройки Выдержка в возрасте до двух недель:
Фильтр выбросов 1: 590 нм, время экспозиции 300 сек
Эмиссия фильтр 2: 600 нм, время экспозиции 240 сек
Фильтр выбросов 3: 620 нм, время экспозиции 180 сек
Фильтр выбросов 4: 640 нм, время экспозиции 120 сек
Для крыс старше P20
Фильтр выбросов 1: 600 нм, время экспозиции 300 сек
Эмиссия фильтр 2: 620 нм, время экспозиции 300 сек
Фильтр выбросов 3: 640 нм, время экспозиции 300 сек
Нажмите здесь, чтобы увеличить рисунок .
В связи с уменьшением уровня сигнала в более старых животных, время экспозиции увеличивается для трех лучших фильтров выбросов. - Установите уровень Этап B
- Установите Биннинг к среде.
- Установите F / Stop на 1
- После измерения, мар К крыс с помощью earhole кода, чтобы отличить их друг от друга и, чтобы соответствовать их к IVIS живого изображения фотографий
- В конце процедуры измерения, выключить ИФ приток и держать крысу на утепленной плиты в течение нескольких минут, прежде чем вернуть в клетку.
3. Анализ биолюминесценции изображения
Поколение 3D изображения, 3D-фильмов и количественного определения объема источника сигнала производится с помощью программного обеспечения живой образ, предварительно установленным на IVIS Spectrum.
- Генерация 3D-изображений
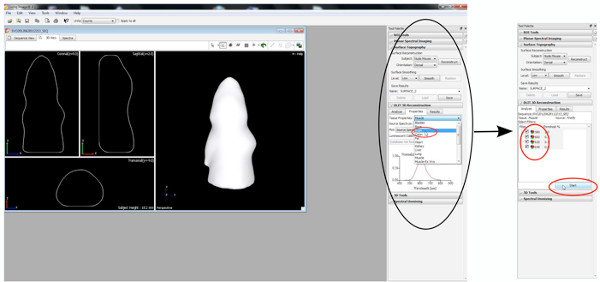
- Во-первых, восстановить топографию поверхности, поэтому установить порог между 20-30%.
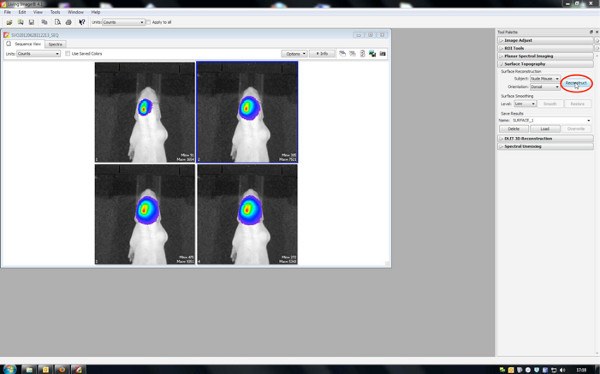
Нажмите здесь, чтобы увеличить рисунок .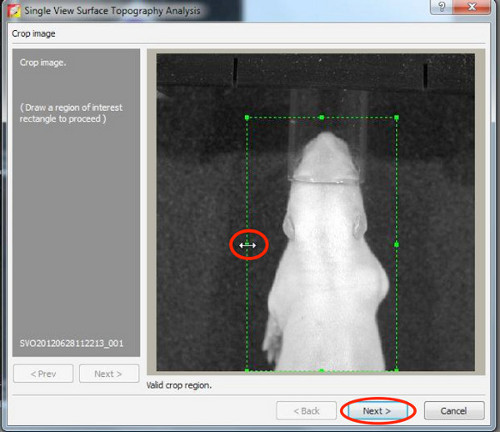
ееп 6 "Первоначально" / files/ftp_upload/50146/50146screen6.jpg "/> - Начните DLIT 3D-реконструкция с изображения пороге 10% для каждой длины волны.
Нажмите здесь, чтобы увеличить рисунок .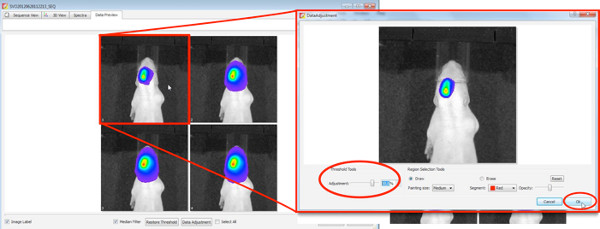
Нажмите здесь, чтобы увеличить рисунок .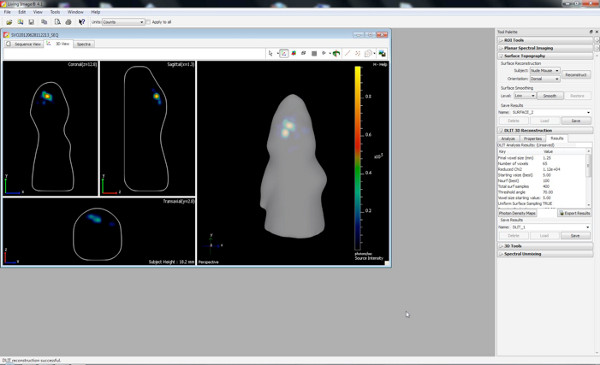
Нажмите здесь, чтобы увеличить рисунок . - Создание 3D-фильмов с помощью кнопки анимировать в панели инструментов 3D.
- Выберите различную ориентацию 3D-изображения, а также масштабирования взгляды как ключевых кадров и нажмите "Record & #39; кнопку, запись переход от одного положения / ориентации к другой.
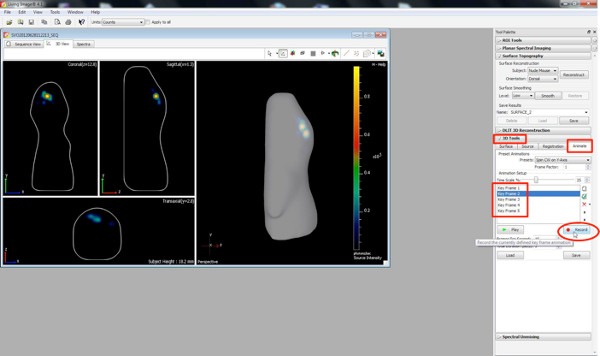
Нажмите здесь, чтобы увеличить рисунок .
- Во-первых, восстановить топографию поверхности, поэтому установить порог между 20-30%.
4. Поведенческий тест
Поведенческая Тестирование проводилось для того, чтобы определить, является ли ИЭГ-опосредованных генов манипуляции на крысах может инициировать долгосрочные последствия, которые сохраняются и в зрелом возрасте. В настоящем конкретном случае, эффект переходного, односторонний полная длина человеческой DISC1 корковых избыточная экспрессия после ИЭГ была исследована путем тестирования передвижения в открытом поле (), с и без низкой дозой амфетамина, как специфический тест на допамин, связанных с поведение 24. В аналогичной процедуры в исполнении Нива и др.. Мышей ИЭГ использованием DISC1 нокдаун, мышей ИЭГ, но не управляет показали гиперчувствительностьс амфетамином 18.
Крысы, которые были в утробе матери электропорированные с DISC1 сверхэкспрессирующие вектора были проведены в лабораторных условиях с 12 ч света с 7 утра до 7 вечера и кормили вволю. В 3-месячного возраста, крысы прошли поведенческие тестирование.
Для количественной оценки передвижения как считывания эффектов амфетамина, с открытым полем деятельности системы Tru Scan, расположенной в звуко-и светло-изолированной камере был использован. Эта система измеряет время продолжительность и расстояние ходы животных, время и расстояние, потраченные на полях или центра открытом поле, а также воспитанию поведение 25.
- В первый день, проверить после инъекции физиологического раствора
- Взвесьте животных.
- Введите внутрибрюшинно 1 мкл / г веса тела солевым раствором (1 × PBS).
- Сразу после инъекции, положить животное в открытом поле и начать измерение TruScan системы. Запись в течение 15 мин апд разделить данные в 3 х 5 мин частей.
- Положите животное обратно в дом клетке.
- Второй день, тест на инъекции амфетамина
- Взвесьте животных.
- Введите внутрибрюшинно 1 мкл / г веса тела в 0,5 мг / мл раствора амфетамина.
- Сразу после инъекции положить животное в открытом поле и начать измерение TruScan системы. Запись в течение 15 мин и разделить данные в 3 х 5 мин частей.
- Вернуться животное в исходное клетке.
- Анализ передвижения и разведение поведение, порожденное специального программного обеспечения Tru Scan. Создание графиков с Graphpad (Prism) и подсчитать статистику по SPSS Statistics программного обеспечения.
Результаты
Фигура 3 показывает жить измерения изображений трех крысят в Р7 после инъекции 150 мг люциферин / кг массы тела. Различия силы сигнала, указывающие на изменчивость в эффективности МСЭ видны. Сильные сигналы биолюминесценции зафиксировано не было, пока P36 (рис. 4). На рисунке 5, способность определить корковой (5А и 5С) и гиппокампа (рис. 5B и 5D) электропорации по визуализации биолюминесценции изображены. Корреляция биолюминесценции сигнала (фиг.7а) с его сигнала флуоресценции после удаления черепа (фиг.7В) и соответствующий GFP-электропорации клеток в cryosectioned мозга (рис. 8) на P14 изображены на рисунках 6-8. Следует отметить, что не было никакого обнаружение сигнала флуоресценции в живых крыс в любой момент времени.
палатка "> В естественных изображений биолюминесценции позволяет приблизительное дискриминации различных областей мозга электропорации по 2D (фиг. 5A и 5B), который значительно улучшилась с DLIT программы программного обеспечения IVIS спектра генерации изображений 3D (фиг. 5С и 5D). В показанных примерах , электропорацию префронтальной коры и гиппокампа можно выделить. Следует отметить, что в то время как с целью электропорации гиппокамп, некоторые клетки-предшественники для коры лежащий спинного гиппокампа также может быть удар (рис. 7).Крысы в одностороннем порядке в период внутриутробного развития электропорированные с pCAX вектора в кору, а затем сверхэкспрессирующие длина полного человеческого DISC1 были исследованы как спонтанного, так и амфетамином гиперактивности, как взрослые. Крысы электропорированные с pCAX-DISC1 были гиперчувствительностью к низкой дозой амфетамина. Эти крысы значительно переехал месповторно после амфетамина лечения, чем после инъекции физиологического раствора, в то время как контрольные животные не было (рис. 10).
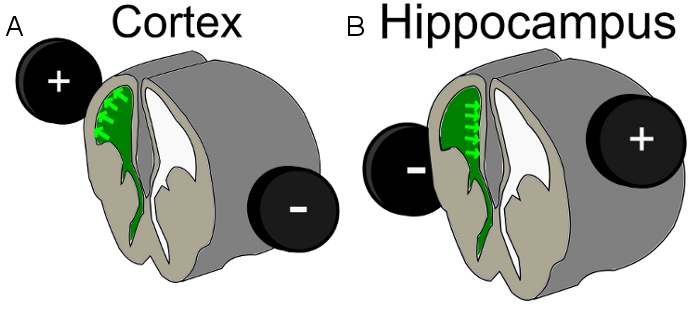
Рисунок 1. Схема положении электрода для A) кора электропорации и В) гиппокампа электропорации, зеленый = вводили ДНК-Mix в желудочек.
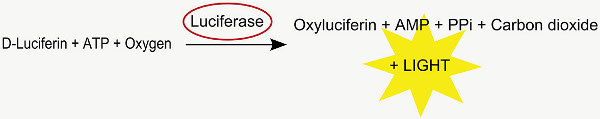
Рисунок 2. Люциферазную реакция.
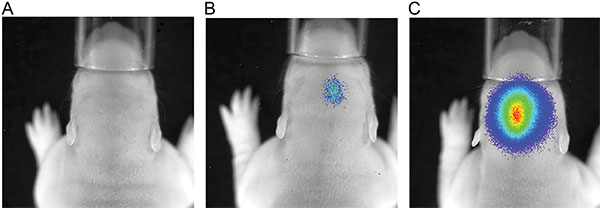
Рисунок 3. Измерение люминесценции P7 крыс после инъекции 150 мг / кг массы тела люциферин; время экспозиции 180 сек; A) крыса, не люминесценции сигнала; B) крыса со слабым биолюминесценции сигнала; C) крыса с сильным сигналом люминесценции.
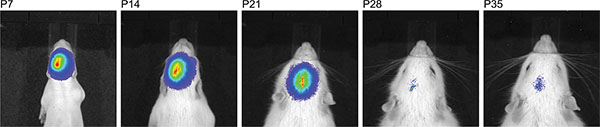
Рисунок 4. Время линия последовательных измерений биолюминесценции того же крысы после инъекции 150 мг / кг люциферина демонстрируя большое окно времени, где ИЭГ успех может быть обнаружена.
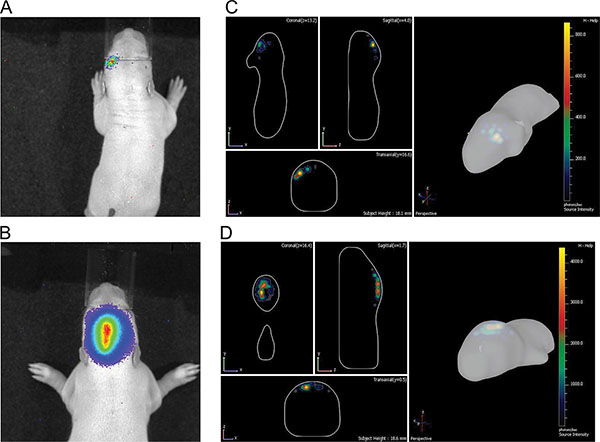
. Рисунок 5 Иллюстрация различий между корковой и гиппокампа электропорации в P7 А) и Б) 2D картинки;. C) и D) 3D изображений: а) & C) из коры, б) и г) от гиппокампа.files/ftp_upload/50146/50146fig5highres.jpg "> Нажмите здесь, чтобы увеличить рисунок.
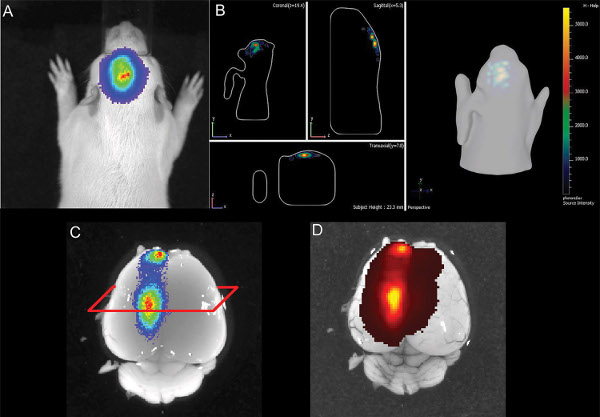
Рисунок 6. Иллюстрация E16 гиппокампа электропорации крысы щенка на P14 А) 2D-изображения биолюминесценции B) 3D иллюстрации биолюминесценции сигнала C) расчлененный мозг с биолюминесценции сигнала D) головного мозга с GFP эпи-сигнала флуоресценции. Нажмите здесь, чтобы увеличить рисунок .
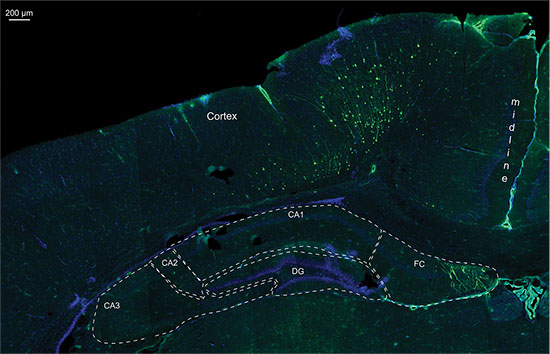
Рисунок 7. Деталь флуоресценции изображение с крио разделе 20 мкм того же P14 мозга крысы электропорации с GFP, содержащий плазмиды и люциферазывектор, ядра окрашивание DAPI; АК1-3 = Корню Ammonis 1-3; DG = зубчатой извилине; FC = Fasciolarum серое вещество.
Видео 1. 3D анимация гиппокампа электропорации крысу на P14.
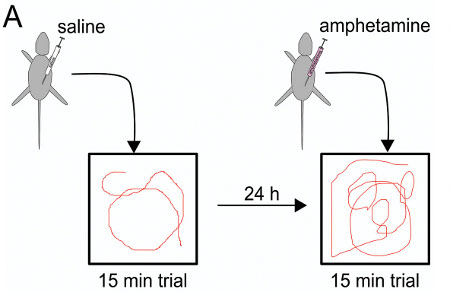
Рисунок 8. Амфетамин испытания схема: первый день инъекции физиологического раствора до 15 мин судебного разбирательства, 24 часа в сутки позже амфетамин впрыска до тестирования в открытом поле камеры.
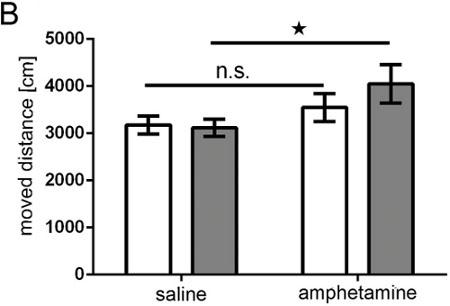
Рисунок 9. Амфетамин испытания. Бар график, показывающий перемещенный расстояние (в см) животного, записанные с помощью TrueScan системы в течение 15 мин белые полосы = контрольной группе;. Серые полосы = DISC1 гиперэкспрессией группа; контрольная группа п = 10; DISC1 избыточная экспрессия группа п = 11; ANOVA: генотип * лечение р = 0,043; Т-тест для общего времени физиологическим раствором против амфетамина нс = не имеет значения PControl = 0,172, pDISC1 = 0,001.
Обсуждение
В нашем исследовании показано, что МСЭ подходит для генерации взрослых крыс с нейроны экспрессирующие трансген в селективной области мозга, и что в результате этого вмешательства, эти животные обладают изменений в поведении, указывающий функциональность выполненной манипуляции. В этом исследовании, в качестве примера, крысы сверхэкспрессирующие DISC1 в одностороннем порядке в небольшой части префронтальной коры показали гиперчувствительность к амфетамина (рис. 9).
Выбор крыс для электропорации успехом в естественных условиях биолюминесценции изображений было эффективным в борьбе присущего изменчивости ИЭГ трансфекции клеток и был применен для создания группы с однородным ИЭГ области низкого межпредметных изменчивости для дальнейших исследований.
В этом исследовании, мы не смогли выбрать электропорации щенков из помета путем выявления со-электропорации GFP-индуцированной флуоресценции в новорожденного животного, даже хотяУф в то же время и в том же животного биолюминесценции сигнала одинаково со-электропорации люциферазы могут быть обнаружены после инъекции люциферин (рис. 6), и GFP выражения нейронов были все еще присутствует в головном мозге в возрасте шести месяцев. Мы пришли к выводу, что, у крыс, реакция люциферазы / люциферина хорошо подходит для дифференциации животных с успешными электропорации мозгов (рис. 3).
Количественный контроль ИЭГ успеха относится к мощности сигнала биолюминесценции, которая измеряется по пунктам фотонов в то же время экспозиции (рис. 3) и соответствует ферментативной активности совместной экспрессии люциферазы. Слабые сигналы биолюминесценции обнаруживаются на 100-200 пунктам фотонов, и, в сиянии ~ 1x10 4 фотон / сек / см 2 / стерадиан шоу 1000-2000 GFP-окрашенных клеток в гистологии в 6 месяцев мозга крысы. Самый высокий сигнал DISPзаложен в сияние до ~ 5x10 6 фотон / сек / см 2 / стерадиан и ~ 64000 пунктам.
В линии крыс Спрэг Dawley используется, мы наблюдали ослабление сигнала биолюминесценции продольно с увеличением возраста и сигнал исчез в возрасте старше P35 (рис. 4). На данный момент, мы не знаем, уменьшает ли либо временными, плазмиды вектор на основе экспрессии люциферазы, или если сигнал биолюминесценции ослабляет связи с увеличением массы мозга, или обоих причины для сигнала исчезает. Для настоящего функциональном анализе в взрослых крыс, выбор для поведенческих исследований было сделано только на основе расположения сигнала, но не силой биолюминесценции сигнала.
Несмотря на то, мониторинг 3D количественный биолюминесценции разрешено дифференциация между различными электропорации областях (рис. 5), его точность была ограничена для клеток, расположенных в глубине десяти центовnsion мозга. 6 показан пример гиппокампа электропорации, когда измерение биолюминесценции в 2D и 3D изображения, указанного хорошую позиционирование электропорации. В рассеченной посмертного мозга, сигнал флуоресценции GFP-был обнаружен примерно в той же позиции, что и сигнал биолюминесценции, что указывает на правильный нацеливание гиппокампа. Но гистологии показывает, что также клетки в коре головного мозга спинной гиппокампа были направлены (рис. 7). Это означает, что биолюминесценции анализа является полезным инструментом для выявления положительных ИЭГ щенков, а также иметь представление о электропорации области, но, в конечном счете, работы с изображениями не могут заменить посмертного гистологию точно локализовать положительно клетки-мишени.
Наша демонстрация показывает перспективы для применения ИЭГ технологии, чтобы генерировать тонкие целенаправленные манипуляции корковых или гиппокампа областях мозга для имитации aberrances в сortical миграция или другие дефекты развития нервной системы, которые могут повлиять на взрослого животного. В то время как двусторонние электропорации 26 имеет преимущество всего большее влияние на поведение, есть и еще смертности эмбрионов. Одностороннее электропорации был выбран для того, чтобы сравнить два полушария с одним в качестве внутреннего контроля, а также для демонстрации, что даже ИЭГ манипулирования в одностороннем, небольшой области достаточно, чтобы изменить поведение. ИЭГ-индуцированные изменения в связи или архитектуры между нейронами могут, таким образом быть вызваны не вызывая поражение и необходимое матч к-быть-ИЭГ-манипулировать области с соответствующим поведенческим теста зависит от научного вопроса.
Поиск и устранение неисправностей
Уменьшение размера помета Есть несколько предложений относительно повышения выживание ИЭГ щенков. Во-первых, использование очень тонких стеклянных капилляров в течение электропорации, с тем чтобы свести к минимуму ткани lesioн рекомендуется. Во-вторых, не электропорации первый эмбрион в вагинальной конце каждого матки рога: смерть первенца эмбриона повышает шансы на прерывания всех других эмбрионов. В-третьих, после рождения, мать крысы часто убивают часть их потомства из-за перинатальной стресса. Для того чтобы уменьшить дополнительную нагрузку, не начинайте с живого изображения сразу после рождения, но ждать в течение семи дней.
Обнаружение GFP-флуоресценция щенков
Через неделю после рождения, нет сигнала флуоресценции либо с помощью живой бинокулярное флуоресценции микроскопических изображений или изображений флуоресценции с IVIS Spectrum (эпифлуоресцентной и transfluorescence режимов; для возбуждения GFP / эмиссии: 465/520 нм и 500/540 нм). Вполне возможно, что оба, ограниченный передачи коротких длин волн возбуждения и излучения света через ткань как черепа и высокого фона автофлуоресцентной кожи предотвратить с помощью флуоресценции под алфавитуribed условия на крысах. Как показано на фиг.6, люциферазы сигнала в живом организме также могут быть обнаружены в головном мозге расчлененным (без черепа) и там, также сигнал флуоресценции обнаруживается (рис. 6D).
Дифференциация биолюминесценции в близко расположенных областях мозга
Даже в 3D иллюстрации расположение области биолюминесценции не могут быть предсказаны на 100%. Особенно клетки в верхней части или ниже предсказанной области также может быть случайно мишенью и трансфецируют. Точное положение должно быть под контролем Post Mortem (флуоресценция) гистологии (см. рисунок 7).
Раскрытие информации
Авторы этого исследования не имеют финансовый интерес в этом исследовании и не были авторами промышленности для данного исследования. Сборы открытого доступа были предоставлены сообщению издания PerkinElmer Инк.
Благодарности
Авторы выражают благодарность Трейси Янг-Пирс и Ацуши Камия за предоставление плазмиды.
Эта работа финансировалась по Нейрон-Eranet обнаружить или и CK (BMBF 01EW1003), DFG (Ko 1679/3-1; GRK1033) к CK, и (DE 792/2-4) к массовым
Материалы
| Name | Company | Catalog Number | Comments | ||||||||||||||||||||||||||||
| Reagent name | |||||||||||||||||||||||||||||||
| Dulbecco's Phosphate-Buffered Saline (PBS) | Invitrogen | 14190-250 | without calcium, without magnesium | ||||||||||||||||||||||||||||
| D-luciferin, sodium salt | SynChem OHG, Germany | BC218 | CAS number: 103404-75-7 substrate for firefly-luciferase | ||||||||||||||||||||||||||||
| Fast Green FCF | Sigma Aldrich, USA | F7258-25G | CAS: 2353-45-9 | ||||||||||||||||||||||||||||
| D-Amphetamine | Sigma Aldrich, USA | A 5880 | CAS: 51-63-8 | ||||||||||||||||||||||||||||
| kodan Tinktur forte | Schülke Mayr GmbH, Germany | 104 005 | |||||||||||||||||||||||||||||
| Material / product | |||||||||||||||||||||||||||||||
| Glass capillaries | Sutter Instrument | Novato, California, USA | borosilicate glass O.D.:1 mm, I.D.: 0.78 mm | ||||||||||||||||||||||||||||
| Needle Pipette Puller | David Kopf Instruments | Tujunga, California, USA | |||||||||||||||||||||||||||||
| Tweezer electrode | Nepa Gene CO., LTD. | Shioyaki, Ichikawa, Chiba, Japan | 7 mm in diameter platinum disc electrodes (CUY650P7) | ||||||||||||||||||||||||||||
| Surgical Scissors - sharp | Fine Science Tools | Heidelberg, Germany | Straight, 12 cm (14002-12) | ||||||||||||||||||||||||||||
| Ring Forceps | Fine Science Tools | Heidelberg, Germany | 2.2 mm ID, 3 mm OD (11021-12) | ||||||||||||||||||||||||||||
| Square wave pulse electroporator (CUY21SC) | Nepa Gene CO., LTD. | Shioyaki, Ichikawa, Chiba, Japan | (CUY21SC) | ||||||||||||||||||||||||||||
| Vicryl surgical suture material | Ethicon | Norderstedt, Germany | 3-0; 2 Ph. Eur; | ||||||||||||||||||||||||||||
| Wound Clip Applicator | Fine Science Tools | Heidelberg, Germany | Reflex 9 mm (12032-09) | ||||||||||||||||||||||||||||
| Syringe filter | VWR | Darmstadt, Germany | 0.45 μm cellulose acetate | ||||||||||||||||||||||||||||
| IVIS Spectrum | Caliper Life Science / PerkinElmer | Waltham, MassachusettsUSA | |||||||||||||||||||||||||||||
| XGI-8 Gas Anesthesia System | PerkinElmer | Waltham, Massachuset tsUSA | |||||||||||||||||||||||||||||
| Open-field | Coulbourn Instruments | Allentown, USA | (40 x 40 x 39 cm) | ||||||||||||||||||||||||||||
| Tru Scan activity system | Coulbourn Instruments | Allentown, USA | |||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
Ссылки
- Saito, T., Nakatsuji, N. Efficient gene transfer into the embryonic mouse brain using in vivo electroporation. Developmental Biology. 240, 237-246 (2001).
- Fukuchi-Shimogori, T., Grove, E. A. Neocortex patterning by the secreted signaling molecule FGF8. Science. 294, 1071-1074 (2001).
- Walantus, W., Elias, L., Kriegstein, A. In Utero Intraventricular Injection and Electroporation of E16 Rat Embryos. J. Vis. Exp. (6), e236 (2007).
- Rice, H., Suth, S., Cavanaugh, W., Bai, J., Young-Pearse, T. L. In utero Electroporation followed by Primary Neuronal Culture for Studying Gene Function in Subset of Cortical Neurons. J. Vis. Exp. (44), e2103 (2010).
- Takahashi, M. Manipulating gene expressions by electroporation in the developing brain of mammalian embryos. Differentiation. 70, 155 (2002).
- Tabata, H., Nakajima, K. Efficient in utero gene transfer system to the developing mouse brain using electroporation: visualization of neuronal migration in the developing cortex. Neuroscience. 103, 865-872 (2001).
- Nakahira, E., Yuasa, S. Neuronal generation, migration, and differentiation in the mouse hippocampal primoridium as revealed by enhanced green fluorescent protein gene transfer by means of in utero electroporation. J Comp Neurol. 483, 329-340 (2005).
- Young-Pearse, T. L., et al. A critical function for beta-amyloid precursor protein in neuronal migration revealed by in utero RNA interference. The Journal of Neuroscience : the Official Journal of the Society for Neuroscience. 27, 14459-14469 (2007).
- Niwa, M., et al. Knockdown of DISC1 by in utero gene transfer disturbs postnatal dopaminergic maturation in the frontal cortex and leads to adult behavioral deficits. Neuron. 65, 480-489 (2010).
- Sapir, T., et al. Accurate balance of the polarity kinase MARK2/Par-1 is required for proper cortical neuronal migration. The Journal of Neuroscience : the Official Journal of the Society for Neuroscience. 28, 5710-5720 (2008).
- Weinberger, D. R. From neuropathology to neurodevelopment. Lancet. 346, 552-557 (1995).
- Murray, R. M., Lewis, S. W. Is schizophrenia a neurodevelopmental disorder?. British Medical Journal. 295, 681-682 (1987).
- Kamiya, A., et al. A schizophrenia-associated mutation of DISC1 perturbs cerebral cortex development. Nat Cell Biol. 7, 1167-1178 (2005).
- Miyoshi, K., et al. Disrupted-In-Schizophrenia 1, a candidate gene for schizophrenia, participates in neurite outgrowth. Mol Psychiatry. 8, 685-694 (2003).
- Mao, Y., et al. Disrupted in schizophrenia 1 regulates neuronal progenitor proliferation via modulation of GSK3beta/beta-catenin signaling. Cell. 136, 1017-1031 (2009).
- Millar, J. K., et al. Disruption of two novel genes by a translocation co-segregating with schizophrenia. Hum Mol Genet. 9, 1415-1423 (2000).
- Steinecke, A., Gampe, C., Valkova, C., Kaether, C., Bolz, J. Disrupted-in-Schizophrenia 1 (DISC1) is necessary for the correct migration of cortical interneurons. The Journal of Neuroscience : the Official Journal of the Society for Neuroscience. 32, 738-745 (2012).
- Niwa, M., et al. Knockdown of DISC1 by in utero gene transfer disturbs postnatal dopaminergic maturation in the frontal cortex and leads to adult behavioral deficits. Neuron. 65, 480-489 (2010).
- Taniguchi, Y., Young-Pearse, T., Sawa, A., Kamiya, A. In utero electroporation as a tool for genetic manipulation in vivo to study psychiatric disorders: from genes to circuits and behaviors. The Neuroscientist : a Review Journal Bringing Neurobiology, Neurology and Psychiatry 18. , 169-179 (2012).
- Bai, J., et al. RNAi reveals doublecortin is required for radial migration in rat neocortex. Nat Neurosci. 6, 1277-1283 (2003).
- Osumi, N., Inoue, T. Gene transfer into cultured mammalian embryos by electroporation. Methods. 24, 35-42 (2001).
- Momose, T., et al. Efficient targeting of gene expression in chick embryos by microelectroporation. Development, Growth & Differentiation. 41, 335-344 (1999).
- LoTurco, J., Manent, J. B., Sidiqi, F. New and improved tools for in utero electroporation studies of developing cerebral cortex. Cereb Cortex. 19, 120-125 (2009).
- Featherstone, R. E., Kapur, S., Fletcher, P. J. The amphetamine-induced sensitized state as a model of schizophrenia. Progress in Neuro-psychopharmacology & Biological Psychiatry. 31, 1556-1571 (2007).
- Pum, M., Carey, R. J., Huston, J. P., Muller, C. P. Dissociating effects of cocaine and d-amphetamine on dopamine and serotonin in the perirhinal, entorhinal, and prefrontal cortex of freely moving rats. Psychopharmacology. 193, 375-390 (2007).
- dal Maschio, M., et al. High-performance and site-directed in utero electroporation by a triple-electrode probe. Nature Communications. 3, 960 (2012).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены