Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
РНК предсказание вторичной Структура Использование высоких-пропускная способность SHAPE
В этой статье
Резюме
Высокая пропускная способность селективного 2 'гидроксильные ацилирование анализировали с помощью удлинения праймера (ФОРМА) используется новый химический зондирования технологии обратной транскрипции, капиллярный электрофорез и вторичных программное обеспечение предсказания структуры для определения структуры РНК от нескольких сотен до нескольких тысяч нуклеотидов в единичных нуклеотидных разрешение.
Аннотация
Понимании функции РНК, участвующих в биологических процессах требует тщательной знания в области конструкций РНК. К этому концу, методология дублированный "гидроксил ацилирование высокой пропускной способностью селективными 2 'анализировали с помощью удлинения праймера», либо SHAPE, позволяет предсказание из РНК вторичной структурой с единичные нуклеотидные разрешение. Этот подход использует химические зондирования агенты, которые предпочтительно ацилирования одноцепочечной или гибких участков РНК в водном растворе. Сайты из химическую модификацию обнаруживаются путем обратной транскрипции из модифицированному РНК, и продукты из этой реакции являются фракционировали с помощью автоматизированный капиллярный электрофорез (СЕ). Так как обратной транскриптазы паузами по крайней такие нуклеотиды, РНК модифицированный по SHAPE реагенты, результирующие кДНК-библиотеку косвенно отображает тех, рибонуклеотиды, которые имеют одно на мель в контекст из сложенной РНК. Используя ShapeFinder программное обеспечение, то электрофореграммы произведенный по автоматизированный CE, обрабатываются и преобразуется в нюcleotide таблицам реактивностью, которые сами являются преобразованы в псевдо-с ограничениями энергопотребления,, используемый в RNAStructure (v5.3) Prediction алгоритму. Двумерной РНК структурах, получаемых соединением SHAPE зондирования в кремнии РНК предсказание вторичной структуры были найдены гораздо более точным, чем структуры, полученные с помощью этих методов в одиночку.
Введение
Для того чтобы понять функций каталитических и некодирующие РНК участвует в регуляции сплайсинга, трансляции, репликация вирусом и рак, подробные знания в области конструкций РНК требуется 1,2. К сожалению, точного предсказания укладки РНК представляет собой грозным вызов. Классическая зондирования агенты страдают от многих недостатков, таких как токсичность, неполные нуклеотидные покрытия и / или пропускной способности ограничиваясь 100-150 нуклеотидов в эксперименте. Невооруженным вторичные алгоритмы предсказания структуры являются Точно так же невыгодные, вследствие неточностями в результате их неспособность эффективно отличить среди энергетически аналогичных структур. Большие RNAs в частности, являются также часто рефрактерны к методы из 3D-решимость структуру, такие как рентгеновской кристаллографии и ядерном магнитном резонанса (ЯМР) спектроскопия, в связи с их конформационные гибкость и больших количествах из высоко чистых образцов требуются для этих методов.
HIGH-пропускная способность SHAPE решает многих из этих проблем путем предоставления эффективным, простым подход к зондировании структурах больших RNAs при напряжениях с одной нуклеотидными резолюцию. Более того, реагенты, используемые для SHAPE являются безопасными, просты в обращении и, в отличие от большинство других химический зондирование реактивов, вступают в реакцию с все четыре рибонуклеотиды. Эти реагенты также могут проникать клеточных мембран, что делает его возможный того чтобы зондировать RNAs в их в естественных условиях контекст (ы) 3. Первоначально разработанная в Недель лаборатория 4, SHAPE была использована, чтобы анализировать широкий разнообразие из RNAs, наиболее заметными из пример, являющийся определение полной вторичной структуре ~ 9 кб РНК ВИЧ-1 геном 5. Другие заметных достижений использованием SHAPE включают в себя выяснение структур инфекционных вироиды +6, человеческие длинных некодирующие РНК 7, дрожжи рибосомах +8, и riboswitches 9, а также для идентификации сайтов связывания белков в вирионом-ВИЧ, связанной с-1 РНК +3. БелыйИль оригинальные и высокой пропускной способностью вариациями из SHAPE протокол были опубликованы в другом месте 10-12, настоящее работа обеспечивает подробное описание из РНК вторичный решимость структуру путем высокой пропускной способностью SHAPE с использованием флуоресцентных олигонуклеотиды,, то компании Beckman Coulter CEQ 8 000 Genetic Analyzer, и SHAPEfinder и RNAStructure (v5.3) программное обеспечение. Ранее не публиковавшиеся технические детали и рекомендации по устранению неполадок, также включены.
Вариации из SHAPE
Суть SHAPE и его вариациях является воздействие из РНК в водном растворе до электрофильные ангидриды, который селективно ацилировать 2'-гидроксильных (2'-OH) рибозу групп, производя громоздкий аддуктов в то сайтах из модификации. Эта химическая реакция служит средством из опрашивая местных РНК структурную динамику,, как одноцепочечными нуклеотиды являются более склонными к принять конформациях способствующей электрофильной атаке этими реагентами, в то время базой парными или архитектурно Constrained нуклеотиды являются менее или нереакционноспособной +10. Сайты из образование аддукта обнаруживаются путем обратной транскрипции инициировании от флуоресцентно или радиоактивно меченные праймеры, гибридизуют со специфической сайт базирующейся на модифицированных РНК (далее «(+)" удлинения праймера реакция). Когда обратной транскриптазы (RT) не пересекают ацилированных рибонуклеотидов, пула кДНК товарной продукции, длины которых совпадают с участками модификации. Контролем ", (-)" праймер реакции удлинения использующий РНК, которая не была подвергается, чтобы реагент также выполняется так что, что преждевременная прекращение из синтез ДНК (то есть "остановками») за счет РНК структура, неспецифические прядь РНК поломки, и т.д,, может. следует отличать от ПРИОСТАНОВКА произведенный путем химической модификации. И, наконец, два дидезокси-секвенирование реакциями инициировании от теми же самыми праймерами которые используются в качестве маркеры, чтобы коррелировать реактивный нуклеотиды с РНК первичный последовательность, следующую-электрофореза.
В оригинальной применении SHAPE, то же самое 32 Р-конец-меченый праймер используется для (+), (-), и двух реакциях секвенирования. Продукты из этих реакций которые загружаются в смежный скважин в 5-8% гель сляб полиакриламид, и фракционируют помощью электрофореза в денатурирующем электрофорез в полиакриламидном геле (СТРАНИЦЕ; Рисунок 1). Количественный анализ гель изображений производится обычными SHAPE можете быть выполнены с использованием SAFA, полу-автоматизированный футпринтинга программное обеспечение для анализа 13.
В противоположность этому, высокой пропускной способностью SHAPE использует флуоресцентно меченных праймерами и автоматизированных капиллярный электрофорез. В частности, для каждого региона из РНК под следствием, собой набор из четырех ДНК праймеров, имеющих, общих последовательностях значений, но различными 5 'флуоресцентный наклейки должны храниться на быть синтезированы с или приобрели. Эти по-разному-меченых олигонуклеотидов служить к простым две SHAPE реакциям и две секвенирование реакциями, продукты, из, которые объединяли и фракционированный / обнаруженный по автоматизированный капиллярный электрофорез (СЕ). WherEAS реактивность профиля 100-150 нуклеотидов РНК могут быть получены из набора из четырех реакций с использованием оригинального подхода с высокой пропускной SHAPE дает разрешение 300-600 нуклеотидов от одного объединенного образца 3. До 8 наборов реакций может быть фракционированный одновременно, а целых 96 образцов может подготовлены для фракционирования в течение 12 последовательных пробегов CE (рис. 2). Кроме того, SHAPEfinder программное обеспечение, разработанное для обработки и анализа данных выходящих из CEQ и другие генетические анализаторы, более автоматизирована и требуют гораздо меньше вмешательства пользователя, чем SAFA 13 или другой гель-анализа пакетов.
Более продвинутые высокой пропускной методологии в последнее время появились такие, как Парс (параллельный анализ структуры РНК) 14 и Frag-Seq (фрагмент секвенирования) 15, которые используют структуру специфических ферментов, а не алкилирования реагентов в сочетании с следующего поколения секвенирования для получения ИНФОРМАЦИЯн о структуре РНК. Несмотря на привлекательность этих методов, многих ограничений, присущих нуклеазу зондирования по-прежнему остаются 16. Эти проблемы можно избежать в виде последовательности (SHAPE-Seq) 17 протокол, где следующий последовательности поколения предшествует химической модификации и обратной транскрипции РНК в манере, подобной той, что выполняется в обычной форме. Хотя эти методы могут представлять будущее определение структуры РНК, важно помнить, что в следующем последовательности поколения стоит очень дорого, и остается недоступным для многих лабораторий.
Анализ данных фигуры
Данные, полученные в генетическом анализаторе представлен в виде electropherogram, в котором интенсивность флуоресценции образца (ов), протекающей через капилляр детектор представлено в зависимости от индекса миграции времени. Этот участок имеет форму перекрытие следов, соответствующих четырем флуоресценции каналсек использоваться для обнаружения различных флуорофоров, и где каждый след состоит из пиков, соответствующих отдельным кДНК или секвенирования продуктов. Electropherogram данные экспортируются из генетического анализатора как табуляцией текстовый файл и импортировать в преобразовании ShapeFinder и анализ программного обеспечения 18.
ShapeFinder первоначально использоваться для выполнения ряда математических преобразований данных, чтобы гарантировать, что миграция раз и пиковых объемов точно отражают идентичность и количество продуктов реакции соответственно. Пики затем выровнены и объединены, а результаты представлены вместе с первичной последовательности РНК. "Реактивность профилем" для соответствующих сегментов РНК получают вычитанием контрольных значений от (+) значений, связанных с каждым РНК нуклеотидных и нормализации данных, как описано ниже. Этот профиль будет импортирован в RNAstructure (V5.3) программного обеспечения 19,20, который преобразует нормированное Вал реактивностьЕЭС в псевдо-энергии ограничения, которые включены в РНК вторичный алгоритм складной конструкции. Объединение химической зондирования и складывания алгоритмы таким образом значительно повышает точность предсказания структуры по сравнению с любым методом только 12,21. Выход RNAstructure (v5.3) включает в себя изображения наименьшей энергии вторичных структур РНК цветом с профилем SHAPE реактивность (ы), а также те же структуры в текстовой дот-скобок. Последнее может впоследствии быть экспортированы в программное обеспечение, предназначенное для графического отображения вторичной структуры РНК, таких как Варна 22 и PseudoViewer 23.

Рисунок 1. Блок-схема РНК определение структуры через SHAPE 4,10. (А) РНК мAY быть получены из биологических образцов или в пробирке транскрипции. (В) в зависимости от источника, РНК сложить или иначе обработаны и модифицированные SHAPE реагента. (C) Обратная транскрипция использованием флуоресцентно или радиоактивно меченных праймеров. (D) кДНК-продукты фракционированного либо через капиллярную или плиты на основе геля электрофореза. (E) Фрагмент анализа. (F) РНК предсказания структуры. Нажмите здесь, чтобы увеличить рисунок.
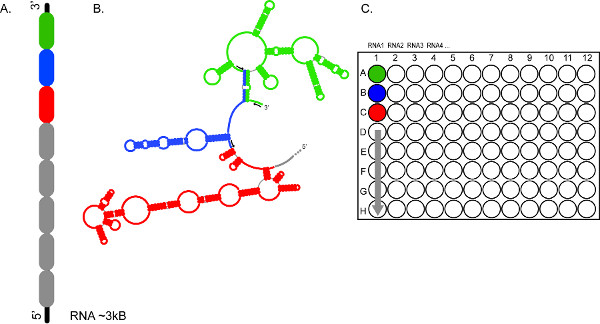
Рисунок 2. Высокой пропускной характер CE на основе форма обеспечивает быстрый анализ нескольких РНК и / или несколько сегментов одного и того же РНК. (A) представляет, как РНК может быть разделена на 300-600 разделов NT (с цветовым кодом в зеленый, синий и красный) (B) Разделы РНК опрашиваются независимо с использованием различных наборов флуоресцентных праймеров (черные стрелки) (C) Наборы реакций, объединяли и загружали в лунки A1, B1, C1, и т.д., соответственно, что обеспечивает полный охват ~ 3 т.п.н. RNA1. Продуктов реакции из РНК 2, 3, 4 и т.д., могут получить аналогичным образом, для фракционирования в последовательных электрофоретических работает. Нажмите здесь, чтобы увеличить рисунок.
протокол
Дизайн Primer и расширение концом РНК 3 '
Для анализа длинных РНК на высокой пропускной SHAPE, ряд участков гибридизации праймера должна быть выбрана таким образом, что они (я) отделены друг от ~ 300 нт, (II) 20-30 нуклеотидов в длину, и (III), что РНК / ДНК гибридов путем отжига ДНК, чтобы эти сайты имеют ожидаемую температуру плавления> 50 ° C. Кроме того, сегменты РНК, которые прогнозируются быть хорошо структурированы следует избегать, хотя делает такое определение требует некоторого предвидения структуры РНК, которая часто недоступна. ДНК гибридизации праймеров, которые на эти сайты должны быть разработаны, заботясь, чтобы гарантировать, что они не должны будут образовывать устойчивые димеры или внутрицепочечные вторичных структур.
Как только разработан, наборов праймеров должны быть либо приобрели (например, от комплексной ДНК технологии, Эймс, штат Айова) или синтезированные 24,25. Праймеры 5'-меченного Cy5, Cy5.5,WellRedD2 (Beckman Coulter) и IRDye800 (Lycor) / WellRedD1 (Beckman Coulter) лучше всего подходят для Beckman Coulter 8000 CEQ, обеспечивая хороший интенсивности сигнала при минимизации перекрестных помех. Меченые олигонуклеотиды могут храниться бесконечно в небольших, 10 мкМ аликвотах при -20 ° С; избежать повторных циклов замораживания / оттаивания.
С использованием праймеров, сконструированных таким образом, можно получить данные о форме практически всю РНК любой длины. Однако последовательность на или вблизи 3'-конца РНК всегда является недоступным для формы, если РНК не сконструирован так, чтобы содержать 3'-концевое удлинение (например, "структура кассета"), к которой праймер может быть гибридизовали 4.
Получение РНК через капиллярного электрофореза
Хотя РНК из биологических образцов может быть использован для высокой пропускной SHAPE, протокол приведенные здесь оптимизирован для РНК производится в пробирке транскрипции. Коммерческая траnscription наборов, таких как MegaShortScript (Ambion) используется в сочетании с MegaClear очистки РНК столбцов (Ambion) хорошо подходят для генерации больших объемов чистого РНК. РНК должны храниться в буфере ТЕ между -20 ° C и -80 ° C. Для достижения наилучших результатов, РНК должна появиться однородная обеими денатурирующих и неденатурирующем гель-электрофореза.
1. Укладки РНК
- В 0,5 мл микроцентрифужных трубки, развести 12 пмоль РНК до 18 мкл с водой и добавить 2 мкл 10X буфера ренатурацию. Хорошо перемешать.
- Нагреть до 85 ° C в течение 1 мин, затем охлаждают до 4 ° С со скоростью 0,1 ° С / сек.
- Добавить 100 мкл воды и 30 мкл 5X складной буфера.
- Инкубируют при 37 ° С в течение 30-60 мин, в зависимости от РНК складывания. В общем, Mg 2 +-зависимых складывания дольше, и более структурированный РНК, требуют более длительного времени инкубации.
- Передача 72 мкл аликвоты в каждую из двух пробирок 0,5 мл микроцентрифужных: модификацийЭд (+) и управления (-).
2. Химическая модификация РНК
Хорошо охарактеризованы, электрофильных реагентов SHAPE включать изатового ангидрида (IA), N-methylisatoic ангидрид (NMIA), 1-метил-7-нитро-изатового ангидрида (1M7) 26 и бензоил цианид (BzCN) 27. Из них наиболее часто используемых для высокой пропускной SHAPE являются 1M7 и NMIA, и только последний является коммерчески доступным (Life Technologies). Конечная концентрация модифицирующего реагента должна быть оптимизирована для каждого РНК, чтобы получить "одноударные" модификация кинетики, то есть состояние, в котором большинство РНК в растворе изменяются один раз в области РНК анализируемого 11. Это оптимальная концентрация может быть определена путем выполнения нескольких реакций, в которых концентрация реагента изменяется во всем диапазоне (ов), указанных в таблице в разделе 2.1 ниже. Использование концентрации реагента, который производит легко обнаружить сигнал при минimizing разница в интенсивности сигнала между длинными и короткими синтез ДНК продукты (например, рисунок 3).
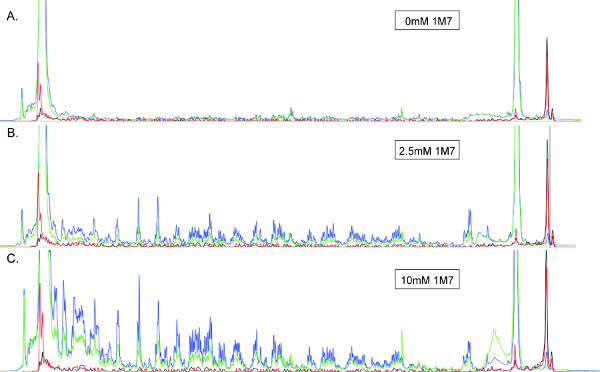
Рисунок 3. SHAPE электрофореграммы получены из ~ 360 нт РНК обрабатывали (A) 0 (B), 2,5 мМ или (С) 10 мМ 1M7. Все электрофореграммы отображаются в том же масштабе. Синий, зеленый, красный и черный следы соответствует (+) продуктов реакции (Cy5), (-) продуктов реакции (Cy5.5) и две последовательности лестницы (WellRed D2 и IRDye800) соответственно. РНК используют для получения изображения (B) была обработана с оптимальным количеством 1M7, демонстрируя хорошее разрешение пиков и интенсивности, с минимальным спада сигнала в течение следа (слева). Читайте длина максимальна в этих условиях. В отличие от этого, отсутствие среднего десятичногоensity, хорошо разрешенных пиков в () предполагает, суб-оптимальную концентрацию 1M7. С другой стороны, затухание сигнала очевидны в (С) указывает, что один кинетика удара не наблюдается, и РНК составляет более модифицированных. В таких случаях, особенно при комнатной температуре не ожидается, столкнутся с 5'-конца РНК-матрицы, читайте длина будет оптимальной.
- Подготовьте 10X запас SHAPE реагента (NMIA или 1M7). Это лучше всего достигается за счет добавления небольшого количества реагента 1,5 трубки микроцентрифужных мл, затем добавлением ДМСО, чтобы получить желаемую концентрацию. Внимание: решения SHAPE реагент должен оставаться безводный, пока не смешивается с РНК. Магазин ДМСО в сушильном шкафу при комнатной температуре, а также подготовить растворы непосредственно перед использованием, чтобы свести к минимуму воздействие на окружающую водяного пара.
Реагент Оптимальная 10-кратной концентрации (в ДМСО) Времяполной деградации реагент 27 NMIA 10-100 мМ ~ 20 мин 1M7 10-50 мм 70 сек
Таблице 1. Электрофильные реагенты, используемые для РНК модификации. - Добавить 8 мкл 10X NMIA/1M7 или безводный ДМСО модифицированных (+) и контрольной (-) смесей, соответственно. Примечание: 2,5 мМ оказалась эффективной исходной концентрации для NMIA и 1M7, независимо от РНК анализируется.
- Инкубировать при 37 ° С в течение 50 мин (NMIA) или 5 мин (1M7), соответственно.
- Осадок РНК путем добавления 8 мкл (0,1 объема) 3 М ацетата натрия (рН 5,2), 8 мкл 100 мМ ЭДТА, 240 мкл (3 объема) холодного этанола и 1 мкл 10 мг / мл гликогена. Поставить в холодильник на 2 часа, а затем центрифуге при 14 000 мкг в течение 30 мин при 4 ° C. Промыть гранулы дважды холодным 70%-ным этанолом. Внимание: Важноминимизировать холодильной время центрифугирования времени и скорости, чтобы минимизировать совместным осаждением соли, так как это может отрицательно повлиять на разрешение пиков при электрофорезе.
- Удалить супернатант микропипеткой, и воздух сухой осадок в течение 5 мин при комнатной температуре.
- Растворить осажденный РНК в 10 мкл ТЕ-буфера и инкубируют 5 мин при комнатной температуре. Этого достаточно растворенного РНК в течение двух обратных реакций транскрипции. Храните неиспользованную часть при температуре -20 ° C. Внимание: Механические ресуспендирование гранулы, как правило, не нужно, и это может повредить РНК.
3. Обратная транскрипция
Этот шаг генерирует флуоресцентно меченного кДНК-продуктов, которые используются, чтобы косвенно определить степень, в которой нуклеотиды РНК были изменены SHAPE реагента. Для формы, выполнение Superscript III (Invitrogen) RT превосходил всех других РЦ протестированы и представляет собой фермент, выбранный для использования с этимпротокола. Олигонуклеотиды, меченные Cy5 и Cy5.5 используются для простого (+) и (-) реакций соответственно. Для более коротких РНК праймеры гибридизуют с 3'-концевое удлинение родного РНК (например, "структура кассета»), чтобы получить информацию о 3'-конца 4. Внимание: С этой точки через CE, образцы должны быть защищены от свет.
- Подготовить (+) и (-) образцы для обратной транскрипции в 0,5 мл пробирок микроцентрифужную. Для (+) реакции RT, смешайте 5 мкл модифицированной РНК (+), 6 мкл воды и 1 мкл Cy5-меченый праймер (10 мкМ), для (-) реакции RT, смешайте 5 мкл управления РНК (-), . 6 мкл воды и 1 мкл Cy5-меченый праймер (10 мкМ) Внимание: Зарштедт ПЦР пробирок (REF 72.735.002) рекомендуются для этого приложения.
- Место труб в термоциклере и отжига праймеров к РНК и подготовить для обратной транскрипции с использованием следующих программ: 85 ° С, 1 мин, 60 ° С, 5 мин;35 ° C, 5 мин, 50 ° C, держите.
- Во время отжига, подготовить достаточно 2.5X RT смесь для ряда реакций должна быть выполнена, плюс 50% (например, в течение двух (+) и две (-) реакции, масштаб 4,5 раза). Один реакция требует 8 мкл, следующим образом: 4 мкл 5х буфера РТ, 1 мкл 100 мМ ДТТ, 1,5 мкл воды, 1 мкл 10 мМ дНТФ, 0,5 мкл Надстрочный III комнатной температуры. Держать на льду. Внимание: 5X буфера РТ и 100 мм DTT снабжены индексом III RT.
- Когда температура отжига смеси достигнет 50 ° С, добавить 8 мкл смеси 2.5X RT в (+) и (-) реакции Рекомендация. Теплый смесь комнатной до 37 ° С в течение 5 минут перед добавлением к реакции .
- Инкубируют в течение 50 мин при 50 ° С, затем охлаждают до 4 ° С и / или место на льду. Примечание: Инкубация реакции RT в течение более 50 мин, может привести к аберрантной кДНК-продуктов.
- Гидролиза РНК добавлением 1 мкл 4 М NaOH и нагреванием до 95 ° C в течение 3 мин. Холодный реакции на льду и затем нейтрализовать их добавлением 2 мкл 2 М HCl. Внимание: Отсутствие этого шага приводит к плохой качество сепарации кДНК-продуктов.
- Объединение (+) и (-) реакции и осаждение кДНК путем добавления 0,1 объем 3 М ацетата натри, 0,1 объем 100 мМ ЭДТА, 1,5 об холодного этанола и 1 мкл 10 мг / мл гликогена. Поставить в холодильник на 2 часа, затем центрифуге при 14 000 мкг в течение 30 мин при 4 ° C. Промыть гранулы дважды холодным 70%-ным этанолом. Внимание: центрифугирование при более высоких скоростях или в течение длительного периода приводит к трудности ресуспендирования осадка (ов).
- Ресуспендируют гранулированный кДНК в 40 мкл деионизированной формамиде при нагревании до 65 ° С в течение 10 мин с последующим энергичным встряхиванием в течение более 30 мин. Внимание: Гранулы могут быть невидимы. Отсутствие сигнала или слабый электрофореза следующим сигнал может быть результатом неспособности адекватно растворить осадок на данном этапе.
Секвенирование лестницы служить в качестве маркеров для определения положения нуклеотида в процессе обработки данных. Эти генерируются с использованием цикла USB Sequencing Kit (# 78500), ДНК, имеющую ту же последовательность, что и РНК изучается, и праймеры, меченные WellRed D2 или D1/Lycor 800. Как правило, ДНК, используемый в этой реакции будет то, что используемый в качестве транскрипционного шаблон для РНК, о котором идет речь. Хотя реакция протокол, представленные здесь, близко напоминает рекомендованных производителем набора, реакцию расширены в несколько раз. В то время как ддА и ДДТ используются в качестве терминаторов цепи в реакциях, описанных ниже, любой пары терминаторы могут быть использованы для генерации последовательности лестниц.
- Смешать 40 мкл смеси прекращение ДВР, 5 пмоль ДНК-матрицы, 4,6 мкл 10х буфера секвеназа 10 мкл WellRed D2 меченого праймера, 4,6 мкл секвеназа и воду, чтобы довести общий объем до 82 мкл. Добавить секвеназа последним. Prepaповторно второй реакции секвенирования таким же образом, с использованием ДДТ и Licor IR800 меченый праймер вместо.
- Перейдите к ПЦР-амплификации с использованием USB рекомендуемых условий. Внимание: добавление минерального масла не требуется и не рекомендуется для протоколов / термоциклерами которые используют нагреваемой крышкой.
- Объедините ддА и ДДТ реакции секвенирования в один 1,5 мл пробирке (~ 164 мкл общего объема).
- Осадок ДНК следующим образом: Добавить 16 мкл 3 М ацетата натрия (рН 5,2), 16 мкл 100 мМ ЭДТА, 1 мкл 10 мг / мл гликогена, и 480 мкл 95% этанола. Смешать, инкубировать при температуре 4 ° С в течение 30 мин и центрифугируют при 14000 х г в течение 30 мин при 4 ° С.
- Ресуспендируют гранулированный ДНК в 100 мкл деионизированной формамиде при нагревании до 65 ° С в течение 10 мин с последующим энергичным встряхиванием в течение 30 мин.
5. Фракционирование продуктов реакции методом капиллярного электрофореза
Капиллярный электрофорез позволяет одновременноРазделение продуктов кДНК синтеза из четырех реакций объединены в одном образце. Восемь образцов может быть фракционирован одновременно, а целых 96 образцов может быть фракционирован в течение одного хода (фиг. 2).
- Смешать 40 мкл объединенных образцов SHAPE с 10 мкл объединенного лестницы последовательности, и передача 96-луночных планшетах образца. Внимание: Очень важно, чтобы Beckman Coulter реагентов и пластин (в том числе LPA-я гель, рабочий буфер, минеральное масло, образец загрузка раствора и образец и буфер пластины) использовать с Beckman-Coulter CEQ 8000 Genetic Analyzer.
- Программы и подготовить капиллярного электрофореза инструмент и начать работать в соответствии с инструкциями производителя. Примечание: Для лучшего разрешения образцы, использовать ранее опубликованные параметры CAFA метода 28.
В идеале, вне грунтовки и сильные остановки пиков сигналов для каждого пика во всех четырех electropherogram трасы должны быть в линейном диапазоне; постепенным высадки в сигнал является приемлемым. Иногда, однако, большие пики (остановки) очевидны даже с контрольной реакции, и они могут мешать последующей обработки данных. Усеченный кДНК, которые вызывают эти пики могут быть результатом естественной препятствие в процессе обратной транскрипции (например вторичной структуры РНК) или деградации РНК. В первом случае, добавки, такие как бетаин может улучшить RT процессивность и уменьшить RT приостановка / досрочного прекращения.
Обработка данных
ShapeFinder программное обеспечение позволяет пользователю просматривать и преобразовывать CE следы и конвертировать их в форму реактивности профилей 18. После реактивности значения приведены в таблице, они нормализуются и импортировать в RNAStructure (v5.3), чтобы создать и совершенствовать вторичных структурных моделей.
6. ShapeFinder Software
Расширение BaseFinder следов обработки PlatФорма 29, опубликованную версию ShapeFinder находится в свободном доступе для некоммерческого использования 18. Подробные инструкции по обработке данных в ShapeFinder снабжены документацией по программному обеспечению.
- Электрофореграммы импортируются из CEQ в ShapeFinder, где они корректируются для коррекции (I) флуоресцентный фон, (II) спектрального перекрытия между флуоресцентными каналами, (III) мобильность сдвиги предоставленная иначе отмеченных грунтов, (IV) различия в цветении интенсивности общие продукты, маркированные разными флуорофорами и (V) затухание сигнала в результате досрочного прекращения обратной транскрипции.
- "Настройка" функция "Выравнивание и интегрировать" инструментом в ShapeFinder автоматически назначает тождества отдельных пиков и коррелирует это последовательность РНК, как это определено пользовательского ввода и две лестницы секвенирования. Хотя первоначальные задания, как правило, несовершенны, ошибки могут быть исправлены вручную с помощью "Изменить" функциютот же инструмент. Наконец, "Fit" функция вычисляет площади под выровненные (+) и (-) реакции пики, и заносим в таблицу эти реактивности значения вместе с соответствующими номерами нуклеотидов в табуляцией текстовый файл.
Примечание: Анализ данных является критическим для точности формы и некоторые соображения очень важны во время этого анализа, в том числе:
- Отношение сигнал-шум: отношение сигнал-шум должен быть таким, чтобы отдельные пики должны быть легко идентифицировать даже для позиций с низкой реакционной способностью. Хотя ShapeFinder предоставляет опцию сглаживания данных; эту альтернативу следует использовать крайне осторожно, так как он может исказить последующего анализа.
- Область анализ: как правило, надежные данные могут быть получены из кДНК 300-600 нуклеотидов, начиная области 40-80 нуклеотидов удалены из праймера 3'-конца и кончая как сигнал затухает до уровней трудно отличить от фонового шума. Использование многокорпусныхPLE наборы грунтовки необходимо будет проанализировать более длинных отрезках РНК. В этом случае рекомендуется, чтобы перекрытие в надежных сигнала между наборов праймеров находится в диапазоне 30-50 нуклеотидов. На более коротких РНК, где обратная транскриптаза часто достигает конца РНК-матрицы, необходимо соблюдать осторожность, чтобы исключить тех пиков, отношение сигнал-шум зависит от синтеза ДНК сильный остановки.
- Сигнал распада: затухание сигнала связан степень РНК модификации в ходе эксперимента, а также несовершенный процессивности РТ. В идеале, одноударные кинетика относительно области РНК анализируемого должно быть достигнуто с целью максимизации длины чтения. Shapefinder содержится инструмент, который является эффективным в коррекции затухания сигнала, однако, потому что это, как правило внесения ошибки в анализе - особенно, когда одна кинетики хитом не наблюдается, то лучше использовать, когда затухание сигнала минимальна (то есть, когда распределение пиков согласуется с одного удара коровтики). Недавно улучшенные алгоритмы для преобразования спада сигнала сигнала были опубликованы 30 и должны быть исследованы, если затухание сигнала вызывает особую озабоченность в конкретном эксперименте.
- Масштабирование сигнала. Вероятно, наиболее произвольным шагом в обработке SHAPE данных, управляющая профиль должен быть масштабированы так, что пик интенсивности между минимально реактивный (+) и (-) следы равны. Масштабирование управления след слишком большой степени приведет обилие отрицательных значений реактивности в первый квартиль (см. Нормализация данных ниже). В этом случае коэффициент масштаба должны быть снижены соответственно и данные реинтеграции.
- Пики назначение. В общем, автоматизированный вариант пик назначение работает хорошо. Когда процесс выходит из строя, однако, важно, чтобы пользователь гарантировать, что все пики были признаны программного обеспечения, в частности, когда отношение сигнал-шум является низким. Плечо пиков, например, не всегда обнаружена, и G-богатые себепоследствия часто сжаты.
7. Нормализация данных
Чтобы включить нуклеотидных профилей реактивности во вторичную структуру алгоритма используются RNAStructure (V5.3) программного обеспечения и / или для сравнения профилей тесно связанных РНК, формы данные должны быть нормализованы на стандартные 12. Это включает в себя (я), за исключением выбросов из последующих вычислений, (II) определение "эффективное максимум" реактивности (например, среднее из самых высоких 8% реактивность стоимости, исключая выбросы) и (III) нормализации путем деления все реактивность значений «эффективный максимум", а именно:
- Откройте табуляцией текстовый файл, созданный после выравнивания и интеграции и скопировать его содержимое в таблицу Excel. Правой колонке этого файла (RX.area-BG.area) содержит расчетные абсолютные SHAPE реактивности значения для каждого нуклеотида РНК. Крайняя левая колонках, касаются этой реактивности к РНК SEQUENCE.
- Вычислить и сохранить первый и третий квартиль (то есть, 25-й и 75-й процентили) значения (RX.area-BG.area) с помощью функции Excel "= КВАРТИЛЬ (Array, кварта)"
- Вычислить и сохранить межквартильный разница "= КВАРТИЛЬ (Array, 3)-КВАРТИЛЬ (Array, 1)"
- Вычислить и сохранить "выброс пороговое значение" по формуле "= (КВАРТИЛЬ, массив, 3) 1,5 * ((КВАРТИЛЬ (Array, 3)-КВАРТИЛЬ (массив, 1))". Все реактивности значения больше этого значения должны быть исключены из последующих расчетах.
- Копирование реактивность значения из (RX.area-BG.area) и вставить их в соседнюю, пустой столбец, а затем отсортировать эти значения, такие, что наибольшее находятся в верхней части колонны.
- Во вновь созданном "отсортированного столбца значений", удалять значения больше, чем значение отсечки выброс.
- Рассчитать и сохранить средний наибольший 8% реактивность величины оставшегося в "отсортированных значений ColuМН ". Это значение является" эффективное максимум "реактивности.
- Разделите несортированный (RX.area-BG.area) каждого нуклеотида (включая выбросы) на "эффективную максимум" реактивности значение для получения "нормированные значения реактивности". Хранить их в пустой столбец, в результате чего пустой колонке слева. Затем скопировать с номерами нуклеотидов в левой части таблицы и вставить их в пустой столбец непосредственно слева от "нормированных значений реактивность".
- Скопируйте и вставьте положение нуклеотида нормированные пар реактивности значение в текстовом редакторе.
- Ликвидация значениях ниже -0,09 (то есть, оставьте пустым пространствам), а они, вероятно, результатом RT Пауза во время синтеза кДНК по иным причинам, чем химическую модификацию шаблона. Кроме того, любая реактивность значения для нуклеотидов, при котором сильная пауза наблюдается на немодифицированных шаблона (определяется визуальным осмотром "Выравнивание и интегрировать" Профиль ShapeFinder), должны быть исключены.
- Saве файл с расширением. формы расширения для использования в структурном анализе с RNAstructure (V5.3) программного обеспечения.
8. Моделирование данных
RNAstructure (v5.3) программное обеспечение используется для предсказания экспериментально поддерживается вторичной структуры РНК (ы) с помощью псевдо-свободная энергия ограничения, полученные из анализа формы 19. Программное обеспечение обеспечивает графическое представление наименьшей энергии 2D структур РНК, а также текстовое представление этих структур в дот-скобок. Последние могут быть импортированы в зрителя РНК структура предпочтений пользователя, например Pseudoviewer 23 или Варна 22, чтобы произвести публикацию качественного изображения.
Примечание: Необходимо соблюдать осторожность при рассмотрении структуры производства RNAstructure (V5.3) программного обеспечения. Например, программное обеспечение не может разрешить третичных взаимодействий, таких как псевдоузлов и целовать петли, и не может отличить ли отсутствиереакционной способности в определенной области обусловлено спаривание оснований или стерических защиты связанных белков. Как следствие, эти факторы, наряду с энергией сообщается на отдельные структуры, должны учитываться при представлении окончательного структурной модели.
Результаты
РНК, содержащей ВИЧ-1 об ответ элемент (RRE) и 3'-концевую структуру кассеты 4 получали из линеаризованные плазмиды в пробирке транскрипции, после чего она была сложена путем нагревания, охлаждения и инкубации при 37 ° С в присутствии из MgCl 2. РНК подвергали NMIA а затем обрат?...
Обсуждение
Мы приведем здесь подробный протокол для высокопроизводительного форма, метод, который позволяет вторичное определение структуры однонуклеотидным разрешение для РНК любого размера. Кроме того, муфта экспериментальных данных SHAPE со средним алгоритмов предсказания структуры облегча?...
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
С. Lusvarghi, J. Sztuba-Solinska, KJ Purzycka, JW Рауш и SFJ Le Грайс поддерживаются Внутренние программы исследований Национального института рака, Национального института здоровья, США.
Материалы
| Name | Company | Catalog Number | Comments |
| REAGENTS | |||
| N-methylisatoic anhydride (NMIA) | Life technologies | M25 | Dissolve in anhydrous DMSO |
| 1-methyl-t-nitroisatoic anhydride (1M7) | see ref. 22 | ||
| Superscript III Reverse Transcriptase | Life technologies | 18080044 | 10,000 units |
| Thermo sequenase cycle sequencing kit | Affymetrix | 78500 | |
| Materials provided by the user | |||
| RNA of interest | 6 pmol per reaction (the limit of detection will be determined by the instrument) | ||
| Sets of four 5' labeled primers (Cy5, Cy5.5, WellRed D2 and WellRed D1/Licor IR800) | Primers are complementary to the RNA and are used in reverse transcription and sequencing reactions. The listed fluorophores are optimal for the Beckman Coulter 8000 CEQ. Primers may be purchased or synthesized in house. | ||
| DNA template | DNA is used for sequencing reactions, and must contain the sequence of the RNA being studied - including any 3'terminal extension, if present. Where applicable, it is often convenient to use the RNA transcription template. | ||
| Buffers | |||
| 10x RNA renaturation buffer | 100 mM Tris-HCl pH 8.0, 1 M KCl, 1 mM EDTA | ||
| 5X RNA folding buffer | 200 mM Tris-HCl pH 8.0, 25 mM MgCl2, 2.5 mM EDTA, 650 mM KCl. (This buffer might be changed depending on the case (e.g. pH, EDTA, Mg, RNase inhibitor) | ||
| 2.5X RT mix | 4 μl 5X buffer, 1 μl 100 mM DTT, 1.5 μl water,1 μl 10 mM dNTPs, 0.5 μl SuperScript III. Note that the 5X buffer and 100 mM DTT are provided with purchase of SuperScript III (Invitrogen). | ||
| GenomeLab Sample Loading Solution (Beckman Coulter) | Attention: Avoid multiple freeze-thaw cycles | ||
| EQUIPMENT | |||
| Capillary electrophoresis | Beckman | CEQ8000 | |
| Thermocycler | varies | ||
Ссылки
- Scott, W. G., Martick, M., Chi, Y. I. Structure and function of regulatory RNA elements: ribozymes that regulate gene expression. Biochim. Biophys. Acta. 1789, 634-641 (2009).
- Moore, P. B., Steitz, T. A. The roles of RNA in the synthesis of protein. Cold Spring Harb. Perspect. Biol. 3, a003780 (2011).
- Wilkinson, K. A., et al. High-throughput SHAPE analysis reveals structures in HIV-1 genomic RNA strongly conserved across distinct biological states. Plos Biol. 6, 883-899 (2008).
- Merino, E. J., Wilkinson, K. A., Coughlan, J. L., Weeks, K. M. RNA structure analysis at single nucleotide resolution by selective 2 '-hydroxyl acylation and primer extension (SHAPE). J. Am. Chem. Soc. 127, 4223-4231 (2005).
- Watts, J. M., et al. Architecture and secondary structure of an entire HIV-1 RNA genome. Nature. 460, 711-716 (2009).
- Xu, W., Bolduc, F., Hong, N., Perreault, J. P. The use of a combination of computer-assisted structure prediction and SHAPE probing to elucidate the secondary structures of five viroids. Mol. Plant Pathol. , (2012).
- Novikova, I. V., Hennelly, S. P., Sanbonmatsu, K. Y. Structural architecture of the human long non-coding RNA, steroid receptor RNA activator. Nucleic Acids Res. 40, 5034-5051 (2012).
- Leshin, J. A., Heselpoth, R., Belew, A. T., Dinman, J. High-throughput structural analysis of yeast ribosomes using hSHAPE. RNA Biol. 8, 478-487 (2011).
- Souliere, M. F., Haller, A., Rieder, R., Micura, R. A powerful approach for the selection of 2-aminopurine substitution sites to investigate RNA folding. J. Am. Chem. Soc. 133, 16161-16167 (2011).
- Wilkinson, K. A., Merino, E. J., Weeks, K. M. Selective 2 '-hydroxyl acylation analyzed by primer extension (SHAPE): quantitative RNA structure analysis at single nucleotide resolution. Nat. Protoc. 1, 1610-1616 (2006).
- McGinnis, J. L., Duncan, C. D. S., Weeks, K. M. High-Throughput Shape and Hydroxyl Radical Analysis of Rna Structure and Ribonucleoprotein Assembly. Method Enzymol. 468, 67-89 (2009).
- Low, J. T., Weeks, K. M. SHAPE-directed RNA secondary structure prediction. Methods. 52, 150-158 (2010).
- Das, R., Laederach, A., Pearlman, S. M., Herschlag, D., Altman, R. B. S. A. F. A. Semi-automated footprinting analysis software for high-throughput quantification of nucleic acid footprinting experiments. Rna-a Publication of the Rna Society. 11, 344-354 (2005).
- Kertesz, M., et al. Genome-wide measurement of RNA secondary structure in yeast. Nature. 467, 103-107 (2010).
- Underwood, J. G., et al. FragSeq: transcriptome-wide RNA structure probing using high-throughput sequencing. Nat. Methods. 7, 995-1001 (2010).
- Mauger, D. M., Weeks, K. M. Toward global RNA structure analysis. Nat. Biotechnol. 28, 1178-1179 (2010).
- Lucks, J. B., et al. Multiplexed RNA structure characterization with selective 2'-hydroxyl acylation analyzed by primer extension sequencing (SHAPE-Seq). Proc. Natl. Acad. Sci. USA. 108, 11063-11068 (2011).
- Vasa, S. M., Guex, N., Wilkinson, K. A., Weeks, K. M., Giddings, M. C. ShapeFinder: a software system for high-throughput quantitative analysis of nucleic acid reactivity information resolved by capillary electrophoresis. RNA. 14, 1979-1990 (2008).
- Reuter, J. S., Mathews, D. H. RNAstructure: software for RNA secondary structure prediction and analysis. BMC Bioinformatics. 11, 129 (2010).
- Pang, P. S., Elazar, M., Pham, E. A., Glenn, J. S. Simplified RNA secondary structure mapping by automation of SHAPE data analysis. Nucleic Acids Res. 39, e151 (2011).
- Deigan, K. E., Li, T. W., Mathews, D. H., Weeks, K. M. Accurate SHAPE-directed RNA structure determination. Proc. Natl. Acad. Sci. USA. 106, 97-102 (2009).
- Darty, K., Denise, A., Ponty, Y. VARNA: Interactive drawing and editing of the RNA secondary structure. Bioinformatics. 25, 1974-1975 (2009).
- Byun, Y., Han, K. PseudoViewer: web application and web service for visualizing RNA pseudoknots and secondary structures. Nucleic Acids Res. 34, 416-422 (2006).
- Brown, T., Brown, D. J. S., Eckstein, F. . Oligonucleotides and Analogues - A Practical Approach. , 20 (1990).
- Legiewicz, M., et al. The RNA Transport Element of the Murine musD Retrotransposon Requires Long-range Intramolecular Interactions for Function. J. Biol. Chem. 285, 42097-42104 (2010).
- Steen, K., Siegfried, N. A., Weeks, K. M. Syntheis of 1-methyl-8-nitroisatoic anhydride (1M7). Protocol Exchange. , (2011).
- Mortimer, S. A., Weeks, K. M. A fast-acting reagent for accurate analysis of RNA secondary and tertiary structure by SHAPE chemistry. J. Am. Chem. Soc. 129, 4144-4145 (2007).
- Mitra, S., Shcherbakova, I. V., Altman, R. B., Brenowitz, M., Laederach, A. High-throughput single-nucleotide structural mapping by capillary automated footprinting analysis. Nucleic Acids Res. 36, e63 (2008).
- Giddings, M. C., Severin, J., Westphall, M., Wu, J., Smith, L. M. A software system for data analysis in automated DNA sequencing. Genome Res. 8, 644-665 (1998).
- Aviran, S., et al. Modeling and automation of sequencing-based characterization of RNA structure. Proc. Natl. Acad. Sci. USA. 108, 11069-11074 (2011).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены