Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Измерение внутриклеточного Са
В этой статье
Резюме
Внутриклеточного Са 2 + Динамика очень важны в сперме физиологии и Ca 2 + Чувствительных флуоресцентных красителей представляют собой универсальный инструмент для их изучения. Население экспериментов (флуорометрию и остановил поток флуорометрию) и разовых экспериментов клетки (проточной цитометрии и одной ячейки изображения) используются для отслеживания пространственно-временных [Ca 2 +] Изменения в человеческих клетках спермы.
Аннотация
Сперматозоиды мужских репродуктивных клетках рассчитанным в первую очередь, признать и сливаться с яйцом. Для выполнения этих задач, сперматозоиды должны быть готовы к постоянно меняющейся окружающей среде и преодолеть несколько физических барьеров. Будучи по сути транскрипции и поступательно молчать, эти подвижные клетки глубоко полагаться на разнообразных сигнальных механизмов ориентироваться и плавать в направленном моде, и, чтобы бороться с сложных условиях окружающей среды во время их путешествия, чтобы найти яйцо. В частности, Ca 2 +-передачи сигналов имеет решающее значение для нескольких функций спермы: активация моторики, капацитация (сложный процесс, который готовит спермы для акросомной реакции) и акросомной реакции (экзоцитоза событие, позволяющее спермы яйца синтеза). Использование флуоресцентных красителей для отслеживания внутриклеточных колебаний этого иона имеет значительное место из-за их легкости применения, чувствительность и универсальность Detперегиба. Использование одного красителя загрузке протокола мы используем четыре различных флуорометрическая методов для контроля спермы Ca 2 + динамики. Каждый из этих методов имеет определенные информацию, которая позволяет пространственное и / или временное разрешение, генерации данных как на одну клетку и уровни клеточной популяции.
Введение
Са 2 + является универсальным вторичным мессенджером путей сигнальной трансдукции в эукариотических клетках. Внутриклеточного Са 2 + (Ca 2 + I) участвует в регуляции многих фундаментальных физиологических процессов в обоих возбудимы и не возбудимых клеток. Важность и универсальность Са 2 + в качестве вторичного мессенджера во время события передачи сигнала является производным от его пространственно-временной гибкость в передаче информации внутри клетки. В то время как Са 2 + не могут быть синтезированы заново или деградации в клетке, его внутриклеточной концентрации ([Са 2 +]) поддерживается в пределах очень строгих ограничений через различные клеточные механизмы, которые непрерывно буфер, улавливание, устроены и / или накапливать Са2 +. Изменения концентрации этого иона может происходить в сильно локализованной области в пределах ячейки 1 и расшифровка таких колебаний имеет важное значение для получения деEPER понимание (1) их роль в сигнальный механизм, (2) их физиологическое значение, и (3) общие механизмы клеточной сигнализации. Ca 2 +-опосредованной сигнализации имеет особое значение в сперме физиологии 2. Подвижность сперматозоидов является одним из наиболее важных функций для оплодотворения успех, и в самом деле, некоторые дефекты подвижности сперматозоидов может привести к бесплодию 3-5. Важность Ca 2 + в движение жгутиковых Уже давно признано, 6, однако механизм того, как Ca 2 + контролирует специфическая форма жгутиковое изгиба до конца не изучен.
Перед сваркой с яйцом, сперматозоиды должны пройти капацитация, сложный процесс зависит от спермы резиденции внутри женского тракта. Во капацитация, липидные мембраны сперматозоидов архитектуры и организации будут изменены, в основном в результате удаления холестерина из плазмы мембраны. Кроме того, некоторые белки тирозин-фосфорylated 7. Важно отметить, что во время капацитации происходит увеличение внутриклеточного рН (я) и [Са 2 +], и мембранный потенциал гиперполяризует у некоторых видов 2. Капацитация происходит только в субпопуляции сперматозоидов (20-40%), а также механизмы, участвующие во всех этих клеточных изменений, далеко не ясны. Принято считать, что только субпопуляции капаситированных спермы проходят акросомной реакции (AR) под воздействием физиологических индукторов. AR также Ca 2 +-регулируемых событий необходимы для оплодотворения у всех видов обладающих акросоме (специализированные органеллы с внешней и внутренней мембраны). Во время этого процесса внешней мембраны акросомную предохранители с плазменной мембраны сперматозоидов, выпуская гидролитические ферменты, которые позволяют сперматозоидам проникнуть в глико-белковые матрицы, окружающей яйцо (пеллюцида или ZP). AR также предоставляет новые фузогенные поверхности сперматозоида, который взаимодействует смембраны плазмы яичного для окончательного слияния двух гамет. Есть несколько сотовых лигандов, которые вызывают AR, прогестерон является одним из наиболее изученных среди них.
В данной работе мы представляем четыре различные методы, связанные с использованием Са 2 +-чувствительного флуоресцентного красителя для измерения [Ca 2 +] я изменения в сперме человека вызваны прогестерона (за исключением проточной цитометрии, в которых мы определили [Ca 2 + ] Я увеличить индуцированной во время процесса капацитация в пробирке). В данном случае мы использовали Fluo-3 утра (Life Technologies, Grand Island, NY), проницаемые мембраны красителя с К D = 325 нм. Экстракорпоральное мы провели мониторинг изменений флуоресценции как функции времени с тремя из методологий, и с четвертым техники были измерены величины флуоресценции на одной данный момент времени. Эти различные подходы дополняют друг друга, так как в целом они обеспечивают пространственное и временное разрешениеOlution как на одну клетку и уровни клеточной популяции.
Клеточной популяции или массовых экспериментов
Массовые методы широко используются не только потому, что они требуют инструментов легко доступны, но и потому, что они просты, хорошо известна, и позволяют усреднение информации из измерений, проведенных на миллионов клеток в одном эксперименте.
Метод № 1. Обычные флуорометрии
Этот метод отслеживает изменения флуоресценции в зависимости от времени; Эксперименты проводились в стеклянной кюветы с образцами объемом от 200 до 1000 мкл. Правильное смешивание реагентов требуется добавить магнитной мешалкой и, следовательно, временное разрешение получено составляет порядка нескольких секунд. Типичный диапазон концентрации клеток из анализируемых образцов составляет 10 5 -10 8 клеток / мл.
Метод № 2. Остановленной струи флуорометрии
Tего техники также отслеживает изменения флуоресценции в зависимости от времени, но реагенты быстро смешивают вместе (с помощью давления) в запись кювету очень небольшой объем образца (в пределах от 25-100 мкл). Таким образом, гомогенизации реагентов происходит мгновенно, что позволяет высоким временным разрешением порядка миллисекунд. Анализ полученного в результате флуоресценции в зависимости от времени следы пригодны для определения скорости реакции выяснения сложность механизма реакции, получение информации о недолго промежуточных продуктов реакции и т.д. общий диапазон концентрации клеток из анализируемых образцов составляет 10 5 -10 7 клеток / мл.
Одноместный экспериментах с клеточными
Массовое экспериментов сообщают среднего поведение большого количества клеток, однако популяции может часто демонстрируют гетерогенные свойства, которые пропускаются в течение такого типа измерений. Одноместный Клеточные технологии при этом используются в дополнение к-йэлектронной информации, полученной с экспериментами клеточной популяции.
Метод № 3. Проточной цитометрии
Несмотря на важность информации, вытекающие из отдельных измерений клетки, важно проанализировать большое количество клеток для того, чтобы предотвратить ошибочное экстраполяции клетка-специфическими свойствами в совокупности. По этой причине высокой пропускной методами собираются в стаи и самый популярный метод проточной цитометрии, в которых 10 000 клеток на состояние условно проанализированы. Этот метод позволяет мульти-параметрического анализа гетерогенных популяций, как это классифицирует клетки в зависимости от их размера (прямого рассеяния (FSC)), детализации (бокового рассеяния (SSC)) и интенсивность флуоресценции (особая маркировка с антителом, жизнеспособность маркером и т.д.) , тем самым обеспечивая информацию о распределении параметров для группы ячеек. Проточной цитометрии обеспечивает мгновенный, а не зависящие от времени информации 8. Вперед и в стороны разброс значений арэлектронной также полезны для выбора ворот, который включает клетки, но дискриминационным клеточных остатков, пыли и т.п. Для измерения флуоресценции, отрицательных и положительных флуоресценции управления также должны быть включены. Если более чем один флуоресценции канал используется, процесс, известный как компенсация должна быть выполнена (подробнее см. http://www.bdbiosciences.com/resources/protocols/setting_compensation.jsp ). Компенсация позволяет спектрального перекрытия дискриминации среди флуорофорам. Проточная цитометрия также позволяет дискриминация мертвых клеток, обычно с помощью окрашивания йодистым пропидием.
Метод № 4. Одноместный изображений Сотовые
Микроскопия является еще одним распространенным методом изучения поведения одного клетки; он хорошо подходит для зависящих от времени исследований, а также обеспечивает пространственное разрешение. Основным недостатком является то, что высокопроизводительного анализа только в зачаточном состоянии в настоящее время 9.
протокол
В данной работе мы сообщаем об использовании четырех вышеупомянутых методов измерения [Ca 2 +] я изменения в клетках человека спермы. Мы использовали прогестерон, чтобы вызвать Са 2 + ответ, как это хорошо известно, что этот стероид производит переходные [Са 2 +] увеличение сперматозоидов. В частности, в сперматозоидах человека, прогестерон непосредственно активирует Ca2 + каналов (а именно CatSper) экспрессируется исключительно в плазматической мембране клеток спермы 10,11. Мы также измеряли отдыха [Ca 2 +] я до и после капацитация учитывая, что он также широко признано, что увеличение [Ca 2 +] я происходит во время капацитация. Для методы требуют положительного контроля был использован Са 2 + ионофором иономицином, чтобы вызвать максимальное Са 2 + поглощение в камеру, и, таким образом, максимальное флуоресценции ответ; для минимальной флуоресценции, мы использовали Mn 2 + для гашения флуоресценции.
1. Подготовка образцов спермы от кромки метод (см. рисунок 1)
Используйте только воскликнул образцов (полученную путем мастурбации), характеристики которых выполняют параметрами, установленными последнем издании Всемирной организации здравоохранения Лабораторное руководство (доступно по адресу http://whqlibdoc.who.int/publications/2010/9789241547789_eng.pdf ) для проведения экспертизы и обработки спермы человека.
- Получение образца спермы в стерильном контейнере и место его (с ослабить крышки) в инкубаторе при температуре 37 ° C и CO 2, 5% / 95% воздуха в течение 30 мин. Этот шаг является образцом для сжижения.
- Место 500 мкл аликвоты сжиженный образца спермы на дно чистое стекло пробирки (1,0 х 7,5 см). Примерно восемь пробирки необходимы для среднего размера выборки (4 мл).
- Тщательно слоя 1 мл F-10 среднего Хэма (ГУ. pplemented с 2 мМ CaCl 2 и 5 мг / мл бычьего сывороточного альбумина содействовать капацитации в пробирке) в верхней части каждого семени аликвоту (см. рисунок 1) ТИП: Нажмите на стенке трубки с наконечником пипетки и осторожно обойтись среде над образцом. Очень важно делать это медленно, как смешивания обоих слоев (образец и средних) следует избегать.
- Осторожно наклоните труб углом 30 ° примерно. Это приведет к увеличению площади поверхности между двумя жидкостями, повышая тем самым смещение (кромки) человеческих клеток от образца к среде в течение инкубации.
- Поместить группу опирался пробирки в термостат при 37 ° С и CO 2, 5% / 95% воздуха в течение 1 часа.
- С помощью микропипетки осторожно снимите верхнюю мкл 700 F-10 среднего HAM (теперь содержащие подвижных сперматозоидов) из каждой пробирки и бассейн все собранные образцы в одну чистую стеклянную трубку (1,0 х 7,5 см, при больших объемах использовать 15 млСокол трубки), избегая образования пузырьков. Место 10 мкл объединенной выборки на оптические листового стекла Маклер Счетной палаты базу, а затем установите крышку стекла (только крышка на месте, избегать подъема или покрытие еще раз, чтобы сохранить равномерное распространение образец спермы). Убедитесь в том, чтобы избежать образования пузырьков внутри камеры так как это приведет на неточных клеток.
- Заметим под микроскопом соединение (использование 20X цель рекомендуется). Защитное стекло из счетнокамерное Маклер имеет большую площадь состоит из 100 меньших квадратов (то есть 10 на 10 сетка). Подсчет клеток в любой полосе 10 квадратов. Это число представляет их концентрации в миллионах клеток / мл. Повторить подсчет в двух дополнительных 10 квадратных полосы, и вычислить среднее значение трех пунктов обвинения. ПРИМЕЧАНИЕ: Если камера Маклер Подсчет (что особенно предназначенная для подсчета сперматозоидов) не доступен, любой гемоцитометром камера может использоваться.
- Регулировка FINA образцал концентрации 1х10 7 клеток / мл в обогащенной F-10 среда Хэма. При необходимости, инкубировать образец при 37 ° С и CO 2, 5% / 95% воздуха в течение 5 часов, чтобы способствовать капацитации.
2. Флуоресцентные красителем в течение Са 2 + Измерения
Есть несколько флуоресцентных красителей, доступные для измерения внутриклеточного Са 2 +, соответствующий одному должен быть выбран в соответствии с его K д, и ее излучения и возбуждения длин волн (на качественных и количественных измерений, одно-и двойной излучения длин волн возбуждения и, соответственно, должна быть используется) дополнительной информации). Для настоящего качественному применению мы использовали Флуо-3 AM, проникающий в клетку красителя с К D = 325 нм, и одного излучения и возбуждения длинами волн 506/526 нм соответственно 12.
- Подготовка 50 мкл 1 мМ Fluo-3 утра маточного раствора путем растворения содержимого одного флакона 50 мг красителя (молекулярная масса 1130 г / моль) в 44 мкл безводного ДМСО.
- С помощью 1,5 мл пробирке смешивать требуемого объема суспензии сперматозоидов (см. необходимое количество для каждого конкретного метода ниже) с достаточной 1 мМ Fluo-3 утра маточного раствора с получением конечной концентрации 2 мкМ Fluo-3 AM (т.е. 1 мкл со Fluo-3 утра добавляется на каждые 500 мкл суспензии сперматозоидов).
- Инкубируют в течение 30 мин при 37 ° С в защищенном от света месте.
- Центрифуга трубки при 750 х г в течение 5 мин с использованием микроцентрифужных, аспирации и отбросить супернатант и ресуспендируют осадок в соответствующем объеме (см. требуемой концентрации для каждого конкретного метода ниже) человека средней Сперма (ИМП, мМ: NaCl 120, 15 NaHCO 3 , 4 KCl, 1,8 CaCl 2, MgCl 2 1, HEPES 10, 10 Na лактат, 5 D-глюкозы, 1 пирувата Na, рН = 7,4) Примечание: формирование облако вместо гранул показывает, что клетки в хорошем состоянии.
- Клетки теперь загружается с красителем, они остаются жизнеспособными (выдерживали при 37 ° С в защищенном от света месте) в течение приблизительно двух часов, и может быть использован в любой из следующих методов.
3. Метод № 1. Обычные флуорометрии (Средняя информации из большого клеточной популяции)
Оборудование: для населения нашей спермы [Ca 2 +] я измерений мы используем спектрофлуорометра ОДС Aminco управляется программным обеспечением Олисе (Богарт, Джорджия, США) с магнитной мешалкой управления (SIM Aminco) и соединен с синим светодиодом (Luxeon Звезда LXHL- LB3C, от LUMILEDS) и 465-505 нм полосового фильтра (Цветность технологий корпорации) для Fluo-3 утра возбуждения. Светодиодные контролируется заказ питания (+700 мА). Светового излучения измеряется путем установки длины волны излучения (λ Em) до 525 нм на монохроматор спектрофлуорометра автора.
- Место 570 мкл HSM и 30 мкл суспензии клеток спермы (предварительно загружены Fluo-3 утра и ресуспендировали в HSM получить 1x10 8 клеток / мл) в плоской трубки со стеклянным дном (ID 8 х 50 мм). Установите магнитную мешалку внутри трубки и вставить трубку в чтении Палатой спектрофлуорометра (предварительно нагретую до 37 ° С), перемешайте образец в течение всего времени приобретения.
- Начать эксперимент с использованием программного обеспечения оборудования (Олисе программного обеспечения в данном случае) и приступить к приобретению значения флуоресценции на частоте 0,5 Гц в течение 300 сек. Применение желаемых соединений теста путем инъекции соответствующего объема из исходного раствора (обычно 100X более концентрированным, чем желаемой конечной концентрации) с использованием Hamilton микрошприца следующим образом:
- Приобретать базальной флуоресценции в течение 30 сек.
- Добавить 4 мкм прогестерона (PG).
- При 100 сек добавить 20 мкМ иономицина (в качестве положительного контроля, чтобы получить максимальную флуоресценцию значение).
- Выполнить отрицательного контроля, повторяя шаги 3.1 до 3.2.3 и выше, но вместо добавления Pg только растворитель, используемый для его растворения (HSM с 0,01% безводного ДМСО).
- Экспорт сырья флуоресценции значения интенсивности Microsoft Excel и нормализовать их с помощью следующего уравнения: (F/F0) - 1. Где F является измеренной интенсивности флуоресценции в любой момент времени (т), F0 является средним базальным флуоресценции принято во время первых 30 сек. Участок общей серии (F/F0) - 1 значений в зависимости от времени (рис. 2А). Измерение разности значений интенсивности флуоресценции до и после добавления испытуемого соединения (ΔF), сюжет их в виде столбика и обрабатывать данные, применяя соответствующие статистические методы анализа (фиг. 2В).
4. Метод № 2. Остановлено FloW флуорометрии (Информация с высоким временным разрешением от большой популяции клеток)
Оборудование: внутриклеточная [Ca 2 +] изменения измеряются с высоким временным разрешением использованием SFM-20 остановил поток смесителя соединен с MOS-200 быстрое кинетики оптической системой, как с BioLogic научных инструментов (Гренобль, Франция). Все данные анализируются с Bio-Kine32 программного обеспечения из той же компании.
- Установите соответствующие условия в оборудование; источник освещения должен быть включен по крайней мере за 15 минут до начала эксперимента; настроить возбуждения и эмиссии фильтры, настраивать ФЭУ значению напряжения в пределах установленных остановил поток производителя и установить температуру бани при температуре 37 ° С.
- Заполните один из шприцов прибора с 1 мл Fluo-3 утра нагруженных сперматозоидов (1X10 7 клеток / мл), а второй шприц 1 мл тестируемого соединения, либо HSM (отрицательный контроль),10 мкМ иономицин (положительный контроль) или 10 мкМ Pg растворяется в HSM. Примечание: На этом этапе очень важно, чтобы избежать образования пузырьков во время рисования жидкостей в шприцах.
- Лифт оба инструмента поршни, пока они не касаются наконечник шприца плунжеров.
- Установка скорости потока до минимального значения, которые обеспечат измеримых ответ для того, чтобы минимизировать повреждения клеток. Скорость потока мы используем в SFM-20 системы составляет 1 мл / сек 13.
- Установка частоты (в данном случае 10 мс), а общее время выборки (в данном случае 50 секунд).
- Триггер смешивания реагентов. Примечание: В то время как один единственный триггер в то время, может быть сделано вручную, набор автоматических последовательных триггеры могут быть запрограммированы, а также.
- Следом сырья флуоресценции (в произвольных единицах) от времени отображаются на экране компьютера.
- Смешение реагентов таковой будет генерировать след, который не является прямой линией. Таким образом, для получения фактического [Са2 +] изменение происходит от стимула, контроль следов, полученных из клеток с перемешиванием среды (отрицательный контроль) необходимо вычесть из каждой из экспериментальных следов. Анализ данных по мере необходимости, другие параметры кинетики могут также быть получены с помощью Bio-Kine32 приобретение программного обеспечения. Сырье без следов вычитание приведены в дополнительном рисунке 1 для сравнения.
- Чтобы изменить реагента в шприце тестируемого соединения, очистить его тщательно с дистиллированной водой. Затем заполните шприц до максимального объема дистиллированной водой, поместите его в соответствующее поршня остановил поток флуорометре и нажмите воды через внутренний механизм (промывочной воды должна быть направлена на контейнер для отходов). Повторите это действие еще два раза.
- Повторите этапы 4,2 до 4,9, заполнение второго шприца со следующей желательной тестируемого соединения.
- В конце эксперимента, промыть всю оборудование дистиллированной водой, полностью слива воды извнутренние шланги.
5. Метод № 3. Проточной цитометрии (Единое информационное клетку, полученную из большого числа клеток)
Оборудование: Этот метод позволяет одновременное измерение нескольких параметров в один момент времени, но в отличие от предыдущих методов, он не измеряет изменение с течением времени, а это обеспечивает значений параметров во время измерения. Таким образом, вместо добавления Pg, чтобы вызвать ответ, в данном случае мы измерили внутриклеточного Са 2 + уровня сперматозоидов до и после индукции капацитация. Мы использовали FACSCanto цитометра (Becton Dickinson) и данные анализировали с FlowJo программное обеспечение (дерево звезда 9.3.3).
- Подготовка экспериментальных образцов в цитометре трубы, помещая 500 мкл клеточной суспензии (4x10 6 клеток / мл) в трубке под каждым условием для тестирования (в данном случае, десять условий, см. таблицу 1). Сбор данных флуоресценции сюдам 10 000 событий на образец.
- Чтобы поставить эксперимент, использовать программное обеспечение для оборудования:
- Создайте новый: папки, эксперимент, образца и количество трубок.
- Выберите подходящие настройки для цитометром Fluo-3 утра (используйте FITC-Флуоресцеинизотиоцианат-фильтр) и PI (PI-использовать Пропидий йодид-фильтр).
- Запустите неокрашенные трубы управления 1 и 2 в цитометром. Сбор FSC и SSC данных, чтобы проверить, что пороговые параметры соответствуют и для создания соответствующей воротам, чтобы различить мусор из клеток.
- Для создания компенсации контроля, выполните следующие контрольные образцы, собирая авто и максимальной флуоресценции (PI и FITC каналов) (Примечание: эта задача обычно выполняется техником оборудования):
- Неокрашенные клетки (трубки 1 и 2).
- Клетки загружены Fluo-3 AM (2 мкМ) (трубки 3 и 4).
- Мертвые клетки (сперматозоиды суспендировали в 0,1% Тритон Х-100 в HSM в течение 10 мин при комнатной температуре)окрашивали PI (1,2 мкМ PI, т.е. 0,25 мкл 2,4 мМ ПИ добавляют к 500 мкл суспензии сперматозоидов) в течение 30 мин при 37 ° С в защищенном от света (трубки 5 и 6).- Просмотр записанных данных и выбрать ворота для нужного населения.
- Отрегулируйте ворот, и выберите "Применить" для всех компенсационных Controls.
- Выберите эксперимента> компенсацию Настройка> расчета компенсации.
- Переименовать настройки компенсации и ссылку и сохранить.
- Выполнить все экспериментальные трубы (в данном случае, труб 7-10). В конце концов, экспортировать все данные в программное обеспечение, доступное для анализа (см. шаг 5.6).
- Анализировать результаты каждого эксперимента с использованием программного обеспечения оборудования, имеющегося в продаже программного обеспечения или FlowJo Cytobank свободного программного обеспечения ( http://www.cytobank.org/ ).
6. Метод № 4. Одноместный изображений Сотовые (Single информации Сотовый с высоким пространственным разрешением)
Оборудование:. Построен по индивидуальному заказу изображений настройке Наши изображения настройки состоит из перевернутого Nikon Diaphot 300 Микроскоп оснащен регулятором температуры (Medical System корпорации, Greenvale, Нью-Йорк), Nikon Planapo 60X (1.4 NA нефти погружения) цели. Флуоресцентная подсветка обеспечивается Luxeon V Звезда Lambertian голубого светодиода часть # LXHL-LE5C (Lumileds Lighting ООО, Сан-Хосе, Калифорния), присоединенные к заказных стробоскопического блока управления. Светодиодная был установлен в FlashCube40 сборки зеркальные M40-DC400 (Rapp Opto Электронные, Гамбург, Германия) (полосы: возбуждение 450-490 нм, дихроичным зеркалом 505 нм и излучения 520-560 нм). Индикатор выходного был синхронизирован с экспозиции Out сигнал Прохладный оснастку CCD камеры через блок управления для получения разовой вспышкой 2 мсек на отдельные экспозиции. Время экспозиции камеры был установлен эквивалентный длительность вспышки (2 мс). Изображения собирают каждые 250 мс (или могут быть скорректированы в соответствии снужное временное разрешение) с помощью программного обеспечения IQ (Андор Bioimaging, Уилмингтон, штат Северная Каролина).
- Подготовка круглый покровных (диаметр = 25 мм) с применением 5-мкл каплей поли-L-лизин раствор (0,01% вес / объем) по центру. Дайте отстояться в течение не менее 1 часа (это могут высохнуть). Используя шприц бутылку промойте обработанный участок водой перед использованием. Эта процедура позволит сперматозоиды придерживаться покровного стекла из головы, а их жгутик еще может двигаться.
- Подготовка испытываемых соединений при растворении их в HSM в соответствии с таблицей 2. Соединения добавляют последовательно в той же камере записи, убедившись, что всегда добавляют такой же объем, а также регулировать концентрацию исходного раствора с учетом разбавления он будет иметь при смешивании с объемом уже присутствует в камере (как указано в таблица 2). Хранить всех испытуемых растворов в ванне при 37 ° С, пока они не используются.
- Установите крышку скольжения внутри RECОрдинг камерой и место 10 мкл Fluo-3 утра нагруженных клеток (1 × 10 7 клеток / мл) в центре. Крышка клеток с 200 мкл подогретого HSM.
- Поместите камеру на столик микроскопа предварительно нагретой до 37 ° С, просматривать клетках (с использованием фазово-контрастного) и выбора области изображения. Важно, чтобы выбрать область, где плотность клеток соответствующих (см. рис 5А); слишком много клеток затруднить анализ из-за перекрытия сигналов ПРИМЕЧАНИЕ: Клетки должны быть прочно прикреплены к покровным стеклом их головы, но выставляю жгутиковое движения, что подтверждает. жизнеспособность.
- Приобретать флуоресцентные изображения в режиме реального времени для настройки фокуса и яркости.
- Начать эксперимент по активации временных рядов получения изображений программное обеспечение (IQ в данном случае). Обычно четыре изображения приобретаются в секунду с подсветкой 2 мс на изображении.
- Используйте микропипетку тщательно добавить (каплям) тестируемого соединения (Pg в данном случае), продолжают мнимойэлектронной приобретение в соответствии с требованиями и выполняют две последовательные дополнений управления в той же камере (1) 20 мкМ иономицина для получения максимальной флуоресценции и (2), 5 мМ MnCl 2 для получения минимальной флуоресценции. Кроме того, соединения могут быть добавлены с помощью перфузии камеры, которая предлагает преимущества включения стимул удаление, а также возможность равномерно купить клеток с соединением. В то же время, это не имеет недостатков требующих больших количеств раствора и создания регулирования температуры более проблематичным.
- Повтор приобретения в новой камере с каждой желаемой тестируемого соединения.
- Выполнить анализ изображений в Интернете с помощью программного обеспечения оборудования, или в автономном режиме с использованием либо программное обеспечение бесплатно или IQ изображения J. Нарисуйте регионах, представляющих интерес (трансформирования) вокруг каждой ячейки (или часть клетки), а также выбрать ячейку-зоне свободной (для автоматического вычитания фона с помощью программного обеспечения). Временных интенсивности флуоресценции серии затем получают для каждого ROI, и эти данные маY быть экспортированы в Microsoft Excel для дальнейшего анализа. Нормируем значений интенсивности флуоресценции с помощью следующего уравнения: (F/F0) - 1. Где F является измеренной интенсивности флуоресценции в любой момент времени (Т) и F0 является средней флуоресценции принято во время первых 30 сек. Участок общей серии (F/F0) - 1 в зависимости от времени (рис. 5В). Значения могут быть также нормализуют с использованием флуоресценции значение, полученное после иономицин того за 100%.
- Анализ изображения может альтернативно быть выполнены с использованием изображения J свободного программного обеспечения.
Метод № 1. Обычные флуорометрии
Прогестерон является одним из известных индукторов AR и, как и ожидалось, это не вызовет переходные [Са 2 +] увеличение спермы человека (показанные на фигуре 2). Добавление кальция ионофором (иономицин) вызывает максимальный [Ca 2 +] я увеличение, которое не возвращается в базальных уровней.
Метод № 2. Sверхом флуорометрии потока
Прогестерон-индуцированный [Ca 2 +] я увеличение измеряли как и раньше (обычные флуорометрию), но на этот раз с большим временным разрешением, в этом случае частота приобретения составляла 0,1 Гц. Как показано на рисунке 3, и прогестерон, (переходный, красная линия) и иономицин (устойчивый, синяя линия) вызвала очень быстро [Ca 2 +] я увеличиваться. Отсутствие задержки в прогестерон индуцированный [Ca 2 +] я увеличение согласуется с предыдущими сообщениями о том, что прогестерон непосредственно активирует Са 2 + каналов CatSper, без промежуточных сигнализации 10,14.
Метод № 3. Проточной цитометрии
[Ca 2 +] я была измерена в капаситированных и не капаситированных человеческой спермы. Как сообщалось ранее, в 15 мыши, коровы спермы 16 и человеческой спермы 17, мы также наблюдается повышенная [C2 +] я в капаситированных сравнению с не-капаситированных человеческой спермы. Baldi и соавт. (1991) 17 сообщили о росте базальной [Ca 2 +] я в капаситированных, чем в других капаситированных человеческой спермы с использованием обычных флуорометрию. В этой работе мы использовали проточной цитометрии для измерения [Ca 2 +] я до и после экстракорпорального капацитация. Проточной цитометрии позволяет нам видеть, что распределение флуоресценции значения для капаситированных спермы (рис. 4D, синяя линия) смещается в сторону более высоких значений по сравнению с не-капаситированных спермы (рис. 4D, красный след). Флуоресценции значений для каждой отдельной клетки можно наблюдать в двумерной точка участков показано на рисунке 4G; важно то, что сигнал, вытекающих из мертвых клеток (15% примерно) может быть устранена (рис. 4G, верхний квадранта).
Метод № 4. Одноместный изображений Сотовые
Прогестерон вызываетD [Ca 2 +] я измеряли изменения в отдельные клетки спермы. Прогестерон того вызывает прирост [Ca 2 +] я как в головку сперматозоида и жгутик. Как отмечено в экспериментах населения, один клеточного анализа показали переходных и устойчивый рост прогестерона и иономицин соответственно.
Результаты
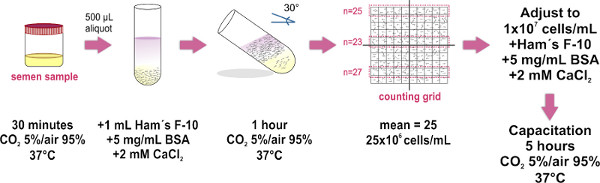
Рисунок 1. Принципиальная схема экспериментальной протокол образец спермы подготовка к которому можно подплыть методом. Основные шаги для разделения подвижных спермато?...
Обсуждение
Внутриклеточной сигнализации является жизненно важным для большинства сотовых деятельности; Са 2 + является повсеместное посланника, который сопровождает клетках млекопитающих на протяжении всей своей жизни, от их происхождения при оплодотворении, к концу своего жизненного ци?...
Раскрытие информации
Нам нечего раскрывать.
Благодарности
Авторы благодарят Хосе Луис де ла Вега, Эрика Melchy и доктор Такуя Nishigaki за техническую помощь. Эта работа выполнена при поддержке Национального совета де Ciencia у Tecnología (КОНАСИТ-Мексика) (99 333 и 128 566 КТ); Dirección генерала де Asuntos дель Личная Academico / Национального автономного университета Мексики (IN202212-3 КТ).
Материалы
| Name | Company | Catalog Number | Comments |
| Ham's F-10 | Sigma-Aldrich | N-6013 | |
| Bovine Serum Albumin | Sigma-Aldrich | A-7906 | |
| Calcium Chloride Dihydrate approx. 99% | Sigma-Aldrich | C-3881 | |
| Makler Counting Chamber | SEFI Medical Insruments LTD | SEF-MAKL | |
| Fluo-3 AM | Invitrogen | F-1242 | 20 vials/50 μg each |
| Ionomycin | Alomone | I-700 | |
| Progesterone | Sigma-Aldrich | P0130 | |
| Sodium chloride | Sigma-Aldrich | S-9888 | Reagents for human sperm medium (HSM) |
| Potassium chloride | Sigma-Aldrich | P-3911 | Reagents for human sperm medium (HSM) |
| Sodium bicarbonate | JT Baker | 3506 | Reagents for human sperm medium (HSM) |
| Magnesium chloride | Sigma-Aldrich | M-2670 | Reagents for human sperm medium (HSM) |
| Calcium chloride anhydrous | Sigma-Aldrich | C-1016 | Reagents for human sperm medium (HSM) |
| HEPES | Sigma-Aldrich | H-3125 | Reagents for human sperm medium (HSM) |
| D-Glucose | JT Baker | 1906-01 | Reagents for human sperm medium (HSM) |
| Sodium pyruvate | Sigma-Aldrich | P-2256 | Reagents for human sperm medium (HSM) |
| Sodium L-lactate (aprox. 99%) | Sigma-Aldrich | L- 7022 | Reagents for human sperm medium (HSM) |
| Propidium Iodide | Invitrogen | L-7011 | Component B |
| Triton X-100 (t-Octylphenoxypolyethoxyethanol) | Sigma- Aldrich | X-100 | 2.4 mM solution in water |
| Round coverslip | VWR | 48380 080 | 25 mm diameter |
| Poly-L-lysine solution | Sigma-Aldrich | P8920 | |
| Manganese chloride | Sigma-Aldrich | M-3634 | |
| Attofluor; Cell Chamber, for microscopy | Life technologies | A-7816 | |
| Dimethyl Sulphoxide | Sigma-Aldrich | D2650 | 5x5 ml |
Ссылки
- Bouschet, T., Henley, J. M. Calcium as an extracellular signalling molecule: perspectives on the Calcium Sensing Receptor in the brain. Comptes Rendus Biologies. 328, 691-700 (2005).
- Darszon, A., Nishigaki, T., Beltran, C., Trevino, C. L. Calcium channels in the development, maturation, and function of spermatozoa. Physiol. Rev. 91, 1305-1355 (2011).
- Esposito, G., et al. Mice deficient for soluble adenylyl cyclase are infertile because of a severe sperm-motility defect. Proc. Natl. Acad. Sci. U.S.A. 101, 2993-2998 (2004).
- Avenarius, M. R., et al. Human male infertility caused by mutations in the CATSPER1 channel protein. American Journal of Human Genetics. 84, 505-510 (2009).
- Carlson, A. E., et al. Pharmacological targeting of native CatSper channels reveals a required role in maintenance of sperm hyperactivation. PLoS ONE. 4, e6844 (2009).
- Brokaw, C. J. Calcium and flagellar response during the chemotaxis of bracken spermatozoids. J. Cell. Physiol. 83, 151-158 (1974).
- Visconti, P. E., et al. Capacitation of mouse spermatozoa. II. Protein tyrosine phosphorylation and capacitation are regulated by a cAMP-dependent pathway. Development. 121, 1139-1150 (1995).
- Svahn, H. A., van den Berg, A. Single cells or large populations. Lab on a chip. 7, 544-546 (2007).
- Pepperkok, R., Ellenberg, J. High-throughput fluorescence microscopy for systems biology. Nat. Rev. Mol. Cell Biol. 7, 690-696 (2006).
- Strunker, T., et al. The CatSper channel mediates progesterone-induced Ca2+ influx in human sperm. Nature. 471, 382-386 (2011).
- Lishko, P., et al. The Control of Male Fertility by Spermatozoan Ion Channels. Annu. Rev. Physiol. , (2011).
- Kao, J. P., Harootunian, A. T., Tsien, R. Y. Photochemically generated cytosolic calcium pulses and their detection by fluo-3. J. Biol. Chem. 264, 8179-8184 (1989).
- Kilic, F., et al. Caged progesterone: a new tool for studying rapid nongenomic actions of progesterone. Journal of the American Chemical Society. 131, 4027-4030 (2009).
- Lishko, P. V., Botchkina, I. L., Kirichok, Y. Progesterone activates the principal Ca2+ channel of human sperm. Nature. 471, 387-391 (2011).
- Xia, J., Ren, D. The BSA-induced Ca2+ influx during sperm capacitation is CATSPER channel-dependent. Reprod. Biol. Endocrinol. 7, 119 (2009).
- Galantino-Homer, H. L., Florman, H. M., Storey, B. T., Dobrinski, I., Kopf, G. S. Bovine sperm capacitation: assessment of phosphodiesterase activity and intracellular alkalinization on capacitation-associated protein tyrosine phosphorylation. Mol. Reprod. Dev. 67, 487-500 (2004).
- Baldi, E., et al. Intracellular calcium accumulation and responsiveness to progesterone in capacitating human spermatozoa. J. Androl. 12, 323-330 (1991).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены