Method Article
Выделение предшественника В-клеточных подмножеств из пуповинной крови
В этой статье
Резюме
Здесь мы опишем протокол для выделения подмножеств предшественники В-клеток из пуповинной крови. Достаточное количество и качество нуклеиновые кислоты могут быть извлечены из клеток и используется в последующих анализах использованием ДНК или РНК.
Аннотация
Пуповинная кровь высоко обогащенные для гемопоэтических клеток-предшественников на разных этапах приверженность линии. Мы разработали протокол для выделения предшественники В-клеток в четырех разных стадиях дифференцировки. Потому что гены экспрессируются и эпигенетические изменения происходят в тканях определенным образом, жизненно важно различать тканей и типов клеток для того, чтобы быть в состоянии идентифицировать изменения в геноме и эпигенома, что может привести к развитию заболеваний. Этот метод может быть адаптирован к любой тип клеток, присутствующих в пуповинной крови на любой стадии дифференцировки.
Этот метод включает в себя 4 основных этапа. Во-первых, одноядерные клетки разделены плотности центрифугирования. Во-вторых, B-клетки обогащаются использованием биотином антителами, которые признают и удаления не B-клеток из моноцитов. Третий B-клетки флуоресцентно меченые клетки с поверхности белка антител, специфичных к отдельным стадиямВ-клеточного развития. Наконец, флуоресцентно меченые клетки сортируются и отдельных групп населения будут восстановлены. Полученные клетки имеют достаточного количества и качества, которые будут использоваться в последующих анализах нуклеиновых кислот.
Введение
Для того чтобы определить аберрации, которые находятся в болезни, очень важно, что мы используем здоровых тканей или клеток, которые соответствуют тканей или клеток типа, страдающих этим заболеванием. Одной из причин этого является то, что эпигенетические изменения у типов тканей несет ответственность за регуляции экспрессии генов и является критическим для дифференциации клеток во время нормального человеческого 1,2 развитием. Второй причиной является то, что аберрантных ткани специального регулирования ген может иметь тяжелые последствия для нормального развития и, как известно, способствует множество болезненных состояний, включая рак. Таким образом, лучше понять болезнь, которая включает в себя гемопоэтических клеток требует знания здоровых гемопоэтических клеток.
Развитие кроветворных клеток в костном мозге доходов путем систематического порядок событий характеризуются изменения в экспрессии маркеров клеточной поверхности 3. Исследования с участием взрослых участников естьПоказано, что костный мозг обычно содержит небольшое количество прекурсоров В-клеток 4,5, тогда как исследования с участием педиатрической участников показали, что процент предшественника B-клеток является относительно высокая у людей меньше, чем 5 лет 6. Пуповинная кровь используется в качестве источника гемопоэтических стволовых клеток в лечении расстройств, связанных с кровью и злокачественных опухолей, легко доступны через банки пуповинной крови и обогащается для незрелых B и Т-клетки 7, которые являются клетками-мишенями нескольких заболеваний, включая лейкемию и лимфомы.
Предшественник B-клеток в костном мозге были широко phenotyped 8,9 и может быть определено наличие специфических маркеров клеточной поверхности, которые могут быть использованы для сортировки этих клеток в различных подмножеств. Нормальный B-клеточной дифференцировки проходит через ряд этапов в костном мозге, начиная с самых ранних про-В-клеток и заканчивая незрелых или наивные В-клеток. Пован Zelm и коллеги 10, про-В-клетки характеризуются наличием CD34 и в переходе к стадии 2 (Pre-BI) CD19 приобретения. Этап 3 (Pre-ВП) клетки больше не экспресс CD34 и начинают выражать цитоплазматических IgM. Наконец, отличительной чертой стадии 4 (незрелых В-клеток) является выражением поверхности IgM. Сортировка стратегии, описанной в данном протоколе была впервые описана Caldwell и коллег 6 и включает в себя использование только 3 маркеров клеточной поверхности, что значительно снижает сложность и стоимость проведения экспериментов сортировки клеток. В своей работе, отношения между CD45 и этапы B-клеточной дифференцировки была создана. Они отметили, что B-клеток в костном мозге отображать различные уровни экспрессии CD45. В частности, клетки, которые выразили высокий уровень CD45 соответствовало клетки, которые выразили поверхности IgM (незрелых В-клеток), те, которые выразили среднего уровня CD45 соответствовало клетки, которые выразили cytoplasmic IgM (предварительно BII клетки), и те, которые выражены низкие уровни CD45 соответствовало клетки, которые не выражают цитоплазматических IgM (предварительно BI клеток). Этот протокол использует стратегию, разработанную Caldwell и коллег от 6 до изолировать подмножества предшественники В-клеток из пуповинной крови (рис. 1), которые могут быть использованы в последующих анализах требующих высокого качества нуклеиновые кислоты, такие как метилированные CpG-анализа восстановление острова (MIRA ) 11 и количественный ПЦР в реальном времени анализы. Метод использует начальные разделения с использованием магнитных шариков, чтобы исчерпать все не-В-клеток из пуповинной крови и не требует окрашивания только с 3 антител (CD34, CD19 и CD45). Клетки, которые выделяют 4 стадии представляют В-клеточной дифференцировки: 1) CD34 +; CD19 + (поздно Pro-B и начале предварительного BI), 2) CD34 -, CD19 +, CD45 низкой (в конце предварительной BI); 3) CD34 -, CD19 +, CD45 мед (до ВП) и 4) CD34 -; CD19 +; CD45 высокой (незрелых В-клеток).
протокол
1. Выделение мононуклеарных клеток из пуповинной крови
- Подготовка EDTA-PBS буфера добавляют 5 мл бычьего сывороточного альбумина (БСА) раствор для полоскания 95 мл буфера (1:20 разбавление). Дега буфера и сохранить буфер на льду. ВНИМАНИЕ: Невыполнение дегазации буфера может привести к менее оптимальных результатов при вычленении CD19 + B-клетки, потому что пузырьки могут заблокировать выделение столбцов.
- Подготовка 50 мл конические пробирки для центрифугирования в градиенте плотности. Определить количество труб, необходимых для обработки пуповинной крови (1 туба может обрабатывать 8 мл крови) и добавить 15 мл Ficoll-Пак Плюс в каждую пробирку.
- Развести 8 мл пуповинной крови с 24 DPBS мл (1X) и осторожно слой разбавленной смеси пуповинной крови в верхней части Ficoll-Пак Плюс в каждом из 50 мл конические пробирки. Не смешивать кровь и Ficoll-Paque PLUS. ВАЖНО: Чтобы избежать смешивания пуповинной крови и Ficoll-Пак Плюс, держа трубку на 45 градусов ислой крови смесь медленно.
- Центрифуга при 400 х г в течение 40 мин при 20 ° C. Мононуклеарных клеток (МНК) останется на плазменные Ficoll-Пак Плюс интерфейс, тогда как гранулоциты и эритроциты осадка за счет более высокой плотности на осмотическое давление Ficoll-Paque PLUS. Этикетка семь 5 мл с круглым дном трубы, которые будут использоваться в часть 3 с образцом ID, дату и следующее:
| Труба | Этикетка | Цель |
| 1 | Незапятнанный | Неокрашенные клетки для нормализации в проточной цитометрии |
| 2 | 7AAD | Чтобы определить жизнеспособность при проточной цитометрии |
| 3 | + + + | Содержит клетки, которые будут отсортированы |
| 4 | 34 + | Для сбора CD34 + / CD19 +(В конце про-B - начале предварительного BI) клеток |
| 5 | 45 странах с низким | Для сбора CD34 - / CD19 + / CD45 низких (до-BI) клеток |
| 6 | 45 мед | Для сбора CD34 - / CD19 + / CD45 мед (предварительно BII) клеток |
| 7 | 45 высокая | Для сбора CD34 - / CD19 + / CD45 высокой (незрелых B) клетки |
Пальто труб 4, 5, 6 и 7 с 2% FBS и поставить все трубы на льду.
- Аспирируйте верхний слой плазмы осторожно и избегать контакта с мононуклеарных слоя клеток. Использование 10 мл стеклянной пипетки, тщательно передать мононуклеарных слоя клеток в новый 50 мл коническую трубку. Комбинат мононуклеарных клеток из трех труб в единую 50 мл трубки.
- Заполнить трубу с PBS, аккуратно перемешать и центрифуге при 300 х г в течение 10 мин при20 ° C. Осторожно аспирации супернатант, не нарушая осадок клеток. Повторите 1x. После первой стирки, ресуспендируют гранул и передать одну 50 мл коническую трубку.
- Аккуратно ресуспендируют осадок клеток в 200 мкл PBS. Удалить 1 мкл клеточной суспензии, добавьте его в 1 мл PBS в 1,5 мл трубки микроцентрифужных и отложите в сторону для счета (кол-во клеток после размещения 50 мл клеточной суспензии в центрифуге). Заполнить трубу с PBS и центрифугируют при 200 х г в течение 15 мин для удаления тромбоцитов. Удалить супернатант полностью, не нарушая осадок клеток.
2. Измененный B-клетки Изоляция от мононуклеарных клеток помощью разделения MACS
- Ресуспендируют гранул, начиная с шага 1.7 с 160 мкл холодного (4 ° C) EDTA-PBS буфера.
- Добавить 40 мкл В-ХЛЛ биотином антитела коктейль. Пипеткой тщательно перемешать и выдержать в течение 10 мин при 4 ° C.
- Вымойте клетки - добавляют 1 мл холодного (4 ° C) EDTA-PBS буфером на 10 млн. клеток (клетки нюmber определяется в шаге 1,7) и центрифугируют при 300 х г в течение 10 мин. Аспирируйте супернатант полностью, а затем ресуспендируют осадок клеток в 320 мкл холодного (4 ° C) EDTA-PBS буфера.
- Добавить 80 мкл анти-биотин микрошарики, хорошо перемешать и выдержать в течение 15 мин при 4 ° C.
- Вымойте клетки - добавляют 1 мл холодного (4 ° C) EDTA-PBS буфером на 10 млн. клеток и центрифуги при 300 х г в течение 10 мин. Ресуспендируют до 100 миллионов клеток в 500 мкл холодного (4 ° C) EDTA-PBS буфера. Масштаб объем буфера по числу клеток.
- Подготовка MACS MACS Колонны и сепараторов во время центрифугирования (шаг 2,5). Поместите LS колонку в магнитном поле сепаратора MACS, добавить 3 мл холодного (4 ° C) EDTA-PBS буфера в колонку и позволяют буфера капать через колонку. Используйте сосуд, чтобы поймать поток через. Откажитесь от потока через.
- Поместите 50 мл коническую трубку под колонки и пипеткой клеточную суспензию на колонку. Разрешить немеченого клетки капать Througч столбце и в 50 мл коническую трубку. ВАЖНО: Это те клетки, которые будут использоваться для маркировки антител и сортировки клеток. Не выбрасывайте потока через. Для восстановления всех клеток с шагом 2,5, добавляют еще 1 мл холодного (4 ° C) EDTA-PBS буфера в стенах коническую трубку. Аккуратно перемешайте и пипетировать оставшиеся клеточной суспензии на колонку. Повторите 1x. Перейдите к шагу 2.8 Использование немеченого клетки, собранные в конической трубе после прохождения через колонку.
- Заполните коническую трубку с немеченого клетки с PBS и центрифуги при 300 х г в течение 10 мин. Осторожно удалите супернатант, не нарушая осадок клеток. Добавить 200 мкл ЭДТА буфере PBS и осторожно ресуспендируют клеток.
3. Маркировка антител и подготовка для сотовых Сортировка
- Аспирируйте 1 мкл суспензии клеток и поместить в трубку с надписью "безупречной" (шаг 1,4). Добавить 500 мкл ЭДТА-PBS буфера и хранения труб на льду.
- Добавить 20мкл антител (CD19, CD34 и CD45) на миллион клеток в оставшейся суспензии клеток. Все хорошо перемешать и поместить трубку в темноте в течение 30 минут при комнатной температуре. CD антитела являются светочувствительными, выполните шаги 2-4 с выключенными фарами.
- Через 30 мин инкубации с антителами, аспирацию 40 мкл клеточной суспензии и поместить его в пробирку с надписью "7AAD". Добавить 1 мл PBS в трубку и центрифуги при 500 мкг в течение 2 мин. Удалить супернатант и ресуспендирования клеток в 100 мкл буфера для связывания. Добавить 7 мкл 7AAD (7-Aminoactinomycin D) и инкубировать в темноте в течение 10 мин при комнатной температуре. В течение 10 мин инкубации полный шаг 3.4.
- Добавить PBS в верхней части трубки, содержащей оставшиеся клетки помечены CD антител. Центрифуги трубы при 500 мкг в течение 3 мин. Удалить супернатант, добавить 500 мкл ЭДТА-PBS буфером и ресуспендируют осадок клеток. Перенесите весь объем клеточной суспензии в трубе с надписью "+ + +". Чтобы восстановить все клеточной суспензиидд дополнительно 1 мл ЭДТА-PBS буфера в 50 мл коническую трубку и передачи в трубу с надписью "+ + +".
- После инкубации (шаг 3,3), добавьте 300 мкл буфера для связывания в 7AAD трубку. "Безупречной", "7AAD" и "+ + +" проб и "34 +", "45 низкая", "45 мед" и "45 высокая" трубы готовы для проточной цитометрии.
4. Сортировка клеток с помощью потока MoFlo XDP Цитометр
- Настройка MoFlo для сортировки: Выровнять лазеров; стабилизировать капли потока; определить падение задержки.
- Подготовка одного цвета компенсацию управления с помощью мыши Invitrogen AbC шарик комплект (или подобное) в соответствии с инструкцией завода-изготовителя. Выполните одно контроля цвета, регулировка напряжения флуоресценции каналы для оптимального разделения положительных и отрицательных населения. Установить коэффициенты компенсации и применять компенсацией параметра в коллекции протокол. Восстановить компенсации коэффициентов каждый раз новую партию антитело получают.
- Создание протоколов, включая участки, как показано на рисунке 2.
- Выполнить неокрашенных образцов, установить напряжение и усиление для прямого и бокового рассеяния, а также определить отрицательную флуоресценции населения. Потому что ДНК восстановление цель в этом роде, порог должен быть установлен низкий (≤ 1%), так что ДНК-содержащих мусор не загрязняет восстановленные образцы. * Убедитесь, что Аэрозоль системы эвакуации работает на все времена, которые живут клетки человека в настоящее время работают на MoFlo.
- Выполнить небольшой аликвоты + + + образца (~ 50000 событий), чтобы установить строб стратегии (рис. 2). Потому что предшественниках В-клеток не рассеивают идентично зрелых В-клеток, backgate ungated CD19 + / CD34 + населения на участке SSC против FSC для обеспечения лимфоцитов ворот включает в себя потенциальную Pro-B клеток. Из этого примера также установить отрицательную флуоресценции населения 7AAD.
- Запустите 7AAD образца для определения жизнеспособности образца. Только вид клеток из образца с высокой жизнеспособностью вПрежде всего (≥ 95%), а мертвые клетки без разбора, и пятна могут загрязнить рода групп населения.
- Установить рода решений для сбора четырех популяций: CD19 + / CD34 +; CD19 + / CD34 - / CD45 низкой; CD19 + / CD34 - / CD45 мед и CD19 + / CD34 - / CD45 высокой. Включите лимфоцитов и дублет ворота дискриминации в своем роде решения всех групп населения.
- Для предотвращения засорения в сортировке наконечником, фильтр + + + образца через 40 мкм ячейки фильтра непосредственно перед сортировкой и повторного фильтра, если любая агрегация происходит в образце в процессе сортировки.
- Сортировка клеток в коллекцию трубок (шаг 1,4) покрытием с 2% FBS в PBS в охлажденном или льда упаковке держателя трубки.
- Сразу же после сортировки завершена, извлекать ДНК.
Результаты
Между образцом изменений играет важную роль в успехе ячейки рода (табл. 1). Образцы с хорошими показателями успеха имеют низкий уровень загрязнения мусором (рис. 3А) и образцы с плохой процент успеха имеют высокий уровень загрязнения мусором (рис. 3В). Между образцом изменения могут быть несколько контролируется, если в образце пуповинной крови были собраны в течение 24 часов отгрузки (O / N приоритет).
Поток отсортированных клеток друг от предшественников В-клеток подмножества имеют достаточного количества и качества выполнения изоляции нуклеиновых кислот. ДНК, выделенная высокого качества и могут быть использованы в последующих анализах. Мы регулярно использовать эту ДНК в MIRA 11 по обогащению для метилированной ДНК (рис. 4).
| Шнур данных Кровь фонда | Плохо Сортировка | Добрый Сортировка |
| Рабочая объема крови с антикоагулянтами (мл) | 110 | 104 |
| Белые клетки крови [10 3 / мкл] | 8,68 | 11,19 |
| Лимфоцитов [10 3 / мкл] | 3,88 | 3,76 |
| Лимфоцитов (%) | 44,70 | 33,6 |
| Красные кровяные клетки [10 6 / мкл] | 3,65 | 3,05 |
| В доме данных | ||
| Сотовый номер после Ficoll-Paque | 206 м | 309 м |
| Сотовый номер после разделения MACS | 22 M | 16,5 м |
| Общее количество событий (MoFlo XDP) | 30,57 M | 19,97 M |
| Жизнеспособность (%) | 98,00 | 98,00 |
| Клетки в ворота лимфоцитов (%) | 17,00 | 50,00 |
| CD19 + / CD34 + | ||
| Общее количество сотовых | 10959 | 48316 |
| % От общей события | 0,04 | 0,24 |
| Эффективность | 88% | 88% |
| CD19 + / CD34 - / CD45 низкой | ||
| Общее количество сотовых | 16619 | 26941 |
| % От общей события | 0,05 | 0,13 |
| Эффективность | 89% | 87% |
| CD19 + / CD34 - / CD45 мед | ||
| Общее количество сотовых | 469745 | 507540 |
| % От общей события | 1,54 | 2,54 |
| Эффективность | 89% | 89% |
| CD19 + / CD34 - / CD45 высокой | ||
| Общее количество сотовых | 1896062 | 2047142 |
| % От общей события | 6,2 | 10,25 |
| Эффективность | 91% | 90% |
Таблица 1. Представитель ячейки рода статистика. Строки 1-5 являются рассчитывает предоставляемых объекта пуповинной крови. Остальные строки данных, собранных в нашей лаборатории. Плохо рода, содержащиеся высоких уровнях мусора и низкий процент клеток в лимфоциты ворот.
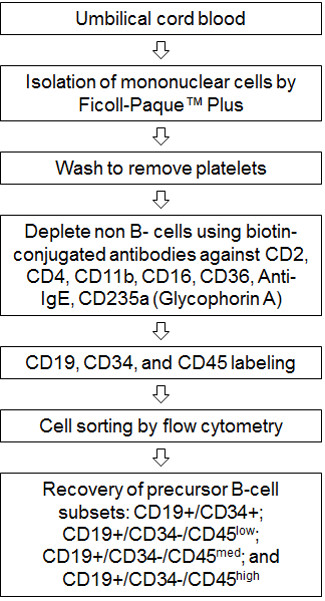
FIGURe 1. Блок-схема процедуры. Пуповинная кровь обрабатывается и мононуклеарных клеток выделяют с помощью Ficoll-Пак плюс. Дополнительным шагом стирка включены, чтобы удалить загрязнения тромбоцитов. B-клетки выделяют из мононуклеарных клеток, используя MACS человека B-изолятор комплект (В-ХЛЛ). Этот шаг используется биотин-сопряженных моноклональных антител (CD2, CD4, CD11b, CD36, анти-IgE и CD235a), чтобы удалить все не-В-клеток. Восстановленные B-клетки помечены CD19-APC, CD34-PE и CD45-FITC антитела затем сортируются с использованием потока MoFlo XDP цитометр для восстановления предшественника В-клеточных подмножеств: CD19 + / CD34 +; CD19 + / CD34 - / CD45 низкой , CD19 + / CD34 - / CD45 мед и CD19 + / CD34 - / CD45 высокой.
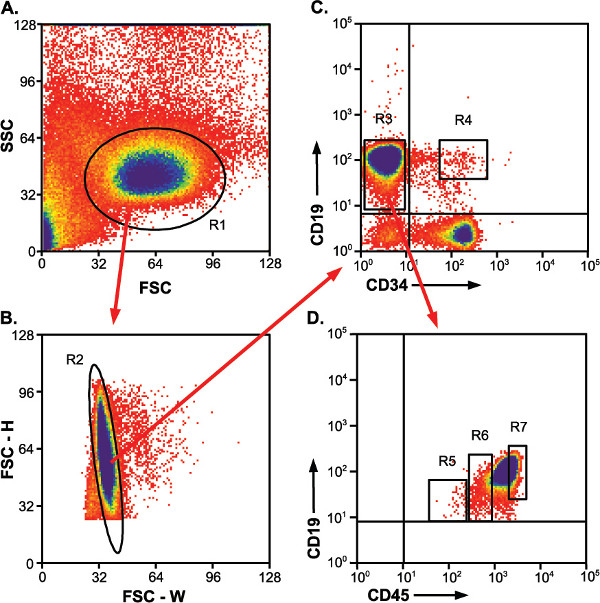
Рисунок 2. Память стратегии для выявления и сортировки поп-ulations. Красные стрелки показывают ворота, которые применяются к последующим сюжетом. R4, R5, R6 и R7 ворота указывают отсортированы населения.) Вперед по сравнению с разбросом стороне график, показывающий обогащенной популяции лимфоцитов. R1, лимфоцитов ворот. Б) Рост по сравнению с шириной вперед сюжет разброс для идентификации отдельных клеток по сравнению с дублетов. R2, одна ворот клетки. С) CD19-позитивные клетки APC попадают в CD34-PE отрицательные и положительные населения. R3, CD19 + / CD34 - ворота, R4, CD19 + / CD34 + ворота указывает желаемый вид населению г) CD19 + / CD34 - клетки делятся на три несколько различающихся CD45-FITC населения.. R5 и R6, CD19 + / CD34 - / CD45 низкой и CD19 + / CD34 - / CD45 мед населения, соответственно. R7, из-за высокого количества клеток в CD19 + / CD34 - / CD45 высокой плотностью населения, этот вид ворот включает в себя толькоЧасть населения. Все клетки этой популяции не должны быть собраны для последующего анализа.
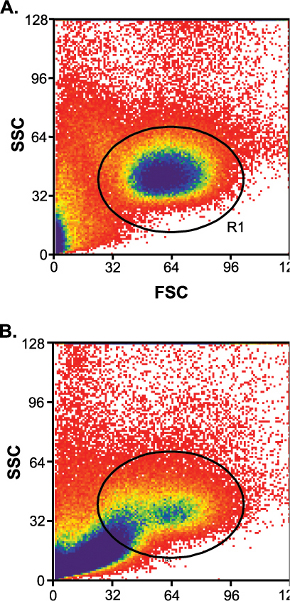
Рисунок 3.) Низкий уровень загрязнения мусором после того, как колонна обогащения. R1, лимфоцитов ворот. Б) высокий уровень загрязнения мусором после того, как колонна обогащения.
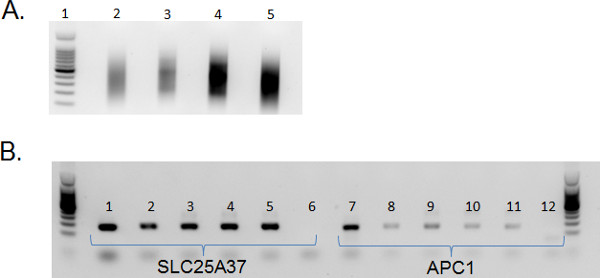
Рисунок 4. Обогащение метилированной ДНК из подмножеств предшественников В-клеток.) Ультразвуком ДНК, выделенной из предшественников В-клеточных подмножеств высокого качества. Для библиотек ДНК строительства ультразвуком в среднем до 200-600 базисных пунктов. Полоса 1: Promega 100 б.п. лестнице (каталог # G2101); Lane 2: Total ДНК, выделенной из CD19 + / CD34 + клеток; переулок, дом 3: Всего ДНК, выделенной из CD19 + / CD34 - / CD45 низкой клеток; Lane 4: 100 нг ДНК, выделенной из CD19 + / CD34 - / CD45 мед клеток; Lane 5: 100 нг ДНК, выделенной из CD19 + / CD34 - / CD45 высокой клеток. ДНК ультразвуком помощью Bioruptor Diagenode на высоко в течение в общей сложности 9 мин (30 сек ON; 30 сек OFF). ДНК была колонка очищенный и визуализируется на 1% агарозном геле с SYBR зеленого нуклеиновых кислот гель пятно. Б) После MIRA помощью ActivMotif MethylCollector Ультра комплекта ПЦР с SLC25A37 (1-6) и APC1 (7-12) проводится для подтверждения Обогащение метилированную ДНК. 1 и 7: ультразвуком геномной ДНК (не MIRA), 2 и 8: MIRA-CD19 + / CD34 + ДНК, 3 и 9: MIRA-CD19 + / CD34 - / CD45 низкой ДНК, 4 и 10: MIRA-CD19 + / CD34 - / CD45 мед ДНК, 5 и 11: MIRA -CD19 + / CD34 - / CD45 высокой ДНК, 6 и 12: Вода контроль. Высшее усиления SLC25A37 подтверждает обогащения метилированной ДНКВ подмножеств предшественники В-клеток.
Обсуждение
Фактор, наибольшее влияние на успех протокола является наличие загрязнения мусором. Если запрашивающий кровь из банка пуповинной крови очень важно, чтобы кровь отправлены, как только после сбора, как это возможно. Кроме того, образцы, которые классифицируются как лимфоцитоз содержат большее количество лимфоцитов, однако эти образцы не имеют достаточного количества предшественников В-клеток и не должна быть использована. Чтобы увеличить вероятность получения достаточного количества клеток для каждого из предшественников подмножества мы рекомендуем начиная по крайней мере с 85 мл пуповинной крови.
Важно отметить, что в отличие от взрослых периферической крови разделений, когда фракционирования пуповинной крови мононуклеарных слоя часто загрязнены красных кровяных клеток 12. Этот протокол включает в себя дополнительный шаг мыть, чтобы удалить загрязнения тромбоцитов. Протоколы описания мононуклеарных расстояния из пуповинной крови предлагают в том числе т шаг лизисO удаления нежелательных красных кровяных клеток. Мы не рекомендуем этот шаг, поскольку он производит загрязнение мусором и оказывает негативное влияние на успех ячейки рода.
Для того, чтобы уменьшить количество ячеек, которые должны быть выделены проточной цитометрии необходимо выполнить B-клетки обогащения до сортировки клеток. Протокол, предоставляемый Miltenyi Biotec, который сопровождает B-изолятор Kit (В-ХЛЛ), была оптимизирована для периферической крови и рекомендует использовать 10 мкл В-ХЛЛ биотином антитела коктейль за 10 миллионов клеток. На этом этапе используются антитела против CD2 (Т-клетки, NK-клетки), CD4 (Т-клетки), CD11b (гранулоциты, моноциты, макрофаги), CD16 (NK клеток, макрофагов, тучных клеток), CD36 (тромбоциты), CD235a (эритроидных клеток) истощать, не-B клеток из пуповинной крови. Важно использовать набор описанных и не B-изолятор комплект II, потому что бывшие комплект содержит антитела против CD43, который присутствует на про-В-клеток. Во время нашего опtimization этого протокола, мы обнаружили, что в общей сложности 40 мкл В-ХЛЛ коктейль антител биотин, достаточно для получения положительного результата рода клетки. Кроме того, мы обнаружили, что использование всего лишь 5 мкл больше В-ХЛЛ коктейль антител биотин оказывают неблагоприятное воздействие на клетки рода. Поэтому мы настоятельно рекомендуем использовать 40 мкл В-ХЛЛ коктейль антител биотин для общего мононуклеарных номера сотовых между 175-250 миллионов. Если, начиная с нижнего или выше количества клеток может быть необходимо для расширения реагентов соответственно.
Есть множество противоречивых публикаций, описывающих маркеры, которые могут быть использованы для различения субпопуляции В-клеток. Большинство расхождение можно объяснить тем, что дифференциация непрерывный процесс, и что наличие или отсутствие маркеров клеточной поверхности происходит в постепенном образом, а не в все или ничего манере. В этом протоколе CD34 - / CD19 + и уровень интенсивности CD45 + (низкий, средний, высокий) выражение используется, чтобы различать предварительно BI, предварительно BII и незрелых В-клеток с повышением уровня экспрессии CD45 соответствующие прогрессии дифференциации 6. Pro-B клетки были описаны некоторые, CD19 + / CD34 + 13 в то время как другие показали, что про-В-клетки CD19 - / CD34 + и предварительно BI клетки CD19 + / CD34 + 9,10. Основываясь на этих расхождениях мы обозначили CD19 + / CD34 + клеток, как в конце про-В-клеток / начале предварительного BI клеток. Важно отметить, что эта стратегия была разработана, чтобы изолировать подмножества предшественники В-клеток, которые соответствуют клетки, страдающих этим заболеванием острым лимфобластным лейкозом. Однако, есть несколько сортировки стратегий, которые могут быть использованы в зависимости от клетки подтипа интерес.
Антитела-флуорохромом комбинации должны быть выбраны исходя из возможностей имеющегося сортировщик клеток. Как родамл правило, самые яркие флуорохромом в панели должны быть использованы для обозначения наименее населенный антиген, и наоборот. В обнаружения двойной окрашенных населения, особенно редких событий, таких, как эти, дублет дискриминации (рис. 2В) является жизненно важной частью литниковой стратегии. Это гарантирует, что двойные позитивные события действительно одна клеток, окрашенных с обеих антител, а не просто две отдельные окрашенные клетки придерживаться друг друга.
Высокая скорость, 4-х сортировки клеток обязательно создает контролируемую среду аэрозолей. Таким образом, живые человеческие сортировки клеток должны проводиться с большой осторожностью. Опубликовано безопасности и обеззараживания принципов имеются в наличии и должны быть пересмотрены и реализованы до рода 14. Утверждение от институционального комитета по биобезопасности или их эквивалентов может потребоваться до сортировки. Для надлежащего обеззараживания после сортировки, дезинфицирующие средства должны быть добавлены в контейнер для отходов до конечной концентрации 10%. Сиmilarly, все образцы труб, а также все поверхности в непосредственной близости должны быть тщательно обеззаражены свежеприготовленный 10% раствор отбеливателя.
В целом, этот протокол обеспечивает стратегию для получения редких популяций предшественников В-клеток и могут быть изменены, чтобы изолировать любого редкого населения присутствует в пуповинной крови, в том числе гемопоэтических стволовых клеток и незрелых Т-клеток. Недавно незрелых клеток были выявлены в периферической крови пациентов с поздними стадиями ВИЧ 15. Таким образом, полезность этого метода выходит за рамки изучения рака крови. Наконец, мы еще не выполнили РНК изоляции на поток отсортированных клеток, однако этот метод должен быть адаптирован с оговоркой, что во время сортировки клеток, клетки должны быть отсортированы непосредственно в TRIzol или эквивалентной РНК-совместимых решений, таких как RLT из набора RNeasy через Qiagen.
Раскрытие информации
Авторы не имеют ничего раскрывать.
Благодарности
Эта работа была выполнена при поддержке Национального института здоровья (NCI R00 CA132784) для KT
Материалы
| Name | Company | Catalog Number | Comments |
| DPBS (1X) | Gibco by Life Technologies | 14190-144 | |
| Ficoll-Paque PLUS | GE Healthcare Bio-Sciences AB | 17-1440-03 | |
| LS Column | MACS Miltenyi Biotec | 130-042-401 | |
| MACS Multi Stand | MACS Miltenyi Biotec | 130-042-303 | |
| MidiMACS Separator | MACS Miltenyi Biotec | 130-042-302 | |
| B-Cell Isolation Kit (B CLL) | MACS Miltenyi Biotec | 130-093-660 | |
| Fetal Bovine Serum | ATLANTA Biologicals | S11195 | |
| Microcentrifuge tube (1.5 ml) | MIDSCI | SS1500 | |
| BD Pharmingen 7-AAD (7-Aminoactinomycin D) | BD Biosciences | 559763 | |
| DB Pharmingen APC Mouse Anti-Human CD19 | BD Biosciences | 555415 | |
| DB Pharmingen PE Mouse Anti-Human CD34 | BD Biosciences | 560941 | |
| CD45 FITC | BD Biosciences | 347463 | |
| autoMACS Rinsing Solution | MACS Miltenyi Biotec | 130-091-222 | |
| MACS BSA Stock Solution | MACS Miltenyi Biotec | 130-091-376 | |
| BD Falcon 5 ml Polystyrene Round-Bottom Tube | BD Biosciences | 352058 | |
| BD Falcon 50 ml Tube | BD Biosciences | 352098 | |
| PuraFlow Sheath Fluid, 8X | Beckman Coulter | CY30230 | |
| FlowCheck Alignment beads | Beckman Coulter | 6605359 | |
| Ultra Rainbow Alignment beads | Spherotech | URFP-30-2 | |
| ViroSafe Aerosol Evacuation Filter | Beckman Coulter | ML01330 | |
| ABC Mouse bead kit | Invitrogen | A-10344 | |
| 40 μm cell strainer | Fisher Scientific | 22363547 | |
| Fisher Scientific Hemocytometer | Fisher Scientific | 267110 | |
| Microscope | |||
| accuSpin Model 3R Benchtop Centrifuge | Fisher Scientific | 13-100-516 | |
| MoFlo XDP flow Cytometer | Beckman Coulter | ML99030 | |
| Aerosol Evacuation Unit | Beckman Coulter |
Ссылки
- Song, F., et al. Association of tissue-specific differentially methylated regions (TDMs) with differential gene expression. PNAS. 102 (9), 3336-3341 (2005).
- Ohgane, J., Yagi, S., Shiota, K. Epigenetics: The DNA methylation profile of tissue-dependent and differentially methylated regions in cells. Placenta. 29 (S), 29-35 (2008).
- Brown, G., et al. The sequential determination model of hematopoiesis. Trends Immunol. 28 (10), 442-448 (2007).
- Clark, P., et al. Lymphocyte subsets in normal bone marrow. Blood. 67 (6), 1600-1606 (1986).
- Loken, M. R., et al. Flow cytometric analysis of human bone marrow. II. Normal B lymphocyte development. Blood. 70 (5), 1316-1324 (1987).
- Caldwell, C. W., Poje, E., Helikson, M. A. B-cell precursors in normal pediatric bone marrow. American Journal of Clinical Pathology. 95 (6), 816-823 (1991).
- Tucci, A., et al. Are cord blood B cells functionally mature? Clin. Exp. Immunol. 84 (3), 389-394 (1991).
- Ghia, P., et al. Ordering of human bone marrow B lymphocyte precursors by single-cell polymerase chain reaction analyses of the rearrangement status of the immunoglobulin H and L chain gene loci. J. Exp. Med. 184, 2217-2219 (1996).
- Noordzij, J. G., et al. Composition of precursor B-cell compartment in bone marrow from patients with X-linked agammaglobulinemia compared with healthy children. Pediatric Research. 51 (2), 159-168 (2002).
- van Zelm, M. C., et al. Ig gene rearrangement steps are initiated in early human precursor B cell subsets and correlate with specific transcription factor expression. J. Immunol. 175 (9), 5912-5922 (2005).
- Rauch, T. A., Pfeifer, G. P. The MIRA method for DNA methylation analysis. Methods Mol. Biol. 507, 65-75 (2009).
- Kanof, E. M., et al. Isolation of whole mononuclear cells from peripheral blood and cord blood. Current Protocols in Immunology. , Suppl 19. 7.1.1-7.1.7 (1996).
- LeBien, T. W. Fates of human B-cell precursors. Blood. 96 (1), 9-23 (2000).
- Schmid, I., et al. International society for analytical cytology biosafety standard for sorting of unfixed cells. Cytometry A. 71 (6), 414-437 (2007).
- Malaspina, A., et al. Appearance of immature/transitional B cells in HIV-infected individuals with advanced disease: correlation with increased IL-7. PNAS. 103 (7), 2262-2267 (2006).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены