Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Использование рГлуорин для оценки динамики аксонов Руководящие рецепторы в клеточной культуре и в Чик эмбриона
В этой статье
Резюме
Мы описываем здесь использование рН чувствительных зеленый флуоресцентный вариант белка, pHluorin, для изучения пространственно-временной динамики аксоновых рецепторов руководства торговли на поверхности клетки. Рецептор с тегами рГлуорина выражается как в клеточной культуре, так и в in vivo,с использованием электропорации эмбриона птенца.
Аннотация
Во время разработки рецепторы аксонового наведения играют решающую роль в регулировании чувствительности аксонов как к привлекательным, так и к отталкивающим сигналам. Действительно, активация рецепторов наведения является первым шагом сигнальных механизмов, позволяющих аксоновые наконечники, конусы роста, реагировать на лиганды. Таким образом, модуляция их наличия на поверхности клетки является одним из механизмов, которые участвуют в установлении чувствительности конуса роста. Мы описываем здесь метод точно визуализировать пространственно-височной динамики поверхности клеток аксонового рецептора как in vitro, так и in vivo в развивающемся спинном мозге птенца. Мы воспользовались рН-зависимой флуоресценции собственности зеленого флуоресцентного белка (GFP) вариант специально обнаружить долю аксонового рецептора руководства, который адресован плазменной мембраны. Сначала мы описываем in vitro проверки таких рН-зависимых конструкций, и мы более подробно их использование in vivo, в цыпленок спинного аккорда, для оценки пространственно-временной динамики аксон руководство рецептор интереса.
Введение
Во время навигации аксоны интегрируют несколько экологических сигналов, которые направляют их к цели. Эти сигналы активируют наведение рецепторов на поверхности аксоновых терминалов, конусов роста, которые, в свою очередь, инициируют соответствующий сигнальный путь. Таким образом, височное и пространственное регулирование распределения поверхности клеток рецепторов имеет решающее значение для установить чувствительность конуса роста1. В этом контексте, средней линии пересечения комиссариальных аксонов является отличной моделью для исследования регулирования уровней поверхности рецепторов клеток. В развивающемся спинном мозге, комиссаральные аксоны первоначально привлекают к брюшной пластины пола, где они пересекают средней линии. После пересечения, они теряют свою отзывчивость на пол пластины притягания и получить ответ на пол пластины репелленты, чтобы они могли выйти из пола пластины и перейти к их конечного пункта назначения в контралатеральной стороненервной системы 2,3. Регулирование доступности рецепторов на поверхности конуса роста является одним из механизмов, лежащих в основе переключения отзывчивости на сигналы среднейлинии 4,5. Таким образом, избирательный мониторинг рецепторов, присутствующих на плазменной мембране конусов роста, имеет первостепенное значение. Мы описываем здесь метод, основанный на рН-зависимых флуоресценции собственности зеленого флуоресцентного белка (GFP) вариант специально визуализировать аксон наведения рецепторов, которые адресованы плазменной мембраны in vitro и in vivo, в развивающихся цыпленок спинного мозга.
Ротман и его коллеги, разработанные точечными мутациями рН-чувствительных вариантов GFP, включая эклиптический рГлуорин6. Эклиптический рГлуорин имеет свойство быть нефлуоресцентным при воздействии кислого рН (<6), будучи флуоресцентным при нейтральном рН. Это позволяет отличить нефлуоресцентные рецепторы, локализованные во внутриклеточных кислых отсеках(т.е. эндосомы, оборот пузырьков) от флуоресцентных рецепторов, включенных в плазменную мембрану и, таким образом, подверженных внеклеточному нейтральномурН 7. Мы воспользовались этим для мониторинга локализации плазменной мембраны plexinA1, рецептора наведения аксона, окаймлив реакцию конуса роста на реакцию среднего репеллента семафорина 3B5 (Рисунок 1A). Мы описываем здесь in vitro характеристику конструкции pHluorin-plexinA1, вместе с в электропорации ово 8-10 этой конструкции в развивающемся спинном мозге цыпленка последованной за микроскопическим анализом cryosections которые позволяют последовать за динамикой рецептора наведения аксона in vivo с и пространственными и височные разрешения.
Access restricted. Please log in or start a trial to view this content.
протокол
1. Стратегия клонирования для тегов PlexinA1 Рецептор с плюхлуорин
- Выберите подходящий вектор выражения в качествепозвоночника (например, мышь рецептора plexinA1 экспрессии вектор, добрый подарок д-р Андреас Puschel11).
Примечание: Этот вектор plexinA1 был разработан для достижения эффективной ВА- или VSV-тегами вставки рецепторов в плазменной мембране. - Усиление ПЦР эклиптической последовательности кодирования рГлуорин с использованием адекватной плазмиды в качестве шаблона (например, рГлуорин помечены ГАМК рецептор, добрый подарок д-р Иаков2). При необходимости добавьте сайт ограничения к концу грунтовки 5', чтобы облегчить шаг клонирования в позвоночнике.
- Вставьте последовательность рГлуорин в кадре между пептидом сигнала и последовательностью кодирования рецепторов с использованием сайтов ограничения(например, сайты ограничения NruI/Kpn2I, описанные на рисунке 1B).
Примечание: Потому что пептид сигнала который обеспечивает правильно пристрелить приемных рецепторов cleaved, pHluorin должно быть помещено после его. Это гарантирует признание пептида сигнала и предотвращает расщепление рГлуорин от рецептора интереса. - Последовательность конструкций, полученных для обеспечения того, чтобы ПЦР не ввел мутации.
2. Характеристика рГлуорин-тегами Рецептор in vitro в клетках COS7
Способность белка синтеза достичь плазменной мембраны и ее обратимая потеря флуоресценции при снижении рН могут быть подтверждены с помощью следующей процедуры.
- День 1. Плита 1,5 х 105 COS7 клеток в стеклянном дне 35 мм блюдо в 2 мл полного Dulbecco модифицированных иглы средних (DMEM - 10% Фетальный бычьего сыворотки - 1 мМ пируват натрия - 25 U/ml пенициллин / стретомицин - 2,5 мкг / мл Амфотерицин B - pH 7,4).
- День 2. Трансфектные клетки:
Примечание: Клетки должны быть 70-80% стечения.- Приготовьте 200 мкл NaCl 150 мМ и добавьте 3 мкг ДНК, т.е. вектор, кодирующий рецептор с тегами рГлуорин. Аккуратно вихрь и спина вниз кратко.
Примечание: Карта вектора рГлуорин-плексинА1, используемого в этих экспериментах, показана на рисунке 1B. - Добавьте 10 мл трансфектного реагента (или соответствующее количество используемого реагента). Вихрь немедленно.
- Инкубация 10 мин на RT.
- Добавьте в клетки 200 мкл смеси трансфектного реагента/ДНК.
- Переместите пластину осторожно, чтобы добиться повторного отливка смеси и поместите клетки обратно в инкубатор 37 градусов по Цельсию.
- Приготовьте 200 мкл NaCl 150 мМ и добавьте 3 мкг ДНК, т.е. вектор, кодирующий рецептор с тегами рГлуорин. Аккуратно вихрь и спина вниз кратко.
- День 3. Удалите трансфекцию среды и замените ее на 2 мл свежей полной DMEM.
- День 4. Выполните живую клеточное изображение трансинфекционных клеток COS7 pHluorin-plexinA1:
- Подготовь две алициты полной среды DMEM и отрегулируйте рН до 3,5 и до 9,5 соответственно.
Примечание: Для одной 35-мм пластины для проведения эксперимента требуется 1,5 мл каждого раствора. - Удалите клеточной среды и заменить его на 1 мл DMEM полный средний рН 7,4.
- Приготовьте шприц 5 мл с соответствующим типом труб для того, чтобы вводить различные компоненты непосредственно в среду клеточной культуры, не открывая микроскопную камеру.
- Используйте модуль, который позволяет поддержание 37 градусов по Цельсию, 5% CO2 влажной рабочей атмосферы.
Примечание: Альтернативный подход к использованию камеры CO2 заключается в использовании HEPES-буферной среды (обычно в диапазоне 10-25 мМ в зависимости от типа ячейки). - Поместите клетки в камеру и отрегулируйте трубки и шприц.
Примечание: Микроскоп должен быть уравновешен, прежде чем начать избегать механического дрейфа во время записи. - Откройте программное обеспечение для визуализации и выберите многомерную программу приобретения.
- Найдите трансфицированные ячейки COS7 с целью 40X и отметдайте положение в программном обеспечении для каждого из них.
- Настройте стек на 15 мкм (фокус может измениться при добавлении мультимедиа в пластину).
- Настройка экспозиции для фильтра GFP и фазы.
- Настройте время приобретения.
Примечание: В течение всего эксперимента с 5 областями, представляющими интерес, приобретение каждые 20 секунд в течение 10 минут должно быть достаточным. - Начните приобретение и возьмите 5 контрольных изображений в DMEM pH 7.4 среды.
- Пауза приобретения, вводить 1,25 мл рН 3,5 полный DMEM для достижения рН 5,5 в среде культуры, знак событие в программном обеспечении и возобновить приобретение еще на 5 времени точек.
Примечание: Зеленая флуоресценция должна постепенно исчезать. - Пауза приобретения, придать 1,2 мл рН 9,5 полный DMEM для достижения рН 7,4 в среде культуры, знак событие в программном обеспечении и возобновить приобретение еще на 5 пунктов времени.
Примечание: Зеленая флуоресценция должна появиться на плазменной мембране. - Анализ изображений.
На рисунке 2 показаны репрезентативные изображения, полученные с помощью такого протокола с конструкцией pHluorin-plexinA1.
- Подготовь две алициты полной среды DMEM и отрегулируйте рН до 3,5 и до 9,5 соответственно.
3. В ово Электропорация рГлуорина-плексина1 Конструкция
- Обработка яиц перед электропорацией:
- Храните оплодотворенные яйца в холодильнике при 14 градусах Цельсия до одной недели до инкубации.
- Инкубационые яйца при 38,5 градусов по Цельсию (101,3 градуса по Фаренгейту) в инкубаторе с насыщенной влажностью в течение 50-52 часов, пока эмбрионы не достигнут стадии HH1412.
Примечание: Яйца должны быть размещены горизонтально во время инкубации, так что эмбрион правильно расположен для электропорации, плавающие на верхней части желтка. HH14 этап подходит для получения выражения плазмидов в дифференцированных нейронов в спинном мозге и в спинном корневом ганглионе с соответствующей выживаемости.
- Электропоратыэмбрионов 8-10:
- Подготовка электропорации:
- Приготовьте плазмиды ДНК без эндотоксина с концентрацией, превосходящей 2 мкг/ль, чтобы иметь возможность разбавить его в качестве желаемой концентрации.
- Потяните достаточно стеклянных капилляров, чтобы ввести различные решения ДНК.
- Приготовьте стерильный PBS (-Ca2' ; -Mg2)- 100 U/ml пенициллин/стрептомицин и эквилибраты при 38,5 градусов по Цельсию.
- Стерилизовать капюшон, изогнутые ножницы и тонкие типсы.
- Управление интервалом электродов.
Примечание: 4 мм пространство между электродами, как правило, используется.
- Окно яйцо13 (Рисунок 3A):
- Используйте изогнутые ножницы, чтобы пробить оболочку на тупой стороне яйца.
- Удалите 2 мл альбумена с помощью иглы 0,9 мм х 25 мм и шприца 5 мл. Ориентируйте иглу вертикально, чтобы не повредить желточный мешок.
- Обложка верхней части яйца с лентой для поддержания целостности оболочки.
- Используя изогнутые ножницы, проколоть оболочку в середине ленты, чтобы уравнять давление при удалении 2 мл альбума из яйца. Затем вырежьте окно достаточно большим, чтобы визуализировать эмбрион и быть в состоянии работать на нем.
- Добавьте стерильный теплый PBS (-Ca2'; -Mg2)- 100 U/ml пенициллин/стрептомицин, чтобы избежать обезвоживания эмбриона и сделать его более доступным для манипулятора.
- Инъекция ДНК и электропорат эмбриона
- Разбавить плазмид в PBS (-Ca2"; -Mg2"в концентрации между 0,5-2 мкг / л и добавить быстрый зеленый краситель, чтобы достичь окончательной концентрации 0,025%. Загрузите смесь ДНК в капилляр. Рекомендуется использовать инжектор.
Примечание: Убедитесь, что капиллярная устойчивость не слишком велика (имеется в виду могут возникнуть трудности при введении эмбрионов) и не слишком мала (имеется в виду, что капилляр может быть слишком большим и может повредить эмбрион). Кроме того, концентрация нуклеиновых кислот выше 2 мкг/ль может вызвать неопределенные последствия и нуждается в контроле. - Прокол желток-мешок и нервной трубки на хвостовой стороне с загруженным капилляром. Введите нейронную трубку с мелким углом и заполнить люмен от хвоста до головы с ДНК смеси(рисунок 3B).
Примечание: Быстрый зеленый позволяет контролировать точность инъекций. - Быстро поместите 4 мм платиновые электроды по обе стороны от нервной трубки на уровне, который вы хотите электропорат и применить 3 импульса на 31 V для 50 msec с интервалом 500 мсек (Рисунок 3C).
Примечание: Избегайте размещения электродов на сердце или на больших дополнительных эмбриональных сосудах, чтобы избежать повреждения развивающегося эмбриона. Пузыри должны образовываться на электродах. - С помощью иглы удалите 2 мл альбума, чтобы снизить уровень в оболочке.
- Печать окна и тупой стороны герметично с лентой.
- Положите яйца обратно на 38,5 градусов по Цельсию в инкубаторе, пока они не достигнут желаемой стадии.
- Разбавить плазмид в PBS (-Ca2"; -Mg2"в концентрации между 0,5-2 мкг / л и добавить быстрый зеленый краситель, чтобы достичь окончательной концентрации 0,025%. Загрузите смесь ДНК в капилляр. Рекомендуется использовать инжектор.
- Подготовка электропорации:
4. Встраивание эмбрионов и криозирование
- 48 часов после электропорации, тщательно собирают электропогрятые эмбрионы (стадия HH24). Вырежьте ленту и половину хориоаллантоидной мембраны. Чтобы предотвратить погружение эмбрионов в желток, располагайте дуршлаг под эмбрионом и разрезайте вторую половину хориоаллантоидной мембраны.
- Перенесите эмбрион в рассечение блюдо, наполненное ледяным PBS.
- Проверьте эффективность электропорации, ищя флуоресценцию в нервной трубке с помощью стерео микроскопа флуоресценции.
Примечание : Coelectroporation контроля плазмид кодирования RFP может помочь визуализировать электропорожной области. - Рассекают эмбрионы с помощью микроскальпеля для выбора электропороговой области спинного мозга.
- Передача расчлененных эмбрионов на пластину из 24 колодец и фиксация рН 7,4 4% Параформалдегид (PFA) - фосфат буферный салин (PBS), O/N при 4 КК.
Примечание: Шаг фиксации имеет решающее значение для стабилизации рГлуорин в его "живой" конформации и, таким образом, чтобы иметь возможность использовать плюхлуорин в фиксированной / permeabilized ткани. Хотя фиксация резко замедляется, зависит от рН изменения флуоресценции, необходимо учитывать, что конформациальные / протонации изменения все еще могут произойти после фиксации. Таким образом, следующий протокол (встраивание, криозации и наблюдение) должен быть выполнен в течение 3 дней после шага фиксации, со всеми буферами при рН 7. Если фиксация не требуется, рекомендуется проводить наблюдения на секциях живой ткани. - Удалите 4% PFA и мыть эмбрионы в рН 7,4 PBS.
- Инкубациоть эмбрионы в PBS-15% сахарозы и держать на 4 градусов по Цельсию, пока эмбрионы раковины.
- Инкубировать фиксированные эмбрионы в рН 7,4 7,5% желатина- 15% сахарозы в течение 45 мин при 37 градусов по Цельсию, чтобы эмбрионы полностью встроены.
- Поместите встраивание форм на лед и добавьте 400 мкл рН 7,4 7,5% желатина - 15% сахарозы для достижения твердой 2 мм базы.
- Аспирировать встроенный эмбрион с разрезом кончика и поместить эмбрион на твердое основание желатина.
- Обложка с рН 7,4 7,5% желатина- 15% сахарозы и положение эмбриона с типсами до желатина затвердевает.
- После того, как желатин твердый, подготовить -40 градусов по Цельсию изопропанол ванны (использовать сухой лед или жидкий азот) и заморозить желатин блок в течение 5 мин.
- Держите замороженные блоки при -80 градусов по Цельсию.
- Поместите замороженный блок при -20 градусов по Цельсию в течение 1 часа.
- Удалите плесень и исправить блок на патрон с полиэтиленгликоль среды.
- После того, как блок плотно фиксированной, поместите патрон в криостат системы.
Примечание: Используйте покрытые слайды, чтобы избежать потери тканей во время окрашивания. - Выполняем серийные криозы (обычно выполняются 20 криозекций).
- Пусть cryosections сухой в течение 15 минут на RT.
Примечание: cryosections должны быть защищены от ненужного воздействия света, чтобы избежать отбеливания флуоресценции GFP.
5. Микроскопический анализ криозекции
- Регидратировать криозации в рН 7,4 PBS на RT в течение 10 мин.
Примечание: При необходимости ядра могут быть запятнаны Hoechst. - Используйте раствор 0,5 мкг/мл Hoechst в PBS и инкубировать криозы в течение 15 мин.
- Промыть слайды 3x с рН 7,4 PBS в течение 5 мин.
- Приступайте к монтажу слайдов. РН 7.4 (или более основной) поливиниловый спирт монтажный раствор, который затвердевает O / N может быть использован: тщательно распоистить крышку, чтобы избежать образования пузырьков воздуха между слайдом и крышкой.
- Пусть монтажная среда затвердевает O/N при 4 градусах цельсия в темноте.
- Используйте перевернутый конфокальный микроскоп, чтобы точно визуализировать белок синтеза pHluorin-plexinA1: выполняйте z-стек при оптимальном пинхоле и оптическом разрешении и используйте линзы 20X (NA 0.75) или 40X (NA 1.3).
Примечание: рГлуорин обнаруживается с теми же параметрами, которые используются для обнаружения GFP(т.е. пик выбросов на уровне 509 нм). Настройки волнового возбуждения и обнаружения фильтра оптимально определяются программным обеспечением для визуализации. Хохст обнаруживается между 425-460 нм (возбуждение составляет 405 нм), GFP или pHluorin обнаруживается между 485-545 нм (возбуждение на 473 нм) и RFP обнаруживается между 575-675 нм (возбуждение на 559 нм).
Репрезентативные изображения экспрессии рГлуорин-плексина А1 и eGFP в спинном мозге эмбриона цыпленка показаны на рисунке 4.
Access restricted. Please log in or start a trial to view this content.
Результаты
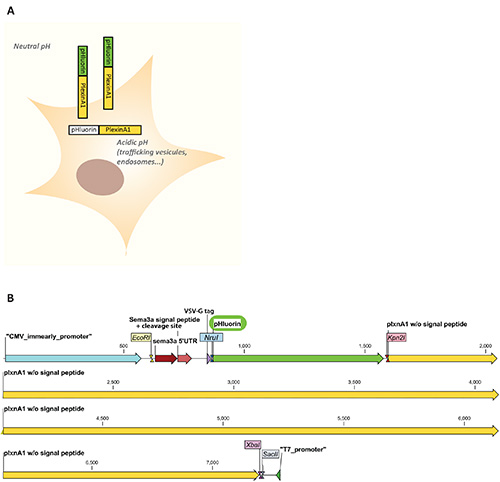
Рисунок 1. О. Схема свойств флуоресценции рГлуорин-плексина A1 в клеточном контексте. ПГЛуорин нетекутерпен в внутриклеточных отсеках, где рН кислый (<6), например, при тор?...
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Этот протокол обеспечивает пошаговую процедуру, чтобы следить за динамикой рецептора руководства аксона как в клеточной культуре, так и в контексте развития спинного мозга эмбриона цыпленка.
Для разработки белка с тегами de novo pHluorin необходимо учитывать две точки от?...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
Авторов нечего раскрывать.
Благодарности
Мы благодарим Хомайру Наваби, Фредерика Море и Изабель Саньяс за помощь. Эта работа поддерживается CNRS, Ассоциация Франсез contre les Myopathies (AFM), ANR YADDLE, Labex DevWeCan, Labex Cortex, ERC YODA В.C.; C.D-B и A.J поддерживаются стипендиями La Ligue contre le cancer и Labex DevWeCan, соответственно.
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| COS7 cells | ATCC | CRL-1651 | |
| DMEM GlutaMAX | GIBCO | 61965-026 | |
| Sodium pyruvate | GIBCO | 11360-039 | |
| Amphotericin B | Sigma | A2942 | |
| Fetal bovine serum | GIBCO | 10270-106 | |
| Penicillin/Streptomycin | GIBCO | 15140-122 | |
| Exgen500 reagent | Euromedex Fermentas | ET0250 | |
| PBS -Ca2+ -Mg2+ | GIBCO | 14190-094 | |
| Fast green dye | Sigma | F7252 | |
| 32% Paraformaldehyde aqueous solution | Electron Microscopy | 15714-S | Dilute extemporaneously in PBS to achieve a 4% solution |
| Gelatin from cold water fish skin | Sigma | G7041 | |
| Sucrose | Sigma | S0389 | |
| Cryomount | Histolab | 00890 | |
| Hoechst 34580 | Invitrogen | H21486 | |
| Mowiol 4-88 | Fluka | 81381 | |
| Consumables | |||
| Bottom-glass 35 mm dish | MatTek | P35G-1.5-14-C | |
| 5 ml Syringe | Terumo | SS-05S | |
| Needles 0.9 mm x 25 mm | Terumo | NN-2025R | |
| Capillaries | CML | PP230PO | capillaries are stretched manually in the flame |
| Superfrost Plus Slides | Thermo Scientific | 4951PLUS | |
| Material | |||
| Curved scissors | FST | 129-10 | |
| Microscalpel | FST | 10316-14 | |
| Forceps | FST | Dumont #5 REF#11254 | |
| Equipment/software | |||
| Time lapse microscope | Zeiss | Observer 1 | |
| Temp module S | PECON for Zeiss | ||
| CO2 module S | PECON for Zeiss | ||
| Metamorph software | Metamorph | ||
| Eggs incubator | Sanyo | MIR154 | |
| Electroporator apparatus | Nepa Gene CO., LTD | CUY21 | |
| Electrodes | Nepa Gene CO., LTD | CUY611P7-4 | 4 mm platinum electrodes |
| Fluorescence stereomicroscope | LEICA | MZ10F | |
| Cryostat | MICROM | HM550 | |
| Confocal microscope | Olympus | FV1000, X81 | |
| Fluoview software | Olympus | ||
| CLC Main Workbench software | CLC Bio |
Ссылки
- Winckler, B., Mellman, I. Trafficking guidance receptors. Cold Spring Harb. Perspect. Biol. 2, (2010).
- Jacob, T. C., et al. J. Neurosci. 25, 10469-10478 (2005).
- Nawabi, H., Castellani, V. Axonal commissures in the central nervous system: how to cross the midline. Cell Mol. Life Sci. 68, 2539-2553 (2011).
- Keleman, K., Ribeiro, C., Dickson, B. J. Comm function in commissural axon guidance: cell-autonomous sorting of Robo in vivo. Nat. Neurosci. 8, 156-163 (2005).
- Nawabi, H., et al. A midline switch of receptor processing regulates commissural axon guidance in vertebrates. Genes Dev. 24, 396-410 (2010).
- Miesenbock, G., De Angelis, D. A., Rothman, J. E. Visualizing secretion and synaptic transmission with pH-sensitive green fluorescent proteins. Nature. 394, 192-195 (1998).
- Miesenbock, G. Synapto-pHluorins: genetically encoded reporters of synaptic transmission. Cold Spring Harb. Protoc.. 2012, 213-217 (2012).
- Avraham, O., Zisman, S., Hadas, Y., Vald, L., Klar, A. Deciphering axonal pathways of genetically defined groups of neurons in the chick neural tube utilizing in ovo electroporation. J. Vis. Exp. (39), 1792-17 (2010).
- Blank, M. C., Chizhikov, V., Millen, K. J. In ovo electroporations of HH stage 10 chicken embryos. J. Vis. Exp. (9), (2007).
- Wilson, N. H., Stoeckli, E. T. In ovo electroporation of miRNA-based plasmids in the developing neural tube and assessment of phenotypes by DiI injection in open-book preparations. J. Vis. Exp. (68), (2012).
- Rohm, B., Ottemeyer, A., Lohrum, M., Puschel, A. W. Plexin/neuropilin complexes mediate repulsion by the axonal guidance signal semaphorin 3A. Mech. Dev. 93, 95-104 (2000).
- Hamburger, V., Hamilton, H. L. A series of normal stages in the development of the chick embryo. 1951. Dev. Dyn.. 195, 231-272 (1992).
- Korn, M. J., Cramer, K. S. Windowing chicken eggs for developmental studies. J. Vis. Exp. (8), (2007).
- Alberts, P., et al. Cdc42 and actin control polarized expression of TI-VAMP vesicles to neuronal growth cones and their fusion with the plasma membrane. Mol. Biol. Cell. 17, 1194-1203 (2006).
- Perret, E., Lakkaraju, A., Deborde, S., Schreiner, R., Rodriguez-Boulan, E. Evolving endosomes: how many varieties and why. Curr. Opin. Cell Biol. 17, 423-434 (2005).
- Li, Y., et al. Imaging pHluorin-tagged receptor insertion to the plasma membrane in primary cultured mouse neurons. J. Vis. Exp. (69), (2012).
- Tojima, T., Itofusa, R., Kamiguchi, H. Asymmetric clathrin-mediated endocytosis drives repulsive growth cone guidance. Neuron. 66, 370-377 (2010).
- Matsui, A., Yoshida, A. C., Kubota, M., Ogawa, M., Shimogori, T. Mouse in utero electroporation: controlled spatiotemporal gene transfection. J. Vis. Exp. (54), 3024-30 (2011).
- Falk, J., et al. Electroporation of cDNA/Morpholinos to targeted areas of embryonic CNS in Xenopus. BMC Dev. Biol. 7 (107), (2007).
- Holzhausen, L. C., Lewis, A. A., Cheong, K. K., Brockerhoff, S. E. Differential role for synaptojanin 1 in rod and cone photoreceptors. J. Comp. Neurol. 517, 633-644 (2009).
- Shang, Y., Claridge-Chang, A., Sjulson, L., Pypaert, M., Miesenbock, G. Excitatory local circuits and their implications for olfactory processing in the fly antennal lobe. Cell. 128, 601-612 (2007).
- Dittman, J. S., Kaplan, J. M. Factors regulating the abundance and localization of synaptobrevin in the plasma membrane. Proc. Natl. Acad. Sci. U.S.A. 103, 11399-11404 (2006).
- Bozza, T., McGann, J. P., Mombaerts, P., Wachowiak, M. In vivo imaging of neuronal activity by targeted expression of a genetically encoded probe in the mouse. Neuron. 42, 9-21 (2004).
- Sankaranarayanan, S., Ryan, T. A. Real-time measurements of vesicle-SNARE recycling in synapses of the central nervous system. Nat. Cell. Biol. 2, 197-204 (2000).
- Stark, D. A., Kasemeier-Kulesa, J. C., Kulesa, P. M. Photoactivation cell labeling for cell tracing in avian development. CSH Protoc.. 2008, (2008).
- Hildick, K. L., Gonzalez-Gonzalez, I. M., Jaskolski, F., Henley, J. M. Lateral diffusion and exocytosis of membrane proteins in cultured neurons assessed using fluorescence recovery and fluorescence-loss photobleaching. J. Vis. Exp. (60), (2012).
- Hanson, G. T., et al. Green fluorescent protein variants as ratiometric dual emission pH sensors. 1. Structural characterization and preliminary application. Biochemistry. 41, 15477-15488 (2002).
- Rose, T., Schoenenberger, P., Jezek, K., Oertner, T. G. Developmental refinement of vesicle cycling at schaffer collateral synapses. Neuron. 77, 1109-1121 (2013).
- Li, Y., Tsien, R. W. pHTomato, a red, genetically encoded indicator that enables multiplex interrogation of synaptic activity. Nat. Neurosci. 15, 1047-1053 (2012).
- de Wit, J., Toonen, R. F., Verhage, M. Matrix-dependent local retention of secretory vesicle cargo in cortical neurons. J. Neurosci. 29, 23-37 (2009).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены