Method Article
Метод мониторинга Доступное ВИЧ-1 Устойчивость к лекарству для настройки ограниченного ресурса
В этой статье
Резюме
Тестирование Лекарственная устойчивость ВИЧ-1-инфицированных лиц неудовлетворительную антиретровирусную терапию (АРТ) может служить ориентиром для будущих терапий и улучшить результаты лечения. Оптимизация частных лиц и населения последствия для здоровья в высокой распространенностью ВИЧ, но с ограниченными ресурсами в конечном итоге потребует недорогих и доступных генотипирование лекарственной устойчивости и методы интерпретации.
Аннотация
ВИЧ-1 лекарственная устойчивость имеет потенциал, чтобы создать серьезную угрозу эффективность и результативность антиретровирусной терапии (АРТ). Как ART программы в странах Африки южнее Сахары продолжают расширяться, лица АРТ следует внимательно следить за появлением лекарственной устойчивости. Наблюдение передаваемой лекарственной устойчивости, чтобы отслеживать передачу вирусных штаммов уже устойчивых к АРТ также имеет важное значение. К сожалению, тестирование лекарственной устойчивости до сих пор не легко доступны в условиях ограниченных ресурсов, потому что генотипирование дорого и требует сложного лабораторного и инфраструктуры управления данными. Открытый доступ генотипическая метод мониторинга лекарственной устойчивости управлять лиц и оценить переданную лекарственной устойчивости описывается. Метод использует свободное программное обеспечение с открытым исходным кодом для интерпретации резистентности наркотиков и генерации отдельных отчетов пациентов. Протокол генотипирование имеет уровень усиления более 95% для образцов плазмы с AVИРАЛ нагрузка> 1000 РНК ВИЧ-1 копий / мл. Чувствительность значительно уменьшается за вирусной нагрузкой <1,000 РНК ВИЧ-1 копий / мл. Описанный здесь метод был проверен на метод ВИЧ-1 лекарственной устойчивости тестирование утвержденной США продовольствия и медикаментов (FDA), методом ViroSeq генотипирования. Ограничения по способу, описанному здесь, включают тот факт, что он не автоматизированный и что он также не усиливать циркулирующей рекомбинантной форме CRF02_AG с пульта проверки образцов, хотя это усиливается подтипы А и В из той же панели.
Введение
Эпидемия ВИЧ в Южной Африке стремительно 1 развивается с сопутствующей экспоненциальному увеличению лиц по антиретровирусной терапии (АРТ), особенно в Южной Африке 2, 3. В качестве доказательства на эпидемиологического воздействия программ крупномасштабных лечения в снижении заболеваемости 4 и увеличения средней продолжительности жизни в странах с ограниченными ресурсами (RLS) 5 продолжает накапливаться, усилия по увеличению охвата АРТ будет усиливаться. Эволюция принципов к использованию лечения как профилактики инструмента 6, 7 под испытать и обработать программ означает, что абсолютное число лиц, получающих лечение приведет к дальнейшему увеличению. Большое количество лиц будет на АРТ в течение более длительных периодов времени, как средняя продолжительность жизни особей, получающих АРТ приближается, что из неинфицированных населения ВИЧ 8. Разработка и передача лекарственной устойчивости ВИЧ имеет ALWAYS были рассматриваться как угроза достижений АРТ 9-12. Таким образом, существует потребность в более строгой наблюдения и контроля за лекарственной устойчивости как все больше людей инициируются на АРТ.
Тестирования Генотипическая лекарственная устойчивость (ОТО) успешно используется в развитых странах, как для наблюдения, а также мониторинг ВИЧ-1 лекарственной устойчивости у лиц, получающих АРТ. В этих условиях, GRT была интегрирована в продолжающегося ухода за ВИЧ-1-инфицированных лиц. Большинство международных руководящие принципы рекомендуют ОТО для взрослых или детей больные не АРТ (первой линии и второй линии) 13-15, педиатрических больных подвергаются профилактики передачи ВИЧ от матери ребенку (ПМР) схемами, но впоследствии заражены 16, и в ситуациях, когда высокие уровни передаваемой лекарственной устойчивости среди остро инфицированных 13-15. Тем не менее, стоимость, технологии и инфраструктуры требования ограничили внедретации подобных подходов к мониторингу лекарственной устойчивости RLS.
Лечение ЮАР ВИЧ и руководящие принципы мониторинга в настоящее время не рекомендуется использовать ОТО в руководящей выбора АРТ для лиц противном случае схемы первой линии 17. Лица включаются базируется прежде всего на вирусологических (РНК ВИЧ-1 вирусной нагрузки) параметров. Однако в 2012 году, юга Африки Общество ВИЧ Клиницисты опубликовал первые южные руководящие принципы Африканского АРВ тестирования лекарственной устойчивости 18. Эти руководящие принципы рекомендуют тестирование GRT для всех взрослых противном случае первой линии и второй линии АРТ и для ВИЧ-инфицированных детей и детей, подвергшихся воздействию ППМР 18. Тем не менее, GRT не рекомендуется 18 для остро инфицированных, потому что в настоящее время нет доказательств для высоких уровней передаваемой лекарственной устойчивости в южной части Африки 19-29. Ожидается, что некоторые из этих рекомендаций будут интегрированы со временем в национальную третерпимостью и лечением и мониторинга руководящие принципы различных стран региона. Уже в южноафриканских принципов лечения 2013 в настоящее время рекомендация ОТО при возникновении неисправности второй линии для взрослых и во время первой или второй линии ПИ на основе отказа режим для детей 30.
Было показано, что включение ОТО в лечебных принципов в Южной Африке будет потенциально экономически нейтральным. Учитывая стоимость второго режима линия препаратов, которые относительно дороже, чем препараты первого ряда, с помощью ОТО для выявления пациентов, которые действительно должны быть переключен на второй линии терапии не приведет дополнительных затрат на программу. Кроме того, GRT может также определить и другие причины для отказа, сохранить варианты лечения и генерировать информацию о новых резистентности 31. Таким образом, необходимо снизить стоимость методов мониторинга лекарственной устойчивости еще дальше в целях улучшения доступа, качество ухода за апрезультаты. D
Здесь мы представляем метод GRT, предназначенный для использования универсальных (Open Source) праймеров для обратной транскрипции, полимеразной цепной реакции (ПЦР) и секвенирования (табл. 1), а также в основном с открытым исходным кодом программного обеспечения для интерпретации лекарственной устойчивости. Для клинического ведения, протокол дополняется комплексного метода обзора и отчетности с специалиста интерпретации отчета лаборатории лекарственной устойчивости с непосредственной соблюдения национальных руководящих принципов лечения. Протокол состоит из четырех различных компонентов: 1) ВИЧ рибонуклеиновой кислоты (РНК) добыча, 2) обратной транскрипции и полимеразной цепной реакции (ПЦР) амплификации вирусных мишеней, 3) Секвенирование и 4) методы биоинформатики для анализа хроматограмм, выравнивание курирование и интерпретация данных последовательностей.
протокол
1. Этилендиаминтетрауксусной кислоты (EDTA) Всего обработки крови
Примечание: Кровь может быть обработан сразу после коллекция может храниться при температуре 4 ° С в течение не более чем 24 часов.
- Работа в шкафу биобезопасности, позволит весь образец крови ЭДТА до комнатной температуры.
- Для каждого образца маркировать достаточно криопробирки с идентификацией образца (ID), хранения материала (плазмы) и даты.
- Центрифуга образцов для 10 мин при 1000 х г. Не используйте тормоза, чтобы остановить центрифуги. Это даст три слоя (сверху вниз): плазма, лейкоциты (светлого сгустка) - очень тонкий слой - и эритроцитов, в том числе тромбоцитов.
- Тщательно аспирата супернатант (плазма) и аликвоты 500 мл в каждую криопробирку. Будьте осторожны, не нарушить слой клеток (Баффи пальто) или передавать какие-либо клетки.
- Хранить при -80 ° С до использования для экстракции РНК или сразу перейти к экстракции РНК.
- Подготовка листа экстракции с идентификаторами образцов, предназначенных для извлечения числе положительных и отрицательных контролей плазмы.
- Для каждого образца должны быть извлечены, маркировать 1,5 мл стерильного микроцентрифужную пробирку с ID образца, дата экстракции и "РНК". Кроме того маркировать собранную столбца и пробирку, а также два трубки микроцентрифужных мл, содержащий рабочую лизирующего раствора с соответствующими номерами от листа экстракции.
- Работа в Кабинете Био-безопасности, добавить 200 мкл пробы с соответствующим 2 мл трубки микроцентрифужных рабочего раствора для лизиса.
- Vortex и инкубировать в течение 10 мин при комнатной температуре.
- Через 10 мин, центрифуги со стенок пробирки.
- Добавить 800 мл абсолютного этанола в каждую из пробирок.
- Смешайте импульсным встряхиванием и кратко центрифуги.
- Трансфер 600 мкл этого раствора с соответствующим сборки колонка / Коллекция трубки. Центрифуга на 6000 хг в течение 1 мин.
- Столбец Переезд в новый пробирку и отказаться от старого сбора трубки, содержащей фильтрат. Повторите предыдущий шаг 2.8 (выше) в два раза больше.
- Добавить 500 мкл промывочного буфера AW1 для каждого столбца и центрифуге при 6000 мкг в течение 1 мин.
- Откажитесь от фильтрата и сбора трубку и передать столбца в новое пробирку.
- Добавить 500 мкл был буфер AW2 и центрифуге при 20000 мкг в течение 3 мин. Повторите шаг 2,11.
- Центрифуга в новом пробирку при 20000 мкг в течение еще 2 мин.
- Откажитесь фильтрата и место колонку в 1,5 мл трубки микроцентрифужных.
- Добавить 60 мкл буфера пр. (РНКазы свободной воды) к середине колонны гарантируя, что вы не обойтись жидкости на стороне колонны.
- Инкубируют при комнатной температуре в течение 1 мин.
- Центрифуга при 6000 мкг в течение 2 мин.
- Откажитесь от колонки и крышки на 1,5 мл микроцентрифужных пробирок.
- Образцы готовы к Reverсебе транскрипции.
- Если тестирование должно быть выполнено немедленно, хранить при температуре 4 ° С в течение до 6 часов. Однако, если тестирование будет отложено, то сразу же месте при температуре -80 ° C. NB: не замораживания / оттаивания образцов больше чем в 3 раза.
3. Подготовка реагентов для обратной транскрипции
- Перед началом расчета объемов каждого из реагентов, необходимых для количества образцов обрабатываемых в том числе, положительных и отрицательных контролей плазмы. Также добавить элемент управления реагента.
- Используя расчетные объемы, начиная с шага 3.1 (выше), подготовить дезоксирибонуклеотида трифосфат (дНТФ)-грунт смеси в чистой стерильной 200 мкл ПЦР-пробирку с последующим кратко импульсов встряхивания. Каждый образец должен иметь 0,5 мкл Обратный праймер RT21 и 0,5 мкл дНТФ, см. таблицу 2.
- Аликвоты 1,0 мкл дНТФ-праймер смеси к 200 мкл ПЦР пробирок.
- Подготовьте обратной транскриптазы (RT) Смесь ферментов, добавив 1 μ; Л 10-кратного обратном буфере транскрипции, 1 мкл 0,1 М DTT и 2 мкл 25 мМ MgCl 2 в стерильную пробирку с последующим встряхиванием и кратко центрифугирования, см. таблицу 3.
- Добавить 0,5 мкл каждого из ферментов RNAseOUT и Верхний III обратной транскриптазы с ферментом смеси трубки затем нажмите трубку осторожно перемешать.
- Держите трубки с дНТФ-грунт смесей и ферментной смеси на холодном блоке и перейти к РНК станции.
4. Обратная транскрипция
- Добавить 6 мкл образца РНК в дНТФ-грунт трубы смеси с последующим кратко встряхиванием перемешать.
- После добавления РНК, перейти к комнате ПЦР с обеих дНТФ / грунтовкой / РНК смеси и смеси ферментов RT трубы на холодную блока или льда.
- Кратко центрифуги пробирки дНТФ / грунт / РНК MIX (начиная с шага 4.2) и поместить их в амплификаторе.
- Нагревают при 65 ° С в течение 5 мин к денатурации РНК.
- Быстро здорово 4 ° С, выдержка в течение 2минимум
- Пауза амплификаторе в то же время при 4 ° С; вывезти трубы.
- Быстро добавить 5 мкл ферментной смеси, сохраняя при этом трубы на холодном блоке.
- Осторожно перемешать, нажав на трубку, то кратко центрифуги пробирки и вернуться к амплификаторе.
- Удержание пробирки при 50 ° С в течение 60 мин в обратном транскрипции РНК с последующим фермента денатурации при 85 ° С в течение 5 мин, чтобы остановить обратную транскрипцию.
- Остудить до 37 ° С Как только температура доходит до 37 ° С, пауза и взять трубку из амплификаторе.
- Быстрое добавление 0,5 мкл РНКазы Н в пробирки и возврата в амплификатор.
- Удержание при 37 ° С в течение 20 мин и затем охлаждают до 4 ° С.
- Комплементарной ДНК (кДНК) можно использовать сразу или можно хранить при температуре -20 ° С или ниже, пока это необходимо. Тем не менее, долгосрочное хранение кДНК должна быть при температуре -80 ° С.
5. Подготовка реагентов для ПЦР
- Befoповторно, начиная, рассчитать объемы каждого из реагентов, необходимых для количества образцов обрабатываемых и управления. В дополнение к трем управления (позитивный, негативный, и реагент), вы также можете добавить элемент управления ПЦР (ДНК ВИЧ). Первый и второй раунд ПЦР смеси могут быть приготовлены одновременно, а второй мастер смесь хранили при -20 ° С до использования. Миксы могут храниться в течение примерно 8 часов.
- Добавить 18,4 мкл воды, 2,5 мкл 10х буфера, 1,0 мкл MgCl 2, 0,5 мкл дНТФ и 0,25 мкл каждого из праймеров, как показано в таблице 4 и вихря.
- Добавить 0,1 мкл Платиновый Taq-полимеразы (5U/μl) и аккуратно перемешать трубку, нажав его.
- Аликвотные 23 мкл мастер-смеси к 200 мкл ПЦР пробирок.
- С трубок мастер микс на холодном блоке или ледяной переезда в комнате ПЦР.
6. Вложенные ПЦР
- Добавить 2 мкл кДНК в 23 мкл первого раунда ПЦР MASTEг перемешать.
- Закройте пробирки, поместить образцы в амплификатор и использовать следующие ПЦР велосипедные условия: 94 ° С в течение 2 мин, 30 циклов 95 ° С в течение 30 секунд, 58 ° С в течение 20 сек и 72 ° С в течение 2 мин, с последующим конечным расширением при 72 ° С в течение 10 мин, как показано на рисунке 1.
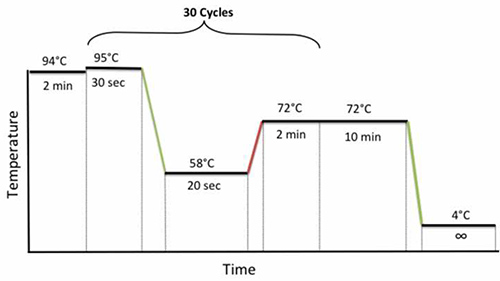
Рисунок 1. Вложенные ПЦР условия велоспорт. Кликните здесь, чтобы посмотреть увеличенное изображение.
- Продолжить на 2-й раунд стадии ПЦР и не храните 1-го тура продуктов ПЦР при температуре -20 ° С или ниже, пока не потребуется на более позднем этапе.
- Для 2-го раунда ПЦР, добавить 2 мкл 1-го тура продукта ПЦР до 23 мкл 2-м раунде ап ПЦР Master MixD Используйте ту же программу ПЦР на рисунке 1.
7. Гель-электрофореза
- Подготовка гель
- Добавить 0,5 г агарозы таблетки в 250 мл стекл нную колбу и добавить 50 мл буфера TBE 1x в колбу.
- Тепло в микроволновой печи до кипения; не вертеться часто (примерно каждые 30 сек), пока полностью солюбилизированный. Используйте силиконовую сцепление или силикон печь перчатки, чтобы понять горячую колбу. Раствор агарозы можно варить из колбы очень легко так внимательно следить за этим процессом.
- Охлаждают при комнатной температуре в течение 10 мин.
- Налейте агарозы в литейной гель лотка с соответствующего размера гребень; гель готов к использованию примерно в 20-30 мин.
- Поместите гель в камеру электрофореза и запустить в соответствии с рекомендациями производителя.
- Гель-электрофорез и визуализация.
- Vortex Роман Сок в течение 10 сек до использования.
- Развести 1 мкл Роман сок с 5 мкл DОбразец Н.А. и смесь.
- Развести 3 мкл Роман сок с 3 мкл маркер молекулярной массы и перемешать.
- Загрузите миксы из разделов 7.2.2 и 7.2.3 (см. выше) и запустите гель при 100 В и 400 мА в течение 40 мин, чтобы оценить ПЦР-амплификации.
- Положительный усиления могут быть визуализированы в УФ-свете, как 1315 п.о., рисунке 2.
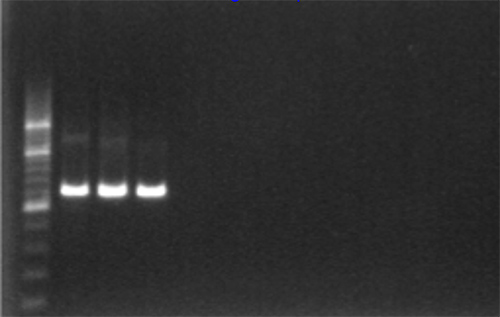
Рисунок 2. Подтверждение Гель ПЦР-амплификации с использованием 1% гель-электрофореза в агарозном и 200 б.п. лестнице. Кликните здесь, чтобы посмотреть увеличенное изображение.- Там не должно быть усиление в отрицательной контрольной и реагентов, что указывает на отсутствие загрязнения.
8. Для очистки продуктов ПЦР продукта
- В рамках подготовки к реакции секвенирования, положительные второго тура ПЦР-продукты очищаются с помощью набора для очистки PureLink ПЦР.
- Добавить 80 мкл буфера для связывания работает высокого среза (B3) в 20 мкл ПЦР-продукта и пипетки смеси.
- Добавить образца смешанной с связывающего буфера в ротационную колонку в пробирку.
- Центрифуга колонку при 10000 х г в течение 1 мин. Перенести колонку в новую пробирку.
- Промыть колонку с 650 мкл промывочного буфера с этанолом.
- Центрифуга колонку при 10000 х г в течение 1 мин. Перенести колонку в новую пробирку.
- Центрифуга колонку при максимальной скорости в течение 2-3 мин, чтобы удалить остатки промывочного буфера.
- Поместите колонку спина в чистом 1,7 мл элюирования трубы, поставляемой в комплекте.
- Добавить 40 мкл буфера для элюции в центре колонны и инкубировать колонку при комнатной темперэ в течение 1 мин.
- Центрифуга столбец с максимальной скоростью в течение 2 мин (> 10 000 мкг).
- Вымывание трубка содержит ваш Очищенный продукт ПЦР готов для секвенирования. Откажитесь от колонки.
- Определите концентрацию и качество ДНК с помощью NanoDrop.
- Если нет в доме секвенирования средства не доступны, очищенные продукты ПЦР могут быть отправлены на коммерческой лаборатории секвенирования на данном этапе.
9. Реакции секвенирования
- Продукты ПЦР секвенировали с использованием большой терминатор краситель комплект версии 3.1 и 4 праймеров для каждого образца (два вперед и два назад). Последовательности праймеров приведены в таблице 2. Таким образом, после секвенирования счете, каждый образец будет иметь четыре последовательности, которые будут собраны в контига.
- Настройка В реакциях секвенирования как указано в таблице 5 для каждого из четырех праймеров.
- Смешайте буфер секвенирования и праймеров путем встряхивания перед использованием.
- Смешайтевода, буфер, и праймера перед добавлением последовательности большого красителя. Смешайте встряхиванием.
- Аккуратно перемешайте мастер микс после добавления большой краситель смесь секвенирования по переворачивая пробирку или нажав на него мягко.
- Аликвоты 9 мкл мастер-смеси в 96-луночный оптической пластины.
- Для того чтобы запустить 24 образцов / пластину, настройте тарелку, как указано ниже рисунке 3.
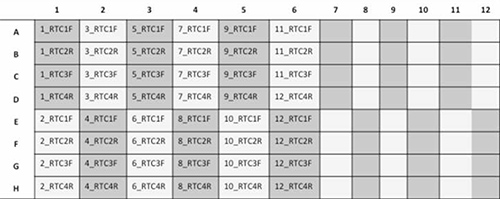
Рисунок 3. Схема представление 96-луночный планшет с 12 образцов пациентов будучи последовательность с 4 праймеров каждый (RTC1F, RTC2R, RTC3F и RTC4R). Кликните здесь, чтобы посмотреть увеличенное изображение.- Добавить 1,0 мкл образца ДНК (~ 20-40 нг), накройте тарелку сн клей алюминиевой крышкой, а затем аккуратно перемешать.
- Центрифуга при 3000 мкг в течение 1 мин. Снимите алюминиевую крышку и добавьте уплотнительную мат.
- Поместите пластину на амплификаторе и выполните следующую программу велоспорт показано на рисунке 4.
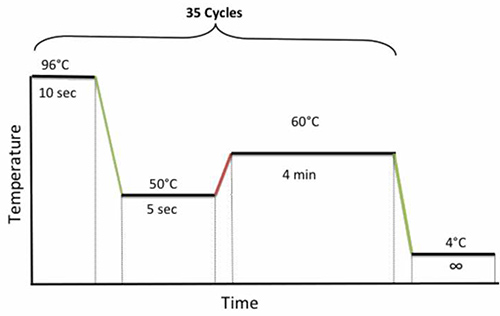
Рисунок 4. ПЦР велосипедные условия для секвенирования. Кликните здесь, чтобы посмотреть увеличенное изображение.- Когда ПЦР заканчивается, немедленно очистить секвенирования продукта.
10. Секвенирование Очистка
- Для каждой реакции секвенирования, смешать 50 мкл абсолютного этанола и 5 мкл 3 М ацетата натрия.
- Использование многоканальной пипетки, добавить 55 &# 956; л раствора ацетата натрия / EtOH в каждую лунку.
- Уплотнение скважин с клеем алюминиевой крышкой, гарантируя, что каждый хорошо запечатан должным образом.
- Центрифуга при 3000 мкг в течение 20 мин.
- Через 20 мин, снять крышку и пластину перевернули, одним плавным движением, на сложенном лаборатории ткани (НЕ бац, чтобы избавиться от супернатанта, как это будет выбить осадок!).
- Центрифуга перевернутым планшетом по той же ткани при 150 мкг в течение 2 мин.
- Сразу добавить 150 мкл холодного 70% этанола. Не откладывайте добавление этанола на этом шаге.
- Уплотнение с той же липкой алюминиевой крышкой и вихря.
- Центрифуга при 3000 мкг в течение 5 мин.
- Инверсия пластину на новый сложенный ткани и центрифугируют при 150 перевернутой мкг в течение 1 мин.
- После центрифугирования разместить обнаружены в амплификаторе и высушить его при 50 ° С в течение 2 мин.
- После того, как пластины сухая, запечатать его с крышками самоклеющейся пленкой, завернуть в фольгу и хранить при температуре -20 ˚ С до готовности, чтобы перейти Wiй секвенирования электрофореза.
- Когда все будет готово последовательности, растворить очищенные секвенирования продуктов в 10 мл Привет-Di формамидом, денатурации и нагрузка для электрофореза.
11. Биоинформатика
- Очередность монтажных работ
- Запустите программу Geneious.
- Создать рабочую папку для хранения последовательности.
- Импортируйте файлы ABI генерируемые секвенирования машины в рабочую папку с помощью утилиты импорта. Geneious выделит показатель качества процент для каждой последовательности импортного.
- Открытые последовательности с качеством оценки> 70%, дважды щелкнув по ним.
- Каждый файл должен открываться в новом окне. Программное обеспечение будет показывать качество на каждом нуклеотида в положении хроматограммы качества последовательности, используя легкие синие полосы. Чем выше показания шкалы, тем лучше качество базового вызова.
- С помощью курсора, выберите среднюю секцию последовательности оставляя концы, которые являются, как правило, низкого качества.
- Нажмите на кнопку экстракта извлечь регион последовательности хорошим качеством.
- Выбрать все четыре выделенные последовательности для каждого образца и собрать их против эталонной последовательности.
- Осмотрите собранный последовательность, чтобы убедиться, что вы находитесь в правильной рамке считывания. Если вы находитесь в правильной рамке считывания, начало протеазы должны начать с следующих аминокислот: PQITLW. Начало РТ начнется с PISPIE.
- Извлеките Contig область, покрывающую начало PR 300-RT-кодона. Во время этого процесса, а также проверить для вставок или удалений.
- Пройдите консенсусной последовательности извлеченного контига, выявления любых неясностей и проверить позиции со смешанными основаниями путем проверки качества (симметрию, высоту, фон и плечи фланговых регионах) из базовых вызовов.
- Выберите консенсусной последовательности и нажмите кнопку экстракт создать отдельный файл консенсусной последовательностью из четырех праймеров и Лабел это соответствующим образом.
- Экспорт последовательность в папку Резервное хранилище на компьютере или в сетевой папке.
- Последовательность оценки качества (HIVDB)
- Анализ последовательности с помощью программы HIVDB на http://hivdb.stanford.edu .
- Проверьте выпадений и вставок в сводных данных и убедитесь, что последовательность охватывает все 99 протеазы (PR) кодоны и первые 300 RT кодонов.
- Проверьте любую выделенную обеспечения качества (QA) вопросов, как для PR и РТ регионах, таких как стоп-кодонов, каркасные сдвигов, неоднозначных положений и необычных остатков.
- Контроль последовательности Качество
- Взрыв новую последовательность с базой данных локальной последовательности от предыдущего запуска.
- Если новый последовательность> 97% похож на любой последовательности в базе, все этапы протокола должны быть пересмотрены, начиная с анализа последовательности и возвращаясь к экстракции РНК в плане обеспеченияе, что не было никаких окон MIX (переключение образец, неправильная маркировка) или загрязнение.
- Если никаких проблем не выявлено, повторить анализ обоих старых и новых образцов из стадии экстракции РНК.
- Если последовательности еще> 97% похоже, пересмотреть историю пациента, чтобы оценить для любого эпидемиологической связи между физическими лицами.
- Филогенетического анализа
- Совместите все последовательности из базы данных, используя программу ClustalW в Geneious.
- Вручную проверить выравнивание для неровные последовательностей, выпадений и вставок и редактировать соответствующим образом.
- Построить филогенетическое древо, используя PHYML, Geneious Tree Builder или другие строители дерево в Geneious.
- Осмотрите дерево для образцов с короткой длине отраслевых.
- Просмотрите образцы с короткими длинами отраслевых для возможного загрязнения.
12. Rega DB информатики
- Последовательность загрузки
- Вход в RegaDВ с использованием уникальное имя пользователя и пароль.
- В меню выпадающего под пациента ID, выберите "Начинается с".
- Добавить идентификатор пациента и выбрать человека, чьи генотип, который будет загружен.
- В меню слева выберите "вирусный изолят".
- Из опций под вирусного изолята выберите "добавить".
- Введите дату, образцы ID, SEQ ID и дату последовательности.
- Выберите "выбрать файл", а затем перейдите к файлу Fasta последовательности быть загружены.
- После выбора файла Fasta для загрузки, нажмите при загрузке.
- После того, как загружены последовательность появится в поле нуклеотидной под выявляет последовательности и даты, нажмите кнопку ОК в нижней правой части окна.
- Проверьте выравнивание белка PR и РТ, нажав на белок кнопку и выбрав либо PR или RT.
- Проверьте мутации лекарственной устойчивости, нажав на кнопку сопротивления. Это даетВы профили сопротивления от трех алгоритмов: ANRS, Стэнфорд HIVDB и RegaDB.
- Генерация отчетов с использованием REGA
- Вход в RegaDB используя свой уникальный логин и пароль.
- В меню выпадающего под пациента ID, выберите "Начинается с".
- Добавить идентификатор пациента и выбрать человека, доклад которой будут созданы.
- В меню справа выберите вирусный изолят.
- Из опций под вирусного изолята нажмите на "вид".
- Дважды щелкните на вирусной изолята, для которого необходимо создать отчет.
- На вирусной окне изолята, нажмите на вкладку вирусного отчета изолят.
- Выберите алгоритмы интерпретации генотипа из выпадающего меню, а затем выберите шаблон отчета, чтобы использовать.
- После того, как алгоритм и шаблон выбраны, нажмите на кнопку "Создать".
- Скачать RTF-документ, сгенерированный.
- Откройте RTF сделатьдокументарные качестве документа слова.
- Изменение размера История лечение диаграмму.
- После графике, добавить раздел «Клиническая диаграммы и интерпретации сопротивление".
- Используя данные на столе сопротивления и клинической графике, добавить описание профиля сопротивления пациента, начиная с истории лечения пациента, и лекарства, к которым вирусная изолят устойчив. Также добавить описание вирусной нагрузки пациента и CD4 + профили подсчета клеток с графика.
- Отправить отчет к инфекционным заболеваниям (ID) специалистов для рассмотрения и рекомендации, касающиеся дальнейшего лечения пациента. Этот процесс также очень важный этап контроля качества. Любые ошибки в генотип или inconsistences в истории лечения, вирусологические и иммунологические профили могут быть выявлены и отзывы до принятия окончательного отчет отправляется со всеми рекомендациями, для врача управляющей пациента.
Результаты
Метод подтверждено являлся модификацией ранее описанным способом 20. Способ генотипирования ViroSeq, который был одобрен FDA, был использован в качестве эталонного метода в проверке. Комплект проб проверки квалификации, полученных от французских национальных учреждений по исследованиям в области СПИДа и вирусного гепатита (ANRS) был использован в первичном сравнения двух методов. Эти два метода генотипирования были на 100% согласных в выявлении всех клинически важные сопротивления мутации, связанные с наркотиками в интерпретации программы HIVDB для образцов, которые были успешно усиливаются обоими методами. Как показано в таблице 6, нуклеотидные последовательности трех пар были 99,5% идентичны. Предсказанные аминокислотные последовательности были на 100% идентичны. Один образец из пяти не может быть успешно амплифицировали с помощью ViroSeq. В дополнение к пробе не усиливается ViroSeq, метод в доме не удалось амплифицировать второй образец, который был показанбыть циркулирующих рекомбинантный вирус (CRF02_AG) по ViroSeq. Три образца, что усиленные с обеих методологий были подтип В (два образца) и подтип (один образец).
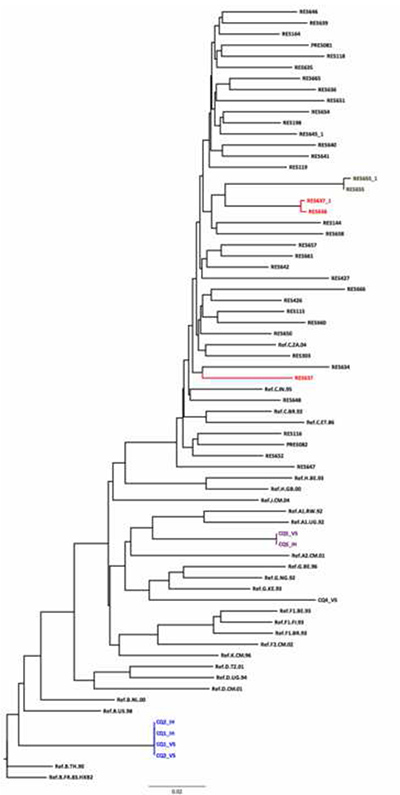
Рисунок 5. Использование HKY Neighbor Присоединение дерево сделано в рамках обеспечения качества последовательность. Есть четыре пары / кластеры последовательности с очень короткими генетических расстояний. Генетическое расстояние между RES655 и RES655_1 (те же образцы последовательность в разные дни) составляет 0,003. Является потенциальная ошибка с парой RES637_1/RES638 как их генетическая дистанция слишком коротка (0,075) для образцов из разных эпидемиологически несвязанных лиц. Существует еще один RES637 на дереве на расстоянии 0,075 при сравнении с RES638_1. CQ01/CQ02 кластера предполагает, что два образцас панели являются дубликатами одного и того же образца. Они группируются вместе с эталонной последовательности подтипа B, подтверждающего подтип присвоенный инструмента REGA подтипов. CQ05 и CQ04 кластер с подтипов А и G соответственно, в то время как инструмент REGA подтипов классифицировали их как А и CRF02_AG соответственно. Еще один полезный инструмент для подтипов ВИЧ и рекомбинации SCUEL, которая доступна на http://www.datamonkey.org. Кликните здесь, чтобы посмотреть увеличенное изображение.
Коллегия в составе пяти образцов был использован для оценки точности метода в доме. Десять повторных генотипы были получены для каждого из пяти образцов. Используя генетический анализатор 16 капиллярного 3130xl, 48 из 50 генотипов были получены из 24 трасс, подготовленный в тот же день. Для всех пяти образцов, предсказанные аминокислотные последовательности были на 100% согласованной между повторами. Для нуклеиновой последовательности кислоты, тыс.прежде чем был> 99% попарно сходство.
В течение первых двух лет после использования этого метода, шестьдесят Образцы повторяется случайным образом из выделения РНК в последовательности. Там не было никаких статистически значимых различий между показателем качества последовательности и количества смешанных баз между повторами. И нуклеотидных и аминокислотных парные сравнения для шестидесяти пар были больше, чем на 99% идентична. Таким образом, лекарственная устойчивость мутации для всех пар были на 100% согласных.
Снижение расходов
Объемы реакции для РТ, ПЦР и секвенирования были снижены по меньшей мере наполовину, по отношению к оригинальным методом 20, 32, без ущерба для качества последовательностей, генерируемых. Это позволило снижение стоимости на 50% для стадии РТ и ПЦР.
Новый метод был первоначально разработан для работы с шестью секвенирования праймера с последовательностью все 99 кодоны гена протеазы и первые 300 кодонов обратной транскриптазы гена 20, 32. Подобные методы также используют шесть-восемь праймеров 33, 34. Некоторые недавно опубликованные методы использовали менее шести праймеров, хотя иногда секвенирования протеазы и гены RT seprately 35, 36. Мы стремились уменьшить количество праймеры для секвенирования с шести до четырех, (рис. 6)
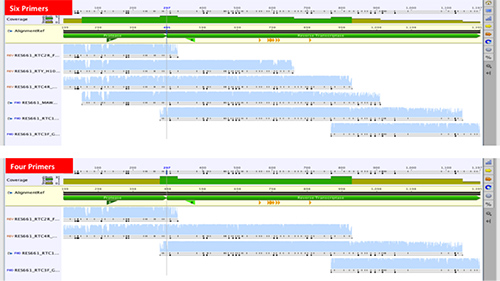
Рисунок 6. Сравнение смежных последовательностей из шести против четырех секвенирования праймеров для генерации 1197 п.н. Pol, охватывающей все 99 ВИЧ-1 протеазы кодонов и первые 300 кодонов обратной транскриптазы гена.242/51242fig6highres.jpg "целевых =" _blank "> Нажмите здесь, чтобы посмотреть увеличенное изображение.
Последовательности из набора 17 образцов, полученных от шести праймеров по сравнению с последовательностей, генерируемых после исключения двух праймеров (MAW46 и RTY). Подтипы были 14 подтипа С, два подтипа Б, и один подтип А. Там не было никаких существенных различий в оценки качества последовательность. Опять же, средний попарно идентичности между 17 пар нуклеиновой кислоты составил 99% и 100% на уровне аминокислот. Таким образом, снижение секвенирующих праймеров с шести до четырех привело к снижению стоимости секвенирования почти на треть.
Единственный фирменный программный инструмент, используемый в этом протоколе было Geneious для сборки последовательности. Инструменты интерпретации лекарственная устойчивость, а также в докладе генерации инструменты все свободные, открытые инструменты доступа. Это снижает стоимость за счет отказа затраты, связанные с использованием проприетарного программного обеспечения. Кроме того, коллективизацииэ переговоров позволил реагенты для этого протокола должны быть упакованы в комплекте для легкого доступа от Life Technologies и доступен как Сатурн / Life Technologies генотипирования метод 37. Кроме того, члены Сатурн можете получить доступ к реагенты по сниженной цене.
Клинических условиях
Описанный протокол был реализован в процессе мониторинга и надзора за лекарственной устойчивостью в сельской общине в провинции Квазулу-Наталь. В общей сложности 604 генотипов были получены из клинических образцов период с декабря 2010 по май 2013 года в качестве величины прироста 95% для образцов с вирусной нагрузкой> 1000 копий РНК / мл. Это клиническое исследование лекарственной устойчивости ВИЧ был одобрен биомедицинских исследований Комитета по этике из Университета Квазулу-Наталь (см. BF052/10) и Научно-исследовательского комитета по здравоохранению в Квазулу-Натал Департамента здравоохранения (см. HRKM 176/10) от. Были получены и отправлены обратно в клиниках Индивидуальные пациент сообщаетдля лечения пациента.
Семьдесят два (72) генотипы Также были получены в рамках надзора за передаваемой исследования лекарственной устойчивости, вложенный в большой проспективного исследования эпиднадзора за ВИЧ на основе населения. Первичные образцы игла укол цельной крови собраны в ЭДТА микропробирок. В генотипирования было величина прироста на 79% 19. Утверждение этики для генотипирования образцов из исследования наблюдения была получена из Университета комитета Квазулу-Натал биомедицинской этике исследований (см. BE066107).
| Грунтовка Имя | Последовательность | Длина | Направление | НХВ2 Статус | |
| MAW-26 | TTGGAAATGTGGAAA GGAAGGAC | 23 | Вперед | 2028-2050 | 1-й тур ПЦР |
| РТ-21 | CTGTATTTCAGCTATC AAGTCCTTTGATGGG | 31 | Обратный | 3539-3509 | 1-й тур ПЦР |
| Pro-1 | TAGAGCCAACAGCCC CACCA | 20 | Вперед | 2147-2166 | 2-й тур ПЦР |
| РТ-20 | CTGCCAATTCTAATTC TGCTTC | 22 | Обратный | 3462-3441 | 2-й тур ПЦР |
| RTC1F | ACCTACACCTGTCAA CATAATTG | 23 | Вперед | 2486-2508 | Секвенирование |
| RTC2R | TGTCAATGGCCATTG TTTAACCTTTGG | 27 | Обратный | 2630-2604 | Секвенирование |
| RTC3F | CACCAGGGATTAGAT ATCAATATAATGTGC | 30 | Вперед | 2956-2994 | Секвенирование |
| RTC4R | CTAAATCAGATCCTAC ATACAAGTCATCC | 29 | Обратный | 3129-3101 | Секвенирование |
| RT-й | GTGTCTCATTGTTTAT ACTAGG | 22 | Обратный | 2967-2946 | Секвенирование |
| MAW-46 | TCCCTCAGATCACTC TTTGGCAACGAC | 27 | Вперед | 2251-2277 | Секвенирование |
Таблица 1. Обратная транскрипция, ПЦР и секвенирования пользовательские праймеры, используемые в генерации 1197 б.п. POL фрагмента, охватывающей все 99 протеазы ВИЧ-1-кодоны и первые 300 кодонов гене обратной trascriptase.
| RT21 (5pmol/ml) | 0.5 | 0,2 |
| дНТФ (10 мМ) | 0.5 | 0,4 |
| Общий | 1 |
Таблица 2. дНТФ / Primer смешивать в реакции обратной транскрипции.
| Реагент | Объем (мл) / реакция | Концентрация / реакция |
| Впервые Strand буфера (10x) | 1 | 1 |
| MgCl 2 (25 мм) | 2 | 4 |
| DTT (0,1 М) | 1 | 0.008 |
| RNaseOUT (40 ед / мл) | 0.5 | 16 |
| Верхний III обратной транскриптазы (200U/ml) | 0.5 | 8 |
| Общий | 5 |
Таблица 3. Смесь ферментов для реакции обратной транскрипции.
| Реагент | Объем (мл) / реакция | Конечная концентрация / Реакция |
| DEPC очищенной воды | 18.4 | - |
| PCR буфера (10x) | 2.5 | 1 |
| MgCI 2 (50 мМ) | 1 | 2 |
| смеси дНТФ (10 мМ) | 0.5 | 0,2 |
| Коварный праймер (5 пмоль / мл) | 0.25 | 0.05 |
| Обратный праймер (5 пмоль / мл) | 0.25 | 0.05 |
| Платина Taq-полимеразы (5 ед / мл) | 0.1 | 0.02 |
| Промежуточный итог | 23 | - |
Таблица 4. Мастер смесь для ПЦР с.
| Реагент | Объем (мл) / реакция | Концентрация / реакция |
| DEPC очищенной воды | 6.1 | |
| Секвенирование буфера (5x) | 2 | 1 |
| Праймер (3,2 пмоль / мл) | 0.5 | 0.16 |
| Большой Краска терминатор Секвенирование смесь | 0,4 | - |
| Общий | 9 |
Таблица 5. Мастер микс для реакций секвенирования.
| ViroSeq | Заказ | % Н.А. Сходство | |||||||
| Номер образца | Класс | Показатель качества | PR Мутации | Мутации RT | Класс | Показатель качества | PR мутации | RT Мутации | |
| CQ01 | B | 99,9 | M46L, I54L, V82A, L90M | D67N, T69D, K70R, M184V, T215V, K219Q | B | 99.2 | M46L, I54L, V82, L90M | D67N, T69D, K70R, M184V, T215V, K219Q | 100 |
| CQ02 | B | 99,5 | M46L, I54L, V82A, L90M | D67N, T69D, K70R, M184V, T215V, K219Q | B | 99,5 | M46L, I54L, V82A, L90M | D67N, T69D, K70R, M184V, T215V, K219Q | 100 |
| CQ03 | Не Доступно | Не Доступно | Не Доступно | Не Доступно | Не Доступно | Не Доступно | |||
| CQ04 | CRF02_AG | 98.4 | I54V, V82F, I84V | M41L, L74I, L210W, T215Y, V108I, Y181C | Не Доступно | Не Доступно | Не Доступно | Не Доступно | Не Доступно |
| CQ05 | 99,7 | K103N | 93 | K103N | 100 | ||||
Таблица 6. Сравнительный Resulц из параллельного анализа между методом генотипирования ViroSeq и метода в доме с помощью панели образцов, предоставленную АНРС.
Обсуждение
Несколько бюджетные в доме методы были описаны в усилиях попробовать сделать лекарственная устойчивость генотипирование ВИЧ более доступными 33, 34, 36. Существует никаких сомнений в необходимости интеграции тестирование лекарственной устойчивости в постоянной помощи для физических лиц на антиретровирусной терапии в условиях ограниченных ресурсов. Тем не менее, большинство зарегистрированных методов сосредоточиться на применении лекарственной устойчивости генотипирования в надзора за лекарственной устойчивостью на уровне населения. Метод генотипирования Сатурн / Life Technologies представляет собой полностью интегрированное протокол для наблюдения и контроля за лекарственной устойчивости. Этот метод был разработан, чтобы быть доступным протокол реализации в основном открытым исходным кодом и открытых биоинформатики доступ к ресурсам для интерпретации лекарственной устойчивости и генерации отчетов для клинического ведения.
Было показано, путем сравнения с FDA утвержденных ViroSeq метода генотипирования, чтобы бытьточны в идентификации мутаций лекарственной устойчивости из панели ANRS образцов профессионального тестирования, в 100% проб панели лабораторных, которые были успешно усиливаются. Точность также оценивали по клиническим образцов подтипа C вирусов, самых доминирующих подтипа в южной части Африки. Метод был точным на подтипа образцов С, как это было на подтипа А и В. Однако, если метод будет использоваться в других частях мира, где преобладает CRF02_AG, существует необходимость для модификации праймеров, так как метод не смогли усилить один из образцов панелей, что было показано, что CRF02_AG. Кроме того, вырожденный набор праймеров чувствительных всей группе М вирусов 33, 36 могут быть использованы в регионах, где распределение подтип более разнородной 38.
Чувствительность обратной транскрипции и ПЦР может быть увеличена путем экстракции РНК из более высоких объемов плазмы, таких как 500 мл. Плазма может быть центрифугированияuged на 21000 мкг в течение 90 мин, чтобы сконцентрироваться вирусные частицы прежде чем приступить к протоколу, как описано вирусной экстракции РНК мини комплект QIAamp.
Как показано, новый метод имеет дополнительное преимущество, что она производит комплексные отчеты для индивидуального лечения пациента. Эти отчеты являются консолидация генотипа, иммунологические и вирусологические данные мониторинга, а также клинические и лечение история от RegaDB. Это сопровождается подробным лабораторного интерпретации профиля сопротивления с последующим столь же подробного обзора истории болезни пациента, а также рекомендации по лечению. Использование врачей-специалистов для рассмотрения докладов и обеспечить рекомендации по лечению пациентов обеспечивает столь необходимую наставничества для практикующих медсестер, а также неопытных врачей, которые все чаще, предоставляющих АРТ в Южной Африке в рамках рекомендаций ВОЗ по пере-дачу. Эти клиническиедоклады были показано, что эффективные учебные пособия для врачей с небольшим опытом или вообще в управлении лекарственной устойчивости. С точки зрения пациента, наш метод снижает необходимость поехать в централизованных сайтов для доступа услуги специалистов ВИЧ.
Таким образом, описанный протокол взятое в целом предоставляет хорошую платформу, через которую управление лекарственная устойчивость ВИЧ могут быть интегрированы, по доступной цене, в продолжающегося ухода за ВИЧ-инфицированных лиц неисправного АРТ. Данные, полученные могут быть использованы для эпидемиологических целей оценить эволюцию и передачу лекарственной устойчивости в обществе. Размер POL фрагмента генерируемого является достаточно хорошим для более сложных филогенетического анализа, который будет производить лучшее понимание эпидемии на уровне населения.
Раскрытие информации
Эта работа была поддержана Wellcome Trust (082384/Z/07/Z), Европейского союза (SANTE 2007 147-790), Центра США по борьбе с болезнями с помощью CAPRISA (Название проекта: Укрепление систем здравоохранения и неудачи Лечение ВИЧ (ВИЧ- TFC)), а также общий проект Швейцарский ЮАР (SSJRP) исследовательский грант под названием «Швейцарский Prot / Южная Африка: Белки Биоинформатика развития ресурсов для важных, связанных со здоровьем патогенов". RL поддерживается Wellcome Trust (номер гранта 090 999 / Z / 09 / Z). Доноры не участвовал в разработке дизайна исследования, сбора и анализа данных, решение о публикации или подготовки рукописи. Авторы заявляют каких конкурирующих финансовых интересов.
Благодарности
Авторы хотели бы выразить признательность всем коллегам, которые сделали эту работу возможной, особенно Майя Balamane, Элизабет Джонстон белый, Шэрон Sjöblom, Грег Ординг Zakhona Гумеде, Xolile Kineri, Phindile Мабасо, Lungisa Ndwandwe, Джеймс Гарви, Гэвин Кобб, Senzo Maphanga, Terusha Chetty , Kevi Найду, Андрей Skingsley, Кэтрин Стотт и Lungani Ndwandwe. Авторы также хотели бы поблагодарить весь персонал Департамента здравоохранения и персонала Африка центр, которые работают на Хлабисе лечению ВИЧ и Программы по уходу.
Материалы
| Name | Company | Catalog Number | Comments |
| Superscript III 1st strand Synthesis kit | Life Technologies | 18080051 | Reverse Transcription |
| SATURN/LiFE Technologies Custom Primers | Life Technologies | 4473517 | PCR |
| Platinum Taq | Life Technologies | 10966026 | PCR |
| PureLink QUICK PCR Purification Kit | Life Technologies | K310002 | PCR |
| Viroseq | ABBOTT | 4J94-20 | Reverse Transcription and PCR |
| Agarose Tablets (Dnase/Rnase free) | BIOLINE | BIO-41027 | PCR |
| TBE Buffer | MERCK | 1.06177.2500 | PCR |
| O'Range Ruler 200 bp DNA Ladder | Fermentas | FE SM0633 | PCR |
| Novel Juice | GeneDireX | LD001-1000 | PCR |
| MiniBis Bioimaging System | DNR Bioimaging Systems Ltd | Gel Documentation | |
| Power Pac 300 | BIORAD | Gel Electrophoresis | |
| Big Dye Terminator Kit version 3.1 | Life Technologies | 4337456 | Sequencing |
| Arrays | Life Technolgies | 4319899 | Sequencing |
| PoP | Life Technologies | 4363785 | Sequencing |
| 10x EDTA Buffer | Life Technologies | 402824 | Sequencing |
| Formamide | Life Technologies | 4311320 | Sequencing |
| 5x Sequencing Buffer | Life Tecgnologies | 4336697 | Sequencing |
| 3130 xl Genetic Analyzer | Life Technologies | Sequencing | |
| GeneAmp PCR System 9700 | Life Technologies | RT/PCR/Sequencing | |
| Centrifuge 5804 | EPPENDORF | Sample Processing | |
| Centrifuge 5415R | EPPENDORF | RNA Extraction | |
| Centrifuge 5415R | EPPENDORF | RT and PCR | |
| Centrifuge 5415D | EPPENDORF | PCR Product Clean up | |
| Centrifuge 5810 | EPPENDORF | Sequencing Clean up | |
| Picofuge | BIORAD | C1301-230V | RT and PCR |
| Vortex Genius 3 | IKA | RNA extraction and reagent preparation | |
| Vortex mixer | IKA | Sequencing Cleanup | |
| NanoDrop 2000 UV/VIS spectrophotometer | ThermoScientific | DNA quantification | |
| 3 M Sodium Acetate | MERCK | 567422 | Sequencing Clean up |
| Absolute Ethanol | MERCK | SAAR2233540LP | Sequencing Cleanup |
| 1.5 ml SARSTEDT Tubes | BIODEX | 72.692.005 | RNA Extraction |
| 2 ml SARSTEDT Tubes | BIODEX | 72.693.005 | RNA Extraction |
| 2 ml Collection tubes | SCIENTIFIC GROUP | MCT-200-NC/S | RNA Extraction |
| Optical MicroAmp 96-well reaction plates | Life Technologies | N8010560 | Sequencing |
| 200 µl 8 Strip StarPCR Tubes with attached flat caps | STAR Lab - supplied by CELTIC | A1402-3700 | RT and PCR |
| 200 µl PCR individual tubes | Scientific Group | CR/3745 | RT and PCR |
| Geneious | Biomatters | Sequence analysis | |
| Internet Access | Preferrably high speed | ||
| Web resources | |||
| hivdb.stanford.edu | Stanford University | Drug reistance analysis | |
| http://bioafrica.mrc.ac.za:8080/regadb-ui/RegaDB | SATuRN | database | |
| http://bioafrica.mrc.ac.za/tools/pppweb.html | SATuRN | Sequence quality tool | |
Ссылки
- Shao, Y., Williamson, C. The HIV-1 epidemic: low- to middle-income countries. Cold Spring Harbor Persp. Med. 2, (2012).
- Mutevedzi, P. C., et al. Scale-up of a decentralized HIV treatment programme in rural KwaZulu-Natal, South Africa: does rapid expansion affect patient outcomes. Bull. World Health Organ. 88, 593-600 (2010).
- Houlihan, C. F., et al. Cohort profile: Hlabisa HIV treatment and care programme. Int. J. Epidemiol. 40, 318-326 (2011).
- Tanser, F., Barnighausen, T., Grapsa, E., Zaidi, J., Newell, M. L. High coverage of ART associated with decline in risk of HIV acquisition in rural KwaZulu-Natal. South Africa. Science. 339, 966-971 (2013).
- Bor, J., Herbst, A. J., Newell, M. L., Barnighausen, T. Increases in adult life expectancy in rural South Africa: valuing the scale-up of HIV treatment. Science. 339, 961-965 (2013).
- Montaner, J. S., et al. The case for expanding access to highly active antiretroviral therapy to curb the growth of the HIV epidemic. Lancet. 368, 531-536 (2006).
- Granich, R. M., Gilks, C. F., Dye, C., De Cock, K. M., Williams, B. G. Universal voluntary HIV testing with immediate antiretroviral therapy as a strategy for elimination of HIV transmission: a mathematical model. Lancet. 373, 48-57 (2009).
- Johnson, L. F., et al. Life expectancies of South african adults starting antiretroviral treatment: collaborative analysis of cohort studies. PLoS Med. 10, (2013).
- Blower, S., Ma, L., Farmer, P., Koenig, S. Predicting the impact of antiretrovirals in resource-poor settings: preventing HIV infections whilst controlling drug resistance. Curr. Drug Targets. 3, 345-353 (2003).
- Geretti, A. M. Epidemiology of antiretroviral drug resistance in drug-naive persons. Curr. Opin. Infect. Dis. 20, 22-32 (2007).
- Larder, B. A., Darby, G., Richman, D. D. HIV with reduced sensitivity to zidovudine (AZT) isolated during prolonged therapy. Science. 243, 1731-1734 (1989).
- Erice, A., et al. Brief report: primary infection with zidovudine-resistant human immunodeficiency virus type 1. N. Engl. J. Med. 328, 1163-1165 (1993).
- Williams, I., et al. British HIV Association guidelines for the treatment of HIV-1-positive adults with antiretroviral therapy. HIV Med. 13 Suppl 2, 1-85 (2012).
- DHHS, . US Panel on Antiretroviral Guidelines for Adults and Adolescents. Guidelines for the use of antiretroviral agents in HIV-1-infected adults and adolescents. , (2012).
- Vandamme, A. M., et al. European recommendations for the clinical use of HIV drug resistance testing: 2011 update. AIDS Rev. 13, 77-108 (2011).
- DHHS, . US Panel on Antiretroviral Therapy and Medical Management of HIV-Infected Children. Guidelines for the Use of Antiretroviral Agents in Pediatric HIV Infection. , (2012).
- . Department of Health. Clinical guidelines for the management of HIV & AIDS in adults and adolescents. , (2010).
- Conradie, F., et al. The 2012 southern African ARV drug resistance testing guidelines. S. Afr. J.HIV Med. 13, 162-167 (2012).
- Manasa, J., et al. Primary Drug Resistance in South Africa: Data from 10 Years of Surveys. AIDS Res. Hum. Retroviruses. 28, 558-565 (2012).
- Tshabalala, M., et al. Surveillance of transmitted antiretroviral drug resistance among HIV-1 infected women attending antenatal clinics in Chitungwiza, Zimbabwe. PLoS ONE. 6, (2011).
- Bartolo, I., et al. Antiretroviral drug resistance surveillance among treatment-naive human immunodeficiency virus type 1-infected individuals in Angola: evidence for low level of transmitted drug resistance. Antimicrob. Agents Chemother. 53, 3156-3158 (2009).
- Bartolo, I., et al. HIV-1 genetic diversity and transmitted drug resistance in health care settings in Maputo, Mozambique. J. Acquir. Immune Defic. Syndr. 51, 323-331 (2009).
- Hamers, R. L., et al. HIV-1 drug resistance in antiretroviral-naive individuals in sub-Saharan Africa after rollout of antiretroviral therapy: a multicentre observational study. Lancet Infect. Dis. 11, 750-759 (2011).
- Hamers, R. L., et al. HIV-1 Drug Resistance Mutations Are Present in Six Percent of Persons Initiating Antiretroviral Therapy in Lusaka, Zambia. J. Acquir. Immune Defic. Syndr. , (2010).
- Nwobegahay, J., Selabe, G., Ndjeka, N. O., Manhaeve, C., Bessong, P. O. Low prevalence of transmitted genetic drug resistance in a cohort of HIV infected naive patients entering antiretroviral treatment programs at two sites in northern South Africa. J. Med. Virol. 84, 1839-1843 (2012).
- Iweriebor, B. C., et al. Molecular epidemiology of HIV in two highly endemic areas of northeastern South Africa. Arch. Virol. 157, 455-465 (2012).
- Parboosing, R., Naidoo, A., Gordon, M., Taylor, M., Vella, V. Resistance to antiretroviral drugs in newly diagnosed, young treatment-naive HIV-positive pregnant women in the province of KwaZulu-Natal South Africa. J. Med. Virol. 83, 1508-1513 (2011).
- Nwobegahay, J. M., et al. Prevalence of antiretroviral drug resistance mutations and HIV-I subtypes among newly-diagnosed drug-naive persons visiting a voluntary testing and counselling centre in northeastern South Africa. J. Health Popul. Nutr. 29, 303-309 (2011).
- Nwobegahay, J., et al. Prevalence of drug-resistant mutations in newly diagnosed drug-naive HIV-1-infected individuals in a treatment site in the waterberg district, limpopo province). S. Afr. Med. J. 101 (2011), 335-337 (2011).
- Rosen, S., Long, L., Sanne, I., Stevens, W. S., Fox, M. P. The net cost of incorporating resistance testing into HIV/AIDS treatment in South Africa: a Markov model with primary data. J. Int. AIDS Soc. 14, 24 (2011).
- Dalai, S. C., et al. Evolution and molecular epidemiology of subtype C HIV-1 in Zimbabwe. AIDS. 23, 2523-2532 (2009).
- Chen, J. H., et al. In-house human immunodeficiency virus-1 genotype resistance testing to determine highly active antiretroviral therapy resistance mutations in Hong Kong. Hong Kong Med. 18, 20-24 (2012).
- Lee, C. K., et al. An in-house HIV genotyping assay for the detection of drug resistance mutations in Southeast Asian patients infected with HIV-1. J. Med. Virol. 84, 394-401 (2012).
- Aitken, S. C., et al. A Pragmatic Approach to HIV-1 Drug Resistance Determination in Resource-Limited Settings by Use of a Novel Genotyping Assay Targeting the Reverse Transcriptase-Encoding Region Only. J. Clin. Microbiol. 51, 1757-1761 (2013).
- Zhou, Z., et al. Optimization of a low cost and broadly sensitive genotyping assay for HIV-1 drug resistance surveillance and monitoring in resource-limited settings. PLoS One. 6, (2011).
- , Life Technologies. Life Technologies and SATuRN Collaborate to Increase Access to HIV Testing in Africa. , (2012).
- Lihana, R. W., Ssemwanga, D., Abimiku, A., Ndembi, N. Update on HIV-1 diversity in Africa: a decade in review. AIDS Rev. 14, 83-100 (2012).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены