Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Флуоресценции изображений с Один-нм Точность (Fiona)
В этой статье
Резюме
Холост флуорофоры могут быть локализованы с нанометровой точностью, используя Фиона. Вот краткое изложение методики FIONA Сообщается, и как проводить Фиона эксперименты описывается.
Аннотация
Флуоресценции изображений с точностью один-нанометровом (Fiona) является простой, но полезный метод для локализации одиночных флуорофоры с нанометровой точностью в плоскости ху. Вот краткое изложение методики FIONA Сообщается и примеры исследований, которые были проведены с использованием Фиона кратко описаны. Во-первых, как настроить необходимое оборудование для Фиона экспериментов, то есть полное внутреннее отражение флуоресценции микроскопии (TIRFM), с подробной информацией о совместив оптику, описывается. Тогда, как провести простой эксперимент Фиона по локализации иммобилизованных Cy3-ДНК одиночных молекул с использованием соответствующих протоколов, а затем с помощью ФИОНЫ для измерения 36 нм размер шага одной усеченной миозина Va двигателя с надписью с квантовой точки, иллюстрируется. Наконец, сообщается недавняя попытка распространить применение Фионы в толстых образцах. Показано, что, используя погружением в воду цели и квантовые точки замачивают в глубине золь-гелей и кролик глазных роговиц (>200 мкм), точность локализации 2-3 нм может быть достигнуто.
Введение
Вокруг 1882, Эрнст Аббе установлено, что разрешение на видном светового микроскопа ~ λ / 2NA, или ~ 200 нм (где λ длина волны и Н.А. является числовая апертура) 1,2. Поэтому любой объект меньше, чем этого измерения будет отображаться как дифракционной месте в оптическом микроскопе. Тем не менее, можно определить центр на месте, то есть местоположение объекта, с гораздо более высокой точностью 3. Флуоресценции изображений с точностью один-нанометровом (Fiona) является простой, но полезный метод для локализации одиночных флуорофоры с нанометровой точностью в плоскости 4. Точность локализации, σ μ (то есть, стандартная ошибка среднего), зависит от общего количества собранных фотонов, 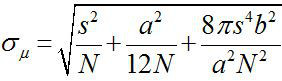 , Где N является количество фотонов, с стандартное отклонение флуоресцентного месте, эторазмер пикселя детектора изображения, и б является стандартное отклонение фоне 3,4. Для флуорофором излучающей ~ 10000 фотоны, ФИОНА может достичь ~ 1 нм точность 4.
, Где N является количество фотонов, с стандартное отклонение флуоресцентного месте, эторазмер пикселя детектора изображения, и б является стандартное отклонение фоне 3,4. Для флуорофором излучающей ~ 10000 фотоны, ФИОНА может достичь ~ 1 нм точность 4.
ФИОНА может быть использован для точного определения положения стационарного излучателя или движущегося один (при условии, изображения могут быть приняты достаточно быстро). ФИОНА может быть применен последовательно в рамках фильма и, таким образом отслеживать движение одной молекулы 4- 8. Фото-защитная реагенты могут быть необходимы для того, чтобы образец не этого разрушению. Кроме того, сама по себе флуоресцентный объект может быть любого размера, меньше или больше, чем дифракционные ограничения, например, он может состоять из органелл (~ 1 мкм) с множеством флуоресцентных белков, диспергированных на ее мембране. Использование ФИОНА еще может дать очень точную (нанометровой) среднем его средней центра масс. Значительное улучшение в точности локализации Фионой позволяет определить nanomeтер Массовое перемещение во времени. Это подтолкнуло микроскопии в молекулярном масштабе длины 4 8.
С момента своего изобретения, варианты ФИОНЫ были разработаны. Например, ярко-поле изображения с точностью один-нанометровом (bFIONA) 9, небольшой варианта Фиона, изображений и локализует плотные объекты, такие как Меланосомы естественных условиях (темных объектов, содержащих пигмент меланин) в с проходящем свете. Кроме того, ФИОНА был принят на работу, чтобы решить несколько красителей. Например, одной молекулы с высоким разрешением изображения с фотообесцвечивания (креветки) 10,11 или одной молекулы с высоким разрешением колокализация (SHREC) 12 были разработаны для решения двух красителей в течение примерно 10 нм. (Заметим, что это разрешение, то есть насколько точно можно сказать, одинаковые красители друг от друга.) Совсем недавно, анализ ФИОНА внесла свой вклад в процесс локализации определенного сверхвысокого разрешения микроскопии, такие как стохастический оптического RECOnstruction микроскопии (ШТОРМОВАЯ) 13-15 и фото-активированный локализации микроскопии (Palm) 16, в котором временные темные флуорофоров возбуждены, а затем флуоресценции локализован. При повторном захватывающей довольно низкой плотности красителей (менее одного дифракционного предела спот), и затем сбора флуоресценции, анализируя каждый из них по Фиона, можно построить в высоком разрешении карту. Резолюция затем просто ограничивается числом фотонов друг краситель звук производится, а также вещей, как хранение образца в неподвижном (в том числе, например, микроскоп) при приобретении.
В этой статье, краткое изложение методики FIONA и кратко описать примеры исследований, которые были выполнены с помощью ФИОНА сообщается. Во-первых, как настроить необходимое оборудование для Фиона экспериментов, то есть полное внутреннее отражение флуоресценции микроскопии (TIRFM), с подробной информацией о совместив оптику, описывается. Тогда, какпровести простой эксперимент Фиона по локализации иммобилизованных Cy3-ДНК одиночных молекул с использованием соответствующих протоколов, иллюстрируется. После этого, использование ФИОНЫ для измерения 36 нм размер шага одной усеченной миозина Va двигателя с надписью с квантовой точки представлена. Миозин Va является важным processive двигателя белок, который осуществляет сотовой груз во время транслокации вдоль нитей актина. Здесь миозина Va построить усеченный используется для удаления доменов не имеющие отношения к размером шага, и с флагом тег добавлен в С-конца, чтобы позволить легкость маркировки с квантовыми точками функционализированными Anti-Flag антител. Этот эксперимент проводится при низкой АТФ замедлить миозин и позволяют использовать достаточно длинных выдержках, чтобы получить хороший счета фотонов в каждом кадре. Любая достаточно ярким флуоресцентную метку можно заменить следующим протоколом. Наконец, сообщается последнее усилие расширения сферы применения ФИОНЫ к толстых образцов. Как доказательство-о-принципе, квантовые точки были пропитаныв Соль-гелей и кролик глазных роговиц, а затем в образ и локализованы с помощью Фиона. Для визуализации, погружения цель 60X вода с NA = 1.2 был использован, потому что эта цель имеет больше рабочее расстояние, чем ранее использовавшийся 100X иммерсионным объективом. Чтобы компенсировать потери в увеличении в цели, экстра-увеличение объектива (3.3x или 4.0X) был вставлен в пути излучения. Кроме того, эпи-флуоресцентный (не МДП) микроскопии должен быть использован для доступа глубокие участки в толстых образцов. Показано, что квантовые точки, смоченные в глубине золь-гелей и в глаз кролика роговицы (Z> 200 мкм) можно локализовать с 2-3 точностью нм.
Access restricted. Please log in or start a trial to view this content.
протокол
О себе Этика: ткани роговицы от кроликов собирали в соответствии с Университетом Иллинойса Уходу за животными и использованию принципов.
1 TIRFM Setup
ПРИМЕЧАНИЕ: носить очки лазерной безопасности все время.
- Убедитесь, что все необходимые оптические компоненты, перечисленные в Перечне материалов имеются в наличии и готовы для выравнивания. При необходимости используйте заменители с аналогичными функциями от других компаний. Убедитесь, что зеркала и линзы должны иметь антибликовое (AR) покрытий, соответствующие лазер в использовании.
- Набор высоты всех оптических компонентов на высоту центра микроскопом задней порта.
- Установите лазер, лазерная затвор и ND фильтр (ы). Использование нейтральные фильтры для ослабления мощности лазера вниз как можно ниже, сохраняя при этом луч видимым. Затянуть винты с соответствующими шестигранные ключи.
- Планируйте путь луча и пометить его с ленты или маркером на оптическом столе (точкаленные синие линии на рисунке 1). Для простоты, поддерживать прямые пути вдоль линий отверстий на оптическом столе.
- Место зеркало M1 (Рисунок 1) на первом прямым углом поворота. Поместите два ирисы вдоль второй прямой участок пути планируемого пучка. Регулировка как положение и наклон M1 таким образом, что лазер проходит через радужных оболочек.
- Место зеркало M2 (Рисунок 1) на втором прямым углом поворота. Поместите расширитель луча 10x (L1 & L2, рисунок 1) вдоль третьей прямой участок пути. Регулировка наклона его таким образом, что расширитель пучка параллельна оптической как таблицы и пути запланированной пучка.
- Отрегулируйте M1 и M2 многократно, так что лазер идет прямо через центры обоих объективов расширителя пучка. Повторите этот шаг, пока профиль пучка расширенной луча не является не-подстриженные Gaussian.
- Отрегулируйте M1 для центрирования луча на L1 (Fiфигура 1) и M2 для центрирования луча на L2 (рисунок 1) многократно. Плохо профиль пучка обычно означает лазер обрезается; использовать лист белой бумаги, чтобы заблокировать луч после расширителя пучка для проверки профиля луча с глазами. Для высокоточного анализа, использовать оптический профайлер луча.
- Отрегулируйте расстояние между L1 и L2 так, что пучок коллимируется. Повторите шаг 1.8 и 1.9, если это необходимо.
ПРИМЕЧАНИЕ: Когда размер пучка не меняется с расстоянием, луч достаточно Коллимированный для установки TIRFM. Для дальнейшего улучшения коллимации пучка, инструменты, такие как интерферометра сдвига могут быть использованы. Типичный размер пучка после расширения составляет ~ 20 мм. - Затвор лазер. Отвинтите объектива микроскопа и винт в мишени флуоресцентного выравнивания. Место зеркал M3 и M4 (Рисунок 1) направить расширенный луч в микроскопе порту и на зеркальные внутри башни. Убедитесь, что лазерный луч отражается от тОн дихроичным и к потолку.
- Отрегулируйте M3 для центрирования яркую часть луча на флуоресцентной мишени, и M4, чтобы отрегулировать наклон луча быть вертикальной.
- Затвор лазер и винт цели масштаб. Если выравнивание в предыдущем шаге сделано хорошо должно быть симметричным местом выхода цели. Тонкая настройка наклоны M3 и M4, чтобы оптимизировать мощность лазера и профиль пучка из цели.
- Смонтировать EMCCD камеру к микроскопу и подключить камеру к компьютеру. Запустите программу для камеры.
- Установите флуоресцентный образец (раствор флуорофоров) на микроскопе. Посмотрите на яркий флуоресцентный пятна на камеру. Убедитесь, что место не сдвигается на экране при изменении фокуса.
- Поместите МДП объектив (L3, Рисунок 1) на этапе перевода XYZ на расстоянии от задней фокальной плоскости объектива, которая равна фокусного расстояния L3 (~ 30 см). Отрегулируйте положение L3таким образом, что лазер проходит через центр линзы.
- Перевести L3 вдоль пути луча, чтобы настроить коллимацию луча. Убедитесь, что луч-прежнему сосредоточены на мониторе и симметричны по форме.
ПРИМЕЧАНИЕ: площадь освещения в плоскости образца возрастает с уменьшением объектива TIR фокусное расстояние. В общем, используйте наименьшее фокусное расстояние, что может поместиться на настройки. - Перевести L3 перпендикулярной траектории пучка наклонить бревно из цели. Держите переводя объектив МДП таким образом, что TIR достигается. Соблюдайте образец люминесцентных бисера через EMCCD камеры, и тонкой настройки L3, чтобы получить хорошего ОСШ.
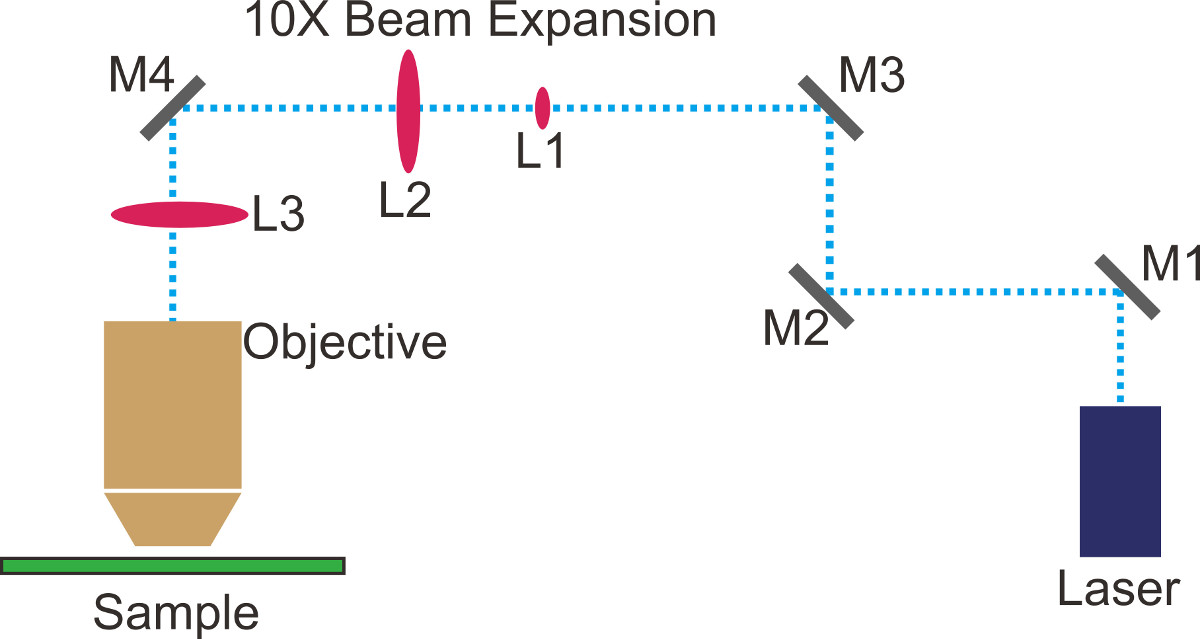
Рисунок 1. оптической конфигурации для общей флуоресценции внутреннее отражение микроскопии (TIRFM).
2 ФИОНА на Cy3-ДНК
- Cпостное предметные стекла и покровные: промыть микроскопа и покровные с DDh 2 O и изопропанола и высушите их газообразным азотом; поместите препараты и покровные в очистителем плазмы в течение 5 мин при аргоновой плазмы.
- Построить примеры камеры (как набросал на рисунке 2).
- Поместите ткань на скамейке, а затем положить кусочек объективов в верхней части ткани. Поместите слайд на объективов. Убедитесь, что чистый сторона слайда вверх.
- Применить две полоски двухсторонней ленты на слайд вдоль длинных краев, оставляя зазор 3-5 мм в центре. Поместите очищенный покровное в верхней части слайда. Убедитесь, что чистый сторона покровного стекла сталкивается слайд.
- Используйте пипетки давить на двухсторонней ленты. Используйте бритву, чтобы удалить избыток ленту с горкой, так, что лента остается только под покровным.
ПРИМЕЧАНИЕ: Открытые концы камеры остаются открытыми и служить на входе и изпусть. Объем камеры в несколько микролитров.

Рисунок 2 Эскиз типичного образца камеры (а) Вид сверху.; (Б) Вид сбоку справа; (С) Вид сбоку от передней.
- Остановите Cy3-ДНК на внутренних поверхностях отборных камер.
- Подготовка Т-50-буфера (10 мМ Трис-HCl, рН 8,0, 50 мМ NaCl). Подготовка BSA-биотин в Т-50 до конечной концентрации 1 мг / мл. Подготовка Т50-BSA буфера путем растворения BSA в Т-50 до конечной концентрации 10 мг / мл.
- Подготовьте 0,5 мг / мл neutravidin в Т50-BSA буфера. Подготовка биотинилированного Су3 меченой ДНК (ДНК-Cy-3) в T50-BSA в конечной концентрации 5-10 мкМ.
- Пипетка 10 мкл БСА-биотин (1 мг / мл) в камере для образца. Подождите в течение 5 мин.
- Вымойте камеру с 40 мкл T50-BSA. Пипетка 10 мкл neutravidin (0,5 мг / мл) в камере для образца. Инкубировать в течение 5 мин.
- Вымойте камеру с 40 мкл T50-BSA. Пипетка 20 мкл Cy-3 ДНК, в отборную камеру. Инкубировать в течение 5 мин и затем промыть в камеру с 80 мкл T50-BSA.
- Изображение Cy3-ДНК одиночные молекулы под TIRFM.
- Получают буфер изображений (100 мкл) путем смешивания 1 мкл Protocatechuate-3,4-диоксигеназы (PCD, 5 мкм), 4 мкл протокатеховая кислота (PCA, 62,5 мМ), 50 мкл 6-гидрокси-2,5,7,8- tetramethylchromane-2-карбоновой кислоты (Тролокс, 2 мМ в Т-50), и 45 мкл Т50-БСА.
- Внесите в 30 мкл буфера изображений и ждать 8-10 мин.
- Установите образец для визуализации на TIRFM что оснащенной зеленый лазер (532 нм), 100X масло погружения цель (1,45 NA), и EMCCD камеры.
- Установите время экспозиции 100 до 500 мс и EM усиления до 25 к 100 Приобретать кино образца для 1,000 кадров.
- Выполнить анализ данных Фиона на записанных изображений Cy3-ДНК.
- Определить эффективный размер пикселя (т.е. коэффициент перехода от пикселей в нанометрах) путем деления физический размер пикселя (читать с листа спецификации в EMCCD камеры), на общее увеличение (увеличение микроскопа цели, умноженной на любых дополнительных увеличениях).
- Определить коэффициент пересчета от интенсивности пикселей в фотонных цифры путем деления чувствительности ПЗС (т.е. электронов на / D считать, читать с листа спецификации камеры на ПЗС) по ВЭУ (ЭМ) усиление использоваться во время получения изображения.
- Компиляция и запустить FIONA.pro для анализа FIONA. Используйте эту программу IDL импортировать полученное изображение, чтобы ввести эффективно Размер пикселя (с шага 2.5.1) и коэффициента преобразования от интенсивности к числа фотонов (со стадии 2.5.2), и выбрать места для анализа FIONA.
ПРИМЕЧАНИЕ: В конце, PROGRAВыход м воля установочные результаты с функциями 2D Гаусса, а также общего количества фотонов и точности локализации. Типичный результат показан в разделе Представитель Результаты и цифры 4с-4d. - Компиляция и запустить phcount.pro охарактеризовать счета фотонов. Используйте эту программу IDL для измерения среднего числа фотонов, испускаемых флуорофором до фотообесцвечивания, импортировать полученное изображение и на входе коэффициента преобразования от интенсивности к числа фотонов (со стадии 2.5.2).
ПРИМЕЧАНИЕ: Программа обнаружит флуоресцентные пятна автоматически (ручной выбор вариант), рассчитать фотоотсчетов в зависимости от номера кадра и выход следы фотоотсчетов.- Откажитесь плохие следы и указывать диапазоны кадров после фотообесцвечивания для коррекция базовой линии. В конце концов, программа выведет список всех чисел фотонов для всех пятен не отбрасываются. Тогда построить распределение числа фотонов и соответствовать спределние с экспоненциальным затуханием получить среднее число фотонов. Типичный результат показан в разделе репрезентативных результатов и фиг 4E-4F.
3 ФИОНА Прикладная для количественного двигателя (например, Миозин на актина) Dynamics в нанометровом масштабе
- Заполимеризуйте актин (т.е. подготовить F-актин) за один день до FIONA эксперимента.
- Восстановить G-актин (мономер) биотин G-актин (мономеров) до 10 мг / мл с общей буфера актина. Движение, чтобы убедиться, что обе полностью растворяется, и держать как на льду.
- Смешать 10 мкл G-актин (мономер) с 1,7 мкл биотина G-актина в 1,5 мл микроцентрифужных трубки. Добавить 100 мкл ледяной холод актина буфер полимеризации.
- Оставьте смесь в течение ночи при 4 ° С (F-актина образуются), а затем добавить DDH 2 O до общего объема 1 мл.
- Хранить актиновые филаменты (F-актина) при 4 ° С для последующего использования в экспериментах.
Заметка: Нити будет разрушаться и сократить в течение долгого времени, но может быть использован, по крайней мере, две недели.
- Подготовка образца для визуализации.
- Сделайте камеру для образца (как описано в Протоколе 2.1 и 2.2). Пипетка в 20 мкл биотинилированных БСА в концентрации 1 мг / мл в DDH 2 O. Инкубируют в течение 10 мин. Смойте 30 мкл DDH 2 O.
ПРИМЕЧАНИЕ: Это блокирует поверхности стекла и ложится биотин для связывания нитей актина. Биотинилированных поли-L-лизин - полиэтиленгликоль (ПЭГ-ФАПЧ) может выполнять ту же функцию. - Пипетка в 0,5 мг / мл neutravidin. Инкубируют в течение 2 мин, а затем моют в камеру с 30 мкл буфера М5.
- Пипетка в готовом F-актина разводили в 25 раз в общем буфере актина, до конечной концентрации ~ 0,004 мг / мл. Подождите 10 минут, промойте камеру с 30 мкл буфера.
- Развести миозина Va с флагом тегов в 30 раз в M5 буфере (20 мМ HEPES (рН 7,6), 2 мМ MgCl 2, 25 мМ KCl, 1 мМ EGTA) до конечной концентрации OF 250 нМ. Смешайте 1 мкл миозин с 1 мкл Anti-Flag-Qdot705 (~ 1 мкм, конъюгированного с Anti-Flag антител и Qdot705 помощью Qdot705 Antibody сопряжения Kit в соответствии с инструкцией по эксплуатации от производителя). Добавить в 8 мкл M5, чтобы заполнить до 10 мкл. Внесите вверх и вниз, чтобы хорошо перемешать. Выдержите в течение 10 мин на льду.
ПРИМЕЧАНИЕ: Это дает смесь 1 мотор до 4 квантовых точек, в ~ 25 нМ концентрации миозина.
- Сделайте камеру для образца (как описано в Протоколе 2.1 и 2.2). Пипетка в 20 мкл биотинилированных БСА в концентрации 1 мг / мл в DDH 2 O. Инкубируют в течение 10 мин. Смойте 30 мкл DDH 2 O.
- Визуализация миозина ходить на актина.
- Получают буфер изображений (100 мкл) путем смешивания 84 мкл М5-БСА (буфер М5 с 1 мг / мл БСА), 1 мкл АТФ (50 мкМ в DDH 2 O), 2 мкл DTT (500 мМ в DDH 2 O), 1 CK мкл (500 ед / мл), 5 мкл CP (200 мМ), 1 мкл PCD, 4 мкл СПС, 1 мкл миозина-qdot после разбавления другой в 10 раз до 2,5 нМ концентрации миозина, и 1 мкл BME.
- Внесите в 20 мкл буфера изображений пробовать камеру и выдержать в течение 8-10 мин.
- Изображение образец на ТIRF микроскоп на 30 мсек воздействия. Приобрести по крайней мере, 1000 кадров. Регулировка громкости миозина-qdot в шаге 3.3.1, если необходимо.
- Выполнить анализ данных и найти размер шага миозина ходьбе.
- Откройте видеофайл в ImageJ 17 и обрезать видео вокруг движущегося месте. Обрезка достаточно большую площадь, что пятно никогда не получает в течение 20 пикселей краю, и убедитесь, что нет никаких других мест в видео. Убедитесь, что это пятно движется в линейном пути.
- Отслеживать место через видео генерировать координаты х и у через время, в пикселях, применяя Фиона анализ (этап 2.5.3) для каждого и каждый кадр видео.
- Преобразование пикселей в нанометрах, как описано в предыдущем разделе.
- Вычислить смещение от начальной позиции в зависимости от времени.
- Запустите т-тест на перемещения для получения этапы миозина ходьбе.
ПРИМЕЧАНИЕ: Программа предусматривает т-тест (step_t_test.zip) кодируется в IDL и консостоит из 14 подпрограмм в папке.- Откройте все подпрограмм в IDL и собрать все в два раза. Затем запустите mtltyanalysis_ttest.pro и выберите текстовый файл, содержащий данные, расстояние в одну колонку. Выходной файл Excel будет создан, содержащий исходные данные, подгонку и размер шага.
- Удалить все нулевые значения из колонки шаг размера. Участок распределение размеров шагов, используя происхождения или MATLAB. Установите Гаусса к гистограмме.
ПРИМЕЧАНИЕ: размеры шаге нулевых значений должны быть удалены, потому что это шаг нуля означает, что ни один шаг не берется из предыдущего кадра. Место дает пик около 36 нм (как показано на рисунке 5).
4 Толстые Подготовка проб для ФИОНЫ
- Подготовьте квантовые точки инкапсулированные в золь-гель.
- Смешайте 4,5 мл TMOS, 1 мл DDH 2 O и 100 мкл HCl (120 мМ). Разрушать ультразвуком смесь на льду в течение 30 мин в ультразвуковой очиститель зрecified в Список материалов (частота = 40 кГц, обогреватель = OFF). Смешайте раствор каждые 10 мин.
- Развести 1,5 мкл Qdot605 в 1,5 мл HEPES (50 мМ рН 7,2). Смешайте раствор с 1,5 мл ТМОС из предыдущего шага.
- Вылейте смесь в стеклянной нижней блюдо. Уплотнение со стеклянным дном блюдо с парафильмом и хранят при 4 ° С для 1 5 часов.
- Добавить 2 мл 1% BME в PBS в образце блюдо и инкубируют при комнатной температуре в течение 30 мин, после чего изображений.
- Подготовьте роговицы образец окрашивали квантовых точек.
ПРИМЕЧАНИЕ: Кролик-глаза были подарки от доктора Марины Марьянович.- Отделите роговицу от глаз и разрезать его на 3 мм х 3 мм шт.
- Развести 1 мкл Qdot 605-стрептавидин в 1 мл ФСБ. Выдержите ткани роговицы с 1 нМ Qdots растворе при 4 ° С в течение 1 часа. Вымойте ткань с PBS.
- Возьмите чистую предметное стекло и # 1.5 покровное. Положите 4 слоя двухсторонней ленты на стекле вдоль длинной стороны,й поставить еще 4 слоев двухсторонней лентой параллельно к предыдущему ленты и оставить канал около 1 см между ними. Положите ткань из предыдущего шага в середине канала, и покрыть ее покровным.
- Пресс аккуратно по бокам покровного стекла, чтобы сделать его прилипать к лентам. Намочите канал с 50 мкл PBS до визуализации.
- Квантовые изображения точки в золь-гель и роговицы.
- Для FIONA изображений в толстых образцах, использовать 60X вода-иммерсионный объектив с рабочим расстоянием 0,27 мм, или 60X вода-иммерсионный объектив с рабочим расстоянием 0,28 мм.
- Установите образец на микроскопом. Регулировка TIRF линзы таким образом, что она достигает режим эпи-флуоресценции (т.е. лазерный луч выходит из объектива с углом по отношению к покровным). Вставьте дополнительный увеличения объектива (3.3x или 4.0x).
- Перемещение фокальной плоскости объектива в требуемом положении Z (например,> 200 мкм). Запись изображения неподвижнымиквантовые точки в образце.
- Выполнить анализ Фиона, как описано в разделе 2.5 настоящего протокола.
Access restricted. Please log in or start a trial to view this content.
Результаты
Типичная задача типа установки TIRFM показано на рисунке 3. Сначала поверхность с иммобилизованным образец Cy3-ДНК образ. Типичный изображение показано на рисунке 4а. Изображение было получено с воздействием 0,5 сек, с Е.М. усиления = 50 и чувствительности ПЗС = 12,13 для камеры. ...
Access restricted. Please log in or start a trial to view this content.
Обсуждение
ФИОНА это техника локализовать положение флуоресцентного излучателя (органического флуорофором или квантовой точки) с нанометровой точностью и временным разрешением до 1 мс 4 8. Когда достаточное количество фотонов собирают, этот метод позволяет определить положение флуоресцен...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
Авторы заявляют, что они не имеют конкурирующие финансовые интересы.
Благодарности
Работа выполнена при поддержке грантов НИЗ 068625, NSF грантов 1063188 и центра физике живых клеток 0822613. Особая благодарность доктору Марина Марьянович в Beckman Института передовой науки и технологии за дар глаз кролика.
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| Double-sided tape | 3M | ~75 µm thick | |
| EMCCD camera | Andor Technology | DU-897E-CS0-#BV | |
| Ultrasonic cleaner | Branson | 2510 | |
| Fluorescence filter set | Chroma | 49016 | |
| Actin polymerization buffer | Cytoskeleton | BSA02 | |
| Biotin G-actin | Cytoskeleton | AB07 | |
| G-actin | Cytoskeleton | AKL95 | |
| General actin buffer | Cytoskeleton | BSA01 | |
| Laser shutter (with driver) | Electro-Optical Products Corp. | SH-10-MP | |
| IDL | Exelis Visual Information Solutions | ||
| Neutravidin | Fisher Scientific | PI-31000 | |
| Coverslip | Fisherbrand | 22X30-1.5 | 0.16-0.19 mm thick |
| Microscope slide | Gold Seal Microslides | 30103X1 | 0.93-1.05 mm thick |
| Plasma cleaner | Harrick Plasma | PDC-001 | |
| Glass bottom dish | In Vitro Scientific | D35-20-1.5-N | |
| Cy3-DNA oligos | Integrated DNA Technologies | 5'-Cy3/GCCTCGCTGCCGTCGCCA-3'Bio | |
| Fluorescent beads | Invitrogen | T-7280 | |
| Qdot 605-streptavidin | Invitrogen | Q10101MP | |
| Qdot605 | Invitrogen | Q21301MP | |
| Qdot705 | Invitrogen | Q22021MP | |
| Qdot705 Antibody Conjugation Kit | Invitrogen | Q22061MP | |
| MATLAB | MathWorks | ||
| Optical table | Newport Corp | RS4000 Series | |
| 60X Objective | Nikon | Plan Apo VC 60x WI | |
| 100X Objective | Olympus | PlanApo 100X/1.45 Oil ∞/0.17 | |
| 60X Objective | Olympus | UPlanApo 60X/1.20W | |
| Inverted microscope | Olympus | IX71/IX70/IX81 | |
| Origin | OriginLab | ||
| Anti-FLAG antibody | Sigma Aldrich | F7425-.2MG | |
| ATP | Sigma Aldrich | A7699 | |
| BME | Sigma Aldrich | 63689-25ML-F | |
| BSA | Sigma Aldrich | A7906 | |
| BSA-biotin | Sigma Aldrich | A8549-10MG | |
| CK | Sigma Aldrich | C3755 | Creatine Phosphokinase from rabbit muscle |
| CP | Sigma Aldrich | P1937 | Phosphocreatine di(tris) salt |
| DTT | Sigma Aldrich | 43815 | DL-Dithiothreitol |
| EGTA | Sigma Aldrich | E3889 | Ethylene glycol-bis(2-aminoethylether)-N,N,N′,N′-tetraacetic acid |
| HCl | Sigma Aldrich | 93363-500G | |
| HEPES | Sigma Aldrich | H0887 | |
| KCl | Sigma Aldrich | P9333 | |
| MgCl2 | Sigma Aldrich | M1028 | |
| NaCl | Sigma Aldrich | S7653 | |
| PCA | Sigma Aldrich | 03930590 | Protocatechuic acid |
| PCD | Sigma Aldrich | P8279 | Protocatechuate-3,4-dioxygenase |
| TMOS | Sigma Aldrich | 341436-25G | Tetramethyl orthosilicate |
| Tris-HCl | Sigma Aldrich | 93363 | |
| Trolox | Sigma Aldrich | 238813 | 6-hydroxy-2,5,7,8-tetramethylchromane-2-carboxylic acid |
| 1” diameter broadband dielectric mirrors with mounts | Thorlabs | BB1-E02, KM100 | Quantity: 2 |
| ½” diameter posts | Thorlabs | TR4 | Quantity ≥ 6 |
| 10X beam expander | Thorlabs | BE10M-A | |
| 2” diameter f = 300 mm lens with mount | Thorlabs | LA1256-A, LMR2 | TIR lens |
| Fluorescent alignment target | Thorlabs | VRC2SM1 | |
| Laser safety goggles | Thorlabs | LG3 | |
| ND filter(s) | Thorlabs | FW1AND | |
| Optical beam profiler | Thorlabs | BP209-VIS | |
| Post-mounted iris diaphragm | Thorlabs | ID25 | Quantity: 2 |
| Shearing interferometer | Thorlabs | SI100 | |
| XYZ translation stage, ½” travel | Thorlabs | T12XYZ | |
| Laser | World Star Technologies | TECGL-30 | 532 nm, 30 mW |
Ссылки
- Abbe, E. The Relation of Aperture and Power in the Microscope. Journal of the Royal Microscopical Society. 2 (3), 300-309 (1882).
- Abbe, E. The Relation of Aperture and Power in the Microscope (continued). Journal of the Royal Microscopical Society. 2 (4), 460-473 (1882).
- Thompson, R. Precise Nanometer Localization Analysis for Individual Fluorescent Probes. Biophysical Journal. 82 (5), 2775-2783 (2002).
- Yildiz, A., et al. Myosin V Walks Hand-Over-Hand: Single Fluorophore Imaging with 1.5-nm Localization. Science. 300 (5628), 2061-2065 (2003).
- Yildiz, A., Tomishige, M., Vale, R. D., Selvin, P. R. Kinesin Walks Hand-Over-Hand. Science. 303 (5658), 676-678 (2004).
- Yildiz, A., et al. Myosin VI Steps via a Hand-over-Hand Mechanism with Its Lever Arm Undergoing Fluctuations when Attached to Actin. Journal of Biological Chemistry. 279 (36), 37223-37226 (2004).
- Yildiz, A., Selvin, P. R. Fluorescence Imaging with One Nanometer Accuracy: Application to Molecular Motors. Accounts of Chemical Research. 38 (7), 574-582 (2005).
- Toprak, E., Yildiz, A., Hoffman, M. T., Rosenfeld, S. S., Selvin, P. R. Why kinesin is so processive. Proceedings of the National Academy of Sciences. 106 (31), (2009).
- Kural, C., et al. Tracking melanosomes inside a cell to study molecular motors and their interaction. Proceedings of the National Academy of Sciences. 104 (13), 5378-5382 (2007).
- Gordon, M. P., Ha, T., Selvin, P. R. Single-molecule high-resolution imaging with photobleaching. Proceedings of the National Academy of Sciences of the United States of America. 101 (17), 6462-6465 (2004).
- Qu, X., Wu, D., Mets, L., Scherer, N. F. Nanometer-localized multiple single-molecule fluorescence microscopy. Proceedings of the National Academy of Sciences of the United States of America. 101 (31), 11298-11303 (2004).
- Churchman, L. S., Ökten, Z., Rock, R. S., Dawson, J. F., Spudich, J. A. Single molecule high-resolution colocalization of Cy3 and Cy5 attached to macromolecules measures intramolecular distances through time. Proceedings of the National Academy of Sciences of the United States of America. 102 (5), 1419-1423 (2005).
- Huang, B., Wang, W., Bates, M., Zhuang, X. Three-Dimensional Super-Resolution Imaging by Stochastic Optical Reconstruction Microscopy. Science. 319 (5864), 810-813 (2008).
- Rust, M. J., Bates, M., Zhuang, X. Sub-diffraction-limit imaging by stochastic optical reconstruction microscopy (STORM). Nat Meth. 3 (10), 793-796 (2006).
- Bates, M., Huang, B., Dempsey, G. T., Zhuang, X. Multicolor Super-Resolution Imaging with Photo-Switchable Fluorescent Probes. Science. 317 (5845), 1749-1753 (2007).
- Betzig, E., et al. Imaging Intracellular Fluorescent Proteins at Nanometer Resolution. Science. 313 (5793), 1642-1645 (2006).
- Abramoff, M. D., Magalhães, P. J., Ram, S. J. Image processing with ImageJ. Biophotonics international. 11 (7), 36-42 (2004).
- Enderlein, J., Toprak, E., Selvin, P. R. Polarization effect on position accuracy of fluorophore localization. Optics Express. 14 (18), 8111-8120 (2006).
- Cheezum, M. K., Walker, W. F., Guilford, W. H. Quantitative comparison of algorithms for tracking single fluorescent particles. Biophysical Journal. 81 (4), 2378-2388 (2001).
- Rasnik, I., McKinney, S. A., Ha, T. Nonblinking and long-lasting single-molecule fluorescence imaging. Nature Methods. 3 (11), 891-893 (2006).
- Zhuang, X., et al. A Single-Molecule Study of RNA Catalysis and Folding. Science. 288 (5473), 2048-2051 (2000).
- Aitken, C. E., Marshall, R. A., Puglisi, J. D. An Oxygen Scavenging System for Improvement of Dye Stability in Single-Molecule Fluorescence Experiments. Biophysical Journal. 94 (5), 1826-1835 (2008).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены