Method Article
Мини-этажном воздуха поднимается Платформа: Новый метод Объединение Поведение с микроскопии или электрофизиологии на Пробудитесь свободно движущейся Грызунов
В этой статье
Резюме
Этот метод создает осязаемое, знакомую среду для мыши для навигации и изучения во микроскопических изображений или одноклеточных электрофизиологических записей, которые требуют твердой фиксации головы животного.
Аннотация
Широко признано, что использование общих анестетиков может подорвать актуальность электрофизиологических или микроскопических данных, полученных из мозга живого животного. Кроме того, длительный восстановление после анестезии ограничивает частоту повторных эпизодов записи / изображений в продольных исследованиях. Таким образом, новые методы, которые позволили бы стабильные записи с не-наркозом ведет себя мышей, как ожидается, для продвижения области клеточной и когнитивных нейронаук. Существующие решения варьируются от простого физического воздействия к более сложным подходов, таких как линейных, так и сферических беговые дорожки, используемых в сочетании с компьютерной генерируемые виртуальной реальности. Здесь, роман способ описан, где голова фиксируется мышь может передвигаться воздушным поднял мобильного homecage и исследовать его окружение под свободной от стрессов условиях. Этот метод позволяет исследователям выполнять поведенческие тесты (например, обучения, привыкания или распознавания новых объектов) одновременно сдвухфотонного микроскопические изображения и / или патч-зажим записи, все это объединено в одном эксперименте. Это видео-статья описывает использование в активный головой животного фиксации устройства (мобильного homecage), демонстрирует процедуры животного привыкания, и является примером ряд возможных применений метода.
Введение
Захватывающая последнее время тенденция в нейронаук является разработка экспериментальных подходов для молекулярной и клеточной зондирования нейронных сетей в мозгу проснуться, ведет себя грызунов. Такие подходы провести обещают пролить новый свет на нейрофизиологических процессов, лежащих в основе моторную функцию, интеграцию сенсомоторную, восприятие, обучение, память, а также прогрессирование травмы, нейродегенерацию и генетических заболеваний. Кроме того, записи из мозга бодрствует животного держит обещание в разработке новых терапевтических агентов и методов лечения.
Существует растущее понимание, что анестезия, которая была широко используется в нейрофизиологических экспериментах, может повлиять на основные механизмы работы мозга, что может привести к ошибочной интерпретации экспериментальных данных. Таким образом, широко используется обезболивающий кетамин быстро увеличивается образование новых дендритных шипиков и усиливает синаптическую функцию 1; другой обычно используемый anesthetМикросхема изофлюран при хирургических уровнях анестезии полностью подавляет спонтанную активность коры у новорожденных крыс и блоков шпинделя-всплесков колебаний в взрослых животных 2. В настоящее время только ограниченное количество подходов позволит эксперименты в не-наркозом мышей с помощью двухфотонного микроскопических изображений или патч-зажим записи. Эти подходы можно разделить на свободно движущихся и головы фиксированной препаратов.
Уникальная привлекательность свободно движущейся подготовки животных является то, что он позволяет оценить естественное поведение, в том числе целых движений тела во время навигации. Один из способов изображения внутри мозга свободно движущейся грызуна приложить миниатюрные устанавливаемый на головке микроскопа или Fiberscope 3-5. Тем не менее, миниатюрные устройства, как правило, имеют ограниченный оптические характеристики в сравнении с объективной основе двухфотонного микроскопии, и не может быть легко объединены с целыми клеток патч-зажим записи 6.
Exiжала решения для головы фиксации активный грызуна полагались в основном либо на физических ограничений 7,8 или на обучение животное выставлять добровольное подголовник 9. Другой популярный подход, чтобы позволить конечности животного двигаться, разместив его на, например, сферическую беговую дорожку 10; этот подход часто сочетается с генерируемой компьютером виртуальной реальности. Электрофизиологические эксперименты на мышах с черепно-фиксированный в основном используется внеклеточных записи и были использованы для изучения центральной регуляции сердечно-сосудистой системы 11, эффекты анестезии на нейронной активности 12, слуховой ответ в стволе головного мозга 13 и обработки информации 14. Пионерские внутриклеточные / записи цельноклеточные в активных ведет себя животных были проведены в 2000-х годах и были направлены на нервной деятельности, связанной с восприятием и движения 15-20. Примерно в то же время, первые микроскопические исследования изображений на бодрствующих мышей пабlished, где двухфотонного микроскопии в сенсорной коре физически сдерживали крыс 7 и на мышах, работающих на сферической беговой дорожке 21.
Последующие IN VIVO микроскопия и электрофизиологии исследования показали, что препарат глава фиксация можно успешно сочетать с поведенческими парадигм, основанных на движениях передних конечностей, распознавание запаха, взбивая, и облизывая 8,22-25. Мыши Расположенные сферической беговой дорожке можно научить ориентироваться в виртуальную визуальную среду сгенерированный компьютером 10,26. Внутриклеточные / внеклеточных записи показали, что в головном фиксированной животного ходовом такую виртуальную среду, активация гиппокампа место клеток могут быть обнаружены 27. В виртуальной визуальной среды, мыши демонстрируют нормальное движение связанных тета-ритма в местной потенциала поля и тета-фаз прецессии во время активного движения 27. В последнее время пространственная и временная Activitу модели нейронных популяций были записаны оптически мышей во время работы решения памяти задачи в виртуальной среде 28.
Несмотря на то, включен исследования прорыва, сферическая конструкция беговой дорожке имеет несколько ограничения, присущие. Во-первых, животное необходимо для перехода на неограниченное поверхности вращающегося воздуха поднял мяч, который не представляет никаких видимых препятствий, таких как стены или барьеры. Это ограничение только частично компенсируется генерируемой компьютером "виртуальной реальности", так как визуальный ввод, возможно, менее эффективны на мышах и крысах по сравнению с тактильной сенсорной информации (например, усов на ощупь или лизать), который, естественно, эти виды рассчитывать на. Во-вторых, значительное кривизна поверхности шара может быть неудобно для лабораторных мышей, используемых в ходьбе по ровной поверхности пола в своих клетках. Наконец, сам диаметр шара (по крайней мере, 200 мм для мышей и 300 мм для крыс) оказывает вертикальный размер сферическаяБеговая дорожка устройство относительно большим. Это делает его трудно сочетать сферическую беговую дорожку с большинством имеющихся в продаже микроскопии установок, и часто требует строительства новой установки вокруг беговой дорожке с помощью заказных кадров микроскопа.
Здесь, роман способ описан, где голова фиксируется мышь может двигаться вокруг мобильного homecage воздуха поднимается, который показывает ровный пол и ощутимые стены, а также изучить физическую среду под свободной от стрессов условиях. В этой статье показано процедуры подготовки мыши и головы фиксации, а также предоставляет характерные примеры, где двухфотонного микроскопия, внутренняя оптических изображений и патч-зажим записи выполняются в мозге бодрствующих ведет себя мышей.
протокол
Все процедуры, представленные здесь, были выполнены в соответствии с местным руководством для ухода за животными (Финский закон о экспериментов на животных (62/2006)). Лицензия животных (ESAVI/2857/04.10.03/2012) получали из местной власти (ELÄINKOELAUTAKUNTA-ELLA). Мышей для взрослых (возраст 1-3 месяца, вес 20-40 г) содержались в группу жилищных клетках в сертифицированной вивария университета Хельсинки и обеспечены питанием и воде.
1. Черепно Окно Имплантация
Черепно окно имплантируется в соответствии с опубликованными протоколами 29-31 с незначительными изменениями, как кратко описаны ниже:
- Стерилизовать инструменты перед началом черепной окно имплантации. Поддерживать стерильных условий во время операции, чтобы свести к минимуму риск послеоперационных осложнений.
- Администрирование анальгетик (кетопрофен, 2,5 мг / кг) за 30 мин до операции и 24 ч после хирургии.esthetize мыши с использованием смеси кетамина (80 мг / кг) и ксилазина (10 мг / кг) вводили внутрибрюшинно. Регулярно контролировать глубину анестезии лапой щипать. Используйте грелку для поддержания температуры тела животного на 37,0 ° С. Для снижения хирургия вызванной воспаление и отек мозга, управлять дексаметазон (2 мг / кг) на подкожной инъекции.
- Применить глаз смазку для защиты глаз от попадания сухой. Бритье головы мыши и очистите бритая области. Разрежьте кожу с помощью хирургических ножниц и щипцов вдоль линии от шкирку ко лбу. Удалите соединительную ткань, прикрепленный к черепу.
- Медленно и осторожно просверлить маленькое хорошо на левой лобной кости, используя высокоскоростное хирургическое сверло. Винт мини болт (см. Материалы) в пробуренной скважины. Провести не более одно-и с половиной полных оборотов винта.
ПРИМЕЧАНИЕ: Избегайте те области, которые расположены непосредственно над поверхностных корковых сосудов. Нарушение этих ВЭСSELS может привести к массивным кровотечением. - Для выполнения трепанации черепа, просверлить круглое окно (3-3,5 мм в диаметре) в правой теменной кости. Нанесите каплю буфера коры (125 мМ NaCl, 5 мМ KCl, 10 мМ глюкозы, 10 мМ HEPES, 2 мМ CaCl 2 и 2 мМ MgSO 4 в дистиллированной H 2 O, с добавлением пенициллина 100 единиц / мл стрептомицина и 100 мкг / мл) и осторожно удалить часть кости, расположенной внутри кольцевой окна.
ПРИМЕЧАНИЕ: Чтобы выразить флуоресцентный белок в определенном субпопуляции клеток, выполните внутричерепное введение аденоассоциированного вирусной (ААВ) вектора или других вирусных векторов в этой точке в процедуре. - Установите круглую стеклянную покровное (# 1.5 толщина код) на черепной окна. Прикрепите покровное к черепу с полиакриловой клея. Поместите металлический держатель на верхней части покровного стекла и закрепите его со смесью зубного цемента и полиакриловой клея.
ПРИМЕЧАНИЕ: Процедура, описанная выше оптимизирован для черепных окониспользуется в экспериментах по оптической визуализации. Чтобы подготовить "перевернутую букву" черепной окно, подходящий для электрофизиологических экспериментов, использовать другую процедуру. Во-первых, клей металлический держатель к черепу. Дрель круглое окно в отверстии держателя на примере в видео. С другой стороны, сделать меньше трепанации черепа (менее 0,5 мм в диаметре) по области, представляющие интерес для предотвращения или минимизации движение мозга 32. Обновите корковой буфер или поместить каплю силиконового клея на черепной окна, а затем закрыть его с круглой покровного стекла. - После завершения операции, поместите животное в утепленной клетке с легкодоступной пищи и воды. Вернуться животное к группе-жилищного клетке только после того, как восстанавливается полностью от наркоза. Повторно вводить обезболивающее при обнаружении каких-либо признаков боли, в том числе нежелание двигаться, есть и не пить, потеря веса, слюнотечение, пилоэрекции или ненормальных звуков дыхания.
2. Анимал Обращение
- Возьмите мышь из клетки и просто удерживайте ее в течение 5-10 мин. Будьте спокойны при обращении с животным, избежать судорожные движения и звуки.
- После обработки, вернуть курсор в клетку.
- Повторите процедуру обработки 2-3x с неравными интервалами между эпизодами обработки, для того, чтобы мышь комфортно с экспериментатором.
- Возьмите небольшую мягкую тряпку и обернуть животных 2-3x с неравными интервалами.
- Животное должно оставаться спокойным и привыкнуть к тому, завернутые. Если мышь возбуждается и нервная, повторите процедуры обработки и упаковки.
3. Дрессировка
- Начните подготовку животного в мобильном homecage на следующий день после привыкания к обработке и упаковке завершена.
- Запишите до и во время тренировки животное взвешивания в день.
ПРИМЕЧАНИЕ: Если во время обучения, животное теряет более 10% своего веса, он должен быть исключен из тон экспериментирует. - Отрегулируйте вертикальное положение головы фиксации руки мобильного устройства homecage, чтобы соответствовать размер обученного животного. Подключение воздухозаборник устройства к стандартной лабораторной выходе сжатого воздуха (обычно, либо резервуара газа или воздуха насос, который обеспечивает достаточно высокое давление и скорость потока воздуха, т.е. примерно 5 бар и 300 л / мин).
- Оберните животное в тряпочку.
- Вставьте держатель металла, которая крепится к голове животного, в голову фиксации руки и твердо зафиксировать его, затянув винты. Включите воздушного потока и убедитесь, что поток воздуха оптимальна для свободного плавающего курса воздушно-поднял homecage. Отпустите животное в мобильном homecage удалив тряпку.
- Чтобы приучить животное к шуму, обеспечивают постоянное воздействие окружающих звуков (с использованием, например, радио или музыкальные записи и речи) в течение всех тренировок, а также в ходе экспериментов.
- Dо время первую тренировку, чтобы свет номера в течение первого часа, затем выключить свет до конца тренировки.
- Через 2 часа обучения в мобильном homecage, отпустите животное от головной фиксации и вернуть его в клетку с запасом воды и пищи. Оставьте его в течение не менее 2 часов в состоянии покоя.
- Очистите мобильного homecage после каждой тренировки с помощью 70%-ный раствор этанола и промойте его водой из-под крана. Выдерживают-воду с одноразовой бумажной салфеткой и высушить мобильный homecage до следующего использования.
- Выполните подряд тренинги в течение 2 часов, с учетом комнатной выключен в то время как животное проходит обучение.
- Выполните тренировку дважды в день.
- После 8 до 12 учебных сессий, использовать животное в экспериментальной сессии на срок до 2 часов за один раз.
ПРИМЕЧАНИЕ: Во время длительных тренировок, которые длятся более 1-2 ч, рассмотреть вопрос о предоставлении мышь жIth питьевой воды, который может быть доставлен либо вручную, либо с помощью пипетки держатель, прикрепленный к подвижной раме homecage. Кроме того, вода может подаваться для вволю использования животного путем размещения вязкие капли гидро-гель непосредственно на стенах мобильного homecage.
ПРИМЕЧАНИЕ: Не забудьте взвесить животных каждый день перед тренировкой, чтобы исключить любые хронические последствия стресса. Исключить животное из эксперимента, если в любой момент времени, он демонстрирует стресс реакций, таких как замораживание, вокализации, или стресс-индуцированной диареи.
4. Приложения
- Двухфотонное изображений в Awake мыши Перемещение мобильный Homecage
- Соберите мобильный homecage. Проверьте позиции моста и глава фиксации руки.
- Оберните обученный животное в тряпочку. Место животное в мобильном homecage. Зажмите металлический держатель в голову фиксации руки. Снимите тряпку.
- Очистите имплантированный покровного стекла от пыли с помощью70% раствор этанола и дайте ему высохнуть.
- Поместите каплю иммерсионной жидкости на классе покрова. Предпочтительно использовать вязкий раствор, так как вода будет быстро испаряться.
- Поместите мобильного устройства homecage с обученным животного под микроскопом (если у вас нет второй такой же устройство, которое стационарный в настройках микроскопии).
- Выполните визуализацию с использованием либо выполненное на заказ или имеющиеся в продаже системы микроскопа изображений лазерного сканирования, оснащенный фемтосекундного импульсного инфракрасного лазера.
- Найти область интереса с использованием режима широким полем из флуоресцентного микроскопа. Используйте длинный пас фильтры для оценки мозговой сосудистой и выберите соответствующий целевой области после осмотра картину кровеносных сосудов.
- Для изображения корковой сосудистой, придать 1%-ный раствор красно-сопряженного декстрана 70000 МВт Техас (или его аналог), либо в хвостовую вену, пока животное будет обездвижен в тряпку или ретро-орбитально в то время какживотное помещают в мобильном homecage. Настройтесь двухфотонного лазера до 860 нм и использовать полосовой фильтр (590-650 нм), чтобы собрать излучаемого света. Используйте фильтр выбросов 515-560 нм для оценки мелкие детали нейронов морфологии или нейронной активности с использованием, например, трансгенных мышей, что выразить YFP или Са 2 + - чувствительный флуоресцентный GCaMP3 белка в субпопуляции нейронов под промоутер Thy1.
- Используйте соответствующее программное обеспечение для получения изображений.
- После обработки изображений, освободить животное от головной фиксации рычага, ослабив винты. Вернуться животное в клетку и дать ему отдохнуть в течение по крайней мере 2 часов, прежде чем начать следующую сессию изображения.
- Храните координаты каждой области интереса (ROI) для последующего reimaging. Изображение же трансформирования с течением времени, а также настроить координаты каждый раз, чтобы максимизировать перекрытие изображения.
- Анализ изображений и создания трехмерных реконструкций с использованием соответствующего обновлявляются (например, ImageJ и т.д.).
- Внутренняя оптических изображений в Awake мыши Перемещение мобильный Homecage
- Соберите мобильный homecage под приобретение камеры образ внутренней установки оптических изображений.
- Оберните обученный животное в тряпочку. Место животное в мобильном homecage. Зажмите металлический держатель в голову фиксации руки.
- Очистите имплантированный покровного стекла от пыли с помощью 70%-ный раствор этанола и дайте ему высохнуть.
- Поместите каплю глицерина на имплантированного стекла и покрыть ее 8 мм круглого покровным.
- Поставьте манипулятор с воздушным ударом трубы напротив противоположной вибрисс.
- Отрегулируйте положение высокоскоростной камерой и сфокусировать его на корковой сосудов.
- Используйте зеленый свет (фильтр 546BP30) без камеры фильтра приобрести карту сосудов.
- Фокус глубже в коре, около 400 микрометров ниже поверхности коры.
- Для изображения тон зависит от уровня сигнала (жирный) оптический сигнал оксигенации крови, поместите 590LP фильтр перед камерой и осветить кору с красным светом (фильтр 630BP30).
- Регулировка освещенности поверхности коры так, что он равномерно распределен по области, представляющей интерес, во избежание чрезмерного. Отрегулируйте интенсивность освещения так, что область интересов попадает в 70-90% сегмента динамического диапазона камеры.
- Используйте LongDaq программное обеспечение захвата изображений для сбора изображений с камеры.
- Используйте изображения частоту сбора от 1 до 10 Гц (то есть от 1 до 10 кадров в секунду) для экспериментов с низкой стимуляции частоты (0,05 Гц).
- Выключите свет номера, чтобы предотвратить любое вмешательство в собственной оптического сигнала.
- Позвольте по крайней мере 30 минут для мыши, чтобы адаптироваться к мобильной homecage.
- Изображение базового активность во время 6-минутной эпизоде без стимуляции.
- Для записи вызвавший грortical деятельность, стимулировать вибрисс в 10 сек режиме ON/10 сек OFF (0,05 Гц стимуляции) с высокой частотой (25 Гц) железнодорожного воздушных затяжек на общую течение 6 мин.
- После получения изображения, отпустите кнопку мыши из головы фиксации руки и вернуть его в клетку.
- Не следует использовать дополнительную фильтрацию данных для частоты, потому что амплитуды откликов стимуляции, как правило, относительно высокой в бодрствующих животных, что приводит к превосходной сигнала к шуму.
- Преобразование полученных наборов изображений в *. Файлов TIF стека и анализировать их дальнейшего использования, например, с открытым исходным кодом Фиджи (ImageJ). Вычтите базовый спонтанную активность из кадров, полученных в ходе вибрисс стимуляции с использованием изображения Калькулятор инструмент. Кроме того, данные фильтра в частотной области с использованием соответствующего программного обеспечения.
- Патч-зажим Записи в Awake мыши Перемещение мобильный Homecage
- Соберите мобильный homecage.
- Оберните обученный животное в тряпочку. Администрирование триметоприм (5 мг / кг) и сульфадоксина (25 мг / кг), чтобы предотвратить бактериальную инфекцию. Место животное в мобильном homecage. Зажмите металлический держатель в голову фиксации руки.
- Чистый и стерилизовать имплантированный зубной цемент "шапку" и покровного стекла, используя 70%-ный раствор этанола или 0,5% хлоргексидина диглюконат и дайте ему высохнуть.
- Медленно и осторожно снимите крышку стекла из металлического держателя.
- Обновите корковой буфера с добавлением пенициллина, стрептомицина и очистите черепной окно от мусора с помощью стерильного гемостаза тампона.
- Поместите заземляющий электрод в корковой буфера.
- Поместите электрофизиологии headstage в микроманипулятора.
- Изготовление пипетки из боросиликатного стекла, направленный на сопротивление наконечника в диапазоне от 6,5 до 8.5MΩ. Заполните патч пипетки с внутриклеточным раствором. Состав патч пипетки раствораСледующий (в мМ): KCl, 8 111 K-глюконат, 0,5 CaCl 2, 2 NaOH, 10 глюкозы, 10 HEPES, 2 Mg-АТФ и 5 BAPTA, рН доводили до 7,2 с помощью КОН. Потенциальные значения мембранные должны быть исправлены в течение рассчитанного жидкой соединительной потенциала -12 мВ 33.
- Целевая область интереса с использованием стереотаксических координат и быстро перемещать электрод в мозг, сохраняя при этом сильную положительную давление на кончика пипетки. После проникновения твердой мозговой оболочки и пипетки позиционирования, измерения сопротивления наконечника и отбросить электроды, которые показывают увеличение сопротивления более чем на 10-15%, в целях улучшения вероятность успеха последующих стадиях.
- Уменьшите положительное давление вдвое, чтобы избежать отек окружающей ткани мозга. Дальнейшие шаги аналогичны стандартным протоколом "слепой патч". Чтобы найти нейрон для записи с, понизить наконечник в головном мозге ступенчато до тех пор, нейрон не обнаружен в тесном proximitу наконечника пипетки, на что указывает характерной временной последовательности изменений импеданса электрода. Основным показателем наличия нейрона является монотонной увеличение сопротивления электрода через несколько последовательных шагов вперед пипетки (обычно 20% увеличение в сопротивлении пипетки через три 2 мкм стадий).
- Для формирования gigaseal контакт с целевой нейрона, применять создается отрицательное давление и гиперполяризацию пипетки.
- Применение краткий импульс большего отрицательного давления в камере, чтобы установить конфигурацию целой клетки. Уберите электрод на 2-3 мкм сохранить хорошее уплотнение.
- Запись спонтанной или вызванной активности в течение требуемого периода времени, вплоть до 20-40 мин.
- После записи, удалить пипеткой из мозга.
- Обновите корковой буфер или поместить каплю силиконового клея на черепной окна, а затем склеить круглый стеклянный покровное на вершине металлический держатель.
- Отпустите Анимдр. из головы фиксации рычага, ослабив винты. Вернуться животное в клетку, по крайней мере за один день до следующей записи.
- Анализ данных, например, с программным обеспечением FitMaster.
- Привыкание-dishabituation Обонятельная Тест в Awake мыши Перемещение мобильный Homecage
- Приложить чистой хлопчатобумажной часть (2 х 2 см) погружали в водопроводную воду на внутренней стороне стенки мобильной homecage помощью двусторонней ленты. Разделить мобильного homecage стену на четыре зоны, поместив цветовые метки на наружной стороне стены так, что кусок хлопка находится в середине "целевой зоны». Fix животное в головодержатель руку с видом на сегмент стены, противоположной той, «целевой» зоне и позволить ему адаптироваться к мобильной homecage в течение 30 мин.
- Возьмите еще один кусок чистой хлопчатобумажной и влажный это с несколькими каплями 1% экстракта ванили. Замените чистый хлопок на мобильном homecage стене с одной несущей Vanilла запах. Представьте запах в течение 5 мин. Отслеживать перемещения мобильного homecage в период запах презентации. Оцените уровень интереса к запаху, измеряя суммарное время, что животное тратит перед "целевой" зону по отношению к общему времени мобильного движения homecage.
- Повторите сеанса приложения 5-мин трижды с использованием запах ванили, с 5-минутного интервала межсессионный. Используйте свежий кусок "ванильным" хлопка в каждой сессии.
- Представить животное с социально значимой запаха во время последнего, пятой сессии. Смочите чистую кусок ваты с нескольких капель мочи (полученных в предыдущий день от животного противоположного пола) и поместить его в середине целевой зоны в течение 5 мин.
- Роман признание запах в бодрствующем мыши передвигаться мобильного homecage
- Разделить стену на четыре зоны, поместив цветовые метки на внешней стороне мобильного homecage стене. AttACH две чистые хлопковые штук (2 х 2 см) погружали в водопроводную воду на внутренней стороне стены в середине зон расположены друг напротив друга (обозначенного в качестве целевой зоны 1 и целевой зоны 2). Fix животное в головодержатель руку обращенной к сегмент стены снаружи из целевых зон, и дать ему возможность адаптироваться к мобильной homecage в течение 30 мин.
- Замените оба хлопка куски с свежими:. Место хлопок кусок влажной с 1% экстракта ванили целевой зоны 1 и еще один мокрый водопроводной водой до целевой зоны 2 Запишите видео мобильных движений homecage в течение 10 мин в течение запахом презентация сессия. Рассчитать запах лечащего как процент времени, что животное проводит перед целевую зону 1 относительная кумулятивная время, проведенное перед зон 1 и 2.
- После интервала 10 мин, поместите другую пару аппликаторов на homecage стене для последующего 10-минутного периода. Поместите "ванильный" хлопка в целевой зоне 1 и хлопчатобумажной аппликатора влажной 1% банановой еИзвлечь в целевой зоне 2. Сделать видеозапись мобильных движений homecage. Рассчитайте предпочтение новым запахом, как процент времени, что животное проводит перед сегмент стены с новым запахом (целевая зона 2) по отношению к совокупное время, обращенной зон 1 и 2.
Результаты
Метод, представленный здесь, предназначен для микроскопических изображений или электрофизиологических записей одноклеточных у бодрствующих, головной установлено, но имеются иным образом свободно движущихся и ведут себя мышей. Животное может двигаться в двух измерениях в реальном (в отличие от виртуального), материального и знакомой среде, в то время как череп того животного фиксируется твердо глава фиксации руки. Приучая мышей к воздушным поднял мобильного homecage состоит из 4-6 дней два раза в день заседаний 2-часовой подготовки (рис. 1). Подготовленные животные затем могут быть использованы в экспериментах немедленно. Типичный исследование включает в себя ряд сессий визуализации или записи сессий патч-зажим, которые отстоящими друг от друга, начиная от нескольких часов до нескольких дней или недель. Важно отметить, что оба оптических и электрофизиологические записи могут быть выполнены одновременно с когнитивными и поведенческими стимулами и показаний, в рамках одного эксперимента.
Для оценки механической стабильностиГлава фиксация мыши в мобильном homecage, изображение последовательности корковых сосудов, меченных флуоресцентной-сопряженных декстрана и корковых дендритов, выражающих YFP были собраны в то время как экспериментальные животные были навигации мобильного homecage (рис. 2). Максимальные перемещения мозга во время передвижения животного не правило, превышают 1-1,5 мкм. Эти перемещения произошли в горизонтальных направлениях и очень редко приводит к обнаружению сдвига плоскости изображения, что делает излишним коррекцию артефактов движения. Устойчивая фиксация головы в мобильном homecage позволяет количественно отдельных дендритных шипиков в бодрствующих животных с такой же надежностью, как под наркозом мышей. Дендритных плотность позвоночника, морфология и оборот может контролироваться в ходе длительных исследований с нескольких сеансов изображений, выполненных с интервалом от нескольких часов до нескольких дней или недель.
Удобство работы с мOBILE homecage для функционального оптических изображений был испытан в соматосенсорной коры активных мышей с использованием двух подходов: I) двухфотонного микроскопии на трансгенных мышах Thy1-GCaMP3 и II) внутренний изображений оптический сигнал у мышей дикого типа. Са 2 + томография была выполнена в слое 2/3, в котором содержится клеточных тел многих флюоресцентно меченых нейронов, а также их дендриты и аксоны (рис. 3). Сюжеты флуоресценции над времени из отдельных регионах, представляющих интерес (Rois) показаны на рисунке 3, демонстрируя спонтанную активность нейронов (измеряется как преходящее увеличение флуоресценции GCaMP3) во время активной навигации мыши в мобильном homecage. Оптический изображений на основе собственных сигналов позволяет отображение пространственного распределения функциональных областей. Рисунок 4 иллюстрирует волнообразные изменения уровня оксигенации крови (отражающие региональную нейронов активации), которые распространяются по соматосенсорной коре в ответ на Vibrissa стимуляция с частотой 0,05 Гц.
Для проверки возможности патч-зажим записи с мобильного homecage, мы использовали 2-3 месяца-старые мышей C57BL/6J. Layer 2/3 нейроны в соматосенсорной коре были записаны с в конфигурации цельных клеток с использованием текущего режима зажим. Записи патч-зажим в мозгу бодрствующего мышей голова фиксируется на мобильный homecage по сути похожа на ослепить патч-зажим в срезах мозга. Примерно 50% попыток привела успешного формирования gigaseal, из которых более 70% дали стабильную запись конфигурации цельноклеточная. Не наблюдалось события потери gigaseal контакт из-за механического перемещения клеток. Рисунок 5 иллюстрирует 60-секундный фрагмент репрезентативной 10 мин продолжительной записи ток-зажим коррелирует с эпизодами активного (бег) мыши и пассивных (в состоянии покоя) состояний.
Рисунок 1. Способ фиксации головы активный мышей в мобильном homecage. А) Обзор воздушным поднял мобильного дизайна homecage и иллюстраций общей концепции. Б) схема типичного экспериментального шкале. Исследование начинается с имплантации черепной окна за две недели до приучая мышь к внешнему воздействию и упаковка, за которой следует восьми два раза в день тренировок. Типичный исследование включает в себя ряд сессий визуализации или записи сессий патч зажим, которые отстоящими друг от друга, начиная от нескольких часов до нескольких дней или недель. Обе оптические и электрофизиологические измерения может быть сделано параллельно с когнитивных или поведенческих стимулов и показаний в рамках одного эксперимента. Пожалуйста, нажмите здесь, чтобы посмотреть увеличенную версию этой фигуры.
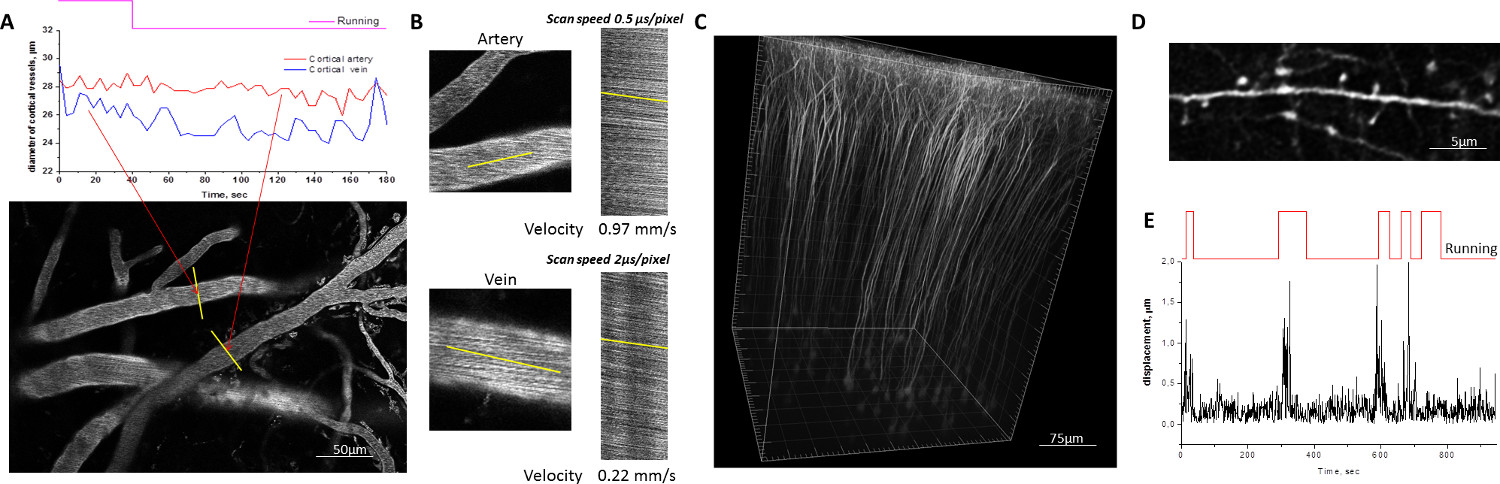
Рисунок 2. Пример двухфотонного микроскопических изображений на бодрствующих мышей движущихся вокруг мобильного homecage. А, В) Кортикальная сосудистую, помечены красных сопряженного декстрана 70 кДа Техас. Диаметр отдельных сегментов сосудов измеряется путем построения со временем профиля линий, проведенных через просвета сосуда в периоды отдыха и работы мыши (A). Скорость кровотока в артериях и венах измеряется линейного сканирования вдоль линий, нарисованных параллельно стенке сосуда (B). C, D) мелкие детали нейронов морфологии визуализируется в мозге трансгенных мышей, которые выражают YFP в субпопуляции нейроны под промоутер Thy1. Трехмерная реконструкция пирамидальных нейронов в мыши соматосенсорной коры (C). Образы дендритных бранчо приобрел в активном, ведет себя мыши достаточно стабильны для количественного определения индивидуального дендритных позвоночника морфологии (D). Е) Количественная оценка движения мозга, вызванного движениями мыши. Большие сдвиги амплитуды коррелируют с периодами работающем мыши. Пожалуйста, нажмите здесь, чтобы посмотреть увеличенную версию этой фигуры.
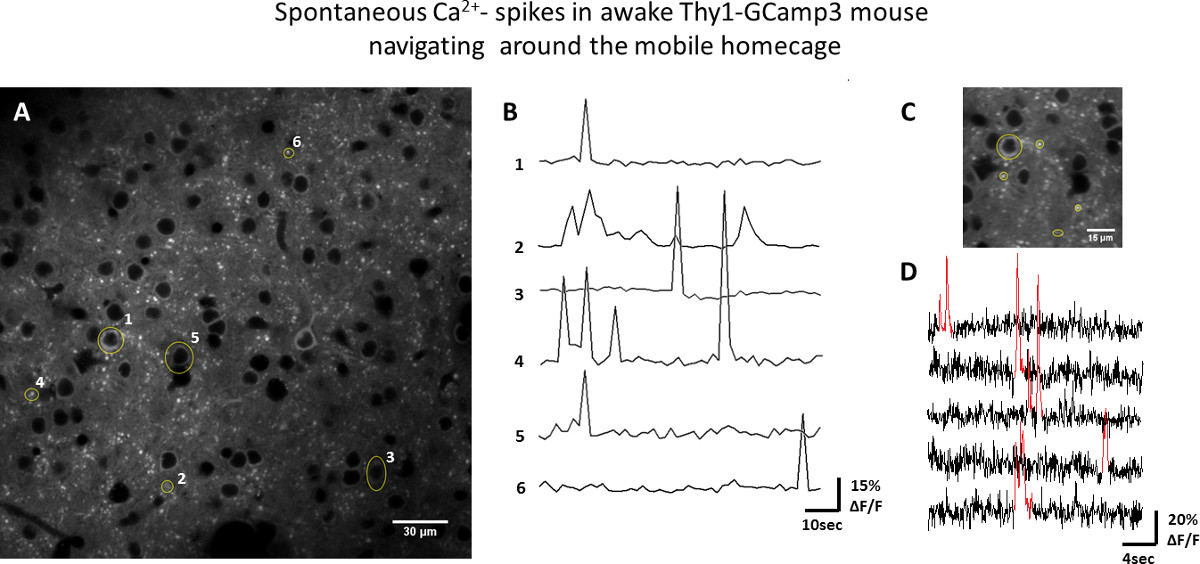
Рисунок 3. Пример нейронной активности населения в бодрствовать Thy1-GCaMP3 мыши передвигаться мобильного homecage. А) Двухфотонное образ коркового слоя нейронов II / III. Трансформирования, например нейронные клеточные органы, дендриты и аксоны показаны желтым цветом. B) f / F следы GCaMP3 флуоресценции от трансформирования показанных на А (пораEries записан в 1,5 сек / кадр). С) Увеличенный в области отображаемого на 65 мс / кадр. D) флуоресценции от желтого трансформирования из С нанесены с течением времени, показывает, что кратковременное повышение (красные) в флуоресценции GCaMP3, соответствующие действия потенциальные вызванной Ca 2 + эпизоды приток. Пожалуйста, нажмите здесь, чтобы посмотреть увеличенную версию этой фигуры.
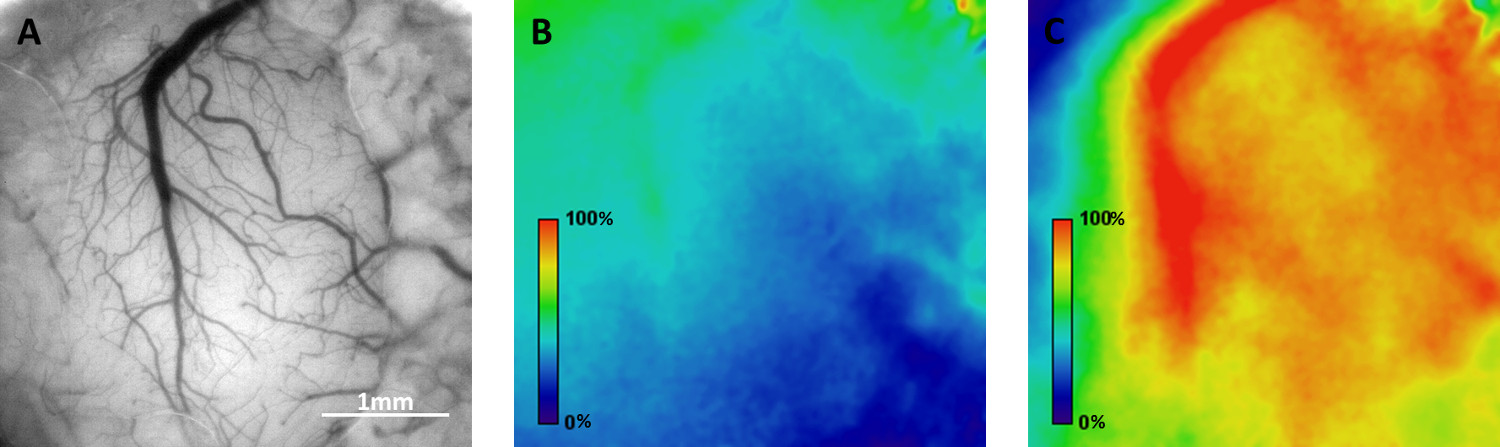
Рисунок 4. Пример отображения пространственное распределение функциональных реакций в коре активный мыши с помощью визуализации на внутренние оптические сигналы. А) вид Яркий-поле из поверхностных кровеносных сосудов через черепной окна. Б) Магнитуда карта базового деятельности в мобильный хоmecage во время 6-минутной эпизода. C) Магнитуда карте активности нейронов, распространяющегося вдоль соматосенсорной коре в ответ на вибрисс стимуляции на частоте 0,05 Гц. Пожалуйста, нажмите здесь, чтобы посмотреть увеличенную версию этой фигуры.
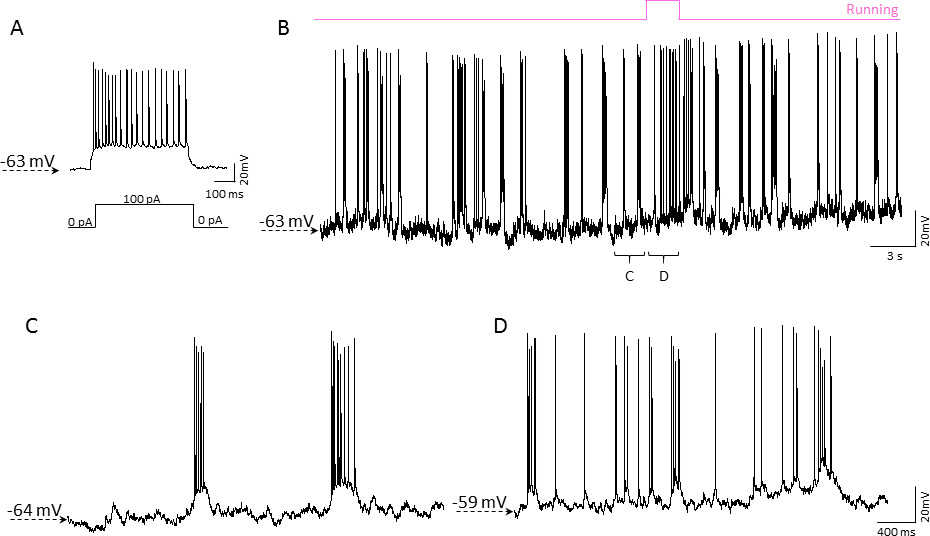
Рисунок 5. Пример цельноклеточной записи патч-зажим в коре активный перемещения мыши вокруг мобильного homecage. А) записи Текущий зажим от нейрона в мышь коркового слоя 2/3. 0,5 сек, 100-PA ток инжекции (указано ниже следа) приводит в порыве потенциалов действия. Ячейка показал адаптации характерная частота шип для пирамидальных нейронов. Б) Непрерывная запись ток-зажимиз того же нейрона коррелировала с мышь 'двигательной активности (показан в розовом выше следа). Представитель спонтанная активность слой 2/3 нейрона в периоды мышь отдыхает (C) и работает (D). Пожалуйста, нажмите здесь, чтобы посмотреть увеличенную версию этой фигуры.
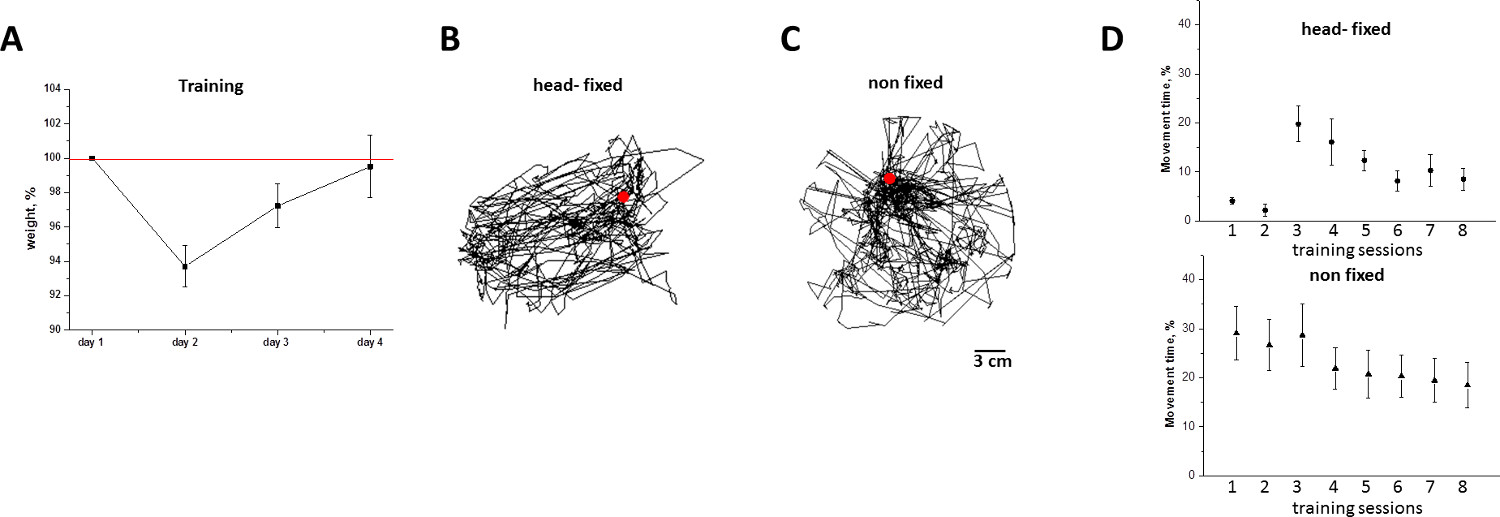
Рисунок 6. Потеря веса животных и двигательная активность head-fixed/non-fixed мышей во время учебных занятий в мобильном homecage. А) вес животных (средний + SD,%) до учебных занятий. Обратите внимание, что потеря веса полностью отменено 7-8 м тренировке. Б) траектории горизонтального двигательной относительно мыши на мобильный homecage,который был экстраполированы из гусеничного движения мобильного homecage во 8-й тренировке. C) Гусеничные перевозкой не-голова фиксированной мыши исследуя круглый клетку во время 8-й тренировке. D) продолжительность головной фиксированной (круга) и нефиксированное (треугольник) движение мыши во время 1-4 й день обучения (среднее + SD,%). Обратите внимание, что, на 4-й день, мыши голова-Исправлено отображение ни замораживание (как в 1 день), ни чрезмерного двигательную активность. Пожалуйста, нажмите здесь, чтобы посмотреть увеличенную версию этой фигуры.
Обсуждение
Чтобы лучше понять физиологию мозга и патологии, исследования должны быть выполнены на различных уровнях сложности подготовки, используя наиболее подходящие методы для каждого препарата. В настоящее время широкий спектр нейронауки методологий (от всего тела МРТ в суб-органелл STED микроскопии) легко применены к наркозом животных, в то время как эксперименты по бодрствующих и ведущих себя животных представляет собой значительный методологический вызов.
Здесь новый подход описан где лабораторным животным, несмотря на то, твердо голова фиксируется, может передвигаться воздушным поднял мобильного homecage и исследовать его материальное окружение под свободной от стрессов условиях. Глава фиксированной себя подготовка животных представлены здесь предоставляет ряд важнейших преимуществ. Во-первых, электрофизиологические или изображений данные, полученные с помощью этого метода являются бескомпромиссной ни анестезии, ни затрудненность стрессу. Позиционирование мыши в доме на колесахклетка быстро и не требует анестезии животного даже временно. Во-вторых, воздух-поднял homecage обеспечивает механическую стабильность, необходимую для количественной оценки изменений в тонкой нейронов морфологии и записать электрофизиологические активность одноклеточных у бодрствующих животных. Наконец, конструкция мобильного homecage является более компактным по сравнению с сферической беговой дорожке, таким образом позволяя позиционирования мобильной homecage под стандартной прямой микроскоп для двухфотонного визуализации или записи патч-зажим в головном мозге бодрствующих мыши.
Фирма фиксация головы в мобильном homecage требуется имплантация специально разработанной четырехдверный металлический держатель, с круглым отверстием в центре для оптического или электрического доступа к основной области мозга. Эти держатели металлические прикреплены к черепу с помощью комбинации клея, зубным цементом и небольшой болт ввинчивается в кости черепа. Эта хирургическая процедура была разработана на основе большого числа ранееопубликованные процедуры, и было обнаружено, приводит к стабильной и воспроизводимой черепной подготовки окна. В естественных условиях электрофизиологических экспериментов, в форме полумесяца окна 34, малый размер трепанации черепа (менее 0,5 мм) 32 и просверленные застекленном подготовки 35 были использованы. Здесь «перевернутой буквы" черепной окно имплантировали либо с большим диаметром (3,5 мм) или небольшой (диаметром менее 0,5 мм) краниотомии. Минимизация движение мозга имеет решающее значение для стабильных записей отдельных клеток, и именно поэтому он рекомендуется выполнить небольшие краниотомии размера для электрофизиологических экспериментов. По имплантации черепной окна для экспериментов оптических изображений, животные дают восстановиться, по крайней мере 2 или 3 недели, в течение которых окно сначала временно теряет прозрачность, а затем восстанавливает его (с выходом 50-70%, в зависимости от генетический фон штамма мыши). Прозрачность черепной окна и Stabilность зубного цемента «шапкой», прикрепленной к черепу можно проверить с помощью регулярной бинокулярный микроскоп и физического досмотра во время обращения с животными. В конце на 2-3 недельного периода восстановления, те животные, которые показывают каких-либо признаков остаточной послеоперационного воспаления или механических дефектов в зубной цемент, должны быть исключены из экспериментов и прекращается.
Оптимальный возраст для начала обучения мышей в 2-4 месяца (в соответствии с массой тела 20-40 г). У молодых животных, закрепление зубной цемент "шапкой" к черепу могут быть ненадежными, которые могут уменьшить свою устойчивость к механическим нагрузкам, что налагается передвижения головного фиксированной мыши в мобильном homecage. Хотя мужчины и женщины мышей кажутся одинаково готовы ориентироваться в мобильном homecage, существует тенденция для достижения лучшего процент черепных окон восстановления их прозрачности у самок мышей (данные не представлены). Таким образом, для того, то обеспечить сбалансированное сочетание полов в когорте животных выбранных для работы с изображениями, имплантации черепные окна примерно на 30% больше самцов мышей рекомендуется. Социальные взаимодействия, как известно, улучшить благосостояние животных и уменьшить стресс, поэтому желательно, чтобы помета работают и обучаются параллельно и держались вместе в группу жилищных клетках.
В отличие от опубликованных процедур для сферического подготовки беговой дорожки 13, метод с использованием мобильного homecage не требует анестезии мыши в момент головной фиксации. Это различие важно, потому что это позволяет исключить любые остаточные явления, что даже краткий и "свет" анестезия эпизод, вероятно, от физиологических измерений, полученных вскоре после этого. В самом деле, несмотря на то, в исследованиях, где глава фиксация было сделано под наркозом и фактические эксперименты были начаты после краткого периода ожидания 13, нельзяисключить возможные долгосрочные последствия краткого анестезии эпизоде на экспериментальных данных. Другие исследования опирались на лишение воды для систематического привыкания животных к возглавляют фиксацию и используется награду воды как средства мотивации животное остаются неподвижными 36. Однако метод голова фиксация награда основе ограничивает выбор применимых поведенческих тестов и, что немаловажно, занимает одно из устоявшихся стимул-вознаграждение ассоциаций. В противоположность этому, метод мыши привыкания к голове фиксацию в мобильном homecage не требует водной депривации и последующее вознаграждение.
Дополняя мобильный homecage с системой подачи воды рекомендуется для длительных экспериментов. Учебные животных сессии и эксперименты, представленные здесь, были сделаны в дневное время (с 8 утра до 6 вечера), что соответствует физиологически пассивного периода для тех мышей, которые хранятся в соответствии со стандартной 12-часовой световой графика (Lights на в 6 утра и выключается в 6 часов вечера). Поскольку потребление воды напрямую связано с деятельностью мыши, во время пассивных мышей период не требуют подачу воды, если продолжительность сеанса обучения / изображения / записи не превышает 2 часов. В дополнение к времени и продолжительности тренировок, нужно решить вопрос об оптимальном количестве проведенных сеансов, необходимых для приучая животных на мобильный homecage. С этой целью два критерия были использованы для оценки стресс, вызванный процедур головы фиксации: Я) потеря веса, и II) уровне двигательной активности. Как показано на рисунке 6, потеря веса достигает среднего уровня 6% по обучению день 2, и полностью отменено учебного дня 4 (рис. 6А). Последовательно с весом динамики, уровень двигательной активности головных фиксированной животных подавляется в первый день обучения, но стабилизирует по тренировочного дня 4 (рис. 6D). На основе этих измерений, предложет, что минимальная длительность периода обучения мыши на мобильный homecage 4 дня, как описано в протоколе настоящим.
Использование воздушного поднял, плоский полом мобильного homecage позволяет добавлять сложные задачи (сенсомоторных, перцептивных и когнитивных) в учебные парадигм мышей головы фиксированной. В настоящем исследовании два протокола из поведенческих тестов представлены. Оба протокола использовать запах сигналы и могут быть объединены с продольными изображения / записи в коре головного мозга мыши. Хотя мобильная homecage изготовлен из непоглощающих материалов, один все еще необходимо принимать во внимание возможные помехи между запахом устройства и тест запаха (ы). Другим фактором, который может влиять на визуальных / тактильных сигналов поведенческого эксперимента является узлом между стеной и вставки, которая не является цельной и может, таким образом, быть воспринято животным в качестве ориентира. Стоит отметить, что здесь, для того чтобы свести к минимуму стресс животного в течение такого интеrventions как размещение запах-представляющих хлопка на мобильный homecage стене, экспериментатор должен практиковать для выполнения таких вмешательств как можно быстрее и избегать длительного обработку углеродного каркаса. Альтернативные стратегии нового представления запах / объекта мыслимы, например, размещение гидрогеля решение на базе капель или предметы (например, чипсы) на небольших полках, прикрепленных к внутренней поверхности углеродного каркаса стены в высоте, соответствующей позиционирования головки животного.
Мобильная homecage позволяет головные фиксированной животные выполнять широкий спектр двумерных движений, включая горизонтальной передвижения, situp, холить, взбивая, облизывая, нос-тыкать, квалифицированных передние движений лап, и стены прикосновения с передних конечностей, как показано в настоящем исследовании . Использование мобильного homecage и протоколы, представленные здесь, исследователи могут изучать нейронов систему сенсомоторную с высоким уровнем контроля над как условии стимуляциис и поведенческие читать-аутов. Кроме того, исследования познавательных способностей в бодрствующих мышей могут быть выполнены во время выдержки, пространственной навигации и задач принятия решений.
Есть несколько практических ограничений этого метода. Во-первых, значительное количество сжатого воздуха необходим для достижения homecage-подъемную силу и выполнять длительные эксперименты. Во-вторых, мобильный homecage в ее настоящем осуществлении всего 18 см в диаметре, и, следовательно, обеспечивает относительно небольшое пространство и простой по сравнению с виртуальной реальности, где сложный экспериментальный среда может быть выполнен без каких-либо пространственных ограничений. В-третьих, во время усов стимуляции и экспериментов вознаграждения на основе представленных здесь, устройство было использовано, что ограничивает возможность настенного-контакт для мыши. Добавление внешнего визуального или сенсорной стимуляции канала (например, глазной-направленный луч проектора) потребует разработки более эргономичным и компактное устройство по сравнению сМножественные экраном или купольного проекционные решения, которые были использованы в сферических экспериментов беговой дорожке.
Таким образом, использование головных фиксированной мышей, движущихся в воздушно-поднял мобильного homecage значительно облегчает исследования, которые сочетают клеточные, молекулярные и поведенческие уровни наблюдения и манипуляции в одном эксперименте. Специфические области применения, показанные здесь, включают двухфотонного микроскопических изображений, внутреннюю изображений оптического сигнала и патч-зажим записи в не-наркозом ведет себя мышей. Ожидается, что такой подход откроет новые горизонты в экспериментах на активный, ведет себя мыши и служить в качестве полезного инструмента для обоих разработки лекарств и фундаментальных исследований функции мозга.
Раскрытие информации
Авторы не имеют ничего раскрывать.
Благодарности
Авторы выражают благодарность профессору Ээро Кастреном за ценные замечания по рукописи. Работа выполнена при поддержке грантов от Академии Финляндии, Центр международной мобильности Финляндии, и финской Высшей школы неврологии (Brain и разум докторской программы).
Материалы
| Name | Company | Catalog Number | Comments |
| Tweezers, Stainless Steel, 115 mm | XYtronic | XY-2A-SA | |
| Animal trimmer, shaving machine | Aesculap | Isis GT420 | |
| Binocular Microscope | Zeiss | Stemi 2000 | |
| Biological Temperature Controller with stainless steel heating pad | Supertech | TMP-5b | |
| Blunt microsurgical blade | BD | REF 374769 | |
| Borosilicate tube with filament | Sutter Instruments | BF120-69-10 | For patch pipette production |
| Camera | Foscam | FI8903W | Night visibility |
| Carprofen | Pfizer | Rimadyl vet | |
| Dental cement | DrguDent, Dentsply | REF 640 200 271 | |
| Dexamethasone | FaunaPharma | Rapidexon vet | |
| Disposable drills | Meisinger | HP 310104001001008 | |
| Dulbeco’s PBS 10x | Sigma | D1408 | |
| Dumont #5 forceps, 110 mm | FST | 91150-20 | |
| Eyes-lubricant | Novartis | Viscotears | For eyes protection during operation and as viscose solution for immersion |
| Foredom drill control | Foredom | FM3545 | |
| Foredom micro motor handpiece | Foredom | MH-145 | |
| Four-winged metal holder | Neurotar | ||
| Head Holder for Mice | Narishige | SG-4N | Assembled on stereotaxic instrument |
| Hemostasis Collagen Sponge | Avitene, Ultrafoam BARD | Ref 1050050 | |
| Imaris | Bitplane | ||
| Ketamine | Intervet | Ketaminol vet | |
| Kwik-Sil | WPI | ||
| Mai Tai DeepSee laser | Spectra-Physics | ||
| Micro dressing forceps, 105 mm | Aesculap | BD302R | |
| Microelectrode puller | Narishige | PC-10H | Vertical puller for glass pipette production |
| Micromanipulator | Sensapex | ||
| Mini bolt | Centrostyle | Ref. 00343 s/steel M1.0x4.5 | |
| Mobile Homecage | Neurotar | ||
| Multiphoton Laser Scanning Microscope | Olympus | FV1000MPE | |
| Nonwoven swabs, 5 x 5 | Molnlycke Health Care | Mesoft | Surgical tampons |
| Polyacrylic glue | Henkel | Loctite 401 | |
| Round glass coverslip | Electron Microscopy Sciences | 1.5 thickness | |
| Small animal stereotaxic instrument | David Kopf Instruments | 900 | |
| Student iris scissors, straight 11.5 cm | FST | 91460-11 | |
| Xylazine | Bayer Health Care | Rompun vet |
Ссылки
- Li, N., et al. mTOR-dependent synapse formation underlies the rapid antidepressant effects of NMDA antagonists. Science. 329, 959-964 (2010).
- Sitdikova, G., et al. Isoflurane suppresses early cortical activity. Annals of Clinical and Translational Neurology. 1 (1), 15-26 (2013).
- Helmchen, F., Fee, M. S., Tank, D. W., Denk, W. A miniature head-mounted two-photon microscope. high-resolution brain imaging in freely moving animals. Neuron. 31, 903-912 (2001).
- Piyawattanametha, W., et al. In vivo brain imaging using a portable 2.9 g two-photon microscope based on a microelectromechanical systems scanning mirror. Optics letters. 34, 2309-2311 (2009).
- Sawinski, J., Wallace, D. J., Greenberg, D. S., Grossmann, S., Denk, W., Kerr, J. N. D. Visually evoked activity in cortical cells imaged in freely moving animals. Proceedings of the National Academy of Sciences of the United States of America. 106, 19557-19562 (2009).
- Fee, M. S. Active stabilization of electrodes for intracellular recording in awake behaving animals. Neuron. 27, 461-468 (2000).
- Greenberg, D., Houweling, A., Kerr, J. Population imaging of ongoing neuronal activity in the visual cortex of awake rats. Nat Neurosci. 11 (7), 749-751 (2008).
- Fujiwara-Tsukamoto, Y., et al. Reinforcing operandum: rapid and reliable learning of skilled forelimb movements by head-fixed rodents. Journal of Neurophysiology. 108, 1781-1792 (2012).
- Scott, B. B., Brody, C. D., Tank, D. W. Cellular Resolution Functional Imaging in Behaving Rats Using Voluntary Head Restraint. Neuron. 80, 371-384 (2013).
- Dombeck, D. A., Harvey, C. D., Tian, L., Looger, L. L., Tank, D. W. Functional imaging of hippocampal place cells at cellular resolution during virtual navigation. Nat Neurosci. 13, 1433-1440 (2010).
- Parry, T. J., McElligott, J. G. A method for restraining awake rats using head immobilization. Physiolog & behavior. 53 (5), 1011-1015 (1993).
- Brecht, M., Schneider, M., Sakmann, B., Margrie, T. W. Whisker movements evoked by stimulation of single pyramidal cells in rat motor cortex. Nature. 427 (6976), 704-710 (2004).
- Van Looij, M. A. J., Liem, S. -. S., van der Burg, H., van der Wees, J., De Zeeuw, C. I., van Zanten, B. G. A. Impact of conventional anesthesia on auditory brainstem responses in mice. Hearing research. 193, 75-82 (2004).
- Hentschke, H., Schwarz, C., Antkowiak, B. Neocortex is the major target of sedative concentrations of volatile anaesthetics: strong depression of firing rates and increase of GABAA receptor-mediated inhibition. The European journal of neuroscience. 21, 93-102 (2005).
- Margrie, T. W., Brecht, M., Sakmann, B. In vivo, low-resistance, whole-cell recordings from neurons in the anaesthetized and awake mammalian brain. Pflugers Archiv: European journal of physiology. 444, 491-498 (2002).
- Crochet, S., Petersen, C. C. H. Correlating whisker behavior with membrane potential in barrel cortex of awake mice. Nat Neurosci. 9, 608-610 (2006).
- Houweling, A. R., Brecht, M. Behavioural report of single neuron stimulation in somatosensory cortex. Nature. 451, 65-68 (2008).
- Poulet, J. F. A., Petersen, C. C. H. Internal brain state regulates membrane potential synchrony in barrel cortex of behaving mice. Nature. 454, 881-885 (2008).
- Bryant, J. L., Roy, S., Heck, D. H. A technique for stereotaxic recordings of neuronal activity in awake, head-restrained mice. Journal of neuroscience methods. 178, 75-79 (2009).
- De Kock, C. P. J., Sakmann, B. Spiking in primary somatosensory cortex during natural whisking in awake head-restrained rats is cell-type specific. Proceedings of the National Academy of Sciences of the United States of America. 106, 16446-16450 (2009).
- Dombeck, D. A., Khabbaz, A. N., Collman, F., Adelman, T. L., Tank, D. W. Imaging large-scale neural activity with cellular resolution in awake, mobile mice. Neuron. 56, 43-57 (2007).
- Hentschke, H., Haiss, F., Schwarz, C. Central signals rapidly switch tactile processing in rat barrel cortex during whisker movements. Cerebral cortex. 16, 1142-1156 (2006).
- Stüttgen, M. C., Rüter, J., Schwarz, C. Two psychophysical channels of whisker deflection in rats align with two neuronal classes of primary afferents. J. neuroscience. 26, 7933-7941 (2006).
- Connor, D. H., Peron, S. P., Huber, D., Svoboda, K. Neural activity in barrel cortex underlying vibrissa-based object localization in mice. Neuron. 67, 1048-1061 (2010).
- Drew, P. J., Shih, A. Y., Kleinfeld, D. Fluctuating and sensory-induced vasodynamics in rodent cortex extend arteriole capacity. Proceedings of the National Academy of Sciences of the United States of America. 108 (20), 8473-8478 (2011).
- Harvey, C. D., Collman, F., Dombeck, D. A., Tank, D. W. Intracellular dynamics of hippocampal place cells during virtual navigation. Nature. 461, 941-946 (2009).
- Chen, G., King, J. A., Burgess, N., O’Keefe, J. How vision and movement combine in the hippocampal place code. Proceedings of the National Academy of Sciences of the United States of America. 110 (1), 378-383 (2013).
- Harvey, C. D., Coen, P., Tank, D. W. Choice-specific sequences in parietal cortex during a virtual-navigation decision task. Nature. 484 (7392), 62-68 (2012).
- Holtmaat, A., et al. Long-term , high-resolution imaging in the mouse neocortex through a chronic cranial window. Nat Protoc. 4 (8), 19-22 (2009).
- Mostany, R., Portera-Cailliau, C. A craniotomy surgery procedure for chronic brain imaging. J. Vis. Exp. (12), (2008).
- Portera-Cailliau, C., Trachtenberg, J. T., de Paola, V., Svoboda, K., Wilbrecht, L., Holtmaat, A. Imaging Neocortical Neurons through a Chronic Cranial Window. Cold Spring Harbor Protocols. 2012, (2012).
- Garaschuk, O., Milos, R. -. I., Konnerth, A. Targeted bulk-loading of fluorescent indicators for two-photon brain imaging in vivo. Nat Protoc. 1 (1), 380-386 (2006).
- Barry, P. H. JPCalc, a software package for calculating liquid junction potential corrections in patch-clamp, intracellular, epithelial and bilayer measurements and for correcting junction potential measurements. Journal of neuroscience methods. 51 (1), 107-116 (1994).
- Golshani, P., Gonçalves, J. T., Khoshkhoo, S., Mostany, R., Smirnakis, S., Portera-Cailliau, C. Internally mediated developmental desynchronization of neocortical network activity. The Journal of neuroscience. 29 (35), 10890-10899 (2009).
- Polack, P. -. O., Friedman, J., Golshani, P. Cellular mechanisms of brain state-dependent gain modulation in visual cortex. Nat Neurosci. 16 (9), 1331-1339 (2013).
- Schwarz, C., et al. The head-fixed behaving rat--procedures and pitfalls. Somatosensor., & motor research. 27, 131-148 (2010).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены