Method Article
Workflow для высокого содержания, отдельная клетка количественной флуоресцентных маркеров из Всеобщей микроскоп данных, поддерживаемые ПО с открытым кодом
В этой статье
Резюме
Представлен гибкий информатика рабочий позволяя мультиплексированных на основе образа анализ флуоресцентно меченых клеток. Рабочий процесс количественно ядерных и цитоплазматических маркеров и вычисляет маркер перемещение между этими отсеками. Процедуры предназначены для возмущения клеток с использованием миРНК и надежную методику для обнаружения маркера путем непрямой иммунофлуоресценции в форматах 96-а.
Аннотация
Достижения в понимании механизмов контроля, регулирующих поведение клеток в прикрепленных млекопитающих моделей культуры ткани становятся более зависимыми от режимов анализа одноклеточного. Методы, которые поставляют композитных данные, отражающие средние значения биомаркеров из клеточных популяций рискуем потерять динамику подгрупп населения, которые отражают неоднородность исследуемой биологической системе. В соответствии с этим, традиционные подходы заменяются или поддерживается, более совершенных форм клеточном анализе разработанных с целью оценки High-контент микроскопии. Эти анализы потенциально генерировать большое количество изображений флуоресцентных биомаркеров, которые позволили сопровождая собственные программные пакеты, позволяет многопараметрических измерений в клетке. Тем не менее, относительно высокие капитальные затраты и сверхспециализации многих из этих устройств не позволили их доступность многих исследователей.
Описанный здесьуниверсально применимой рабочий процесс для количественного определения нескольких люминесцентных интенсивности маркеров из определенных субклеточных регионах отдельных клеток, пригодных для использования с изображениями от большинства люминесцентных микроскопов. Ключом к этому рабочего процесса реализация в свободном доступе сотовый Профили программного обеспечения 1 различить отдельные клетки в этих изображениях сегмент их в определенные внутриклеточные регионов и доставить интенсивность флуоресценции маркера конкретные значения этих регионах. Добыча отдельных значений интенсивности клеточного из данных об изображении главная цель этого процесса и будет показано при анализе данных управления от экрана миРНК для G1 регуляторов контрольно-пропускном пункте в прикрепленных клетках человека. Тем не менее, представленные здесь технологический процесс может быть применен к анализу данных, полученных другими способами клеток возмущения (например, соединение экраны) и другие формы флуоресценции на основе клеточных маркеров и, таким образом, должны быть полезны для широкого круга лабораторий.
Введение
Работа, представленная здесь описывается использование свободно доступного программного обеспечения Cell Profiler для выполнения алгоритма наведения разбивку флуоресцентной микроскопии изображений прикрепленных клеток для идентификации отдельных клеток и определенные субклеточные регионы. Этот подход, называемый сегментации изображения, позволяет последующее мульти-параметрический анализ отображаемого клеток путем количественной флуоресцентно меченых маркеров, локализованных в каждую ячейку или субклеточном области (именуемого сегментированных объектов). Этот рабочий процесс, является основанием для включения высоким содержанием анализ и предназначен для использования в качестве инструмента, который может быть дополнительно разработана и изменение в соответствии с многопараметрического, отдельная клетка анализов в лабораториях, не имеющих доступа к специализированным высоких содержанием документов или проприетарное программное обеспечение. Файлы, поставляемые с этой рукописи включают в себя тестового набора соответствующих данных изображений в формате RAW, параметры алгоритма и поддерживающих скрипты для создания анализа, описанного. При условии, настройки алгоритма Fили сотовый Profiler оптимизированы для примера набора данных и детали Обсуждение раздела, что может быть необходимо корректировки, чтобы разрешить использование данных изображений из других исследований.
После того, как количественные данные были извлечены с помощью мобильного Profiler, различные лаборатории могут иметь разные требования для того, как использовать информацию, представленную отдельных значений ячеек в исходных данных; показанный здесь, один подход, с помощью которого ворота применяются к необработанным данным для каждого анализа. Использование этих воротах, данные преобразуются в двоичные точки зрения ответ, что позволяет визуализировать тенденций, связывающих различные процедуры с субпопуляций клеток, подвергающихся ответ, определяемый ворот. Ворота устанавливаются на основе наблюдений за распределениям данных, полученных для соответствующих положительных и отрицательных контролей для каждого соответствующего измерения. Использование ворот является лишь одним примером того, как управлять сырье, измерения на основе клеток. Кроме того, показано здесь является использование интенсивности ядерной ДНК меняasurements в сыром виде в виде непрерывного диапазона значений в сочетании с закрытых данных. Другие подходы к управлению данными анализа изображений следует учитывать, в зависимости от характера исследования; статистические альтернативы использованию ворота для назначения клетки к субпопуляции были зарегистрированы 2 и систематические сравнения стратегий для обобщения данных высокого контента в большое количество параметров были зарегистрированы 3.
High-контент анализ данных изображения нашли применение в сотовых исследований лекарственной ответ обратной генетики и экологический стресс сигнализации 4 - 6. Заслуга высокопроизводительного анализа содержания связано с тем, что алгоритмическая анализ флуоресцентной микроскопии данных позволяет количественные и пространственные параметры должны быть рассмотрены одновременно на отдельных клеток 7. Таким образом, сотовые результаты многочисленных анализов могут быть перекрестные ссылки, дифференциальное поведение анализа-Defined субпопуляции клеток могут быть отслежены в экспериментальных условиях и анализы могут включать в себя рассмотрение морфологических переменных. Стратегии и анализ документооборота обсуждается здесь, как и для других подходов высокого содержания, способных доставлять мультиплексированных данных, которые имеют перекрестные ссылки на отдельные клетки. High-контент методы костюм исследования, которые генерируют флуоресцентного микроскопа изображений и применимы к анализу данных, начиная от нескольких десятков изображений, полученных в условиях низкой пропускной обычной флуоресценции на основе микроскопии до тысячи изображений, полученных с использованием автоматизированных высокие содержанием платформы скрининга.
Рабочий процесс иллюстрируется здесь с примерами данных, из которых отдельные анализы измеряется в единицах либо ядерных люминесцентных интенсивности маркера или ядерной / цитоплазматической транслокации флуоресцентного репортерного белка, соответственно. Рабочий процесс является гибким в том, что эти анализы можно рассматривать отдельно или в комбинации в зависимости от ВАСч данного исследования вопрос разными исследователями. Примерные данные получены в рамках РНК-интерференция (RNAi) эксперимента (рис 1). Малых интерферирующих РНК олигонуклеотиды (миРНК) используются в нокдаун специфических белков в НСТ116 человек колоректального клеток карциномы, которые приводят к изменениям в течение двух люминесцентных журналистами киназы (CDK) деятельности циклинзависимой. CDK6-зависимого фосфорилирования белок ретинобластомы ядерного на серин 780 (P-S780 RB1) оценивается с помощью окрашивания антител. В тех же клеток, зеленый флуоресцентный белок меченного корреспондент CDK2 деятельности (GFP-CDK2 Reporter) оценивается ее ядерный цитоплазматической отношение, где в отсутствие CDK2 деятельности репортер проживает в ядре и при активации CDK2 челноков в цитоплазму 8. Кроме того, ядерной ДНК каждой клетки окрашивали с использованием ДНК-интеркалирующего красителя, Bisbenzimide, который служит в качестве средства для идентификации клеток и определить границы ядер в изображениях, аSA показатель плотности ДНК, содержащий информацию о положении клеточного цикла клетки (рис 2).
Активность CDK6 и CDK2 могут быть обнаружены в клетках транзита из G1 в S-фазе клеточного цикла 5 и сменяют друг друга 9,10 и, таким образом, близко согласование между двумя репортерами в отдельных клетках, как ожидается. Демонстрация набора данных используется здесь анализ в качестве примера эффект киРНК нацелена CDK6, белка ретинобластомы (RB1) и ненацеливании отрицательный контроль (таблица 1). Нокдаун CDK6 должны вызывать как уменьшение в RB1 эпитопом Р-S780 и накопление клеток в G1 фазе клеточного цикла. RB1 нокдаун служит контролем реагентов для специфичности антитела фосфо-S780. Флуоресцентного микроскопа изображения с формалином фиксированных 11, флуоресцентно окрашенные НСТ116 тканевых культур клетки используются для алгоритмической анализа изображений. Полученный числовые данные затем используется дляперекрестных ссылок, что журналисты и оценить влияние различных бросовым государств.
Потенциальный размер данных, полученных такого анализа могут представлять угрозу для нормальных инструментов анализа. Например, данные, индивидуальные клеточные может быть больше, чем некоторые таблицы программное обеспечение размещения. Включены Perl скрипты, которые выполняют простую, высоко повторяющуюся, руководил обработки данных, чтобы помочь анализа больших наборов данных. Сценарии Perl написаны специально для выходных файлов, произведенных сотовым Profiler, при обработке графических файлов с определенным присвоения имен файлов (рис 3), а также позволяют переменным числом полей в скважине, которые будут использоваться в анализе. Это часто важно, чтобы данные затвора отдельная клетка анализа для отслеживания тенденций в клеточных субпопуляций 5 и показано здесь является использование сценария Perl с флагом каждая ячейка на основе заданного заранее определенного ворот для каждого типа анализа. Кроме того, включены дополнительные скрипты Perlв которых суммированы результаты данных для отдельных скважин (или условий), обеспечивая: процент клеток в пределах установленного ворот и средних значений исходных показателей анализа. Последний, более однородной способ просмотра данных, действительна, где ответы влияют на все или большинство клеток в хорошо. Как обсуждалось выше, такая оценка является менее полезным, чем той, которая обеспечивается индивидуальной стробирования данных клеток, где реакция ограничена до подмножества клеток в популяции.
Полезность описанного процесса не ограничивается возмущением по миРНК или маркерных анализов, описанных. Исследования использовали этот подход для анализа ответов в Культура ткани эксперименты с использованием комбинации миРНК, химические ингибиторы и лучевой терапии, а также для оценки других, чем CDK6 маркеров и CDK2 деятельности 5.
Концептуально, экспериментальная стратегия позволяет множество биологически полезных субклеточных регионах, которые будут автоматически зарегистрированыВ отдельных клеток, присутствующих в флуоресцентного микроскопа изображений. Таким образом, этот подход может дать количественные, мультиплексированных данных, раскрывая биологическую информацию, которая может быть пропущенный через методы, которые сосредотачиваются на популяции, а не отдельных клеток. С незначительными изменениями, рабочий процесс подход и анализ описаны может дать количественные, индивидуальные данные клетки для каких-либо флуоресценции основе анализа результатов и клеточных биологических реакций, где количественная оценка содержания ДНК, количественное ядерной или цитоплазматической флуоресценции или челночный маркеров между этими два отсека по отдельности или в режиме мультиплексирования представляет интерес. Как Требования издательства более склонны к представлению в открытом доступе исходных данных, доступа к ним и знакомство с бесплатными инструментами для анализа микроскопических изображений, такие как те, что описаны здесь также будет представлять непосредственный интерес в лаборатории, глядя на повторный анализ опубликованных данных.
протокол
1. Экспериментальная возмущений и мечения клеток для ответа маркеров (Обратный Трансфекцию миРНК экран)
- В стерильных капот культуры ткани пипеткой 70 мкл 200 нМ миРНК в 1х буфере миРНК в лунки стерильного, простой 96-луночного планшета. Развести трансфекции липидов в 40 объемах бессывороточной DMEM информации и выдачи 105 мкл в каждую лунку, содержащую миРНК.
Примечание: Разбавление 262,5 мкл липида в 10,5 мл бессывороточной DMEM дает основной смеси для целой 96-луночного планшета миРНК, обеспечивая 2,6 мкл на лунку липидов. Использование 200 нМ миРНК исходной концентрации на этом этапе будет доставлять рабочую концентрацию 20 нМ на этапе 1,3, но процедуры будет работать для работы до концентрации 5 нМ, с исходной концентрации скорректированной соответствующим образом (т.е. 50 нм). Нижняя рабочая концентрация может снизить мимо цели ложные положительные результаты, хотя они могут уменьшить величину на-мишени ответ, что приводит к увеличению на-щитомт ложные отрицательные темпы. - Смешайте пластину, осторожно вибрации в течение десяти минут при комнатной температуре. Подразделить полученные 175 мкл на три 50 мкл дубликатов на цели на непрозрачном, культуре ткани, обработанной, 96-луночный планшет с прозрачным основанием.
- Обратный трансфекции путем выдачи 8000 клеток на лунку в 150 мкл DMEM, содержащей 10% сыворотки непосредственно на 50 мкл липидных комплексов-миРНК. Использование НСТ116 ободочной клетки человека стабильно выражения GFP с метками маркер отчетности CdK2 деятельность 5,8. Никаких дополнительных смешение не требуется. Уплотнение пластины с стерильной адгезивной дышащей мембраны контролировать влажность и предотвратить 'Edge-эффект "пластины и поместите пластину в увлажненном инкубаторе при температуре 37 ° С, 5% СО 2 в течение 48 ч.
- Аспирации среды, такие, что небольшое остаточное количество средств массовой информации остается в лунках. Fix клетки, добавляя 100 мкл 4% буферном растворе формальдегида в каждую лунку и инкубировать в вытяжном шкафу в течение 10 мин при комнатной темпера тура.
- Удалить фиксирующий раствор путем аспирации пластину. В этот момент либо прекратить эксперимент путем промывки пластины три раза 100 мкл забуференным фосфатом физиологическим раствором (PBS), а затем сохранить герметизируют под 100 мкл PBS в темноте при 4 ° С в течение вплоть до недели или продолжить пермеабилизации клеток.
ПРИМЕЧАНИЕ: Мы рекомендуем обработки пластин как можно скорее после фиксации, и как правило, предпочитают хранить полностью обработанных пластин. Биоцидных консерванты, такие как тимеросал, азид натрия или коммерческих альтернатив могут быть добавлены, чтобы предотвратить рост micoroganismal. Добавление ингибиторов фосфатазы помогает сохранить фосфо-эпитопы, и другие средства для сохранения состояния модификации белка может быть полезным в соответствующих контекстах анализа - Удалить PBS из пластины и клетки проницаемыми путем добавления 100 мкл раствора пермеабилизации. Инкубировать в течение 10 мин при комнатной температуре без встряхивания. Аспирируйте пермеабилизирующего решения с использованием MultichAnnel пипетки. Повторите этот шаг три раза.
- Блок клетки путем добавления 100 мкл блок-раствора на лунку в течение 30 мин при комнатной температуре. Удалить блок раствор путем аспирации пластину, то зонд 50 мкл анти-Р S780 RB1 антитело, разведенное в 500 раз в блоке раствора в течение 2 ч в темноте при комнатной температуре.
- Промыть пластины в три раза с 100 мкл раствора для стирки пластины, в результате чего раствор на пластине в течение 5 мин каждый раз. Зонд пластину в течение ночи в темноте при 4 ° С с 50 мкл флуоресцентно-меченого вторичного антитела, разбавленного в 1000 раз раствором в блоке с добавлением 2 мкМ хроматина специфических красителей ДНК Bisbenzimide. Промыть пластины в три раза, как до, так и магазин с уплотнениями, под 100 мкл PBS в темноте при 4 ° С. Изображение пластины в течение двух недель.
2. Работа с изображениями и изображения Сегментация
- Используйте конфокальной или прядильно-диск флуоресцентного микроскопа с целью 20X принять отдельный 16-битовая, оттенки серого изображения в формате TIFF в трех каналов, соответствующих красителя ДНК, GFP и иммуно-окрашивания флуорофорами. Захват многие непересекающиеся множества изображений, называемый здесь как кадры, к изображению примерно 1000-2000 клеток на лунку.
- Назовите файлы изображений систематически, так что каждое имя файла уникальное сочетание "имя эксперимента", "адрес также ',' номер кадра" и "идентификатора канала", в этом порядке (рисунок 3). Данный пример данных использует "Blue" (хроматина окрашивания ДНК) или "Зеленый" (GFP) или "Red" (иммуно-окрашенных флюорофор) в качестве идентификаторов каналов. Адрес также, номер кадра и канала идентификатор далее на упоминается как метаданные изображения. Используйте символ подчеркивания, чтобы избежать запутанной метаданные также и частоту кадров.
- Назовите файлы с этими элементами метаданных в указанном порядке. Это необходимо для того, чтобы последующие шаги программное обеспечение Correctly наборы группы изображений для анализа.
- Скачать и установить бесплатную Cell Profiler, Active Perl Community Edition, R статистическая среда программирования и RStudio. Примите все параметры по умолчанию во время установки; Пользователи ПК Установка Active Perl должен включить все опции, относящиеся к PATH, расширение файла ассоциаций и отображения скрипта, в котором будет предложено. Активный Perl является обязательным для пользователей Mac, но они в противном случае необходимо запустить скрипт Perl в шаге 3.2 из терминала командной строки, а не с помощью значка нажатие.
- Откройте программное обеспечение сотовый Profiler, нажмите кнопку "Файл", "Импорт трубопроводов ', затем' из файла 'и выберите файл 3_channels_pipeline.cppipe (рис S1a и S1B). Файл содержит инструкции, необходимые для программного обеспечения для интерпретации метаданных файла образа из имени файла Конвенции, которая характеризуется. Сотовый Profiler теперь связывает изображения, извлекает ядерной ДНК и антител интенсивности от гоESE и использует GFP канал рассчитать соотношение ядерной против интенсивности цитоплазмы для каждой ячейки определяется (рисунки 4 и 5).
- Нажмите кнопку "Просмотреть настройки вывода» в левом нижнем углу окна Cell Profiler. В верхней части нового экрана находятся текстовые поля, помеченные как "ввода по умолчанию Папка 'и' По умолчанию Output Folder". По одному, нажмите на папку-иконки справа от этих ящиков и выберите местоположение файлов изображений для анализа и назначение для извлеченных данных, соответственно (рис S1c).
- Начните анализа изображения, нажав на кнопку "Анализ образов» в левом нижнем углу клетки Profiler. В нижней части экрана наблюдать оставшееся время для извлечения данных, «Остановим анализа» и кнопок «Пауза». При необходимости приостановить анализ, нажав кнопку "Пауза" в любое время, что полезнопри просмотре изображения анализируются (описано в шаге 2,8).
- Дополнительно, откройте окна для любой из стадий анализа изображений, нажав Eye-иконки в панели на крайней левой части окна программы (рис S1D). Обратите внимание на окно "IdentifyPrimaryObjects" и тех, кто за "вторичных" и "третичных объектов", чтобы проверить, что текущие параметры в ячейке Profiler для выполнения сегментации изображения подходят (рис 1 и обсуждение за консультацией по изменению этих настроек).
- Нажмите "Ok" в окне сообщения, которое появляется при завершения анализа. Перейдите в папку 'По умолчанию Output Folder ", где все файлы данных с результатами они сохраняются в виде разделенных запятыми стоимости (.csv) (рис s2a).
3. Извлечение данных
- Найти новый файл "Nuclei.csv", который включен в числоВыход из сотового Profiler. Этот файл содержит индивидуальные данные ячейки для интенсивности флуоресценции ядерной антител, интенсивность ядерной ДНК и GFP-CDK2 значениями отношения репортер (6А и s2a).
ПРИМЕЧАНИЕ: Различные лаборатории будут хотите обработать этот тип данных в соответствии с природой собственных анализов. Рекомендуется для текущих данных стробирование клеток из каждого состояния лечение в соответствии с данным антителом и GFP-CDK2 репортер значений с помощью прилагаемого Perl скрипт '2_gate_classifier.pl. - Скопируйте предоставленный Perl скрипт файл '2_gate_classifier.pl' в той же папке, файл данных 'Nuclei.csv' (рис s2a). Дважды щелкните значок для сценария Perl, а когда потребуется, введите полное имя файла данных, за которым следует ".csv" имя файла для файла, в котором клетки должны быть закрытого типа, и, наконец, значения Ворота для антителафлуоресценции и репортер данные GFP-CDK2.
ПРИМЕЧАНИЕ: Как в основном определяют параметры ворота и применять их для анализа данных будут рассмотрены ниже в разделе и на рисунке 6 репрезентативных данных (для анализа данных, предоставленных использование »0,004» и «1,5», соответственно). Пользователи Mac должны запустить скрипт Perl от терминала командной строки, набрав: "Perl 2_gate_classifier.pl. - Обратите внимание на вновь созданный файл, который сочетает в себе необработанные значения отдельных анализе клеток из исходных данных Cell Profiler с этикетками по отдельным категориям населения, которые показывают, как каждая клетка из каждой лунки выполняет против обоих ворот (6С).
- Участок данных для каждой экспериментальной состоянии, используя отдельные ячейки подгрупп населения этикетки, открыв программу RStudio. Нажмите кнопку "Файл" и "Открыть файл", затем выберите предоставленную файл 'analysis.r ». Соблюдайте команды для построения 6, б, 7 и 8 в верхнем левом окне RStudio (рис S2b). В левом верхнем окне, между двойными символами цитатой на линиях 5 и 6, введите адрес компьютера в папку с стробированные данных. Включить букву диска и имя самого файла, соответственно (например, "C: папки / анализ / вывода анализа» и «nuclei_gated.csv").
ПРИМЕЧАНИЕ: Если RStudio используется впервые на данном компьютере, R графический пакет 'ggplot2 "будет необходимо устанавливать в первую очередь. Это только один раз шаг для новой установки RStudio, после чего этот шаг становится излишним. Для установки "ggplot2», щелкните вкладку "Пакеты" над окном в нижнем правом углу RStudio, нажмите кнопку "Install Packages", который появляется под это. Появится новое окно. Тип "ggplot2" (опуская котировки) в "пакеты" сПАСЕ в этом окне, и, наконец, нажмите кнопку "Установить", чтобы закрыть окно, установите необходимые функции ggplot2 и вернуться к главному окну RStudio продолжить с шага 3.6. - Выделите строки с 1 по 17 в верхнем левом окне RStudio, а затем нажмите кнопку «Выполнить». Это войдет в экспериментальных данных, пороговые значения и расположение деталей и в R (рис S2C). R теперь временно удерживать соответствующие данные для построения.
- Выделите отдельные блоки остального кода под линией 17 и создать соответствующие участки, нажав на кнопку «Выполнить», как раньше. Соблюдайте участки в окне в правом нижнем углу RStudio и сохранить количество форматов, нажав на кнопку "Экспорт" (Рис S2D).
- В то время как закрытие RStudio, нажмите кнопку "Не сохранять", когда будет предложено. Это предотвращает путаницу на следующей использовании RStudio, которые в противном случае будут содержать данныеот предыдущей сессии.
Результаты
Примерный набор изображений генерируется с использованием обратного трансфекции миРНК скрининга протокола были подготовлены для и проанализированы с помощью сотового Profiler программное обеспечение. В результате численного исходные данные таковы, что каждая клетка в отдельности представлены, прослеживается обратно в изображение и хорошо происхождения и измеряется по нескольким параметрам интенсивности флуоресценции (рис 6А). Для каждой ячейки определил среднюю интенсивность ядерной флуоресценции для RB1 антитела P-S780 и интегральной интенсивности ДНК красителем определяется ядерных масок ДНК определяются. Средние величины интенсивности GFP для ядра и цитоплазмы областей каждой клетке, также записываются позволяет рассчитать ядерного против цитоплазматической флуоресценции GFP-репортер CDK2. Вниз по течению от этих алгоритмической измерений интенсивности флуоресценции использования изготовлен из этих индивидуальных данных клеток, чтобы определить ворота в течение двух анализах, окрашивание ядерного антител и GFP-репортер CDK2. После аннотации клеток на гое основой для анализа результатов и использования этих меток, с тем чтобы конкретные субпопуляции в дальнейшем характеризуется третьего измерения (содержание ядерной ДНК) описывается.
Гистограмма данных интенсивности сырья флуоресценции собранных для каждого анализа являются эффективным способом оценки того, как сотовые субпопуляции себя в различных условиях. Гистограммы на рис 6В показаны распределения популяций отдельных данных клеток из трех лунок для каждого нокдауна состоянии РНК-интерференции. Слева находятся данные для интенсивности ядерной антител и справа являются соответствующие данные для GFP-CDK2 репортера. Данные RB1 антитела P-S780 показывает, что клетки в целом существует в двух популяций в связи с этим посттрансляционной модификации и, что сотовые населения с потерей RB1 фосфорилируется на S780 можно выделить в качестве левого пика ядерного интенсивности, которые обогащают когда CDK6 сбит с миРНК. Это же пик леваяВидно, когда сама RB1 является мишенью РНК-интерференции, отражающий откровенную удаление белка и, таким образом окрашивания RB1 Р-S780. В отличие от этого, те же экспериментальные условия для одних и тех же клетках, при наблюдении с помощью GFP-CDK2 анализе репортерного, показывают различные динамические в данных отдельных клеток. Непрерывное распределение наблюдается, только с одним пиком, но миРНК что нарушает клеточный цикл (siCDK6) и приводит к накоплению в результатах G1 фазы в расширении правой обочине этого распределения (то есть, свидетельствующих об улучшении наличие клеток с увеличить в соотношении GFP ядерного / цитоплазмы, построенные на оси Х).
Кроме того, показано на гистограммы рис 6В значения БИС (вертикальные полосы), которые выбираются на основе распределений обоих наборов данных анализа. Правило, которое используется для передачи данных RB1 антител Р-S780 является определение позиции ворот как полувысоте: максимальная ширины позицию на левом плече главная(Справа) пик при рассмотрении данных отрицательного контроля клеток (ненацеливании Серна). Данные красным цветом являются клетки с уменьшенным и отсутствующего RB1 P-S780, которые отождествляются с этих ворот. Аналогичное затвора расположена на противоположной плечо распределения соотношение значение используется для GFP-репортер CDK2. В результате высокого соотношения субпопуляции клеток, которые не имеют или функция сводится CDK2 деятельности, показаны зеленым цветом. Чтобы проиллюстрировать мультиплексированную анализ двух анализов 6С показана реализация обоих значений ворот с помощью скрипта 2_gate_classifier.pl Perl, чтобы преобразовать исходные данные (рис 6а) в аннотированной файла ниже. Этот новый файл включает исходные данные наряду с новой колонке класса этикеток для каждой ячейки и двух значений, используемых затвора, чтобы отличить их (в данном случае ворот 0,004 для данных антител и 1,5 для репортера GFP-CDK2 были использованы, соответственно) ,
После объявление отдельные клетки FROM каждый нокдаун условие на основе двух анализов В настоящее время можно использовать эти метки класса для оказания помощи аннотации сюжетов данных анализа. Рисунок 7 показывает графиков разброса индивидуальных данных клеток для P-S780 RB1 и GFP- CDK2 анализы на примере данных, установленных для всех трех условий РНК-интерференции. Числа аннотирования квадранты о диаграммах рассеяния показывают относительное процентное содержание каждого закрытого субпопуляции в целом за этом контексте нокдауна и генерируются в R с использованием метки класса, описанные выше. Эти участки показывают, что, по сравнению с клетками трансфицированных ненацеливании миРНК (7В), клетки, трансфицированные siCDK6 показывают чистую распределение данных сдвинуты как вниз по оси ординат (указывающий отсутствие RB1 фосфорилирования на серин 780) и справа на оси абсцисс (что свидетельствует о низкой активности CDK2, 7С). Оба этих сдвигов, как ожидается, для нокдауна данной задачи. В отличие от этого, данные от сэраB1 трансфицированные клетки (7А) показывают потерю окрашивания антитела в соответствии с потерей эпитопа, но мало влияет на распределение данных для CDK2 репортера по сравнению с контрольной группой, трансфицированных ненацеливании миРНК, что свидетельствует об отсутствии большое влияние на GFP -CDK2 репортер возникает из RB1 нокдаун.
Для дальнейшего изучения возможностей использования персональных данных клеток, субпопуляции классификации и анализа мультиплексирования Рисунок 8 показывает график рассеяния для данных siCDK6 из 7С наряду парных гистограммы профилей для интегральной интенсивности ДНК. Пары гистограмм относятся к противоположных половинах всего населения, деленный на основе либо интенсивности антител (справа от диаграммы рассеяния) или GFP-CDK2 репортер значениями отношения (выше на диаграмме рассеяния). Количественная оценка интенсивности ядерной ДНК для этих групп населения показывает два пика, характерные для 2N и 4N содержание ДНК в качестве левого и правого пиков, соответственно. Яntentions из ворот, показанные на фиг 6, 7 и 8 являются такими, что клетки идентифицированы по цене по С-S780 (RB1 помечены: P-S780-) или с высоким значением коэффициента от репортера GFP-CDK2 (обозначены: G1) будет находиться в фазе G1 клеточного цикла. Действительно, профиль ДНК гистограммы для групп населения, выявленные с любой из этих анализов преимущественно содержат клетки с содержанием 2N ДНК. Профили ДНК противоположно закрытом населения (обозначены: P-S780 + или не-G1) содержит клетки с распределениями в пределах от 2 н до 4N, в соответствии с такие клетки принятия спектр клеточного цикла позиции после фазу G1.
Хотя основное внимание здесь было производство и анализ индивидуальных данных клеток из флуоресцентной окрашенных образов, это также полезно, чтобы иметь возможность принять эти данные и обобщить каждого анализа на основе хорошо по скважине для мониторинга изменчивости между повторами и производительности всех скважин для данного анализа поперек всей пластины данных. На рисунке 9 показаны данные по каждому лечения миРНК кратко как средние значения из трех лунок на процент клеток в ворота относится к а) в Rb1 данных и б P-S780) репортер данных GFP-CDK2. Значения приведены на А и B производятся на двух дополнительных скриптов на Perl, снабженных этой рукописи; "Antibody_fluorescence_summary.pl" и "G1assay_summary.pl ', соответственно. Эти скрипты используют необработанные данные, созданные Cell Profiler (Nuclei.csv) и данные об отдельных хорошо, как и я) Всего клетки, измеренных на лунку, II) количество клеток в ворота, III) процентов клетки в ворота и IV) арифметика среднее из измеренных, сырые данные для этого также. Это входит в качестве опции подходящего для поиска в больших наборов данных анализа, до сосредоточив внимание на отдельных данных о лечении с помощью мультиплексной оценку индивидуальных данных клеток, как показано на 7 и 8. Графики отображаются здесь сюжет "III) процентов клеток в ворота" для обоих анализах, которые подходят не-нормальных распределений данных были представлены для данных P-S780 RB1 и GFP-CDK2 в гистограммах рис 6В. Эти сценарии также рассчитать »IV) среднее арифметическое измеренных, сырые данные для этого хорошо", которая бы подходила анализ данных для однородных ответов населения и нормального распределения данных до и после экспериментального возмущения.
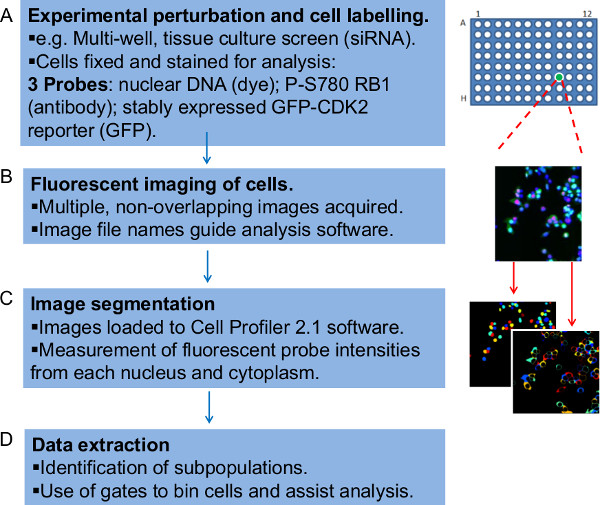
Рисунок 1:. Обзор шагов в рабочий процесс количественно проанализировать данные флуоресцентно меченных микроскопическое изображение рабочего процесса представлен здесь в виде четырех этапов () Прежде всего необходимо экспериментально подготовить клетки для флуоресцентной визуализации.. Пример, описанный здесь является то, чтоЭкран, в котором миРНК обработанных прилипшие клетки опухоли человека выращивали в течение 48 часов, фиксировали и окрашивали на тканевой культуры 96-луночного планшета. Различные условия RNAi присутствуют в трех экземплярах в отдельных скважин в пределах пластины. Клетки окрашивали красителем ДНК, антитела, специфичного для RB1 фосфорилируется на CDK4 и 6 селективного сайт-мишень серин-780 (Р-S780 RB1), и они также стабильно выразить GFP-CdK2-репортер, отчетности выход из клеточного цикла G1. В совокупности эти флуоресцентные зонды являются две пробы отдельно оценивать в процессе. (В) Параллельные микроскопа изображения для каждого флуоресцентного зонда (канала) генерируются и назван так, чтобы включать в себя подробную информацию, с помощью которого программное обеспечение анализа изображения можно организовать данные. (C) Файлы изображений будут загружены в программное обеспечение сотовый Профили, которые алгоритмически идентифицирует отдельные клетки и связанные с ними пары ядер и цитоплазмы до уступая измерения интенсивности для трех флуоресцентных зондов обнаружитьред в каждом. (D) Наконец, сценарий Perl используется для организации сырые количественные данные, полученные. Этот шаг применяется ворота данным интенсивности флуоресценции для каждой ячейки, эффективно биннинга клеток в субпопуляции, которые могут быть нанесены, отслеживаются и перекрестному допросу. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этой цифры.
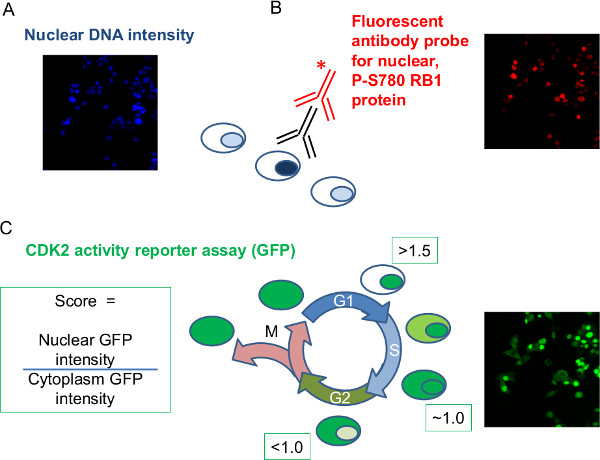
Рисунок 2: Экспериментальные данные должны быть получены путем анализа изображений фиксированной, миРНК обращению, флуоресцентно меченых клеток на примере набора данных были обследованы и измерения соответствующих интенсивностей приняты на ячейку.. Типичные данные изображения показаны для каждого параметра, записанного во время анализа изображений интенсивность (А) ядерной ДНК:. Интенсивность окрашивания красителем ДНК ядерного используется для дают меру ДНК на ядро (B) ядерного интенсивность фосфорно-RB1:. Иммуно-окрашивания, характерные для P-S780 RB1 помощью первичных (черный) антитела и флуоресцентно помечены вторичного антитела (красный) давать измерение интенсивности RB1 фосфорилирования в . S780 на ядро (C) GFP-CDK2 Репортер: клетки, используемые стабильно выразить GFP с метками репортер белок, который транслоцируется между ядром и цитоплазмой в комплекте шаблона с клеточного цикла. Двойной измерение парного интенсивности ядерного и цитоплазматического GFP для каждой ячейки позволяет рассчитать соотношение на клетку, которая может использоваться, чтобы отличить фазу G1 от остальной части клеточного цикла. Три миРНК цели будут использованы для иллюстрации анализа; ненацеливании негативное Серна управления; CDK6 миРНК в качестве положительного контроля в возмущении RB1 фосфорилирование и прогресс клеточного цикла; RB1 миРНК установить специфичности антител.К "> Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этой цифры.

Рисунок 3: Организация файлов изображений до анализа изображений Изображения взяты из планшета для культуры ткани называются систематически, с тем чтобы программное обеспечение для анализа изображений связать данные изображение обратно к первоначальному экспериментального контекста.. Эта информация помещается в имени файла для каждого изображения. () Как в каждую лунку по эксперименту пластины могут соответствовать различным целям РНК-интерференции или лечения, адрес и образует часть имени файла. (B) номер кадра является частью имени файла . в каждую лунку изображается собрать несколько, неперекрывающиеся кадры (C) флуоресцентных зондов из каждого кадра загружаются отдельно; следовательно, имена файлов также должны отражать, какой канал каждое изображение относится к. (D) Пример имена, относящиеся к так (G12), рамы (2) с каждым изображением, представляющим один из каналов (синий, красный, зеленый). Пунктирные линии связывают имя файла элементы соответствующих схемных представлений для скважин, рама и канала, соответственно. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этой цифры.

Рисунок 4:. Использование сотового Profiler для измерения ядерной ДНК и окрашивание антитела с настройками в файле условии трубопровода (3_channels_pipeline.cppipe), значения интенсивности флуоресценции анализа изображений мер программного обеспечения Cell Profiler для ядерной ДНК и антитела-связывающий относящиеся к отдельным ячейкам . () Ядра указанные в «синей» канала изображения из цветного ДНК. (B) < / STRONG> Позиции ядер ДНК окрашивали которые временно хранятся в «ядер маски». Маска Ядра затем наложить на (С) синие и красные изображения каналов (данные ДНК и флуоресценции антител, соответственно) и значения флуоресценции от сегментов изображения, которые перекрывают с маской, регистрируются на каждого идентифицированного клетки. Успешной идентификации отдельных соседних ядер, может быть визуально оценивали в появлении маски ядер. Для иллюстрации показана кружил в этой маске изображения, примеры, когда выбранные настройки для алгоритма имеют MIS-определенные соседние ядра как одного ядра. Настройка параметров алгоритм минимизации этих событий, внесенные в разделе обсуждение. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этой цифры.
/ftp_upload/51882/51882fig5highres.jpg "/>
Рисунок 5: Использование сотового Profiler для измерения ядерных и цитоплазматических интенсивность GFP GFP с метками CDK2 репортер транслоцируется между ядром и цитоплазмой по отношению к позиции клеточного цикла клеток.. В то же время, что сотовый Профили вычисляет ДНК и антител ядерного интенсивности на ячейку (рис 4), она также вычисляет отношение к ядерному цитоплазме интенсивности GFP для каждой ячейки. (А) Данные красителя ДНК для каждого изображения используется для генерации Маска ядер. (В) Сотовый Профили использует ядер маски в сочетании с GFP изображения с GFP-репортер CDK2 семени положение каждой ячейки, а затем расширяется до периметра каждой ячейки, чтобы оценить всю среду из каждой ячейки. Это становится новой, "сотовый маска". (С) Маска ядра вычитается из маски Cell, чтобы получить пончик, как серию цитоплазме контуры, которые становятся"цитоплазма маска". (D) ядра и цитоплазмы маска маска используются Cell Profiler для измерения пары ядерных и цитоплазматических значений GFP. Эти парные значения затем используются клетки Profiler для расчета коэффициентов, которые информируют, чтобы положение каждой ячейки клеточного цикла. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этой цифры.
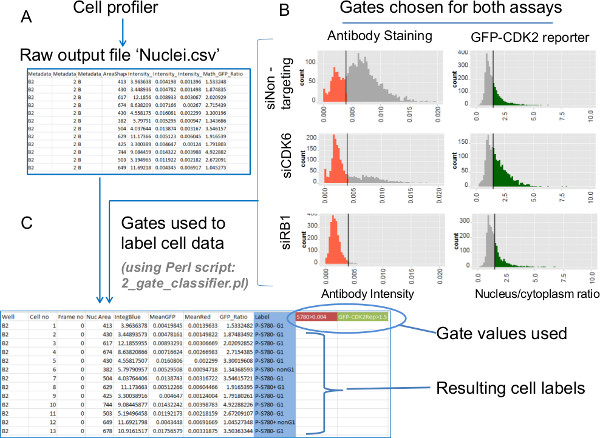
Рисунок 6:. Извлечение данных - Обработка первичных данных отдельных клеток путем введения ворота от значений аналитических биологических тенденций, от индивидуальных данных клеток для окрашивания антител и GFP-CDK2 репортер анализов извлекаются с помощью стробированные данных. Гистограммы исходных данных позволяют идентифицировать подходящие значения Gate. Затем они ввели с помощью скрипта Perl. ()Конечным продуктом анализа файлов изображений с указанных параметрах для сотового Profiler разделяются запятой, значение (.csv). Эти файлы с ontain индивидуальных данных клеток, относящихся к каждой из различных субклеточных сегментов. Файл "Nuclei.csv 'содержит все выбранные измерения, относящиеся к использованию маски ядер. Эти измерения включают в себя интенсивность ядерного антител, интенсивность ядерной ДНК и соотношение GFP (ядро / цитоплазма). (B) Гистограммы интенсивности ядерного антитела (слева) и GFP-репортер CDK2 соотношений (справа), построенных по индивидуальным данным клеток для каждого состояния нокдауна миРНК , Полоски на отображенные гистограммы показывают желаемые позиции Ворота для этих анализов. Цветные данные о гистограмм указывают стробированные субпопуляции. (C) Ворота для двух анализов, показанных на B применяются к исходным данным с использованием Perl Script '2_gate_classifier.pl ». Сценарийсоздает модифицированную копию файла Оригинальный выход Cell Profiler (Nuclei.csv), чтобы помочь последующее рисование. Эти два значения ворота записываются в новый файл (выделяется цветом здесь) и новый столбец "Метка" добавляется. Этикетки бен каждая ячейка в одном из четырех возможных подгрупп на основе двух закрытых значений анализа для каждой ячейки. Эти метки используются в последующих участков, которые показывают расчеты взносов каждой субпопуляции, а также перекрестных ссылок дополнительных параметров, полученных в клеточной Profiler. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этой цифры.
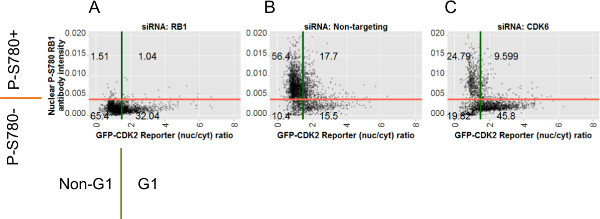
Рисунок 7:. Диаграммы разброса для каждого миРНК состоянии изображением исходные данные для отдельных клеток и положениями затвора графиков разброса INDIVIДанные двойная из всех изображений в условиях миРНК указывается: (A) siRB1; (B) Синона таргетирования отрицательный контроль; (C) siCDK6. Заговор против Y-осей значения ядерной флуоресценции окрашивания RB1 анти-P-S780. Заговор против X-осей соответствующие значения соотношения, которые рассчитываются с GFP-CDK2 репортера. Красные и зеленые полоски указывают положения ворот для RB1 ворот Р-S780 и GFP-CDK2 репортер ворот, соответственно. Два ворота разделить на четыре клетки субпопуляций и числа полученных за квадранты процентов число клеток от каждой из них. Аннотации вокруг осей для А указывают четыре возможных Label-элементы применяются к каждой ячейке по 2_gate_classifier.pl Perl скрипта. Эти метки приведены в соответствии с их соответствующими ворот анализа и могут быть использованы в R-скрипта (analysis.r) для генерации участки на фиг.6, 7 и 8. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этой цифры.
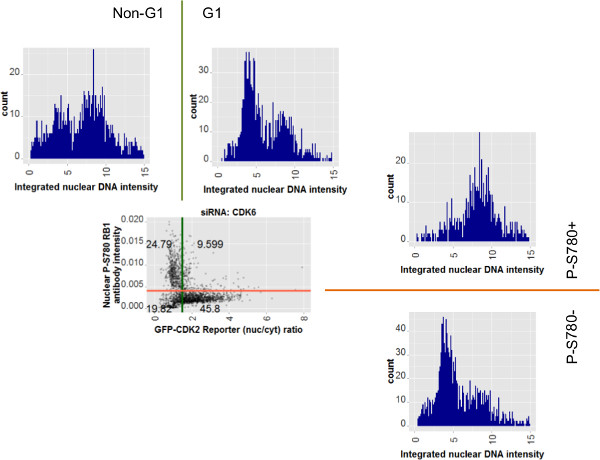
Рисунок 8: Сотовые субпопуляции, определяемые двумя G1 транзитных анализов показывают, 2N и 4N ДНК профилей в соответствии с анализа результатов точечный график данных для ячеек siCDK6 повторяется из фиг.7С.. Ближайшие точечного графика гистограммы для интегральной интенсивности ядерной ДНК, связанной с подмножеств населения. Те выше диаграмме рассеяния относятся к GFP-CDK2 анализе репортерного. Те, справа от диаграммы рассеяния относятся к измерениям антител ядерного фосфо-RB1 в одиночку. Цветные линии ворот распространяются, чтобы показать свое отношение к гистограмм. Ворота этикетки с помощью которого были выбраны данные клеточные для этих дополнительных участков также показаны, Клетки с потерей RB1 Фосфорилированные на серин 780 (С-S780-), или те с высоким GFP-CDK2 репортера ядерный цитоплазматической отношения (с указанием низкую CdK2 деятельность) показывают преимущественно 2N-как ДНК-профили, в то время как их противоположностей для каждого соответствующего анализа показать распределение 2N и 4N, характерной смешанной, пост-G1 фазы популяции клеток. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этой цифры.
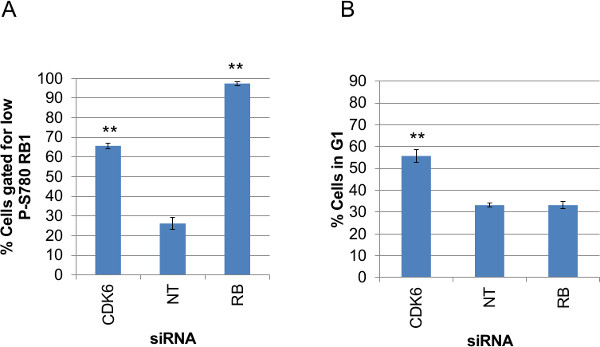
Рисунок 9: Сводная участки закрытых значений анализа для каждого миРНК состояние участков сводные данные о закрытых (а) р-S780 RB1 данных и (B) GFP-CDK2 данных трех лунок для каждого нокдауна состоянии миРНК.. Значения были рассчитаны с выхода сырья сотовый Профили (Nuclei.csv) с помощьюPerl скрипты, 'antibody_fluorescence_summary.pl' (A) или "G1assay_summary.pl" (B). Значения построенные являются средством процент клеток в ворота, приложенного к каждой анализа. Бары указывают на стандартные ошибки, вычисленные из трех лунок. Неспаренные, гомоскедастичный значения T-Test P для каждого нокдауна состоянии по сравнению с ненацеливании Серна показаны выше данных на графике, где P <0,001 (**) и P <0,05 (*). Пожалуйста, нажмите здесь, чтобы увидеть увеличенное фигура.
Рисунок S1. Настройка сотовый Profiler программное обеспечение для анализа изображений. () Скриншот клеточной Profiler до того, как настройки анализа изображения вводятся. (B) Скриншот клеточной Profiler после детали алгоритма, содержащиеся в '3_channels_pipeline.cppipe "были загружены. Высокая зажег вкладка в левом верхнем углу указывает, что этот экран показывает параметры для сцены "LoadImages" анализа. Нажатие на других частях списка ниже Это позволит выявить детали для последующих ступеней в анализе. (C) Скриншот клеточной Profiler с деталями для ввода папки и папки вывода вошел. (D) Скриншот клеточной Profiler после "Проанализировать изображения кнопок "была нажата, чтобы начать анализ. Наложение три новых окна, иллюстрирующие алгоритмически произведенных маски, созданные с помощью программного обеспечения от образов при анализе. Эти окна доступны, нажав на «глаз» иконки в открытое положение рядом с соответствующими ступеней в анализе, в левом верхнем углу главного окна Cell Profiler. Эти взгляды помочь пользователю проверить, будут ли параметры генерации конфетти цвета маски согласны с сопровождающими, оригинал, в оттенках серого данных.
ЛОР "> Рисунок S2. Использование Perl и RStudio в ворота индивидуальных данных клеток и сюжет Полученную клеточную субпопуляции. () на правой панели показывает папку выбрали для получения выходных данных CSV-файлов (зеленые значки) из анализа клеток Профили. Сценарии Perl, предоставляемые с рукописью (синий икон), копируются в эту папку. Мелированные является Perl скрипт '2_gate_classifier.pl ", который был дважды щелкнул мышью, чтобы произвести диалоговое окно, в левой панели. Показаны подсказки и соответствующие ввели ответы, необходимые для ворот индивидуальные данные клетки, из файла 'Nuclei.csv. (B) Скриншот RStudio сразу после загрузки сценария' analysis.R. Выделенные команды закачать стробированные данные из в Программное обеспечение до построения (подробности отметить в строках 5 и 6 должны быть скорректированы в соответствии с которой закрытого данных находится на вычислительныхR используется для анализа). (C) Скриншот RStudio раз данные были загружены. (D) Скриншот RStudio с выделенным блок кода, необходимого для получения участка, показанный в нижней правой части окна. Коды для каждого сюжета, разделяются пустыми строками и сгруппированы по типу участка.| миРНК целевой | Адреса Plate также |
| Ненацеливании (NT) | E5, F5, G5 |
| Retinoblastoma (РБ) | E7, F7, G7 |
| Cyclin зависимой киназы 6 (CDK6) | B2, C2, D2, |
Таблица 1: Ну адреса и соответствующие миРНК условия, используемые в примерах набора данных.
Обсуждение
Рабочий процесс описывается представляет собой процедуру многоямного perturbance клеток с использованием миРНК, последующее обнаружение маркеров и, наконец, использовать в серии с программным шагов для облегчения извлечения количественных данных из полученного флуоресцентной микроскопии изображений. Подход ориентирован на доставку ценностей ядерных и цитоплазматических интенсивности отдельных клеток, который имеет широкое практическое применение во многих приложениях на основе клеток. Примерные данные, используемые здесь был создан в установки экрана миРНК в котором два флуоресцентные анализы для транзита клеточного цикла G1 фазы прошли проверку и коррелирует вернуться к более прямым биофизической меры содержания ядерной ДНК.
Использование флуоресцентным красителем ДНК к фотографиям ядерной ДНК является необходимым шагом в процессе сегментации изображения, так как позволяет идентифицировать отдельные клетки и в результате "Ядра маска" служит отправной точкой для определения соответствующего cytoplasmiС регионы. GFP с метками CDK2 репортер, который стабильно экспрессируются в клетках, дает переменную пока последовательно выше, чем фонового сигнала в цитоплазме, с помощью которых этот отсек может быть разграничены. Же трубопровод анализ должен быть применим к анализу транслокацию белка событий, используя другие подходящие флуоресценции связаны журналистам и их реакцию на perturbance. Кроме того, подставляя GFP-CDK2 корреспондент цитоплазмы конкретных флуоресцентных красителей позволит альтернативное использование этого алгоритма для измерения размеров в цитоплазме и относительные размеры клеток в изображениях.
Другой дизайн рассмотрения в сегментации стратегии изображения, описанного здесь использование сотовых Profiler для доставки комплексных значений интенсивности для количественного ДНК. Интеграция интенсивности значения для ядерной ДНК данных окрашивания позволяют возможных изменений в ядро размером, и представляет собой близкое соответствие для количественного профилей виделдля пропидий йодид окрашенных FACS данных. Тем не менее, интегральная интенсивность не может обеспечить надлежащие средства для оценки функции белка, где средняя концентрация, на примере средней интенсивности флуоресценции антигена, более биологически значимым, чем интегрированного общего количества белка (и связанного с флуоресценцией) в пределах соты отсека. Поэтому средние значения интенсивности были использованы для P-S780 RB1 и данных GFP. Возможность изменять между этими двумя режимами (средний или интегрированный) оценки данных, найденных на панели "ExportToSpreadsheet" программного обеспечения Cell Profiler.
Настройки анализа в файле 3_channels_pipeline.cppipe оптимизированы для изображений в наборе данных в следующем примере. Анализ новых изображений множеств с этим протоколом будет требовать, чтобы имена файлов принять именования описано выше (Рисунок 3). Кроме того, чувствительность значения в соответствии с яркостью окраски ядерной ДНК и порогов для фонаинтенсивности в новых наборов изображений может потребоваться корректировка в настройках сотовый Profiler. Учитывая ключевую роль окрашивание ДНК имеет место для строительства различных сегментации изображения маски, применение правильных настроек чувствительности для данного канала является ключом к успешному анализа новых данных изображения с программным обеспечением Cell Profiler. Файл настроек при условии, сотовый Profiler (3_channels_pipeline.cppipe) содержит информацию о наиболее часто полезно параметров для адаптации анализ к новым данным. Эти заметки хранятся в текстовом поле в верхней части экрана в Профили главном окне Cell и включают в себя рекомендации по изменению настроек чувствительности и корректировки количество каналов, которые будут проанализированы. Как предъявлены обвинения в Протоколе разделе 2.8, чтобы проверить настройки для новых данных изображения может быть необходимо соблюдать сегментацию во время анализа изображений, нажав открыть «глаз» иконки для каждого из «Определить ... предметов« шаги протокола (рис S1D ). В частности, визуализация данных изображения через «IdentifyPrimaryOjects" покажет, будет ли маска Ядра правильно идентифицированы изображений окрашивания ДНК. На страницу программного обеспечения Cell Profiler для модуля "IdentifyPrimaryOjects" является фактором порог коррекции. Методом проб и ошибок настройки этого значения будет исправить большинство ошибок ядерных распознавания. Значения сбалансировать канал ДНК от интенсивности фона для каждого изображения. Значения коэффициента коррекции порога зависеть вокруг 1, где больше, более жесткое (хорошо для четких изображений) и менее чем 1 мягок (подходит для изображений с меньшим контрастом между окрашиванием и фона).
Сырой продукции отдельных данных клеток из клеток Profiler могут быть проанализированы различными способами, чтобы удовлетворить потребности других исследований. Здесь показано использование скрипта Perl применять ворота двух измеряемых параметров на ячейку в целях содействия извлечения биологических тенденций от ап данныхРазрешение d перекрестных ссылок выявленных групп населения с дополнительными измерениями. Хотя это в равной степени можно включать элементы стробирования в рамках клеточной Profiler, альтернативный маршрут используется здесь обеспечивает большую гибкость и скорость, особенно если большие наборы данных должны быть оценены. Медленный этап в фазах после приобретения образ текущего протокола является работа программного обеспечения Cell Profiler. Сотовый профилировщик здесь выполняется без наложения ворота с получением сырого набор данных не-закрытый, которые могут быть повторно проанализированы с последующим сценария Perl более быстро и, в случае необходимости, многократно с различными значениями затвора. Не все исследования будут заранее знать подходящие значения ворота, как это может варьироваться в зависимости от реагентов на любой набор данных, и, возможно, с течением времени. Он, таким образом, рекомендуется произвести гистограммы, изображающие сырой распределение данных, полученных из клеток Profiler для положительного контроля и макет возмущенных клеток для того, чтобы определить подходящий ворота VALUES для параметров, представляющих интерес.
Сценарии Perl написаны принять жестко определенную структуру столбца данных из ячейки Profiler и может прекратить работу, если пользователь изменяет количество выходных параметров по мобильному Profiler, используя настройки "ExportToSpreadsheet. Чтобы помочь реализовать изменение запискам, включены в файлах Perl скрипт с настройками. Чтобы увидеть эти просмотреть скрипт в текстовом редакторе, предпочтительно текстовый редактор программиста на цвет элементов кода Perl (например, http://www.activestate.com/komodo-edit). Эти заметки показывают, где для регулировки сценарий адаптироваться к изменениям в формате данных. Как и в сценарии Perl, файл R-код, предоставленный (analysis.r), содержащая инструкции для построения фигуры из анализа данных изображения, можно прочитать в текстовом редакторе или программного обеспечения RStudio, чтобы увидеть дополнительные замечания по использованию и адаптации. Эти заметки могут быть дополнены с подробной информацией о регулярных выражений и Perl 12 и ggplot2 13 пакет для R, оба из которых составляют основу для того, как данные считываются, аннотированный и построены, соответственно.
Новые исследования с использованием флуоресцентной микроскопии, а также необработанные данные, размещенные в открытых исходных публикаций поддаются методов анализа, таких как те, которые описаны здесь. Сама природа данных с высоким содержанием поддается рекурсивного анализа с различных аналитических акценты в зависимости от научных интересов любого данного наблюдателя. Хотя вопросы, которые могут быть заданы из данных ограничивается датчиками первоначально использовались данные изображения, часто можно осмысленно переосмыслены выходит за рамки исследований, которые генерировали их.
Раскрытие информации
Авторы не имеют ничего раскрывать
Благодарности
Эта работа была поддержана грантами CRUK 15043 и CRUK 14251.
Мы благодарим Даниэль Wetterskog и Ка Kei Хо технической помощи и критическое прочтение рукописи.
Материалы
| Name | Company | Catalog Number | Comments |
| AllStars negative control siRNA | Qiagen | 1027280 | Negative control siRNA. |
| CDK6 siRNA | Dharmacon/ Custom synthesis | NA | Antisense sequence: 5' CUCUAGGCCAGUCUUCUUCUU |
| RB1 siRNA | Dharmacon/ Custom synthesis | NA | Antisense sequence: 5' GGUUCAACUACGCGUGUAATT |
| 5x siRNA buffer | Thermo Scientific | B-002000-UB-100 | To be diluted with nuclease-free, non-DEPC treated water. |
| Nulcease-free water (non-DEPC) | Applied Biosystems | AM9937 | For dilution of siRNA buffer. |
| Hiperfect | Qiagen | 301705 | Transfection lipid. |
| DMEM | Life Technologies | 41966052 | Pyruvate and high-glucose supplemented tissue culture media. |
| 96 well tissue culture plate | Falcon | 3072 | Plain, 96 well tissue culture plate for the parallel, compartmentalized mixing of transfection complexes. |
| Packard Viewplate | Perkin Elmer LAS | 6005182 | 96 well TC plate with optical base on which cells are transfected, grown, fixed and eventually imaged. Supplied with opaque, adhesive plate seals, which are used during storage of used plates. |
| Breathable membrane | Alpha Labs | LW2783 | Sterile, gas-permeable, adhesive membrane. |
| Neutral buffered formalin, 10% | Sigma-Aldrich | HT5012-1CS | 10% Formalin (4% formaldehyde) fixative used neat in protocol. |
| Triton X-100 | Sigma-Aldrich | X100PC | Non-ionic detergent |
| [header] | |||
| Tris | Sigma-Aldrich | T1503 | Trizma base (tris(hydroxymethyl)aminomethane) |
| Tween 20 | Sigma-Aldrich | P2287 | For plate wash solution. |
| Anti-P-S780 RB1 antibody | Abcam | ab32513 | Rabbit monoclonal |
| AlexaFluor647 Anti-rabbit | Invitrogen | A21245 | Highly cross-adsorbed, fluorescently labelled secondary antibody. |
| Hoechst 33342 (Bisbenzimide) | Sigma-Aldrich | B2261 | Fluorescent, chromatin-intercalating, DNA dye. |
| Permeabilization solution | NA | NA | 0.1% Triton X-100 in 50 mM Tris-buffered saline, pH 8.0. |
| Plate wash solution | NA | NA | Tris-buffered saline containing 0.1% Tween-20. |
| Block solution | NA | NA | 5% powdered milk in Tris-buffered saline and 0.1% Tween-20. For blocking plate prior to immuno-staining and dilution of antibodies. |
| Cell Profiler 2.1 | Broad Institute | http://www.cellprofiler.org/download.shtml | |
| Active Perl Community Edition | ActiveState | http://www.activestate.com/activeperl/downloads | |
| R programming environment | The R Foundation | http://www.r-project.org | |
| Rstudio | Rstudio | http://www.rstudio.com/ | |
Ссылки
- Carpenter, A. E., et al. CellProfiler: image analysis software for identifying and quantifying cell phenotypes. Genome Biol. 7 (10), 100 (2006).
- Khan, A., Eldaly, H., Rajpoot, N. A gamma-gaussian mixture model for detection of mitotic cells in breast cancer histopathology images. J Pathol Inform. 4, 11 (2013).
- Selzer, P., Beibel, M., Gubler, H., Parker, C. N., Gabriel, D. Comparison of multivariate data analysis strategies for high-content screening. J Biomol Screen. 16 (3), 338-347 (2011).
- Lyman, S. K., et al. High content, high-throughput analysis of cell cycle perturbations induced by the HSP90 inhibitor XL888. PLoS One. 6 (3), e17692 (2011).
- Richardson, E., Stockwell, S. R., Li, H., Aherne, W., Cuomo, M. E., Mittnacht, S. Mechanism-based screen establishes signalling framework for DNA damage-associated G1 checkpoint response. PLoS One. 7 (2), e17692 (2012).
- Heynen-Genel, S., Pache, L., Chanda, S. K., Rosen, J. Functional genomic and high-content screening for target discovery and deconvolution. Expert Opin Drug Discov. 7 (10), 955-968 (2012).
- Krausz, E. High-content siRNA screening. Mol Biosyst. 3 (4), 232-240 (2007).
- Gu, J., Xia, X., et al. Cell Cycle-dependent Regulation of a Human DNA Helicase That Localizes in. DNA Damage Foci. Mol Biol Cell. 15 (7), 3320-3332 (2004).
- Mittnacht, S. Control of pRB phosphorylation. Curr Opin Genet Dev. 8 (1), 21-27 (1998).
- Mittnacht, S. The retinoblastoma protein--from bench to bedside. Eur J Cell Biol. 84 (2-3), 97-107 (2005).
- Nybo, K. GFP imaging in fixed cells. BioTechniques. 52 (6), 359-360 (2012).
- Schwartz, R. L., Foy, B. D., Phoenix, T. . Learning Perl - Making Easy Things Easy and Hard Things Possible. , 1-363 (2011).
- Wickham, H. . ggplot2: Elegant Graphics for Data Analysis. , 978-970 (2009).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены