Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Грунтовка для иммуногистохимии Cryosectioned ткани мозга крыс: Пример окрашивания для микроглии и нейронов
В этой статье
Резюме
This introductory level protocol describes the reagents, equipment, and techniques required to complete immunohistochemical staining of rodent brains, using markers for microglia and neuronal elements as an example.
Аннотация
Иммуногистохимия это широко используемый метод для обнаружения присутствия, расположение и относительное обилие антигенов в месте. Этот протокол вводный уровень описывает реагенты, оборудование и методы, необходимые для завершения иммуногистохимическое окрашивание тканей мозга грызунов, с помощью маркеров для микроглии и нейронов элементов в качестве примера. В частности, эта статья шаг за шагом протокол для люминесцентных визуализации микроглии и нейронов через иммуногистохимии для Iba1 и Пан-нейронов, соответственно. Флуоресценции дважды маркировки особенно полезен для локализации нескольких белков в пределах того же образца, что обеспечивает возможность точно наблюдать взаимодействие между типами клеток, рецепторов, лиганды, и / или внеклеточного матрикса по отношению друг к другу, а также белка со- Локализация в пределах одной ячейки. В отличие от других методов визуализации, интенсивность окрашивания флуоресценции иммуногистохимии может уменьшаться внедели до нескольких месяцев после окрашивания, если соответствующие меры предосторожности не будут приняты. Несмотря на это ограничение, во многих приложениях флуоресценции дважды маркировки предпочтительнее альтернативы, такие как 3,3'-диаминобензидина тетрагидрохлорид (DAB) или щелочной фосфатазы (AP), а флуоресценции более быстро и эффективно позволяет более точно дифференциации между двумя или более маркеры. Обсуждение включает в себя советы по устранению неполадок и советы по продвижению успех.
Введение
Иммуногистохимическое является способ обнаружения антигенов (т.е. белки) в срезах тканей с использованием первичных антител, которые специфически связываются с антигенами, представляющих интерес. Иммуногистохимия был впервые JR Маррак в 1934 году, когда он решил, что антитела могут локализовать антигены с большой специфичностью 1. Начиная с 1942 года, некоторые из первых в пробирке исследования с использованием флуоресцентных антител к себе иммуногистохимии были опубликованы 2,3, после чего первый в естественных условиях гистохимических исследование было опубликовано 4. В 1960-х годах, три десятилетия после создания иммуногистохимических методов, фермент-сопряженный антитела стали использовать в качестве вторичных реагентов. Эти методы были одновременно и независимо друг от друга разработали во Франции и США 5,6. Сегодня широкий спектр антител дает бесконечные возможности для иммуногистохимических исследований 7.
"> Общая цель этого соответствия, чтобы обеспечить краткое введение в иммуногистохимического окрашивания; он не предназначен, чтобы быть всесторонним и исчерпывающий обзор этой техники в методу, описанному, иммуногистохимических методов для двух антигенов представлены (маркеры для микроглии и. нейроны) для окрашивания параформальдегида перфузии, сахароза криопротекции, cryosectioned мозга крысы Иммуногистохимическое окрашивание. начинается с блокирования неспецифического связывания антигена, чтобы уменьшить фоновое окрашивание. Затем инкубацию с первичными антителами позволяет связываться со специфическим антигеном в ткани. После первичного антитела, другое антитело, называют вторичным антителом, применяется для связывания первичных антител к конъюгированной визуализации сигнала 8. вторичное антитело цели иммуноглобулина G (IgG) домен, определенные для вида, в котором первичное антитело было поднятыми. вторичное антитело усиливает сигнал первичного антитела, так как Fab регионов тОн вторичного антитела связываются с нескольких сайтов на домене IgG первичного антитела. Либо ферментах или флуоресцентных молекул, конъюгированных с F C регионах вторичного антитела включить визуализацию. Например, анти-кролик Iba1 первичное антитело кролика молекулы IgG специфичны для Iba1. При осел анти-кроличий IgG применяется в качестве вторичного антитела, он будет распознавать и связывать с несколькими регионах кролика против IgG Iba1 (рисунок 1). Осел антитела могут быть визуализированы с помощью различных методов. Это соответствие фокусируется на обнаружении флуорофора конъюгированных с вторичным антителом, которое распознает первичное антитело, для визуализации с помощью флуоресцентной микроскопии. В флуоресцентного иммуногистохимии, окрашивающий ядра, такие как Hoechst или DAPI может быть использован для визуализации всех ядер.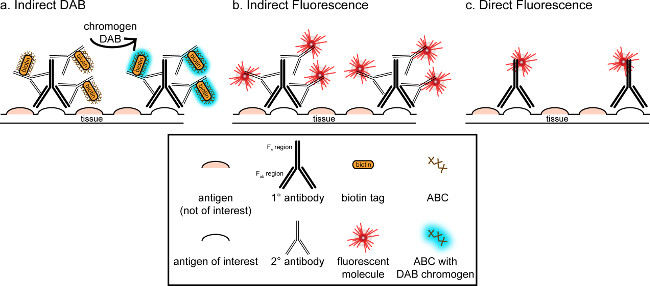
Рисунок 1: Schematic представление прямой против методов непрямой антител маркировки. Антитела связываются с антигеном интерес и может быть усилен вторичных антител, против видов первичных антител. Этот метод может быть выполнена с использованием авидин-биотин комплекса (ABC) для усиления и DAB для визуализации (А), или непосредственно конъюгированное вторичное антитело флуоресцентные (В). Кроме того, первичные антитела могут быть непосредственно сопряжен с различными тегов, в том числе биотин или флуорофора (C). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Альтернативный способ визуализации иммуногистохимического окрашивания использует 3,3'-диаминобензидина (DAB тетрагидрохлорид; см фиг.1 и 2). Это отличается от флуоресценции с помощью биотинилированного илипероксидазой хрена (HRP), конъюгированный вторичное антитело, которое обеспечивает фермент для преобразования DAB в виде осадка, который виден при ярком микроскопии. В случаях, когда один антиген представляет интерес или окрашивание, необходимых, чтобы быть длительным, DAB может быть более подходящим, чем флуоресцентного окрашивания. Тем не менее, окрашивание DAB не очень хорошо подходит для дифференциации между множеством маркеров, особенно если две атомные антигены представляют интерес. Для получения информации о материалах DAB и модификаций протокола, обратитесь таблицу 1. С другой стороны, нитро синий хлорида тетразолия / 5-бром-4-хлор-3-индолил фосфат (NBT / BCIP) может быть использован для визуализации щелочной фосфатазы (AP) конъюгированный вторичный антитела.
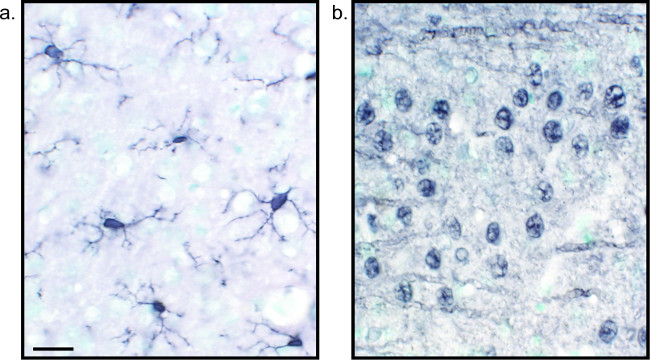
Рисунок 2:. Типичные изображения никеля повышена DAB разделах одно- помечены ткани мозга крыс Крысы мозг сеctions которые меченные никеля повышена DAB для Iba1 (A) и Пан-нейронов (В) позволяют для длительного анализа микроглии или нейроны только. Масштабная линейка 20 мкм. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Необходимо учитывать оценивается обилие интерес антигеном в ткани анализируются. Косвенные методы (как описано выше) могут быть использованы для целей с низкой численностью. Когда интерес антиген находится в высокой численности, прямые методы могут быть применены. Прямые способы включают первичное антитело, непосредственно конъюгированное с сигналом визуализации, и таким образом не вторичное антитело не требуется. Этот метод упрощает процесс окрашивания, но исключает усиление достигается с помощью косвенных методов. Использование непосредственно конъюгированное первичное антитело также устраняет перекрестной реактивности вторичных антителпри двойном маркировки.
Эта связь подробно протокол для двойного мечения Iba1 и Пан-нейронных (подробности в таблице 1). Iba1 окрашивает микроглии во многих государствах, в том числе активации разветвленной, гипер-разветвленная, активированный, амебоидных, и стержня. Пан-нейронные пятна нейронов аксоны, дендриты, и Сома. Так Iba1 окрашивает большинству микроглии и Пан-нейронов мишеней нейрон, это сочетание пятен полезно в получении широкого понимания микроглии-нейронных взаимодействий.
В общем, иммуногистохимического окрашивания зависит от тщательного подбора антител. Как вопрос исследования становится более конкретным, антитела, антигены к альтернативным может быть лучшего. Чтобы настроить таргетинг на определенное состояние активации микроглии, можно выбрать для использования CD45 CD68 антитела или, скорее, чем Iba1. Кроме того, в работе с мышами, F4 / 80 может обеспечить необходимые результаты. Аналогичным образом, нейронные элементы могут быть специально предназначены с антителами РАИСЭД против ядра, синапсов (до или пост-), аксона, и рост конуса. Кроме того, есть и другие маркеры, которые отличают возраст нейрона (Дважды кортин, NeuN), и регенерацию нейронов (GAP-43).
Access restricted. Please log in or start a trial to view this content.
протокол
ПРИМЕЧАНИЕ: Все процедуры были проведены в соответствии с уходу и использованию комитета институциональной животных (IACUC) из Университета Аризоны. Список рекомендуемых материалов и оборудования можно найти в таблице 1.
1. Подготовка ткани
- Перфузия
- Эвтаназии грызуна с передозировкой пентобарбитала натрия (25 мг / кг, внутрибрюшинно), и заливать транскардиальную фосфатным буферным раствором (PBS) до полностью обескровлены (3-5 мин) при скорости потока 8 мл / мин. Инструкции в глубине перфузии см Gage и др 2012 9.
- Сразу же после PBS флеш, исправить ткани путем перфузии 4% параформальдегида в PBS в течение 15-20 мин при скорости потока 8 мл / мин.
- Удалить мозга и место в 4% параформальдегид в течение 24 ч, а затем градуированных растворов сахарозы (15%, 30%, 30%, в последовательности, полученный в трис-буферный солевой раствор) при 4 ° С. Перевести мозг последующей раствор сахарозы Oолько после мозга утонул в каждом растворе. Примечание: Обычно, 5 дней в каждом растворе достаточно времени для ткани тонуть.
- Замораживания тканей и Cryosectioning
- Поместите мозг вложение среды, таких, как октябрь соединения и погрузить в изопентана при температуре -35 ° С. Разрешить мозг, чтобы заморозить в течение как минимум 10 мин, а затем хранить при -80 ° С. Проблемы могут возникнуть, если экспертиза температуры не принято; см обсуждения сведения по устранению неполадок.
- Сокращение последовательных Коронарные срезы с толщиной 20 мкм и температурой -20 ° С. Соберите ткань на положительно заряженных слайды. Срезы мозга может быть помещен в слайд-коробки, обернутой в фольгу в почтовым индексом сумке и хранили длительный срок при -80 ° С. Этот метод хранения создает двойной границу, чтобы предотвратить контакт с воздухом и мороза.
Обработка тканей 2.
ПРИМЕЧАНИЕ: Пример оборудование и материалы гequired для окрашивания показаны на рисунке 3. Альтернативы имеются, однако, эти образы помогут этим новым для иммуногистохимического окрашивания визуализировать соответствующие пункты до покупки.

Требуется Пример элементы для иммуногистохимического окрашивания черная окно, показанное на (А) является идеальным камера влажности для иммунофлуоресценции, а слайды защищенном от света без необходимости обернуть коробку на фольге: Рисунок 3.. После секционирования, горки могут быть сохранены в ящике, такие как желтый окне, показанном на (B). Обертывание окно плотно в фольгу и размещение в почтовым индексом сумке до морозильник помогает защитить образцы ткани из морозильной ожога. Пример слайдов приведены в (С), с различными окрашивания блюд, изображенных на (D) и (Е ). Покровные могут различаться по размеру и толщине (F), однако 1,2 толстые покровные обеспечить хорошие результаты на большинстве изображений вертикальные и конфокальной микроскопии. Карандаш, такой как показано в позиции (G) может быть использован для обозначения слайдов. Маркеры следует избегать, поскольку чернила могут работать, влияя на окрашивание и способность определять, что образец. Мини-PAP пера как, например, показано в (H) позволяет отталкивает границы, который можно сделать на слайдах.
- Подготовка Презентация
- Удалить слайды из морозильника и оттаивания при комнатной температуре.
- Необязательно: Если разделы ранее плавали с горками, поместите размороженные слайды в печи при 60 ° С в течение не более чем 4 часа, чтобы помочь предотвратить срезов ткани уплывать слайдов.
- Место слайдов в слайд-стойки и соответствующего блюдо.
- Промыть слайды три раза в PBS в течение 5 мин каждый, изменяя решение между промывками. От этого шага вперед, избежать sectiдополнения без жидкости в течение продолжительных периодов времени. Примечание: Если разделы высохнуть, фон окрашивание увеличивается, и содержательные данные не могут быть надежно получены.
- Удалить слайды из морозильника и оттаивания при комнатной температуре.
- Ткань Окрашивание
- В светонепроницаемый ящик окрашивания, создать "влажности" камеру с безворсовых тканей, пропитанных деионизированной воды.
- Высушите края слайда с безворсовой ткани, использовать мини-мазок ручку, чтобы сделать жидкий репеллент границу на самом краю слайда, от срезов. Эта граница должна обеспечить достаточное пространство между мениском жидкости, и край ткани таким образом, что поверхностное натяжение не влияет окрашивание.
ПРИМЕЧАНИЕ: отталкивает границы Пап ручка может быть применен до 2.1.3, если антитела интерес не требуют извлечения антигена микроволновая печь. Если PAP ручка была применена перед стиркой в PBS, целостность жидкого репелленты границы должны быть проверены на этом этапе. Используйте мини-мазок ручку для заполнения любых пробелов в границе. - С горки укладывать горизонтально, блок неспецифический связывания антигена путем инкубации в 4% об / об сыворотки в PBS (блок раствор). Пипетка 300 мкл блока раствора на слайде в течение 1 часа при комнатной температуре. Убедитесь, что блок решение распространяется на РАР пера на краю слайда и полностью покрывает ткань, чтобы избежать неравномерной окраски, вызванное поверхностным натяжением около ткани.
- Использование сыворотки из того же вида, в котором вторичное антитело, сделанных. Примечание: В этой процедуре, вторичные антитела выполнены в осла, и, таким образом, используется осел в сыворотке. Если вторичные антитела из двух или более различных видов используются, включают сыворотку от каждого вида.
- Внесите первичное антитело на слайды. Примечание: концентрации антител для этого окрашивания были оптимизированы 1: 5000 и 1: 500 для Iba1 и Пан-нейронов, соответственно. Эти концентрации были найдены, чтобы показать значимое окрашивание с отсутствием фоновое окрашивание.
- Развести блок решение1% сыворотки в PBS и добавить первичных антител. Пипетировать 300 мкл раствора первичных антител в 1% сыворотки на слайд. Опять же, обеспечить жидкость к краю РАР пера. Инкубируют в течение ночи при 4 ° С.
- Включить три контрольных слайдов: один, который не содержит ни Iba1 ни пан-нейронов антител, один с Iba1 без Пан-нейронов антител, и один с Пан-нейронов антител без Iba1. Пятно эти слайды в той же перспективе с теми же растворами, однако опускать первичных антител для проверки неспецифического связывания вторичных антител.
- На следующее утро, стирка слайды три раза в PBS в течение 5 мин каждый, изменив решение между стирок.
- Флуоресцентные антитела светочувствительный, поэтому, от этого шага вперед, свести к минимуму воздействия света, обеспечивая мыть контейнеры, завернутые в фольгу и гибридизации ящики черный или инкубировали в темноте. Внесите соответствующие вторичные антитела на всех слайдах и инкубировать60 мин при комнатной температуре при концентрации 1: 250 в растворе блока (см шаг 2.2.3) в светонепроницаемый "влажности" камеры (см шаг 2.2.1).
- Использование вторичных антител с различными длинами волн. Здесь, для первичного кроличье антитело анти-Iba1, использовать осла анти кролика 594 в качестве соответствующего вторичного антитела. Для первичной мыши антитело против пан-нейронов, использовать осла против мышиного 488 в качестве соответствующего вторичного антитела. С другой стороны, использовать анти-кролика 488 и анти-мышь 594.
- Промыть слайды три раза в PBS в течение 5 мин каждый.
- Дополнительно: выполнить ядерное окрашивание.
- Место в Hoechst (или другого окрашивающим ядра) при концентрации 0,03 мкг / мл в дистиллированной H 2 0 ровно 60 сек.
- Промыть слайды три раза в PBS в течение 5 мин каждый.
- Стирать в DDh 2 0.
- Coverslipping
- Покровное слайды с водной среде монтажа, такие как Fluoromount-G или ProlongGold. Позаботьтесь, чтобы удалить все пузырьки с помощью ватного-аппликатор.
Примечание: Другие крепежные средства могут быть использованы, однако высокая проступание между красителей было отмечено некоторыми в течение нескольких дней coverslipping. - Используйте ясный лак для ногтей, чтобы запечатать края, предотвращая разделы от высыхания из-за испарения. Разрешить лак для ногтей, чтобы высохнуть в светонепроницаемый контейнер, а слайды остаются плоскими и при комнатной температуре, а затем хранить в светонепроницаемой емкости, завернутые в фольгу при 4 ° С.
- Покровное слайды с водной среде монтажа, такие как Fluoromount-G или ProlongGold. Позаботьтесь, чтобы удалить все пузырьки с помощью ватного-аппликатор.
3. Воображение ткани Витражи
- Микроскопия
- Разрешить лак для ногтей, чтобы высохнуть в течение не менее одного часа до начала микроскопии, которая должна проводиться в затемненной комнате.
- Приобретать микрофотографии с помощью конфокальной или исследовательский микроскоп с флуоресцентным источником света и привязанности цифровой камеры. Использование сопроводительное программное обеспечение, установить экспозицию для каждой длины волны - 405, 488 и 594 - отдельно. Примечание: подробные инструкции изображений должны быть доступны на сайте производителя микроскопа.
- Приобретать микрофотографии в каждом канале, не перемещая разделы или регулировки фокуса. Возьмите изображения в цвете, или поочередно в оттенках серого и конвертировать в цвет позже.
Примечание: Цвет или изображений в градациях серого от каждого канала может быть собраны в пост-обработки. - Убедитесь, что срезы ткани не подвергаются воздействию окружающего света или микроскопическим света в течение длительных периодов времени, как будет происходить фото-отбеливание секциях. Чтобы избежать этого, увеличение времени экспозиции, а не увеличением интенсивности света / лазера.
- Не выключайте флуоресцентное источник света в течение 30 мин включения.
Примечание: Переключение источника и выключается в быстрой последовательности может уменьшить срок службы люминесцентной лампы.
Access restricted. Please log in or start a trial to view this content.
Результаты
Этот протокол окрашивания результаты в разделах ткани мозга крыс, которые микроглии флуоресцентно меченных в 594 канала (красный) и нейроны обозначенные в 488 канала (зеленый, см рисунок 4). Если ядерная пятно было сделано, он будет показывать в 405 канале (синий). Изображения могут б...
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Общая цель этой связи было ввести процедуры иммуногистохимии для читателя. Для этого, например, двойной маркировки с Iba1 и Пан-нейронных антигенов наблюдать микроглии и нейронов в параформальдегиде перфузии, был использован сахарозы криопротекции, cryosectioned мозга крысы.
Э...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
The authors have nothing to disclose.
Благодарности
The authors would like to thank Mr. Ryan Hart and Mr. Arriz Lucas for their invaluable feedback on this communication. This work was supported by NIH NINDS R01 NS065052 and Phoenix Children’s Hospital Mission Support Funds.
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| Fisherbrand Superfrost Plus Glass Slides | Fisher Scientific | 22-034-979 | Used for tissue mounting (1.2.2) |
| Oven | Thermo Scientific | 51028112 | Used for tissue drying (2.1.1) |
| Mini Pap pen | Life Technologies | 00-8877 | Used in step 2.2.2 |
| Andwin Scientific Tissue-tek Slide Staining Dish | Fisher Scientific | 22-149-429 | Used for all washes during staining (2.2), as well as the Hoechst step (2.2.8) |
| Kimwipes | Fisher Scientific | 06-666-A | Used for drying slides (2.2) |
| Black Staining Box | Ted Pella | 21050 | Used for blocking and staining steps (2.2) |
| Normal Donkey Serum | Fisher Scientific | 50-413-253 | Used for block and antibody incubation (2.2) |
| Mouse α-Pan-neuronal | Millipore | MAB2300 | Used for primary antibody (2.2.4) |
| Rabbit α-Iba1 | Wako Chemical | 019-19741 | Used for primary antibody (2.2.4) |
| Donkey α-rabbit 594 | Jackson ImmunoResearch | 711-585-152 | Used for secondary antibody (2.2.6) |
| Donkey α-mouse 488 | Jackson ImmunoResearch | 715-545-150 | Used for secondary antibody (2.2.6) |
| Caterer's foil | Any | N/A | Used in steps 1.2.2 and 2.3.2 |
| Fluoromount-G | Southern Biotech | 0100-01 | Used for coverslipping (2.2.8) |
| Coverslips | Fisher Scientific | 12544E | Used for coverslipping (2.2.8) |
| Clear Nail Polish | Any | N/A | Used for coverslipping (2.2.8) |
| Axio Observer.Z1 and LSM 710 (laser scanning, confocal) | Carl Zeiss | N/A | Used for imaging (3) |
| Axioskop A2 | Carl Zeiss | N/A | Used for imaging (3) |
| CitriSolv | FisherScientific | For DAB protocol | |
| ABC | Vector Laboratories | PK-6100 | For DAB protocol |
| DAB Peroxidase kit | Vector Laboratories | SK-4100 | For DAB protocol |
| Biotinylated horse α-rabbit IgG | Vector Laboratories | BA-1100 | For DAB protocol |
| Biotinylated horse α-mouse IgG | Vector Laboratories | BA-2001 | For DAB protocol |
| 30% Hydrogen Peroxide | FisherScientific | H325-500 | For DAB protocol |
| Wheaton slide racks and staining dishes | TedPella | 21043 | For DAB protocol |
| Masterflex perfusion pump and tubing | Cole-Parmer | Used for perfusion (1.1.1 and 1.1.2) | |
| Andwin scientific tissue-tek CRYO-OCT compound (case of 12) | Fisher Scientific | 14-373-65 | Used for tissue freezing (1.2.1) |
| Thermometer (-50 to 50 C) | Fisher Scientific | 15-059-228 | Used for tissue freezing (1.2.1) |
| Cryostat | Leica | CM3500S | Used for tissue sectioning (1.2.2) |
| Staining Dish, Plastic with 2 Lids | Grale Scientific | 353 | For antigen retrival |
| 20 Place Staining Rack, Slides Horizontal | Grale Scientific | 354 | For antigen retrival |
| Microwave | Any | N/A | For antigen retrival |
Ссылки
- Marrack, J. R. Chemistry of antigens and antibodies. Nature. 134, 468-469 (1934).
- Coons, A. H., Creech, H. J., Jones, R. N., Berliner, E. The demonstration of pneumococcal antigen in tissues by the use of fluorescent antibody. J Immunol. 45, 159-170 (1942).
- Marshall, J. M. Localization of adrenocorticotropic hormone by histochemical and immunochemical methods. The Journal of experimental medicine. 94, 21-30 (1951).
- Mellors, R. C. Histochemical demonstration of the in vivo localization of antibodies: antigenic components of the kidney and the pathogenesis of glomerulonephritis. The journal of histochemistry and cytochemistry : official journal of the Histochemistry Society. 3, 284-289 (1955).
- Nakane, P. K., Pierce, G. B. Enzyme-labeled antibodies: preparation and application for the localization of antigens. The journal of histochemistry and cytochemistry : official journal of the Histochemistry Society. 14, 929-931 (1966).
- Avrameas, S., Uriel, J. Method of antigen and antibody labelling with enzymes and its immunodiffusion application. Comptes rendus hebdomadaires des seances de l'Academie des sciences. Serie D: Sciences naturelles. 262, 2543-2545 (1966).
- Cuello, A. C. Immunohistochemistry. , Wiley. (1983).
- Junqueira, L. C. U., Mescher, A. L. Junqueira's basic histology : text and atlas. , Thirteenth edition / edn, (2013).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of visualized experiments : JoVE. , (2012).
- Christensen, N. K., Winther, L. Education Guide: Immunohistochemical (IHC) staining methods. Kumar, G. L., Rudbeck, L. , DAKO North America. Carpinteria, California. 103-108 (2009).
- Wang, G., Achim, C. L., Hamilton, R. L., Wiley, C. A., Soontornniyomkij, V. Tyramide signal amplification method in multiple-label immunofluorescence confocal microscopy). Methods. 18, 459-464 (1999).
- Feldengut, S., Del Tredici, K., Braak, H. Paraffin sections of 70-100 mum: a novel technique and its benefits for studying the nervous system. Journal of neuroscience methods. 215, 241-244 (2013).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены