Method Article
Подготовка, Imaging, и количественное определение бактериальной поверхности моторики Анализы
В этой статье
Резюме
Swarming motility is influenced by physical and environmental factors. We describe a two-phase protocol and guidelines to circumvent the challenges commonly associated with swarm assay preparation and data collection. A macroscopic imaging technique is employed to obtain detailed information on swarm behavior that is not provided by current analysis techniques.
Аннотация
Бактериальной поверхности моторики, такие как копошения, обычно рассматриваются в лаборатории с использованием пластин анализов, которые требуют конкретные концентрации агара и иногда включение конкретных питательных веществ в среде для выращивания. Получение таких явных сред и условий роста поверхность служит для обеспечения благоприятные условия, которые позволяют не только рост бактерий, но скоординированного подвижность бактерий в течение этих поверхностей внутри тонких пленок жидкости. Воспроизводимость рой пластины и другие поверхности моторики пластины анализов может быть серьезной проблемой. Специально для более «умеренных Молодые паразиты», которые обладают подвижность только в диапазонах агара 0,4% -0,8% (вес / объем) незначительные изменения в протокол или лабораторных условиях может значительно повлиять на роя результаты анализа. "Смачиваемость", или содержание воды на границе раздела жидкость-твердое тело-воздух этих плит анализов, часто ключевой переменной для управления. Дополнительной проблемой при оценке роения, как количественно Observed различия между любыми двумя (или более) экспериментов. Здесь мы подробно универсальный протокол двухфазного подготовить и изображения рой анализы. Мы включаем принципы, чтобы обойти проблемы, обычно связанные с роем анализа подготовки медиа и количественной оценки данных этих анализов. Мы специально демонстрируют наш метод с использованием бактерий, которые выражают флуоресцентных или биолюминесцентные генетические журналистам, как зеленый флуоресцентный белок (GFP), люциферазы (LUX оперона), или клеточные пятна для того, чтобы оптический покадровой обработки. Кроме того, мы продемонстрировать способность нашего метода для отслеживания конкурирующих кишащие видов в одном эксперименте.
Введение
Многие бактерии движутся на поверхностях с использованием различных средств самодвижения. Некоторые моторики фенотипы могут быть исследованы в лаборатории с использованием пластинчатых анализов, которые страдают от жидкой среде, связанных с составом полутвердого планшете. Подмножество полезной площади подвижность пластин анализов дополнительно включать в себя газовую фазу, обычно воздуха в помещении. Соответственно, результат какой-либо конкретной поверхности подвижности анализа, требует тщательного контроля интерфейса трех этапов: местной окружающей среды твердой поверхности, жидкой среде, и свойств газовой среды.
Наиболее часто изучали режим подвижности таким трехфазного анализа известен как роятся. Роящиеся Подвижность координацию движений, группа бактериальных клеток, которые побудили их жгутиков через тонкие жидких пленок на поверхностях 1. Это, как правило, изучается в лабораториях, использующих полутвердых анализов пластину, содержащую 0,4% -0,8% (вес / объем) агара 1. Массивпатогенных для человека эксплуатировать этот моторику поведение, чтобы исследовать и колонизировать человеческого организма. Например, Proteus Mirabilis использует роятся моторику, чтобы двигаться вверх уретры, идущие и колонизации мочевого пузыря и почек 2. Роящиеся подвижность, как правило, считается шагом предшественником биопленки, основной причиной патогенеза многих патогенов человека 3.
Фенотип роения весьма разнообразны среди видов бактерий; Экспериментальная успех и воспроизводимость сильно полагаться на такие факторы, как питательной композиции, типа агар и состава, протокол стерилизации (например, автоклавирование), полу-твердых средах отверждения и влажности окружающего (например, сезонные изменения), среди других 3-5. Изменчивость поверхностных ответов моторики подчеркивает проблем, возникающих в этих исследованиях и значительное влияние средств массовой информации и окружающей среды могут оказать. Для некоторых копошились видов, таких как Pseudomonas, кишащей ТОility может происходить на различных средств массовой информации композиций, хотя наблюдаемый фенотип и сопровождающих скорость расширения рой значительно отличаться 3. В совокупности эти факторы могут сделать поверхность моторики исследования чрезвычайно сложной задачей. Сезонное вариабельность в лаборатории может влиять на эти три-фазовые анализы: анализы могут функционировать лучше во влажном воздухе лета и хуже в сухом воздухе в зимний период. Здесь мы представляем общие принципы, чтобы обойти некоторые из наиболее заметных проблем при выполнении исследования поверхности подвижность пластины.
Для некоторых поверхностных моторики исследований, разработка конкретных фенотипов представляет большой интерес. Большинство, но не все, опубликованных исследований по изучению роения P. палочки показывают образование усиков или фракталы излучающих от прививки центра 3-9. Различия между P. штаммы палочка были зарегистрированы 5,8, но большая часть наличия или отсутствия усиков может быть связано с УдельныйС средних и протокол, используемый для этих рой подвижности плит анализов. Здесь мы включаем данные о том, как продвигать усики формирования стаи для P. палочки. Потому что P. палочки является лишь одним из многих толпящихся бактерий, мы включать в себя данные для нашего метода изучения роения Сенная палочка и скольжение Myxococcus Ксанф. Как P. палочки, результаты современных исследований по В. Сенная и М. Ксанф охватывает ряд вопросов, как исследователи работают различить аспекты споруляцией, подвижности, реакции на стресс, и переходной характеристики 1,10. Существует необходимость для количественной оценки характера и динамики конкретного поведения (ов) для этих клеток в роящимися групп.
Наземные регистрирующие подвижность, анализ и интерпретация может быть громоздким и качественно. Мы разработали протокол для детального макроскопического анализа бактериальных стаи, которая обеспечивает в дополнение к рой зоны морфологию и SРазмер (например, диаметр), количественный динамическая информация о скорости расширения роя и бактериальной или плотности БИОПРОДУКТ распределения 7. Кроме того, этот метод может воспользоваться доступных флуоресцентных белков, люминесценции и красителей для получения полное представление о бактериальных взаимодействий 8, а также отслеживать синтез биопродуктов (например, П. палочки rhamnolipid 7,8) в течение рой.
протокол
1. Рой Анализ СМИ Подготовка и Прививка 4,5,7,8,11
- Медиа Подготовка
ПРИМЕЧАНИЕ: состав среды, описанный ниже, относится к P. палочка исследования усик формирования. Пожалуйста, см Характеристики носителя в таблице 1 для P. палочки, B. Сенная, М. Ксанф поверхность моторики анализы.- Смешайте 200 мл ФАБ-минус (NH 4) 2 SO 4 рой среднего (Материалы таблицу), 0,9 г Noble агар и 0,2 г казаминокислот (Таблица 1) при перемешивании магнитной мешалкой. Используйте небольшие объемы (100-300 мл), чтобы улучшить согласованность между экспериментами.
- Автоклав 200 мл агара / медиа смеси с использованием время экспозиции 22 мин, допустимая температура 121,1 ° С, и опция быстрого отверстия. Настройки автоклав позволит должной стерилизации и агар плавления, но предотвратить агар карамелизацией.
ПРИМЕЧАНИЕ: Noble агар склонны к карамелизация; подвижности бактерий изменяется на вареной агара. - Сразу же после цикла стерилизации завершен, закрыть крышку медиа бутылки, чтобы предотвратить потерю воды за счет испарения. Тем не менее, обратите внимание, что жесткий укупорки может вызвать «вакуум уплотнения" -подобных влияние на бутылке.
- Охлаждают носитель до 50 ° С при перемешивании при комнатной температуре (RT) и добавить 2 мл стерильного 1,2 М глюкозы. Кроме того, не ставьте СМИ в инкубаторе или на водяной бане 60 ° С до готовности для использования (до 15 ч позже), и приступить, как указано. Чтобы предотвратить образование пузырьков в средствах массовой информации, тщательно перемешать с помощью магнитной мешалки; пузырей на поверхности агара не позволит даже роятся.
Примечание: Для других анализов, добавить на этом этапе термочувствительные элементы, которые не могут обрабатывать в автоклаве, например, дополнительных питательных веществ или красителей, в случае необходимости (например, добавление 8 мкл Invitrogen SYTO 63 красителя на 100 мл расплавляют агар с изображением M. Ксанф, как показано в Representatiве результатов, ниже). Добавление некоторых красителей может повлиять на базовую поведение роения, которые должны быть проверены против контроля не-красителя. - В лабораторном капотом, аликвоту 7,5 мл стерильной средах на 60 мм диаметр чашки Петри из полистирола и поддерживать пластины в одном слое (не сложены). Для увеличения поверхности, кишат аликвоты 25 мл среды в 100 мм в диаметре чашки Петри. Важно, чтобы заполнить посуду на горизонтальной поверхности, даже. Используйте уровень глаз быка, чтобы проверить, если поверхность выравнивается.
ПРИМЕЧАНИЕ: Для P. палочка анализы, используя Удельный объем средствах массовой информации в пластине будет улучшить согласованность и воспроизводимость. Для В. Сенная и М. Ксанф анализы, ручные заливки дает результаты, сопоставимые с конкретным аликвоты объемом.
- Plate отверждения
- Для небольших пластин (60 мм), позволяют растаял агар для лечения (как установлено в полу-твердых и сыпучих лишней жидкости) в капюшоне непокрытой (т.е. без крышек) в течение 30 мин. Большеплиты (100 мм) требуют более длительного времени отверждения (см обсуждения).
Примечание: В качестве альтернативы, некоторые анализы могут потребоваться для лечения пластины на настольной в течение ночи (20-24 ч), покрытой (т.е. крышки на) в одном слое (таблица 1). Роения чувствительны к избыточной и недостаточной влажности. Влажность, расход воздуха, и температура того или иного лаборатории может потребоваться изменение к пластине лечения способствовать оптимальному роения вас бактерии. - Привить пластины сразу после периода сушки закончен. Не храните пластины для дальнейшего использования.
- Выполните "чернил распространение тест", определяя тестовой пластины с 10 мкл смеси 0,50% (об / об) Хиггинс Водонепроницаемый Черного тушью и бактериального инокулята 11. Если чернила / посевной смесь легко распространяется (т.е. не сохраняют форму капель) на поверхности средств массовой информации, средства массовой информации потребуется дополнительное время, чтобы высохнуть.
ПРИМЕЧАНИЕ: Для видов, которые особенно чувствительны к влажности ( например, П. палочки), выполнить быстрое "распространение чернил тест" 11, чтобы определить, если пластины достаточно сухой.
- Выполните "чернил распространение тест", определяя тестовой пластины с 10 мкл смеси 0,50% (об / об) Хиггинс Водонепроницаемый Черного тушью и бактериального инокулята 11. Если чернила / посевной смесь легко распространяется (т.е. не сохраняют форму капель) на поверхности средств массовой информации, средства массовой информации потребуется дополнительное время, чтобы высохнуть.
- Для небольших пластин (60 мм), позволяют растаял агар для лечения (как установлено в полу-твердых и сыпучих лишней жидкости) в капюшоне непокрытой (т.е. без крышек) в течение 30 мин. Большеплиты (100 мм) требуют более длительного времени отверждения (см обсуждения).
- Рой Анализ Прививка
- Привить 6 мл бульона культуральной среде (табл 1 для деталей) с изолированной колонии от свежего (<5 дней назад, если оставляют при комнатной температуре) лизогении Отвар (LB) пластин культуры. Инкубируют в течение ночи бульонных культур (≤18 ч) при 30 ° С или 37 ° С с горизонтальным встряхивании (240 оборотов в минуту).
- Привить роя пластин, определяя с 1-5 мкл ночной бульонной культуры, или "тыкать" агар стерильной зуба выбрать или проволоки прививка иглы.
Примечание: Мы предпочитаем второй метод, потому что это уменьшает вероятность разбрызгивания инокулята и предотвращает добавление дополнительных влаги к площади поверхности рой.
- Рой Анализ Инкубационный
- Для получения общей анализе, инкубировать роя Планшеты на 30 °C или 37 ° C (или даже 42 ° С в течение B. Сенная, таблица 1) -Это бактерия специфичны. Обратить пластины во время инкубации, так что избыток влаги конденсируется на крышке, а не агара.
ПРИМЕЧАНИЕ: Температура может повлиять на фенотип, а также кинетики. Для P. палочка рои, инкубация при 37 ° С приводит к более быстрому росту и роя расширения, чем инкубации при 30 ° С; Однако морфологи этих стаи часто отличается с этим изменением температуры. - Для покадровой обработки изображений, инкубировать роя пластины при соответствующей температуре предварительного передать в Imaging Station (табл 1 для деталей).
ПРИМЕЧАНИЕ: Эта предварительная визуализация Инкубационный позволяет стаи, чтобы начать их развитие и утвердиться прежде чем переехал в новую среду, которая может или не может быть оптимальным для роятся моторику.
- Для получения общей анализе, инкубировать роя Планшеты на 30 °C или 37 ° C (или даже 42 ° С в течение B. Сенная, таблица 1) -Это бактерия специфичны. Обратить пластины во время инкубации, так что избыток влаги конденсируется на крышке, а не агара.
2. Макроскопическая снимки поверхности моторики Анализы 7,8
<ол>3. Обработка и интерпретация 7,8 данных
- Обработка изображений
- Использование MI программное обеспечение для пакетной экспортировать изображения, как 16-битные файлы TIFF: Файл> Экспорт или экспортировать несколько> Выберите файл (ы) на экспорт и экспорт местоположения.
- Используйте ImageJ открыть одно изображение или импортировать ряд покадровой:
- Откройте одно изображение: Файл> Открыть
- Импорт покадровой последовательности изображений: Файл> Импорт последовательности, и выберите "Сортировать имена численно".
- Для больших покадровой файлов, выберите "Использовать виртуальный стек" в окне "Импорт последовательности", чтобы стек экспортируемые изображения в соответствующих категориях (т.е. GFP, ППП и т.п.).
- Если необходимо, измените изображений из 16-битных файлов на 8-битных файлов: Изображение> Type> 8-бит
ПРИМЕЧАНИЕ: Некоторые ImageJ инструменты требуют 8-битные изображения. - Определите, если сигнал интенсивности для последовательности изображений или покадровой необходимо инвертировать. Наведите курсор на яркое пятно в изображении (например, флуоресцентно меченных роста) и обратите внимание на интенсивность сигнала "Value" в панели инструментов ImageJ. Затем поместите курсор в темном месте вне зоны пластины и обратите внимание на интенсивность сигнала. Если интенсивность сигнала для защищенном от света месте больше, чем интенсивность для яркого пятна, интенсивность сигнала изображения должна быть инвертирована (следуют подстадии 1-2 ниже).
- Обратить сигналы интенсивности: Edit> Invert
- Обратить таблицу поиска: Image> Таблицы поиска> Инвертировать LUT
- Вычитания фона: Процесс> Вычтите фон, и использовать "Rolling радиус шара" с радиусом пикселей, что составляет половину одного измерения изображения (например, 1000 пикселей для 2000 х 2000 рixel изображение).
- Искусственно цвет изображения или покадровой последовательности: Image> Таблицы поиска и выберите подходящий цвет из вариантов списка.
- Для фильмов с двумя или более каналов, слияния и сбалансировать цвета до сохранения в виде фильма (обработка изображений, шаг 8). Чтобы объединить изображения вместе, открыть все стеки изображений в ImageJ, а затем выберите Image> Color> Объединить каналы и назначить каждому стек цветового канала.
- Сохранить последовательность покадровой как AVI или QuickTime Movie: Файл> Сохранить как и выберите нужный формат и технические характеристики.
- Анализ Данных
- Приобретение Бактериальный Площадь поверхностный рост представить в количественном расширения Оценить
- Открыть рисунок (ы) в ImageJ
- Для расчета диаметра пластины в пикселях, нарисуйте линию по центру на планшете для анализа с "прямой" инструмента из и измерьте ее длину: Анализ> Измерение
- Единицу измерения по умолчанию в ImageJ является пиXEL. Получение коэффициента преобразования путем деления диаметра аналитического планшета (например, 60 для 60 мм пластины) по длине пикселя, полученное на предыдущей стадии.
- Изменить единицы измерения от пикселя к мм: Image> Свойства
- Изменение "единицу длины" на "мм", и "Pixel ширины", "Pixel Рост" и "Voxel глубина» с коэффициентом преобразования, рассчитанной на предыдущем шаге. Установите флажок «глобальный», чтобы сохранить этот фактор конверсии по нескольким изображениям.
ПРИМЕЧАНИЕ: Если ImageJ закрытия и повторного открытия или поле зрения изображения изменяется (то есть, изображение увеличено в более, чем другой), коэффициент должен быть пересчитан. Кроме того, выполнять все анализы в пикселях, а затем превращают в мм.
- Изменение "единицу длины" на "мм", и "Pixel ширины", "Pixel Рост" и "Voxel глубина» с коэффициентом преобразования, рассчитанной на предыдущем шаге. Установите флажок «глобальный», чтобы сохранить этот фактор конверсии по нескольким изображениям.
- Для каждого кадра, отслеживать и измерять площадь рой с помощью "Freehand Selections" инструмент на панели инструментов, чтобы проследить НУtline роя и измерить площадь с помощью: Анализ> Измерить. Это создаст измерения необходимо войти которое может быть сохранено для дальнейшего анализа в Microsoft Excel или подобных программ: File> Save As
- Приобретение Бактериальный интенсивности роста поверхности представить в количественном выражении Surface темпы роста
- После того, как фон вычитается (обработка изображения, шаг 5), использовать последний кадр последовательности, чтобы определить максимальную площадь рой (анализ данных, шаг 1).
- Используйте "Овал" выбора инструмента на панели инструментов, чтобы нарисовать прямоугольник вокруг роста бактерий на поверхности.
- Установите означает измерение интенсивности пикселей в окне, используя: Анализ> Set Измерения и выберите "Среднее значение серого".
- Чтобы получить измерения интенсивности сигнала для каждого кадра в последовательности покадровой, в то время как на первом кадре последовательности идут к: Анализ> Measure. Это создаст измерения необходимо войти которое может быть сохранено для дальнейшего анализа в Миcrosoft Excel или аналогичные программы: File> Save As
- Альтернатива предыдущем разделе (анализ данных, шаг 2). Используйте плагин ImageJ макросов для настройки и запуска макросов поверхностный рост скрипт измерения интенсивности.
- Настройка автоматического сценария измерение для анализа нескольких кадров одновременно: Плагин> New> Макрос и вставьте предоставленный сценарий (ниже) в поле и сохранить как текстовый файл ImageJ макросы: Файл> Сохранить и сохраните в папку ImageJ приложений под " макросы ".
numberOfFrames = N
для (я = 0; я Run ("мера");
Run ("Next Slice [>] ');
}
Примечание: Здесь переменной "N" является в течение неопределенного количества кадров. - Отредактируйте файл "numberOfFrames" в плагине макросы для каждого эксперимента, чтобы отразить количество кадров в последовательности изображений до запуска скрипта. Использование: Плагин> Макрос>Изменить и введите нужное число кадров в последовательности и сохранить (File> Save).
- Следуйте подшагов 1-3 в Анализа Данных-Step 2, и в то время на первом кадре последовательности запуска плагина макросов: Plugin> Макрос> Выполнить. Это создаст измерения необходимо войти которое может быть сохранено для дальнейшего анализа в Microsoft Excel или подобных программ: File> Save As
- Настройка автоматического сценария измерение для анализа нескольких кадров одновременно: Плагин> New> Макрос и вставьте предоставленный сценарий (ниже) в поле и сохранить как текстовый файл ImageJ макросы: Файл> Сохранить и сохраните в папку ImageJ приложений под " макросы ".
- Приобретение Бактериальный Площадь поверхностный рост представить в количественном расширения Оценить
Результаты
Изменение подготовке плиты может значительно повлиять на роятся моторику. Отверждения или время сушки после заливки расплавленного агара среды влияет на тонкую жидкости, пленки на поверхности моторики анализов и подвижности бактерий с течением времени. Изменения в питательной композиции также влияют роятся в течение нескольких бактерий. 1А показан кратковременный эффект от времени сушки при распространении тушью и распространение начального инокулята Bacillus зиЫШз 11. Фиг.1В показан эффект во время высыхания и 1в эффекты сульфата аммония [(NH 4) 2 SO 4] При последующем развитии усики, роясь P. палочки 5.
Количественные данные могут быть получены из конечных изображений поверхности подвижности с использованием нескольких стратегий изображений. Рисунок 2 показывает репрезентативные результаты роста поверхность для P. Aeruginosa роятся и связанные с GFP флуоресценции изображение; B. Сенная роения и связанные с биолюминесценции изображения; и поверхностный рост Myxococcus Ксанф и соответствующий красный флуоресцентный образ SYTO 64-окрашенных клеток.
Расширение сбора данных за рамки просто проверки и визуализации результатов конечных точек позволяет для изучения динамических характеристик (ов) для поверхности растущих бактерий. Рисунок 3 7 показан пример P. палочки роения (отображены для GFP экспрессирующих клеток) и связанный с ним производство rhamnolipid (визуализируют с помощью Нил Red липидов пятно) также отображается -The количественное данных из этих образов, чтобы показать коэффициент расширения P. палочки безлюдно. Видео 1 показывает покадровой В. Сенная роения отображаемого использованием свечение люкс экспрессирующие напряжения. Видео 2 8 показывает покадровой P. палочки (зелено-выражения GFP) и Сальмонелла энтерика серовар Typhimurium (красно-выражения люкс) в конкурентной рой анализа.
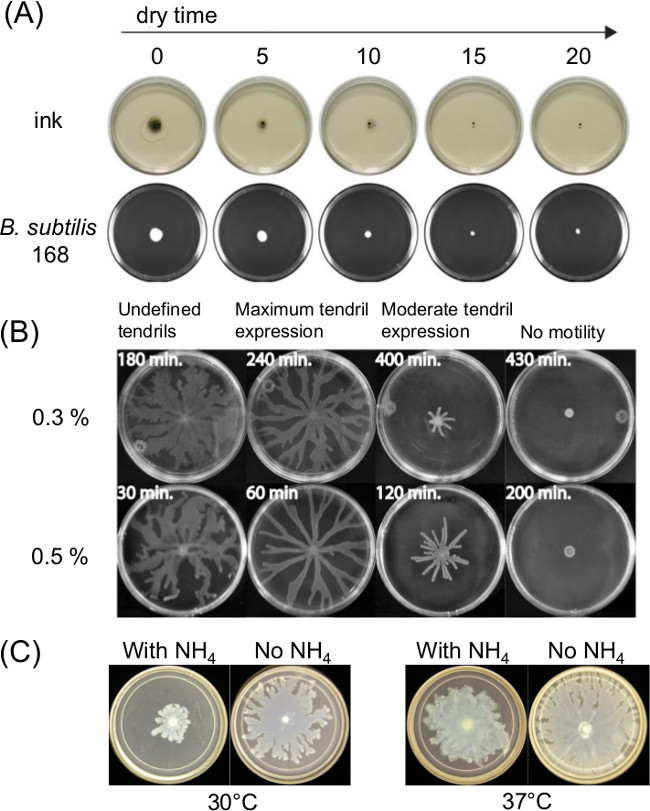
Рисунок 1: Примеры факторов в подготовке поверхности моторики анализа, которые влияют на результаты анализа эффекта (а) времени, агар-агар сушки на поверхности влаги и распространение инокулята для B.. Сенная (ссылка 8), (B) Время агар сушки на P. палочки роения (Перепечатано из работы 5 с разрешением) и (в) наличие или отсутствие сульфата аммония на Р палочки роения и образования усики.
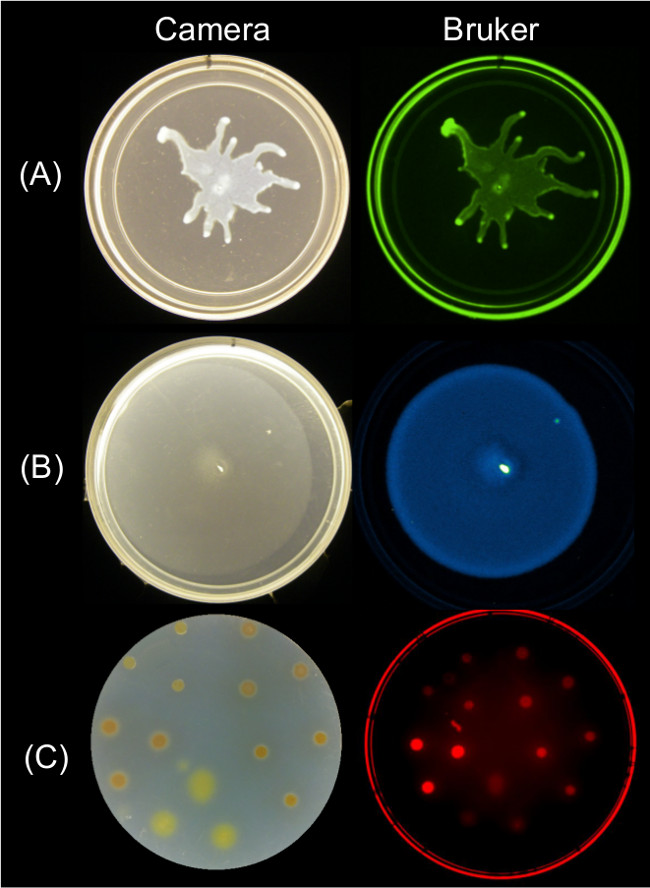
Рисунок 2: Alternatiве подходы для роста поверхности изображения и подвижности бактерий с помощью Imaging Station Bruker. Бок о бок изображением камеры (слева) и Bruker изображение (справа), показывающие (A) P. палочки выражения GFP-визуализируют с помощью настройки зеленую флуоресценцию, (B) B. Сенная, выражающие люкс биолюминесценции Репортер-визуализируют с помощью настройки свечение, и (с) М. Ксанф, окрашенных SYTO 64-визуализируют с помощью настройки красной флуоресценции II. Таблицу 2 для установки детали.
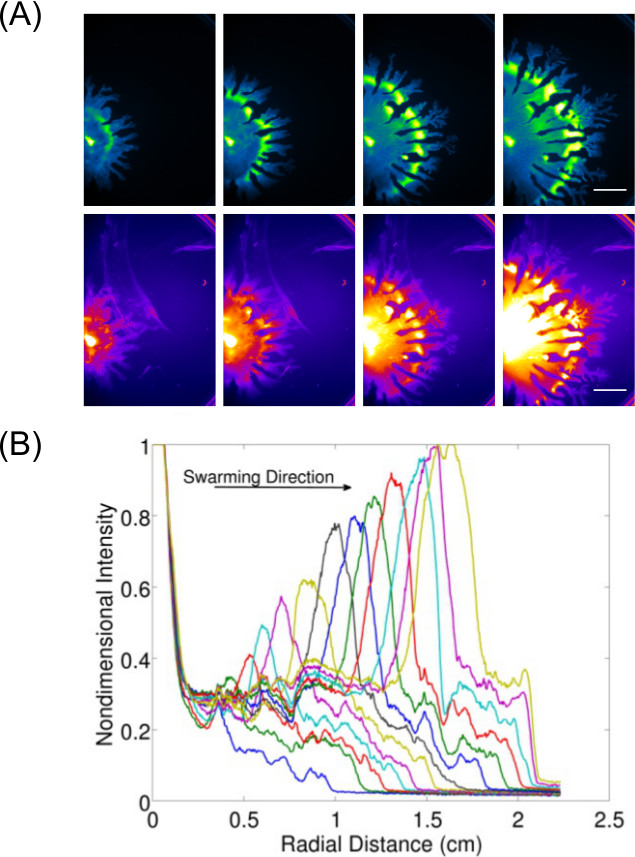
Рисунок 3:. Качественный и количественный анализ поверхности подвижности анализа () Покадровый анализ распределения плотности клеток, rhamnolipid производство (Нил Red липидов пятно визуализируют с помощью красной флуоресценцииЯ настройки; Шкала бар = 15 мм), и (B) Количественная оценка расширения размере от распределения плотности клеток образов P. палочки рой. (Печатается из работы 6 с разрешения.)
Видео 1. Покадровый изображений из B. Сенная рой. B. Сенная выражения люкс и записываются с использованием настроек люминесценции. Таблицу 2 для установки детали.
Видео 2. межвидовой конкуренции визуализируется покадровой обработки. роев P. палочки (зеленый, выражая GFP и записываются с использованием настроек зеленой флуоресценции) и С. enterica серовар Typhimurium (красный, Экспресспеть люкс и записываются с использованием настроек люминесценции). Таблицу 2 для установки детали. (Перепечатка с разрешения из работы 7).
| П. палочки | Синегнойной исследования формирования усик | B. Сенная | М. Ксанф | |
| Ночь бульон культуры СМИ | FAB плюс 30 мМ глюкозы | FAB плюс 30 мМ глюкозы | ФУНТ | СТТ |
| Ночь бульон температура культура Инкубационный | 37 ° C | 37 ° C | 37 ° C | 30 ч при 30 ° С |
| Рой СМИ | FAB | FAB минус (NH 4) 2 SO 4, | 2% (вес / объем) LB | СТТ |
| Рой СМИ: дополнительные компоненты | 12 мМ глюкозы | 10% (вес / объем) CAA, 12 мМ глюкозы | н / | SYTO® 64 |
| Тип агар | Агар, Noble | Агар, Noble | Гранулированный агар | Агар, Noble Affymetrix |
| Концентрация Агар (вес / объем) | 0,45% | 0,45% | 0,60% | 1,50% |
| Рой размер пластины | 60 мм | 60 мм | 100 мм | 150 мм |
| Громкость мультимедиа на планшет | 7,5 мл | 7,5 мл | Рука Лили | Рука Лили |
| Установка Swarm СМИ / способ сушки | Hood; Пластины обнаружили | Hood; Пластины обнаружили | Настольная; пластины покрыты | Настольная; пластины покрыты |
| Установка Swarm СМИ / время сушки | 30 мин | 30 мин | Ночь (20 -24 ч) | Ночь (20 -24 ч) |
| Рой температура анализ инкубационный | 30 или 37 ° C | 30 ° С | 37 ° C | 30 ° С |
| Инкубационный для работы с изображениями промежуток времени | 30 ° С в течение по меньшей мере 4 ч | 30 ° С в течение по меньшей мере 4 ч | 37 ° С в течение 2 ч | RT в течение 12 ч |
| Покадровый длина захвата | 24 ч | 24 ч | 10 ч | 66 ч |
| Установка времени покадровой | 1 кадр / 10 мин | 1 кадр / 10 мин | 1 кадр / 6 мин | 1 кадр / 10 мин |
| Добавлено после автоклавирования. | ||||
Таблица 1:. Технические характеристики поверхности моторики пробирной подготовка включает поверхностьХарактеристики подготовка подвижность анализа для P. палочки, B. Сенная, М. Ксанф.
| Сигнал | Зеленая флуоресценция | Красной флуоресценции Я | Красной флуоресценции II | Люминесценция |
| Белок или краситель | Зеленой флуоресценции белка (GFP) | mCherry белок или Нил Red rhamnolipid пятно | SYTO® 64 | Luciferase от люкс-оперона |
| Длина волны возбуждения (нм) | 480 ± 10 | 540 ± 10 | 590 ± 10 | От |
| Длина волны излучения (нм) | 535 ± 17,5 | 600 ± 17,5 | 670 ± 17,5 | нет фильтра |
| Время экспозиции (сек) | 30 | 60 | 60 | 240 |
| f- остановка | 4,0 | 4,0 | 2,5 | 1,1 |
| FOV (мм) | 190 | 190 | 140 | 120 |
| В фокальной плоскости (мм) | 27,5 | 27,5 | 12,2 | 4 |
| Биннинговых (пикселей) | Ни Одной | 2 х 2 | Ни Одной | 8 х 8 |
Таблица 2: Визуализация Спецификация характеристики изображения Bruker станции для красной и зеленой флуоресценции, и люминесценции изображений бактериального роста поверхности..
Обсуждение
Достижение воспроизводимый роения в лаборатории может быть сложным, как рой анализы очень чувствительны к факторам окружающей среды, таких как влажность и доступных питательных веществ. Самый важный аспект поверхности подвижность планшете влаги на поверхность агара. Перед прививкой, рой носитель должен быть достаточно сухой, чтобы предотвратить бактериальные клетки от плавания по поверхности жидкости, но не настолько сухой, чтобы ингибировать роятся моторику 5. Инкубационный должно происходить в достаточно влажной среде: слишком мало влаги может привести к аналитической высыхания в течение инкубации, в то время как слишком много влаги может привести к искусственной или артефактом поверхность распространяется. Если инкубатор с контролируемой влажностью не под рукой, инкубатор и лабораторное влажность может резко меняться. Следовательно, дополнительный резервуар для воды, увлажнители, или осушитель в инкубаторе может потребоваться, чтобы предотвратить более сушки или накопления избыточной влаги, сохраняя при этом RELATIve влажность около 80%. Поддержание этого Идеальная влажность может оказаться сложной задачей, если изменения сезонных влажности являются существенными. Если это так, то протокол рой анализа требует некоторой корректировки для учета сезонных изменений влажности. Мы обнаружили, что изменения времени рой СМИ, сушка является простым способом настроить для изменения сезонных влажности. Постоянный мониторинг влажности, как внутри, так и за ее пределами инкубатора, рекомендуется. Кроме того, рекомендуется, чтобы исследователи калибровки и проверки их инструменты, инкубаторы, весы и т.д., а незначительные ошибки температуры, объема или количества компонентов сред могут повлиять на воспроизводимость этих анализов.
Следует также отметить, что тип и размер пластины используется в анализе может повлиять на пластину влаги, и, таким образом роятся. Герметичные пластины не выход лишнюю влагу, таким образом, поощряя моторику бассейн. В отличие от этого, открытым лицом пластины позволяют слишком много влаги к бегству. Чашка Петриобеспечивает идеальную среду, потому что отверстия с достаточно избыточной влаги, чтобы предотвратить жидкость наращивать, но сохраняет достаточное количество влаги для предотвращения массовой информации от высыхания. Этот метод подробно описан протокол анализа поверхности моторику, которая позволяет для работы с изображениями высокого качества. Чтобы сохранить агар ясно блюд диаметра изображений 60 мм заполнены 7,5 мл агаровой среде. Если подробно изображений не требуется, объемы до 20 мл и может обеспечить воспроизводимые результаты.
В то время как роятся подвижности может быть достигнуто на широком спектре агар концентрациях, оптимальный диапазон агара, необходимых для роения зависит от вида. В целом, более высокие концентрации агара ингибируют роятся моторику, и, следовательно, время, необходимое для получения роя увеличивается изображения готовности. P. палочки обычно лазает по концентрациям агар между 0,4-0,7% 1, однако мы находим, что оптимальное роение происходит в гораздо более узком диапазоне (0,4-0,5%). Другие, такие как B. Сенная и С. кишечныйрой на 0,6% агара, и Vibrio parahaemolyticus на 1,5% агара 10. Требуется концентрации агара также определяется типом и маркой агара. Более высокие агары чистоты, как благородная агар, значительно укрепить роятся в P. палочки и являются предпочтительными над гранулированной агар 13,14. Тем не менее, эти очищенные версии агар также более склонны к карамелизации в течение цикла стерилизации в автоклаве; в зависимости от инструмента, сокращается / модифицированная последовательность стерилизации (для возможного изменения выхлопной цикл, чтобы предотвратить длительное воздействие тепла) может потребоваться для подготовки рой массовой информации, использующих Noble агара.
Состав средства массовой информации также играет важную роль в наблюдаемом рой фенотипа 3. P. палочка роятся подвижности исследования, как правило, осуществляется с помощью минимальных питательных средах. Мы предпочитаем FAB среднего 4,8 (Материалы таблицу), но и другие средства массовой информации, такие как М9, LB, или небольшими вариациями в этих общих средств массовой информации,были успешно 9,15,16 используется. Образование Tendril лучше всего достигается на FAB минимальной среде с добавлением глюкозы в качестве источника углерода и казаминокислот (ВГА), но без дополнительного источника азота (то есть, (NH 4) 2 SO 4) 6,13. Если формирование усик или морфология не основное внимание в исследовании, то FAB минимальной среде (Материалы Таблица, таблица 1) лишены ВГА рекомендуется, так что последствия конкретных источников углерода и / или дополнительных питательных веществ может быть изучена в деталях. Другие виды, такие как В. Сенная (представлены), являются универсальными Молодые паразиты, способные роятся на LB и гранулированного агара. Эти виды роиться легко, требуя только ~ 10 час разработать полный рой. Это быстрый роятся ставка составляет после прогрессирования потенциально сложной роя, но наш протокол делает такое отслеживание очень возможно. Возможность выполнения рой покадровой визуализации обеспечивает substanциал легкость в приобретении данных рой, в частности, от таких заядлых Молодые паразиты.
Введем эффективной и всеобъемлющей, протокол двухфазного и руководящие принципы, направленные на повышение исполнение и воспроизводимость бактериальной исследований поверхности подвижности и, прежде всего, подчеркнул аспекты важно изучить жгутика-опосредованной роения. Этот протокол рой анализ детали важные аспекты состава средств массовой информации и обработки поверхности моторики пластин для обеспечения большей согласованности и воспроизводимости внутри и между исследовательскими группами. Это позволит улучшить базу сравнения между различными исследований. Кроме того, предложенный подход и протокол предоставляет средства, чтобы сделать исследование на кишат и поверхностных моторики менее восприимчивы к экологическим изменениям, делая исследователей о том, что такие факторы, влияют на их работу и обеспечивая возможные решения (например, как небольшие изменения в агар влияет роятся 4,5 ). Кроме того, протокол предоставляетсяколичественно макроскопические аспекты роения, дает возможность измерять многие атрибуты бактериального роста поверхности, которые ранее были не поддается исчислению.
Мы не рассмотрели все поверхности подвижных бактерий в развитии этого протокола. Таким образом, можно ожидать, что изменения протокола будут необходимы для видов, не представленных здесь. Эффективность этого протокола ограничена ограничения, присущие оборудования и материалов, используемых. Например, исследования, связанные температуры не возможно еще с изображений станции Bruker, поскольку контроль температуры не является особенностью оборудования. Кроме того, использование красителей (например, красный Нила для окрашивания rhamnolipids) может иметь кинетические и концентрационные ограничения 8. Этот метод сильно зависит от обработки и анализа цифровых изображений; улучшена автоматизация анализа данных (например, с помощью дополнительных макросов функцию скрипта в ImageJ) позволит сократить время, необходимое для анализаи расширить полезность данных. Наконец, из-за надежности протокола изображений, будущие приложения должны быть направлены на расширение эту технику, чтобы изучить менее однородные поверхности роста, которые являются более актуальными для поверхностей, колонизированных окружающей среды и патогенных бактерий.
Раскрытие информации
Публикация сборы для данной статьи частично финансировалось Bruker Corporation.
Благодарности
Частичная поддержка этой работы была предоставлена Национальным институтом здоровья (R01GM100470 и 1R01GM095959-01A1; к МА и СДС) и гранта основной комплекс из Индианы клиническим и наук Институт (частично финансируется за счет NIH грант № UL1 TR000006; в JDS).
Материалы
| Name | Company | Catalog Number | Comments |
| Reagentsa | |||
| FAB Minimal Media: | Prepare every ~4 weeks. Top to 1 L with nanopure H2O. | ||
| (NH4)2SO4 | Sigma | A4418 | 2 g. Not used in P. aeruginosa tendril formation studies. |
| Na2HPO4 x 7H2O | Sigma-Aldrich | S9390 | 9 g |
| KH2PO4 | Sigma | P5655 | 3 g |
| NaCl | BDH | BDH8014 | 3 g |
| MgCl2 x 6H2O solution (198 g/L) | Fisher Scientific | M33 | 1 ml |
| CaCl2 x 2H2O solution (14 g/L) | Fisher Scientific | C79 | 1 ml |
| Trace metal solution (see below) | n/a | n/a | 1 ml |
| Trace Metal Solution: | Top to 1 L with nanopure H2O. Maintain in a glass bottle, stirring and covered with foil. | ||
| CaSO4 x 2H2O | Sigma-Aldrich | 255548 | 200 mg |
| MnSO4 x H2O | Sigma-Aldrich | M7634 | 20 mg |
| CuSO4 x 5H2O | Fisher Scientific | C493 | 20 mg |
| ZnSO4 x 7H2O | Sigma-Aldrich | Z4750 | 20 mg |
| CoSO4 x 7H2O | Sigma-Aldrich | C6768 | 10 mg |
| NaMoO4 x 2H2O | Sigma | S6646 | 10 mg |
| H3BO3 | Fisher Scientific | A74 | 5 mg |
| FeSO4 x 7H2O | Sigma-Aldrich | F7002 | 200 mg |
| CTT Media: | Prepare as needed. Top to 100 ml with nanopure H2O. | ||
| Tris-HCl, 1 M solution (adjust to pH 8.0) | Amresco | 0234 | 1 ml. Prepare a 1 M stock solution in nano pure H2O. Adjust pH to 8.0 and filter sterilize (0.2 μm pore). |
| K2HPO4, 1 M solution (adjust to pH 7.6) | Sigma-Aldrich | P3786 | 0.1 ml. Prepare a 1 M stock solution in nano pure H2O. Adjust pH to 7.6 and filter sterilize (0.2 μm pore). |
| MgSO4 solution | Fisher Scientific | M65 | 0.8 ml. Prepare a 1 M stock solution in nano pure H2O. Filter sterilize (0.2 μm pore). |
| Casitone | BD Diagnostics | 225930 | 1 g |
| Additional Reagents: | |||
| LB Broth, Lennox | BD Diagnostics | 240230 | 2% (wt/vol) |
| D-(+)-Glucose | Sigma-Aldrich | G5767 | 30 mM for overnight broth cultures; 12 mM for swarm media. Prepare a 1.2 M filter sterilized stock solution in nano pure H2O. Add to media after autoclaving. |
| Casamino acids (CAA) | Amresco | J851 | 0.10% (wt/vol). Recommended for P. aeruginosa tendril formation studies. Add to media prior to autoclaving. |
| Agar, Noble | Sigma-Aldrich | A5431 | 0.45% (wt/vol). Preferred Noble agar for P. aeruginosa surface motility studies. Add to media prior to autoclaving. |
| Agar, Noble | Affymetrix | 10907 | 1.50% (wt/vol). Used in M. xanthus surface motility studies. Not recommended for P. aeruginosa motility studies. Add to media prior to autoclaving. |
| Agar, Granulated | Fisher Scientific | BP1423 | 0.60% (wt/vol) |
| Higgins Waterproof Black India Ink | Higgins | HIG44201 | 0.50% (vol/vol). Mix ink with inoculum to test swarm media surface moisture. |
| SYTO® 64 Red Fluorescent Nucleic Acid Stain | Invitrogen | S-11346 | Use 4 μl (for P. aeruginosa) or 8 μl (for M. xanthus) of SYTO® 64 per 100 ml of molten agar (added after autoclaving). |
| Relevant Materials and Equipment | |||
| Petri dish, sterile, 150 mm x 15 mm (Dia. x H) | VWR | 25384-326 | |
| Petri dish, sterile, 100 mm x 15 mm (Dia. x H) | VWR | 25384-342 | |
| Petri dish, sterile, 60 mm x 15 mm (Dia. x H) | VWR | 25384-092 | |
| In-Vivo Xtream | Bruker | Use for the macroscopic imaging of surface motility studies. http://www.bruker.com/products/preclinical-imaging/opticalx-ray-imaging/in-vivo-xtreme/overview.html | |
| Bruker MI software | Bruker | http://www.bruker.com/fileadmin/user_upload/8-PDF-Docs/PreclinicalImaging/Brochures/MI-software-brochure.pdf | |
| ImageJ software | NIH | http://imagej.nih.gov/ij/ | |
| aSee MSDS of reagents for handeling and disposal information. | |||
Ссылки
- Kearns, D. B. A field guide to bacterial swarming motility. Nature Reviews: Microbiology. 8 (9), 634-644 (2010).
- Burall, L. S., et al. et al.Proteus mirabilis. genes that contribute to pathogenesis of urinary tract infection: Identification of 25 signature-tagged mutants attenuated at least 100-fold. Infection and Immunity. 72 (5), 2922-2938 (2004).
- Shrout, J. D., et al. The impact of quorum sensing and swarming motility on Pseudomonas aeruginosa. biofilm formation is nutritionally conditional. Mol Microbiol. 62 (5), 1264-1277 (2006).
- Kamatkar, N. G., Shrout, J. D. Surface hardness impairment of quorum sensing and swarming for Pseudomonas aeruginosa. PLoS One. 6 (6), e20888 (2011).
- Tremblay, J., Déziel, E. Improving the reproducibility of Pseudomonas aeruginosa. swarming motility assays. Journal of Basic Microbiology. 48 (6), 509-515 (2008).
- Caiazza, N. C., Shanks, R. M., O'Toole, G. A. Rhamnolipids modulate swarming motility patterns of Pseudomonas aeruginosa. Journal of Bacteriology. 187 (21), 7351-7361 (2005).
- Du, H., et al. High density waves of the bacterium Pseudomonas aeruginosa. in propagating swarms result in efficient colonization of surfaces. Biophysical Journal. 103 (3), 601-609 (2012).
- Morris, J. D., et al. Imaging and analysis of Pseudomonas aeruginosa. swarming and rhamnolipid production. Appl Environ Microbiol. 77 (23), 8310-8317 (2011).
- Tremblay, J., Richardson, A. P., Lépine, F., Déziel, E. Self-produced extracellular stimuli modulate the Pseudomonas aeruginosa. swarming motility behaviour. Environmental Microbiology. 9 (10), 2622-2630 (2007).
- Partridge, J. D., Harshey, R. M. Swarming: flexible roaming plans. J Bacteriol. 195 (5), 909-918 (2013).
- Patrick, J. E., Kearns, D. B. Laboratory strains of Bacillus subtilis .do not exhibit swarming motility. Journal of Bacteriology. 191 (22), 7129-7133 (2009).
- . . Molecular Imaging. , (2014).
- Harshey, R. M., Matsuyama, T. Dimorphic transition in Escherichia coli. and Salmonella typhimurium.: surface-induced differentiation into hyperflagellate swarmer cells. Proceedings of the National Academy of Sciences, USA. 91 (18), 8631-8635 (1994).
- Rashid, M. H., Kornberg, A. Inorganic polyphosphate is needed for swimming, swarming, and twitching motilities of Pseudomonas aeruginosa. Proc Nat Acad Sci U.S.A.. 97 (9), 4885-4890 (2000).
- Caiazza, N. C., Merritt, J. H., Brothers, K. M., O'Toole, G. A. Inverse regulation of biofilm formation and swarming motility by Pseudomonas aeruginosa. PA14. Journal of Bacteriology. 189 (9), 3603-3612 (2007).
- Kuchma, S. L., et al. Cyclic-di-GMP-mediated repression of swarming motility by Pseudomonas aeruginosa.: the pilY1. gene and its impact on surface-associated behaviors. J Bacteriol. 192 (12), 2950-2964 (2010).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены