Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Трансфекции генов к сфероида клетки на Micropatterned культуры Плиты для генетически модифицированной клеточной трансплантации
В этой статье
Резюме
This protocol describes a cell transplantation system using genetically modified, injectable spheroids. Cell spheroids are cultured on micropatterned culture plates and recovered after gene introduction using polyplex nanomicelles. This system facilitates prolonged transgene expression from the transplanted cells in host animals while maintaining the innate function of the cells.
Аннотация
Для улучшения терапевтической эффективности трансплантации клеток, был разработан трансплантации система генетически модифицированных, инъекционных сфероидов. Клеточные сфероиды получают в культуральной системе на micropatterned планшетах, покрытых термочувствительного полимера. Количество сфероидов образуются на пластинах, соответствующие клеточной адгезии областей диаметром 100 мкм, которые регулярно расположенных в виде матрицы двумерной образом, в окружении без липких участков, которые покрыты с помощью полиэтиленгликоля (ПЭГ) матрицы. Сфероиды могут быть легко восстановлены в виде жидкой суспензии путем понижения температуры пластин и их структура находится в хорошем состоянии, пропуская их через инъекционных игл с достаточно крупного калибра (более 27 г). Генетическая модификация достигается с помощью оригинальной невирусный носитель гена, Polyplex nanomicelle, который способен введения генов в клетки, не нарушая структуру сфероид с помощью генной трансфекции. Для чопорнойичных гепатоцитов сфероиды, трансфицированные геном люциферазы, экспрессирующих, люциферазы устойчиво получены в трансплантированных животных, наряду с сохраненной функцией гепатоцитов, как указано альбумина выражения. Эта система может быть применена к различным типам клеток, включая мезенхимальных стволовых клеток.
Введение
Клеточная трансплантация терапия привлекла широкое внимание для лечения различных заболеваний неразрешимыми. Активность и период полураспада биологически активных факторов, которые секретируются трансплантированных клеток необходимы для улучшения терапевтической эффективности системы трансплантации клеток. Генетической модификации клеток перед трансплантацией является полезным технику, чтобы регулировать и управлять клеточные функции, в том числе секреции биологически активных факторов. Важно также, чтобы поддерживать благоприятный микроокружение для клеток для предотвращения гибели клеток или потерю активности клеток. Трехмерная культура (3D) сфероид клеток, в которых клетки к клетке взаимодействия хорошо сохранились, является перспективным для этой цели, например, для улучшения альбумина секрецию первичных гепатоцитов и продвижения нескольких клонов дифференцирование от мезенхимальных стволовых клеток (МСК ) 1-7.
В этом исследовании, новая комбинация система spheroiд культура и трансфекция гена используется в качестве платформы для трансплантации генетически модифицированных клеток. Для создания сфероидами клетки, сфероид система культуры на micropatterned культуры пластин используется. На этих пластин, клеточной адгезии участки диаметром 100 мкм регулярно выстроены в двумерном виде и окружены без липких участков, покрытых матрицей ПЭГ 3. По посева достаточное количество клеток, массивы 3D сфероидов 100 мкм в диаметре образуются соответствующий micropatterned культурном слое.
Сфероиды восстановлены без нарушения их 3D структуры с помощью термочувствительных клеток культуральных планшетах, которые были покрыты термочувствительный полимер, поли (изо-пропилакриламид) (PIPAAm) 8-10. Micropatterned архитектура построена на термочувствительных пластин (изготовленный на заказ). Просто снижение температуры пластин, сфероиды отделен от кровати культуры и дисперсныхд в фосфатном буферном растворе (PBS). Таким образом, большое количество сфероидов с одинаковым размером 100 мкм могут быть получены в виде инъецируемой суспензии.

Рисунок 1. Схематическое изображение системы культуры сфероидов на micropatterned пластины. Генетическое изменение достигается путем трансфекции генов с использованием оригинального невирусный носитель гена, Polyplex nanomicelle. Он состоит из плазмидной ДНК (пДНК) и полиэтиленгликоль (ПЭГ) -polycation блоксополимеров 11. Они имеют характерный ядро-оболочка структуру, состоящую из оболочки ПЭГ и внутреннего ядра конденсированного пДНК, позволяющую безопасное и эффективное внедрение гена в клетках в терапевтических целях 11. Пожалуйста, нажмите здесь, чтобы посмотреть увеличенную версию Тхис фигурой.
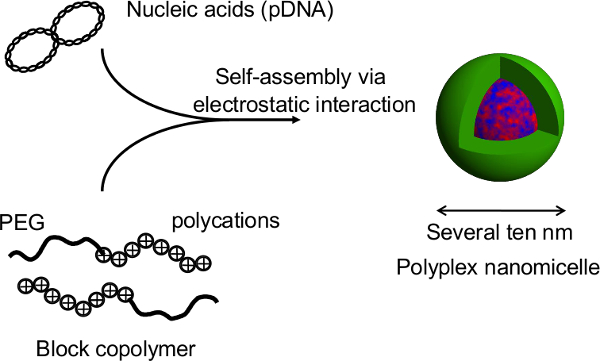
Рисунок 2. Структура POLYPLEX nanomicelle образованного комплекса нуклеиновых кислот и ПЭГ-блок-сополимеров поликатион. В этом исследовании, основное преимущество этого метода в том, что структура сфероид не нарушается во время трансфекции генов со стороны nanomicelles. После nanomicelle-опосредованной трансфекции крыс сфероидов первичной гепатоцитов, длительное трансгенная экспрессия получается более чем за месяц с непрерывным секреции альбумина из гепатоцитов на уровне, сопоставимым с нетрансфицированных сфероидов 12. Выражение трансген и секреции альбумина из сфероидов также сохраняется после выхода из термочувствительной пластины. Очевидно, что можно смело nanomicelles облегчить введение гена без ухудшения врожденные функции ГПУatocytes. Таким образом, сочетание сфероидных клеток, культивируемых на термочувствительных пластин с micropatterned введение гена с использованием nanomicelles является перспективной платформой для трансплантации генетически модифицированных клеток. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Access restricted. Please log in or start a trial to view this content.
протокол
Все исследования на животных проводились с одобрения по уходу и использованию комитета животных университета Токио, Токио, Япония.
1. Сотовый Подготовка
- Для первичных гепатоцитов, следовать протоколу для изоляции гепатоцитов крысы с помощью модифицированного двухступенчатого процесса коллагеназы пищеварения 13,14.
- Обезболить Спрэг Dawley (SD) крыс (самцов, в возрасте 5 недель) при ингаляционной анестезии с изофлуран. Поместите крысу в камеру, соединенную с анестезии машины, чтобы обеспечить изофлуран для камеры. Выньте крысу после засыпания, и установить его на рабочем столе с помощью вентиляции маску. Управление ИФ течь примерно в 0,4 - 0,7 л / мин, проверяя условия крысы. Заливать печени Sprague Dawley (SD) крыс (самцы, возраст 5 недель) от печеночной воротной вены с помощью специального раствора, состоящего из 8 г / л хлорида натрия (NaCl), 400 мг / л хлорида калия (KCl), 78 мг / лнатрия дигидрофосфат дигидрат (NaH 2 PO 4 · 2H 2 O), 151 мг / л гидрофосфат динатрия додекагидрат (Na 2 HPO 4 · 12H 2 O), 2,38 г / л 2- [4- (2-гидроксиэтил) -1 пиперазинил] этансульфоновой кислоты (HEPES), 190 мг / л этиленгликоль этилендиаминтетрауксусной кислоты (EGTA), 350 мг / л гидрокарбоната натрия (NaHCO 3), и 900 мг / л глюкозы.
- Распространить коллагеназы решение через печень.
Примечание: раствор состоит из 500 мг / л коллагеназы, 9,8 г / буферный солевой L Хэнка, 2,38 г / мл HEPES, 556 мг / мл гидрата хлорида кальция (CaCl 2 · H 2 O), 350 мг / л NaHCO 3, и 50 мг / л ингибитора трипсина, с рН доводили до 7,2. - Удалить печень тщательно, фарш, аккуратно на блюдо скальпелем лезвия, добавить Модифицированный Игла среде Игла (DMEM) с добавлением 10% фетальной бычьей сыворотки (FBS), и фильтр клеточной суспензии через 100 мкмнейлоновая сетка. Чтобы удалить дополнительный мусор, центрифугирование клеточной суспензии в 20 × г в течение 1 мин. На этом этапе, гепатоциты в надосадочной жидкости.
- Повторите шаг центрифугирования дважды (всего три центрифугирования). Наконец, центрифугировать гепатоциты при 50 × г в течение 3 мин, чтобы восстановить их в виде гранул.
- Повторное приостановить гепатоциты до концентрации 4 × 10 5 клеток / мл в специальной питательной среде, состоящей из DMEM, дополненной 10% FBS, 1% Pen-Strep-GLUT (PSQ), 1% диметилсульфоксид (ДМСО), 0,1 мкмоль / л дексаметазона, 0,5 мкг / мл инсулина, 10 ммоль / л никотинамида, 0,2 ммоль / л аскорбиновой кислоты фосфорилируется (ASC-2P), и 10 нг / мл человеческого эпидермального фактора роста (hEGF) 15. Эта специальная среда является обязательным для сохранения функции печени в условиях в пробирке.
- Для получения крыс МСК, усыпить Спрэг Dawley (SD) крыс (самцов, в возрасте 5 недель) чрезмерной администрации isoflurане. Резекцию бедренной кости и большеберцовые кости, и собирать кости кабачки, вставив 22 G иглу в тело кости, чтобы очистить его с 10 мл DMEM с добавлением 10% FBS. Сбор клеток путем фильтрации через нейлоновое сито 100 мкм.
- Семенной клеток на 10 см культуры блюд с использованием DMEM, содержащей 10% FBS и 1% пенициллина / стрептомицина. Для сфероидных экспериментов, использовать МСК в течение 5 ходов.
2. Подготовка 3D Сотовые сфероидов
- Коммерчески получить micropatterned культуральных планшетах, на котором липкие участки клеток регулярно выстроенных в диаметре 100 мкм в двумерной образом, в окружении без липких участков, покрытых матрицей ПЭГ.
ПРИМЕЧАНИЕ: Для трансплантации клеток, дополнительное покрытие с термочувствительным полимерной PIPAAm необходимо, чтобы мобильный отряд охлаждением пластин (см шаг 5.1). Температурные колебания могут вызвать изменения в химии этого полимера8-10. При 37 ° С, PIPAAm слегка гидрофобными, позволяя клеткам можно культивировать при нормальных условиях. Снижение температуры ниже 32 ° С приводит к быстрой гидратации полимера, что приводит к спонтанному отряда клеток. - Семенной гепатоцитов или МСК на 12-луночные планшеты при micropatterned плотности 4 × 10 5 клеток / лунку andincubate их при 37 ° С в увлажненной атмосфере, содержащей 5% CO 2. Клетки будут накапливаться на micropatterned областях адгезии и постепенно образуют круглые сфероидов в течение 2 дней.
Примечание: Для получения контрольных клеток в монослойной культуре, использовать обычные пластины 12 а и семян клетки при одинаковой плотности, Согласно методике, как описано выше.
3. Подготовка Polyplex Nanomicelles
- Синтезировать блок-сополимер, ПЭГ-PASP (DET) (поли [N '- [N - (2-аминоэтил) -2-аминоэтил] aspartamide]) (ПЭГ Mw = 12,000, степень полимеризации (СП) от PASP (DET) сегмента = 59), и гомополимер, который состоит из единственного катионного сегменте [PASP (DET)] (DP = 55), в соответствии с процедурами, описанными ранее авторами 11, 16, 17.
- Приготовить смешанный раствор ПЭГ-PASP (DET) блок-сополимера и PASP (DET) гомополимер на равном молярном соотношении остаточных аминогрупп в 10 мМ HEPES буфере (рН 7,3) с доведением концентрации полимера до 33,3 мкг / мл и 19,1 мкг / мл, соответственно.
Примечание: Концентрации полимера, описанные выше, репрезентативные значения для приготовления nanomicelles с остаточным молярном соотношении всех аминогрупп в двух полимеров к фосфатных групп в пДНК (N / P) отношение числа 10. N соотношение / P может изменяться в зависимости от типа клеток и цели (подробнее см Обсуждение). Комбинированное использование двух полимеров можно добиться как эффективного экранирования ПЭГ и функционирование PASP (DET) для повышения эндосомныеизбежать (подробнее см обсуждения) 18. - Подготовка кодирующий пДНК Gaussia люциферазы, GL4 люциферазы, или эритропоэтин путем клонирования, выражающее соответствующие гены в плазмиды pCAG-GS сегмент (http://www.cdb.riken.jp/pcs/protocol/vector/map/m36.html ), чтобы получить выражение под CAG промотор / энхансер с использованием коммерческого набора в соответствии с протоколом производителя. Усилить пДНК в компетентный штамм кишечной палочки и очистить его с помощью плазмиды системы очистки ДНК эндотоксина. Определить концентрацию пДНК при поглощении 260 нм, чтобы получить 150 мкг решение / мл в 10 мМ HEPES буфере (рН 7,3).
- Для приготовления POLYPLEX nanomicelles, тщательно перемешать раствор плазмидной (150 мкг / мл в 10 мМ HEPES буфере) и предварительно смешанный раствор двух полимеров в соотношении 2: 1 (по объему).
4. трансфекции генов в сфероидов
- Инкубируйте клетки (гепатоцитыили МСК) в течение 72 часов после посева на micropatterned пластин, чтобы обеспечить формирование зрелых сфероидов. Для трансфекции генов, добавьте 100 мкл раствора Polyplex nanomicelle (содержащие 10 мкг плазмидной) в каждую лунку, после замены культуральной среды в 1 мл свежей среды. Продолжить инкубации с nanomicelle решения в течение 24 часов.
- Для управления с использованием липидной основе реагента для трансфекции, смешать растворы плазмидной с реагентом при массовом соотношении реагентов / плазмидной из 3. Установите последней дозы плазмидной быть одинаковыми для обоих липидов на основе реагента и методов nanomicelle.
5. Восстановление и Трансплантация Сотовые сфероидов
- Заменить культуральную среду со 200 мкл охлажденного PBS и место пластины на льду.
Примечание: В общем случае, сфероиды могут отделить примерно 15 мин и могут быть восстановлены в виде суспензии для трансплантации. - Осторожно аспирации клеток в 200 мклподвески с помощью шприца с 23 г или 27 г иглы для инъекций в естественных условиях.
6. Оценка экспрессии трансгена
- Для оценки ин витро экспрессии люциферазы Gaussia секретируемого в культуральную среду, собирают 50 - 100 мкл среды точно 24 часа после замены свежей средой. Оцените люциферазы выражение, используя коммерческий рениллы люциферазы системы анализа и люминометра в соответствии с протоколом производителя.
ПРИМЕЧАНИЕ: Gaussia люциферазы остается стабильным в культуральной среде в течение более чем недели. Таким образом, для оценки эффективности в реальном времени выражения трансгенов, замените носитель свежей одного до сбора образца среды. Сроки смены среды могут быть гибкими. - Для оценки в естественных условиях выражения трансгенов в животных-хозяев после трансплантации клеток, обезболить BALB / C мышей (ню женщина; 7 недельстарый) под ингаляционной анестезии с изофлуран.
- Поместите мышь в камере, соединенной с машиной анестезии, чтобы обеспечить изофлуран для камеры. Выньте мыши после засыпания, и установить его на рабочем столе с помощью вентиляции маску. Управление ИФ течь примерно в 0,2 - 0,5 л / мин, проверяя условия мыши.
- Вводят 200 мкл клеточной суспензии, содержащей сфероидов, трансфицированных GL4 люциферазы экспрессирующих плазмидной (как описано в 4.1) в подкожную ткань в области живота.
- Сразу после введения D-люциферин (150 мг / кг; внутривенное маршрут), измерения люциферазы выражение, используя систему визуализации ИВИС в соответствии с протоколом производителя.
- Для оценки терапевтических эффектов клеточной трансплантации, инъекции 200 мкл клеточной суспензии, содержащей сфероидов, трансфицированных эритропоэтина, кодирующий плазмидной вподкожной клетчатки в области живота.
- Соберите образцы крови от подчелюстной кровотечения, чтобы получить примерно 200 мкл крови 19. Измерить гемоглобина и гематокрита с использованием анализатора образца крови.
Примечание: количество клеток для трансплантации регулируется числа высевают на пластинах. К сожалению, это трудно определить точное число клеток, потому что номер внутри сфероидов не может быть измерена.
- Соберите образцы крови от подчелюстной кровотечения, чтобы получить примерно 200 мкл крови 19. Измерить гемоглобина и гематокрита с использованием анализатора образца крови.
- После экспериментов, не размещать мышей на грелку, связанной с регулятором температуры до пробуждения от наркоза.
Access restricted. Please log in or start a trial to view this content.
Результаты
Трансфекции генов в Gaussia люциферазы экспрессирующих плазмидной проводили в сфероидов, образованных гепатоцитов или МСК с использованием POLYPLEX nanomicelles или управления на основе липидов трансфекции реагента 12. В nanomicelles не индуцируется почти никаких изменений в структуре сфероида с?...
Access restricted. Please log in or start a trial to view this content.
Обсуждение
В этом протоколе важно поддерживать 3D структуру сфероидов на этапах введения гена и восстановления сфероида. Это имеет важное значение для поддержания благоприятных микросреды для клеток, чтобы избежать гибели клеток или потерю активности клеток. Например, альбумин секреции, предста...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
The authors declare that they have no competing financial interests.
Благодарности
Мы глубоко ценим доктора Такеши Икея и технический персонал в Toyo Gosei, Токио, Япония для обеспечения термочувствительных micropatterned культуры пластины, а также научные рекомендации. Мы также благодарим г-жу Satomi Огура, г-жа Sae Судзуки, г-Аска Миеси и г-жу Katsue Морий для оказания технической помощи с экспериментами на животных. Эта работа была выполнена при финансовой поддержке в части по ЯОРН KAKENHI Грант-в-помощь для научных исследований, Центр инноваций (ИСП) Программы и S-инновационной программы от Японии науки и технологий агентства (JST), и ЯОРН core- к основной программе, А. перспективных исследовательских сетей.
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| Pen-Strep-Glut | GIBCO | ||
| Dexamethasone | Wako Pure Chemical Industries | 041-18861 | |
| Nicotinamide | Wako Pure Chemical Industries | 141-01202 | |
| Hank’s buffered salt and L-ascorbic acid 2-phosphate (Asc-2P) | Sigma-Aldrich | A8960 | |
| Human epidermal growth factor (hEGF) | Toyobo | PT10015 | |
| Cell-able multi-well plates | Toyo Gosei | PP-12 | |
| Thermosensitive cell culture plates (Upcell) | CellSeed Inc | The micropatterned architecture is constructed on the thermosensitive plates (custom-built by Toyo Gosei) | |
| Lipid-based transfection reagent (FuGENE HD) | Promega | E2311 | |
| Renilla Luciferase Assay System | Promega | E2810 | |
| pGL4 Luciferase Reporter Vector | Promega | E6651 | |
| pDNA expressing Gaussia luciferase | New England BioLabs | N8082S | |
| Mouse erhthropoietin-expressing vector | Origene | MC208445 | |
| pCAG-GS | Kindly provided by Laboratory for Pluripotent Cell Studies, Center for Developmental Biology, RIKEN | ||
| Escherichia coli DH5α competent cells | Takara | 9057 | |
| Endotoxin-free plasmid DNA purification system | Nippon Genetics | NucleoBond Xtra EF | |
| Collagenase | Wako Pure Chemical Industries | 639-00951 | |
| Trypsin inhibitor | GIBCO | R-007-100 | |
| Luminometer | Promega | GloMax™ 96 Microplate Luminometer | |
| IVIS Imaging System | Xenogen Corp. | Xenogen IVIS Spectrum in vivo imaging system | |
| Blood sample analyzer | Sysmex | pocH-100i Automated Hematology Analyzer |
Ссылки
- Landry, J., Bernier, D., Ouellet, C., Goyette, R., Marceau, N. Spheroidal aggregate culture of rat liver cells: histotypic reorganization, biomatrix deposition, and maintenance of functional activities. J Cell Biol. 101 (3), 914-923 (1985).
- Yuasa, C., Tomita, Y., Shono, M., Ishimura, K., Ichihara, A. Importance of cell aggregation for expression of liver functions and regeneration demonstrated with primary cultured hepatocytes. J Cell Physiol. 156 (3), 522-530 (1993).
- Otsuka, H., et al. Two-dimensional multiarray formation of hepatocyte spheroids on a microfabricated PEG-brush surface. Chembiochem. 5 (6), 850-855 (2004).
- Wang, W., et al. 3D spheroid culture system on micropatterned substrates for improved differentiation efficiency of multipotent mesenchymal stem cells. Biomaterials. 30 (14), 2705-2715 (2009).
- Bartosh, T. J., et al. Aggregation of human mesenchymal stromal cells (MSCs) into 3D spheroids enhances their antiinflammatory properties. Proc Natl Acad Sci U S A. 107 (31), 13724-13729 (2010).
- Frith, J. E., Thomson, B., Genever, P. G. Dynamic three-dimensional culture methods enhance mesenchymal stem cell properties and increase therapeutic potential. Tissue Eng Part C Methods. 16 (4), 735-749 (2010).
- Nakasone, Y., Yamamoto, M., Tateishi, T., Otsuka, H. Hepatocyte spheroids underlayered with nonparenchymal cells for biomedical applications. IEICE Transactions on Electronics. E94, 176-180 (2011).
- Nishida, K., et al. Corneal reconstruction with tissue-engineered cell sheets composed of autologous oral mucosal epithelium. N Engl J Med. 351 (12), 1187-1196 (2004).
- Ohashi, K., et al. Engineering functional two- and three-dimensional liver systems in vivo using hepatic tissue sheets. Nat Med. 13 (7), 880-885 (2007).
- Sekine, H., et al. Cardiac cell sheet transplantation improves damaged heart function via superior cell survival in comparison with dissociated cell injection. Tissue Eng Part A. 17 (23-24), 2973-2980 (2011).
- Itaka, K., Kataoka, K. Progress and prospects of polyplex nanomicelles for plasmid DNA delivery. Curr Gene Ther. 11 (6), 457-465 (2011).
- Endo, T., Itaka, K., Shioyama, M., Uchida, S., Kataoka, K. Gene transfection to spheroid culture system on micropatterned culture plate by polyplex nanomicelle: a novel platform of genetically-modified cell transplantation. Drug Deliv and Transl Res. 2 (5), 398-405 (2012).
- Howard, R. B., Christensen, A. K., Gibbs, F. A., Pesch, L. A. The enzymatic preparation of isolated intact parenchymal cells from rat liver. J Cell Biol. 35 (3), 675-684 (1967).
- Berry, M. N., Friend, D. S. High-yield preparation of isolated rat liver parenchymal cells: a biochemical and fine structural study. J Cell Biol. 43 (3), 506-520 (1969).
- Tateno, C., Yoshizato, K. Long-term cultivation of adult rat hepatocytes that undergo multiple cell divisions and express normal parenchymal phenotypes. Am J Pathol. 148 (2), 383-392 (1996).
- Kanayama, N., et al. A PEG-based biocompatible block catiomer with high buffering capacity for the construction of polyplex micelles showing efficient gene transfer toward primary cells. ChemMedChem. 1 (4), 439-444 (2006).
- Itaka, K., Ishii, T., Hasegawa, Y., Kataoka, K. Biodegradable polyamino acid-based polycations as safe and effective gene carrier minimizing cumulative toxicity. Biomaterials. 31 (13), 3707-3714 (2010).
- Uchida, S., et al. PEGylated Polyplex With Optimized PEG Shielding Enhances Gene Introduction in Lungs by Minimizing Inflammatory Responses. Mol Ther. 20 (6), 1196-1203 (2012).
- Golde, W. T., Gollobin, P., Rodriguez, L. L. A rapid, simple, and humane method for submandibular bleeding of mice using a lancet. Lab Anim (NY). 34, 39-43 (2005).
- Uchida, S., et al. An injectable spheroid system with genetic modification for cell transplantation therapy. Biomaterials. 35 (8), 2499-2506 (2014).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены