Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
В режиме реального времени мониторинг реакций осуществляется с помощью обработки прямоточного: Получение 3-Acetylcoumarin как пример
В этой статье
Резюме
Мониторинг в режиме реального времени позволяет быстро оптимизации реакций, выполненных с использованием обработки непрерывного потока. Здесь Получение 3-acetylcoumarin используется в качестве примера. Устройство для выполнения на месте мониторинг комбинационного описано, как и шаги, необходимые для оптимизации реакции.
Аннотация
При использовании встроенного мониторинга, можно оптимизировать реакцию проводили с использованием обработки проточной простым и быстрым способом. Можно также для обеспечения высокого качества продукта с течением времени с помощью этой техники. Мы здесь, показывают, как взаимодействовать коммерчески доступный блок потока с помощью спектрометра комбинационного рассеяния. Проточную кювету комбинационного помещается после регулятора обратного давления, что означает, что он может работать при атмосферном давлении. Кроме того, тот факт, что поток продукта проходит через систему трубок перед входом в проточную кювету означает, что материал при комнатной температуре. Важно, что спектры приобретаются под изотермических условиях, так как интенсивность сигнала комбинационного зависит от температуры. Собрав аппарат, мы затем показать, как контролировать химическую реакцию, пиперидин-катализированного синтеза 3-acetylcoumarin из салицилового альдегида и этилацетоацетатом используется в качестве примера. Реакция может быть выполнена в диапазоне от дебитаD температуры, средство мониторинга на месте используется для оптимизации условий просто и легко.
Введение
С помощью обработки непрерывного потока, химики обнаружили, что они могут выполнять ряд химических реакций безопасно, эффективно и с легкостью 1,2. В результате, химия потока оборудование становится неотъемлемым инструментом для работы как в реакции промышленных установок, а также научно-исследовательские лаборатории в академических учреждениях. Широкое разнообразие синтетических превращений химических были проведены в реакторах потока 3,4. В некоторых случаях, реакции, которые не работают в периодическом было показано, что гладко в условиях прямоточного 5. Для обоих оптимизации реакции и контроля качества, внедрение мониторинга реакции в линию с обработкой потока обеспечивает значительные преимущества. В он-лайн мониторинга обеспечивает непрерывный анализ в режиме реального времени ответ на реальных условиях выборок. Это быстрее и, в некоторых случаях, более надежны, чем аналогичные офф-лайн методов. Ряд в линию аналитических методов были сопряжены с Fнизкие реакторы 7. Примеры включают в себя инфракрасные 8,9, УФ-видимой 10,11, 12,13 ЯМР, спектроскопии комбинационного рассеяния света 14,15 и 16,17 масс-спектрометрии.
Наша исследовательская группа сопряжена спектрометр комбинационного а с научной микроволновой блока 18. Используя это, диапазон реакций контролировались как с качественной и количественной 19 20 точки зрения. Основываясь на этом успехе, мы недавно сопряжена наш комбинационного спектрометра с одним из наших подразделений непрерывного потока и использовали ее для поточного мониторинга реакции ряда ключевых медицински значимых органических преобразований. 21 В каждом случае можно было следить за Реакции, а также в одном примере, с помощью калибровочной кривой, мы смогли определить преобразование продукта из спектральных данных комбинационного рассеяния. В Здесь мы опишем, как настроить аппарат и использовать его для контроля реакции. Мы используем пиперидин-катализированного синтеза 3-ACetylcoumarin (1) салицилальдегида с этилацетоацетатом (рис 1) в качестве модельной реакции здесь.
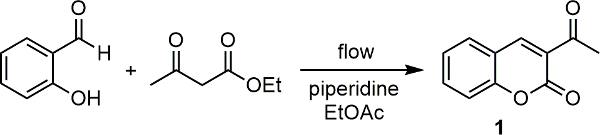
Рисунок 1. Базовая катализируемой реакции конденсации между салицилальдегида и этилацетоацетатом с получением 3-acetylcoumarin (1). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
протокол
1. Найти соответствующие сигналы для мониторинга реакций
- Получение спектров комбинационного рассеяния для всех исходных материалов и продукта.
- Перекрытие спектров и определить интенсивную полосу, что является уникальным для продукта.
- Используйте этот комбинационного группу, чтобы следить за ходом реакции. Полоса при 1608 см -1 был выбран в данном случае.
2. Установите измерительную ячейку
- Получить подходящую ячейку. Здесь использовать один со следующими размерами: ширина 6,5 мм, высота 20 мм, а длина пути 5 мм (фиг.2А).
- Поместите измерительную ячейку в контейнере, который предоставляет среду, свободную от окружающего света.
- Подключение трубопроводов к входным и выходным проточной ячейки (в данном случае 1 мм ID PFA трубки).
3. Интерфейс КРС спектрометр с Проточная ячейка
- Получить подходящую комбинационного спектрометра с гибким оптического блока, который может быть помещен в Cпотерять близость к проточной ячейке.
- Поместите оптического блока через отверстие соответствующего размера в коробке, содержащей проточную кювету в сборе (Фигура 2В).
- Слайд оптический узел, пока он не коснется проточную ячейку, а затем вытащить его обратно, оставляя зазор ~ 2 мм.
- Заполните измерительную ячейку с 100% -ным ацетоном.
- Включите спектрометра комбинационного и приобрести спектров в режиме непрерывного сканирования.
- Фокус лазер, осторожно двигая световода фракцию в то время. Продолжайте двигаться в световод, пока сигнал не достигнет своей наибольшей интенсивности и пики острые и хорошо определены.

Рисунок 2. (А) Проточная ячейка и интерфейс (Б) комбинационного используется. Пожалуйста, нажмите здесь, чтобы посмотреть больше веrsion этой фигуры.
4. Подготовьте реагент и растворитель Solutions
- Добавить салицилового альдегида (6,106 г, 50 ммоль, 1 экв) и этилацетоацетат (6,507 г, 50 ммоль, 1 экв) в 50 мл мерную колбу.
- Добавляют этилацетат до общего объема 50 мл, а затем тщательно перемешать содержимое.
- Передача 10 мл аликвоты исходного раствора в стеклянную пробирку, содержащую 20 мл магнитной мешалкой. Добавьте описание этого флакона "Реагент".
- В бутылке месте 100 мл 90 мл этилацетата. Добавьте эту бутылку "растворитель". В бутылке месте 100 мл 90 мл ацетона. Добавьте эту бутылку "растворитель перехват".
5. Подготовьте аппарат проточного
- Убедитесь, что устройство потока имеет, по меньшей мере двух насосов и маркировать их "P1" и "P2". Определить растворителей и реагентов линии на входе для каждого насоса. Поместите выхода линии от «собирать» и «Отходы» линий в двух яndividual 100 мл бутылки с надписью "продукт" и "отходы", соответственно.
- В реактор, использовать 10 мл емкость PFA катушку, способную нагревать.
- Подключение трубки выхода P1 к входу в реактор катушки PFA.
- Установите три порта полиэфирэфиркетон (PEEK) Ти-смеситель после катушки реактора.
- Подключите трубку выхода P2 на тройник-смеситель, 180 ° от выхода трубы реактора катушки. Подключите кусок трубы к третьему порту Tee-смеситель. На другом конце этой трубки разместить регулятор обратного давления.
- Подключение линии с выхода регулятора обратного давления на входе в проточную ячейку. Подключите линию от выхода проточной ячейки с «отходами / собирать" переключателя.
- Председатель растворитель линии для обоих Р1 и Р2, а также линии для P1 реагента с растворителем. Перемещение линии реагентов для Р1 из бутылки растворителя к бутылке реагента.
- Использование P1, пройти этилацетат через реакторКатушка в 2 мл / мин, пока не будет заполнена. Проход через ацетон Р2 при скорости потока 2 мл / мин в течение 2 мин.
- Регулировка скорости потока растворителя для обоих P1 и P2 на 1 мл / мин. Установите регулятор обратного давления до давления 7 бар. Установите температуру реактора катушки до желаемой температуры.
- Дважды проверьте оборудование настроено, как показано на схеме на рисунке 3.
- После того, как система достигает постоянной температуры и давления, проверить на герметичность, а затем запустить реакцию.
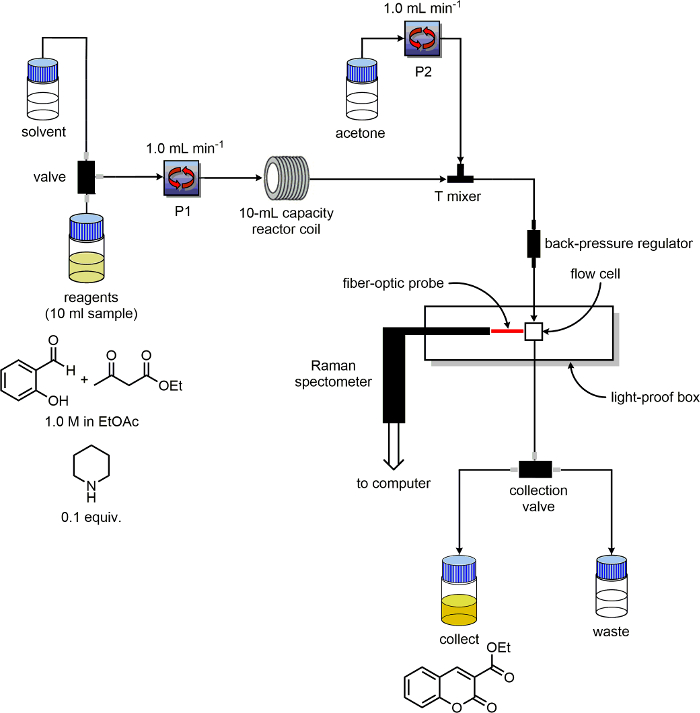
Рисунок 3. Схема конфигурации оборудования, используемого для экспериментов по мониторингу реакция. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
6. Мониторинг реакции
- ТакEA фон сканирование этилацетат / ацетон системы растворителей, как он прошел через проточную ячейку. Это будет автоматически вычитают из всех последующих проверках.
- Настройка спектрометра принимать проверяет каждый 15 сек (в данном случае спектрометр комбинационного был установлен на 10 сек времени интегрирования, Boxcar = 3, и средний = 1).
- Вводите пиперидин (0,05 мл, 0,05 ммоль, 0,1 экв) все сразу в стеклянном флаконе с надписью "Реагент".
- После тщательного перемешивания, переключатель П1 от "растворитель", чтобы "Реагент". Установите поток выхода на "собирать".
- Когда весь материал полностью загружен, переключатель П1 от "реагента" обратно в "растворителе." Продолжить течет растворителя через катушку реактора в течение еще 30 мин. После истечения этого времени, выключить отопление.
- Включите насосы P1 и P2 выключен, когда температура реактора катушка охлаждается ниже 50 ° C.
7. Анализ данных
- Экспорт данных спектрометра комбинационного в электронную таблицу и участок комбинационного интенсивности при 1608 см -1 по сравнению с время.
- Для оптимизации условий, проводить реакцию в целом ряде расхода и температуры в реакторе в итеративным способом.
- Наложение участки комбинационного интенсивности при 1,608 см -1 по сравнению с время.
Примечание: Высшее комбинационного интенсивность коррелирует с более высокой конверсии продукта.
8. Запустите реакции с использованием оптимальных условиях
- Имея экранированные различные условия (различные ставки потока / температуры в реакторе), запустить реакцию, используя оптимизированные условия, получая высокую конверсию продукта.
9. Отключите продукт
- Возьмите содержимое колбы продукции и вылейте его в стакан, содержащий 100 мл льда и 20 мл 2 М HCl.
- Промыть колбу продукт с минимальным количеством этилацетата (2 мл) и передачи в химическом стакане.
- Перемешать смесь ледянойдо весь лед не полностью плавится.
- Установите систему фильтрации с воронкой Hirsch, сторона-руки колбу, резиновой манжетой и длиной резиновых вакуумной трубки.
- Фильтр полученный осадок под вакуумом, промыть холодной диэтиловым эфиром (10 мл) и дают ей высохнуть при тепла лампы (2-3 ч) или сухой O / N в вакууме.
- Подтверждение идентичность продукта с помощью 1 Н ядерного магнитного резонанса (ЯМР) спектроскопии с использованием CDCl 3 в качестве растворителя. Для ЯМР-спектрометра 500 МГц, 1 Н ЯМР данные 3-acetylcoumarin выглядит следующим образом: δ = 2,73 (с, 3H) 7,31 - 7,40 (м, 2Н) 7,65 (дд, J = 7,53, 4,37, 2,60 Гц , 2 Н) 8,51 (с, 1Н) частей на миллион, 13 данные ЯМР: δ = 30,84 (СН 3) 117,00 (СН) 118,56 (С) 124,86 (СН) 125,27 (СН) 130,51 (СН) 134,68 (С) 147,74 (CH) 155,64 (С) 159,52 (С) 195,77 (С) частей на миллион.
Результаты
Препарат проточный 3-acetylcoumarin был выбран в качестве репрезентативного реакции для мониторинга в режиме реального времени. В партии, реакция протекает хорошо при использовании этилацетата в качестве растворителя. Однако продукт (1), не полностью растворим при комнатной темпера?...
Обсуждение
Легкость, в которой спектрометр комбинационного может сопрягаться с блоком потока делает этот встроенный метод ценную для мониторинга реакции. Множество переменных реакции можно зондировать в ускоренном порядке, что позволяет пользователю достичь оптимальных условиях реакции быст?...
Раскрытие информации
The authors have nothing to disclose.
Благодарности
Financial support provided by National Science Foundation (CAREER award CHE-0847262. We thank Vapourtec Ltd and Enwave Optronics for equipment support, and Daniel Daleb of the University of Connecticut for his assistance in construction of the flow cell apparatus.
Материалы
| Name | Company | Catalog Number | Comments |
| Salicylaldehyde | Sigma-Aldrich | S356 | Reagent Grade, 98% |
| Ethyl acetoacetate | Acros Organics | 117970010 | 99% |
| Piperidine | Sigma-Aldrich | 104094 | Reagent Plus, 99% |
| Hydrochloric acid | Sigma-Aldrich | 320331 | ACS Reagent, 37% |
| Ethyl acetate | Sigma-Aldrich | 34858 | CHROMASOLV, for HPLC, >99.7% |
| Acetone | Sigma-Aldrich | 650501 | CHROMASOLV, for HPLC, >99.9% |
| Flow cell | Starna Cells | 583.65.65-Q-5/Z20 | |
| Flow unit | Vapourtec | E-series system | |
| Raman spectrometer | Enwave Optronics Inc | Model EZRaman-L |
Ссылки
- Wiles, C., Watts, P. . Micro Reaction Technology in Organic Synthesis. , (2011).
- van den Broek, S. A. M. W., et al. Continuous Flow Production of Thermally Unstable Intermediates in a Microreactor with Inline IR-Analysis: Controlled Vilsmeier–Haack Formylation of Electron-Rich Arenes. Org. Process Res. Dev. 16 (5), 934-938 (2012).
- Baxendale, I. R. The integration of flow reactors into synthetic organic chemistry. J. Chem. Technol. Biotechnol. 88 (4), 519-552 (2013).
- Malet-Sanz, L., Susanne, F. Continuous Flow Synthesis. A Pharma Perspective J. Med. Chem. 55 (9), 4062-4098 (2012).
- Hartwig, J., Metternich, J. B., Nikzad, N., Kirschning, A., Ley, S. V. Continuous flow chemistry: a discovery tool for new chemical reactivity patterns. Org. Biomol. Chem. 12 (22), 3611-3615 (2014).
- De Beer, T., et al. Near infrared and Raman spectroscopy for the in-process monitoring of pharmaceutical production processes. Int. J. Pharm. 417, 32-47 (2001).
- McMullen, J. P., Jensen, K. F. Integrated microreactors for reaction automation: New approaches to reaction development. Annu. Rev. Anal. Chem. 3, 19-42 (2010).
- Moore, J. S., Jensen, K. F. Automated multitrajectory method for reaction optimization in a microfluidic system using online IR analysis. Org. Process Res. Dev. 16 (8), 1409-1415 (2012).
- Carter, C. F., et al. ReactIR Flow Cell: A New Analytical Tool for Continuous Flow Chemical Processing. Org. Process Res. Dev. 14 (2), 393-404 (2010).
- Ferstl, W., et al. Inline Analysis in Microreaction Technology: A Suitable Tool for Process Screening and Optimization. Chem. Eng. Technol. 30 (3), 370-378 (2007).
- Benito-Lopez, F., et al. Optical fiber-based on-line UV/Vis spectroscopic monitoring of chemical reaction kinetics under high pressure in a capillary microreactor. Chem. Commun. (22), 2857-2859 (2005).
- Gökay, O., Albert, K. From single to multiple microcoil flow probe NMR and related capillary techniques: a review. Anal. Bioanal. Chem. 402 (2), 647-669 (2012).
- Jones, C. J., Larive, C. K. Could smaller really be better? Current and future trends in high-resolution microcoil NMR spectroscopy. Anal. Bioanal. Chem. 402 (1), 61-68 (2012).
- Mozharov, S., et al. Improved Method for Kinetic Studies in Microreactors Using Flow Manipulation and Noninvasive Raman Spectrometry. J. Am. Chem. Soc. 133 (10), 3601-3608 (2011).
- Chaplain, G., Haswell, S. J., Fletcher, P. D. I., Kelly, S. M., Mansfield, A. Development and evaluation of a Raman flow cell for monitoring continuous flow reactions. Aust. J. Chem. 66 (2), 208-212 (2013).
- Browne, D. L., et al. Continuous flow reaction monitoring using an on-line miniature mass spectrometer. Rapid Comm. Mass. Spectrosc. 26 (17), (1999).
- Koster, S., Verpoorte, E. A decade of microfluidic analysis coupled with electrospray mass spectrometry: An overview. Lab Chip. 7 (11), 1394-1412 (2007).
- Leadbeater, N. E., Schmink, J. R., Hamlin, T. A., de la Hoz, A., Loupy, A. Tools for Monitoring Reactions Performed Using Microwave Heating. Microwaves in Organic Synthesis. 1, 327-376 (2012).
- Leadbeater, N. E., Schmink, J. R. Use of Raman spectroscopy as a tool for in situ. monitoring of microwave-promoted reactions. Nature Protoc. 3 (1), 1-7 (2008).
- Schmink, J. R., Holcomb, J. L., Leadbeater, N. E. Use of Raman spectroscopy as an In Situ. Tool to Obtain Kinetic Data for Organic Transformations. Chem. Eur. J. 14 (32), 9943-9950 (2008).
- Hamlin, T. A., Leadbeater, N. E. Raman spectroscopy as a tool for monitoring mesoscale continuous-flow organic synthesis: Equipment interface and assessment in four medicinally-relevant reactions. Beilstein J. Org. Chem. 9, 1843-1852 (2013).
- Kelly, C. B., Lee, C., Leadbeater, N. E. An approach for continuous-flow processing of reactions that involve the in situ. formation of organic products. Tetrahedron Lett. 52 (2), 263-265 (2011).
- Wren, S. N., Donaldson, D. J. Glancing-angle Raman spectroscopic probe for reaction kinetics at water surfaces. Phys. Chem. Chem. Phys. 12, 2648-2654 (2010).
- Leadbeater, N. E., Smith, R. J. Real-Time Monitoring of Microwave-Promoted Suzuki Coupling Reactions Using in Situ. Raman Spectroscopy. Org. Lett. 8 (20), 4589-4591 (2006).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены