Method Article
В Ситу Ca 2+ изображений нервной системы кишечной
В этой статье
Резюме
The enteric nervous system (ENS) is a network of neurons and glia located in the gut wall that controls intestinal reflexes. This protocol describes methods for recording the activity of enteric neurons and glia in live preparations of ENS using Ca2+ imaging.
Аннотация
Reflex behaviors of the intestine are controlled by the enteric nervous system (ENS). The ENS is an integrative network of neurons and glia in two ganglionated plexuses housed in the gut wall. Enteric neurons and enteric glia are the only cell types within the enteric ganglia. The activity of enteric neurons and glia is responsible for coordinating intestinal functions. This protocol describes methods for observing the activity of neurons and glia within the intact ENS by imaging intracellular calcium (Ca2+) transients with fluorescent indicator dyes. Our technical discussion focuses on methods for Ca2+ imaging in whole-mount preparations of the myenteric plexus from the rodent bowel. Bulk loading of ENS whole-mounts with a high-affinity Ca2+ indicator such as Fluo-4 permits measurements of Ca2+ responses in individual neurons or glial cells. These responses can be evoked repeatedly and reliably, which permits quantitative studies using pharmacological tools. Ca2+ responses in cells of the ENS are recorded using a fluorescence microscope equipped with a cooled charge-coupled device (CCD) camera. Fluorescence measurements obtained using Ca2+ imaging in whole-mount preparations offer a straightforward means of characterizing the mechanisms and potential functional consequences of Ca2+ responses in enteric neurons and glial cells.
Введение
Кишечной нервной системы (ЭНС) состоит из двух ganglionated сплетений встроенных в стенке желудочно-кишечного тракта 1. Эти внутримышечные нейронные цепи, мышечной оболочки кишечника сплетение (MP) и подслизистого сплетения (SMP), состоят из нейронов и кишечной глии (рисунок 1) 2. MP и SMP регулировать желудочно-кишечного тракта (ЖКТ) функции, такие как моторики кишечника и эпителия поглощения и секреции, соответственно 3. Кишечная глия находятся в непосредственной близости от нейронов внутри ганглиев, но популяций кишечной глии существуют также и в смежных волокон брошюры и экстра-ганглиозные части стенки кишечника 3,4. Кишечные глиальные клетки были первоначально считали только для обеспечения питательной поддержки нейронов. Однако, недавние исследования убедительно свидетельствуют, что нейрон-глия взаимодействия имеют важное значение для ENS действует 5,6. Например, данные показывают, что кишечно-глии "слушать" нейронной активности 7и модулировать нейронные схемы 6,8, защиты энтеросолюбильной нейроны от окислительного стресса и 9 способны генерировать новые энтеросолюбильной нейронов в ответ на повреждение 10,11. Протокол, представленные в данном техническом обзоре обеспечивает простой и надежный метод для изучения сложных взаимосвязей между нейронами и кишечной глии, используя на месте внутриклеточного Ca 2+ изображений.
Ca 2+ повсеместно сигнальная молекула в возбудимых клеток и играет важную роль в синаптических сигнальных событий в нервной системе 12. Возбуждение нейронов или кишечной глии вызывает возвышение в цитоплазматической Ca 2+ концентрации либо притоком через Са 2+ -permeable каналов или Са 2+ релиз из внутриклеточных депо кальция. Изображениями Ca 2+ в нейронах и глии с люминесцентными красителями и широко используемый метод для изучения функциональной организации и динамикиENS 13-17. Изображениями Ca 2+ было показано, чтобы быть важным инструментом в изучении сегменты неповрежденной GI тканей для выяснения распространения возбудимости через ICC кардиостимулятора сетей 18 и кишечника гладкой мускулатуры 19,20. Это позволяет исследователям исследовать широкий спектр физиологических параметров и предоставляет информацию о как их пространственного распределения и временной динамики. Клетки могут быть эффективно окрашивали в минимально инвазивной образом с помощью мембранных проницаемым люминесцентные индикаторы и оптимизированные протоколы окрашивания 21. Это дает возможность контролировать большое количество нейронов и глии в кишечно функционально сохраненных препаратов 14-16,22, а также в естественных условиях 23. Целые-крепление ткани препараты основная загружается с высоким сродством Ca 2+ индикатора красителя, таких как Fluo-4, что повышает его флуоресценции при связывании с Са 2+. Изменение флуоресценции регистрируются ПЗС-камеры и Анализируется в цифровом 6. Появление Ca 2+ предоставляется возможность отслеживать нейронов и глии межклеточных взаимодействий, отзывчивость на различные раздражители, и участие этих типов клеток в желудочно-кишечной процессов в режиме реального времени.
В месте с изображениями Ca 2+ дала большое понимание в сигнальных механизмов кишечных нейронов и глии и обладает рядом явных преимуществ по сравнению с моделями клеточных культур 6,24. Во-первых, на месте препараты сохранить родной матрицы среду нейронов и глии и оставить большую часть своих связей с целевой ткани нетронутыми. Во-вторых, генетика и морфология культивируемых кишечной глии существенно изменяются по сравнению с в естественных условиях 6,24. В-третьих, многие гетеротипические взаимодействия теряются в первичной культуры клеток, и это ограничивает оценивающие межклеточных взаимодействий. Хотя культивируемые клетки хорошо подходят для исследования фундаментальных свойств, их usefulneСС для изучения сложных взаимодействий между кишечными глии и нейронов ограничена. Исследование нейрон-глия взаимодействие с использованием на месте подход является более физиологически актуальна как синаптические пути остаются нетронутыми 25. По сравнению с клеточной культуры подходов, на месте подхода предлагает улучшенные условия для систематического понимания сложных взаимодействий между нейронами и кишечной глии. Кроме того, плоская организация ganglionated сплетения в целом монтажа подготовки идеально подходит для флуоресцентных изображений внутриклеточных Са 2+ и этот метод обеспечивает простой подход для оценки Нейрон-глии деятельность в ENS.
протокол
ПРИМЕЧАНИЕ: Следующие процедуры, связанные с ткани от лабораторных животных в соответствии с AVMA Руководства по эвтаназии животных в 2013 и были заранее одобрены Мичиганского государственного университета IACUC.
1. Подготовка ткани
- Обезболить исследований на животных в камере, содержащей 2,5% изофлуран в кислороде или путем размещения 3-5 мл жидкости на изофлуран абсорбирующего материала на полу камеры, что обеспечивает физический барьер предотвращает животных от непосредственного контакта с изофлуран. Тест на глубине анестезии, зажимая в подушечку лапы.
ПРИМЕЧАНИЕ: глубина анестезии будет сочтено целесообразным, когда нет вывода рефлекс задней конечности. После того, как соответствующим образом под наркозом, усыпить мышь смещением шейных позвонков - Место животное в лежачем положении и очистите кожу с брюшка с 70% этанола. Используйте пинцет, чтобы зажать кожи живота на срединной линии и использовать хирургические ножницы, чтобы сделать 6 см СМИл разрез вдоль белой линии, чтобы разоблачить внутренние органы пищеварения.
- Используйте тупые щипцы, чтобы найти и разоблачить подвздошной кишки внутри брюшины. Отрежьте подвздошной / толстой кишки брыжейки с ножницами и начать распутывать кишечника.
- После того, как длина кишечника адекватно разгадали, сократить кишечника дистальнее желудка и проксимальный к слепой кишке для приготовления подвздошной кишки. Для большого подготовки кишечника, вырезать толстой кишки дистальнее слепой кишки и вблизи прямой кишки.
- Быстрое удаление кишечного сегмента и поместить его в стакан с DMEM / F12 среде с добавлением 3 мкМ никардипин гидрохлорид и 1 мкМ гидрохлорида скополамин (далее именуемый "информации") на льду. Добавление этих ингибиторов облегчает микродиссекции и последующее изображений, парализуя кишечника гладкие мышцы.
- Cut сегмент интереса (например, тощей кишки, подвздошной кишки, дистальной или проксимальной толстой кишки) на основе установленных анатомических маркеров. Обычно utilizе ткани от дистального отдела подвздошной кишки или дистальном отделе толстой кишки. Тем не менее, использовать ту же основную процедуру, чтобы изолировать, нагрузки и изображений нейронов мышечной оболочки кишечника и глии во всех кишечных регионах.
- Удалить небольшой сегмент (4-6 см) нужного отрезка кишечника и место в Sylgard покрытием чашке Петри, наполненной охлажденной СМИ.
- Безопасный проксимальный и дистальный концы кишечного сегмента с штифтами насекомых и открыть кишечной трубки путем прямой, продольно разрезанной вдоль брыжеечной границе.
- Pin ткани квартиру под легкое напряжение с слизистой стороной вверх и осторожно отсечь слизистой оболочки слой, используя тонкий пинцет (# 5 и # 5/45 работать лучше) и очень прекрасный весенний ножницы.
ПРИМЕЧАНИЕ: удаление слизистой оболочки может быть весьма травматично для ENS, если не сделано должным образом. Для качества препаратов, заботиться, чтобы ограничить резкое удаление слизистой оболочки путем лущения или выскабливание. Лучше всего, чтобы поднять слизистой оболочки и нарезать под тонкими ножницами. - Разрежьте ткань на небольшие подготовкис (примерно 0,5 см 2) и штифт в визуализации блюд (4 углам с круговой мышечный слой вверх) помещают на лед со свежей информации.
- Тщательно отсечь круговой мышцей дразнить друг от друга тонкими щипчиками, чтобы разоблачить мышечной оболочки кишечника сплетение. Избегайте чрезмерного растяжения.
- Поместите изображений блюдо обратно на лед и изменение решения с свежей прессы.
- Подготовка 2 мл ферментной смеси на чашку [диспаза 1 ед / мл (4,48 мг / 8 мл), коллагеназы типа II 150 ед / мл (5,45 мг / 8 мл) в средствах массовой информации].
- Удалить блюда из льда и добавьте смеси ферментов, начиная с шага 1.13.
- Инкубируйте блюда при КТ в течение 15 мин с 5% СО 2/95% воздуха.
- Тканевые препараты для мойки с медиа в 3 раза и вновь контактных углов.
2. Погрузка Fluo-4 краски
ПРИМЕЧАНИЕ: Избегайте фотообесцвечиванию, работая с ограниченной света при работе с флуоресцентными красителями и ткани, загруженные с индикаторными красителями.
- Подготовка 4 мкм Fluo-4 загрузки решение.
- Добавить 1,5 мл среды и 1,2 мкл 250 мМ пробенецида складе в 1,5 мкл аликвоты 4 мм Fluo-4 в наличии. 4 мМ Fluo-4-фри готовят путем добавления 11,4 мкл Pluronic F-127 (20% в ДМСО; с добавкой 0,25% cremaphor-EL) до 50 мкг Fluo-4, Am.
- Инкубируйте Preps в Fluo-4 загрузки раствора в течение 45 мин в темном инкубаторе при 37 ° С.
- Удалить из инкубатора и промыть препараты со средствами массовой информации в 3 раза.
- Обмен медиа-среды, содержащей по 200 мкм пробенецид и инкубировать 15 мин при 37 ° С до визуализации.
ПРИМЕЧАНИЕ: Пробенецид является препарат, который подавляет множественной лекарственной устойчивостью перевозчиков в нейронах. Добавление этого препарата подавляет способность нейронов выталкивать красители и повышает нейронов маркировки. Массовое-загрузка Са 2+ индикаторных красителей в отсутствие пробенецид производит в основном глиальных клеток нагрузку. Добавление пробенецид позволяет визуализации нейронов и глии ответов. - Подготовка Модифицированный KreBS буфера.
- Сделайте измененный буфер Кребса, так что конечные концентрации (в мм) компонентов, как следует: 121 NaCl, 5,9 KCl, 2,5 CaCl 2, 1,2 MgCl 2, 1,2 NaH 2 PO 4, 10 HEPES, 21,2 NaHCO 3, 1 пировиноградная кислоты и 8 глюкозы (рН доводили до 7,4 с помощью NaOH). Добавить 3 мкм никардипин и 1 мкМ скополамин ингибировать сокращения мышц во время Са 2+ изображений и вся монтажа вскрытия.
3. Работа с изображениями и анализ
ПРИМЕЧАНИЕ: Используйте по крайней мере основной буровой изображений с флуоресцентным источником света, микроскоп, качество CCD камеры и соответствующего программного обеспечения приобретения. Вары добавление других компонентов в зависимости от источника света и конкретного применения. Колесо фильтра и затвора должен быть использован с традиционной ксеноновой дуговой источник света. Однако, светодиодные источники света и осветительные системы не требуют эти компоненты.
- Установите RECОрдинг камеру под микроскопом и с помощью проточной системе перфузии тяжести с несколькими подогревом шприцев водоемов установление постоянного скорость перфузии 2-3 мл / мин 37 ° C Кребса буфера. Убедитесь в том, чтобы предотвратить образование воздушного пузырька в обеих входной и всасывающей линии, подключенной к вакуумной ловушки.
- Приносят желаемых сплетения в центре внимания при ярком освещении поля. Избегайте передержки ткани, что может привести к фото отбеливания.
- Проверьте Fluo-4 загрузки в течение ганглиев и выберите здорового ганглиях изображений. Нездоровые / поврежденные ганглии будет проявлять автофлуоресцентной или точечный морфологию и не должны использоваться для визуализации.
- После выбора ганглий, отвлечь путь света к камере и получить живое изображение с помощью программного обеспечения захвата изображений. Убедитесь, что ганглий находится в фокусе и установить частоту захвата изображений и времени воздействия.
ПРИМЕЧАНИЕ: Высокие захвата изображений и время будет изменяться в зависимости от событий следователи хотят записать. Для большинства экспериментов, изображенийтрадиционно приобрел в 0,5-1 Гц для глиальных клеток и до 2-10 Гц в течение нейронов, потому что ответы глиальных Ca 2+ не так быстро, как Са 2+ в нейроны. - Начните эксперимент и установить базовую деятельность в течение 30 сек.
- Применение предварительно нагревают интересующих лекарственных средств, таких как агонисты и антагонисты рецепторов с использованием системы перфузионного самотеком со скоростью 2-3 мл / мин. Последующие применение агонистов / антагонистов путем возврата к нормальной перфузии буфер и позволяют период стирки / извлечения по меньшей мере, 10 мин.
ПРИМЕЧАНИЕ: Время применения препарата будет варьироваться в зависимости от конкретного соединения и опытно-конструкторских. В общем, 20-30 сек применение агониста является достаточным для активации G-белками рецепторов в нейронах и глиальных клеток. Тем не менее, лиганд-ионные каналы (например, никотиновые рецепторы ацетилхолина), требуют время нанесения не более чем на 5-10 сек. Дальнейшие продолжительность воздействия вызовет лиганд ионные каналы быстро дешеnsitize. Антагонисты следует применять в течение примерно 3-15 мин, чтобы обеспечить полную блокаду рецепторов путей. Тем не менее, это полная обобщение и следователи должны всегда оптимизировать любую экспериментальный препарат в своей конкретной парадигмы. - Остановка записи и просмотра покадровой фильм эксперимента. Тщательно выберите регионах, представляющих интерес (ROI в) с использованием соответствующего программного обеспечения для анализа изображений.
- Используйте программное обеспечение, чтобы нормализовать и сравнить ROI интенсивности флуоресценции от его первоначальной стоимости базового флуоресцентного. Изменения в нормированной флуоресценции прямо пропорциональны изменениям [Са 2+].
- Использование модификацию метода, описанного ранее, используя 26; F / F = ((F 1 - F 0) / F 0) ROI - ((F 1 - F 0) / F 0) фона, где F1 является флуоресценции в любой данный точку и F0 является базовой флуоресценции, повысить точность оценки. Эта модификация средствав снижении шума от изменений флуоресценции в тканевых препаратов, которые обладают движение мышечного слоя, лежащего в основе мышечной оболочки кишечника сплетение.
Результаты
Правильное использование этого метода позволяет исследователям точно измерить внутриклеточного Ca 2+ [Ca 2+] я переходных процессов в кишечных нейронов и глии в целом монтажа тканевых препаратов. Типичный пример агонистов, вызвали Ca 2+ ответов в глии в пределах мышечной оболочки кишечника ганглия толстой кишки мыши показано на видео 1. Получены следующие результаты предназначены для иллюстрации некоторых репрезентативных результатов мы, полученные с помощью этого метода. Во-первых, на рисунке 2 представлены результаты эксперимента измерения кишечно-глиальных [Ca 2+] я изменения в ответ на стимуляцию АТФ в морской свинки толстой продольной мышечной оболочки кишечника мышцы сплетение (LMMP) препаратов. В частности, эта цифра показывает метод для правильного анализа экспериментального протокола, указанного выше, включая контур анализируемого мышечной оболочки кишечника ганглии и звездочек, обозначающих расположение кишечных нейронов. Эти результаты также яllustrate оптимальную дозу сто микромолярном АТФ на мобилизацию [Ca 2+] я в морской свинки мышечной оболочки кишечника глии. Эта реакция может быть использована для калибровки кишечно-глиальных стимуляции и нормализации ответы на тестовые стимулы. Далее, Рисунок 3 поясняет, как правильно выбрать интересующие участки (трансформирования) Ближайшие глиальные клетки, как показано с прилегающими желтые круги. Эти результаты также показывают желаемые изменения флуоресценции под базальных условиях и в ответ на фармакологических стимулов. Наконец, на рисунке 4 показывает, пространственные соображения по выбору кишечно-глии и нейронов для [Ca 2+] Я ответах в целом монтажа подготовки.
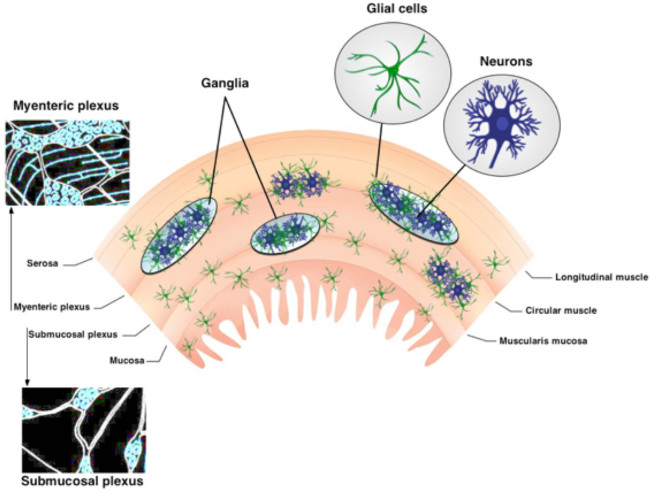
Рисунок 1. Организация ENS. ENS содержит два основных ganglionated сплетения. Мышечной оболочки кишечника сплетения расположен между лongitudinal и круговые слои мышц. Подслизистого сплетения расположен между слизистой и круговой слой мышц. ENS исключительно состоит из нейронов и кишечной глии. Нервные волокна путей подключения ганглиев. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этой цифры.
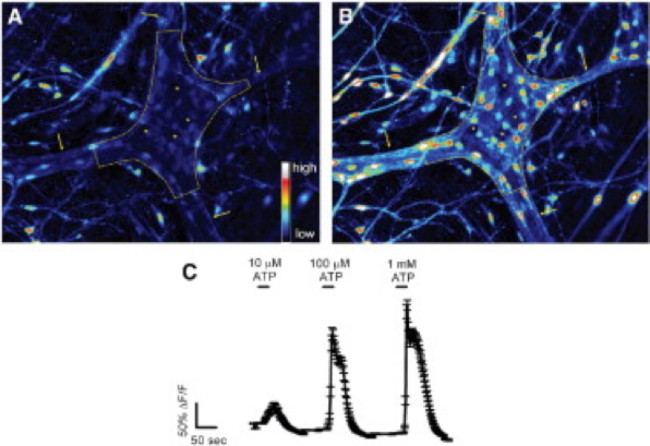
Рисунок 2. Кишечная глия в морской свинки толстой мышечной оболочки кишечника сплетения реагировать на СПС на месте. () Fluo-4 флуоресценции в мышечной оболочки кишечника ганглии (они изложены пунктирной линией) при базальных условиях. Стрелки указывают на толстых путей interganglionic волокон. (В) при стимуляции 100 мкмоль / л АТФ, глиальных клеток, но не нейроны, быстро растут Fluo-4 флуоресценции, указывающий увеличение [Ca 2+] я. Обратите внимание, что ответившие клетки малы и окружают гораздо более крупные нейроны (темные места, отмеченные звездочками). (C) Кишечная глия реагирует на АТФ в зависимости от дозы с 1 ммоль / л выявления максимальных ответов 24. Пожалуйста, нажмите здесь, чтобы посмотреть Более крупная версия этой фигуры.
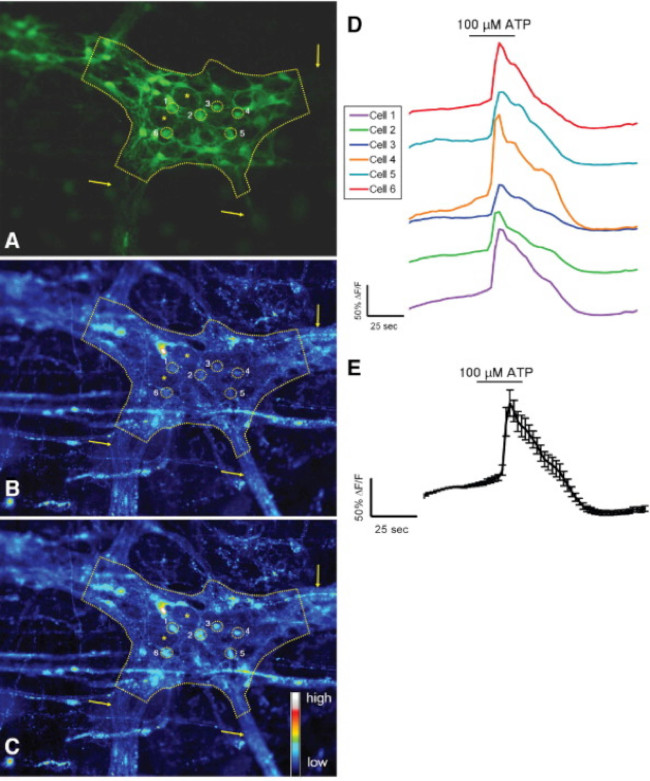
Рисунок 3. мышей S-100-GFP + клеток в толстой мышечной оболочки кишечника сплетения реагируют на АТФ в месте. (А) S-100-GFP + глиальные клетки (зеленый) в толстой мышечной оболочки кишечника мыши ганглия (изложенные пунктирной линией). Шесть регионов интереса (трансформирования) окружающей глиальные клетки в пределах ганглиев представлены в виде желтых кругов. Стрелки указывают толстые участки волокна, ведущие в ганглии. Звездочки denote расположение 2 кишечными нейронов. (B) То же ганглий, показывая Род-2 флуоресценции при базальных условиях. (C) После стимуляции 100 мкмоль / л АТФ, глиальные клетки реагируют с повышенным [Ca 2+] я, как проявляется увеличением Rhod- 2 флуоресценции. (D) Следы, соответствующие каждой ROI, показанном на А-С. (E) Среднемесячная ответ (имею в виду ± SEM) из 6 областей исследования, указанных в D 24. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этой цифры.
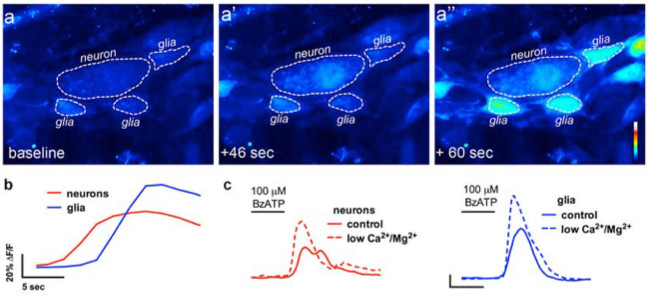
Рисунок 4. В месте визуализации кишечной связи нейрон-к-глии. () Типичные изображения (псевдоцветной) из эксперимента с изображениями Ca 2+, где вся монтажаподготовка мышечной оболочки кишечника сплетения вызов с нейронным агониста Р2Х7 рецепторов BzATP (100 мкм, 30 сек). Обратите внимание, что нейронная агонист вызывает увеличение флуоресценции Fluo4 в нейроне (А ') до окружающих кишечных клеток глии (А "). (В) Анализ изменения флуоресценции с течением времени в глии (синий) и нейронов (красный ) после применения нейронной агониста, BzATP. (C) нейрональных и глиальных реакций на BzATP в нормальном буфера (сплошные линии) и в буфере, содержащем низкой Ca 2+ и Mg 2+ (пунктирные линии), чтобы усиливать нейронные рецепторы Р2Х7 13. Пожалуйста, Нажмите здесь, чтобы посмотреть большую версию этой цифры.
Видео 1. агонистом вызывало Ca 2+ ответ в кишечной глии вСиту. Это видео показывает мышечной оболочки кишечника ганглия мыши дистального отдела толстой кишки, загруженной с Ca 2+ индикатора красителя, Fluo-4. Агонист глиальных клеток, АДФ, добавляют в ванну, когда указано. ADP вызывает увеличение внутриклеточного Са 2+ в кишечной глии, наблюдаемых при помощи переходного возвышения в Fluo-4 флуоресценции. Пожалуйста, нажмите здесь, чтобы просмотреть это видео.
Обсуждение
The methodologies described in this manuscript provide a consistent approach to effectively study neurons and enteric glia in the ENS. Although imaging neurons and enteric glia in culture has yielded a wealth of insight into the function of individual cells, studying these cells in their native, multi-cellular environment is crucial for our understanding their physiology and pathophysiology. Fluorescence microscopy is a crucial technique for assessing multidirectional interactions of cells in the ENS. Loading cells of the ENS with selective fluorescent markers and image acquisition with high-resolution microscopy permits quantitative observations of cellular activity in the ENS. Imaging live tissue samples of the ENS is performed relatively quickly and generates large amounts of in-depth functional and spatial data. Mouse myenteric and submucosal plexus preparations used in these experiments allow for molecular and genetic manipulation approaches. Ca2+ imaging in whole-mount preparations provides a useful tool for the assessment of neuron-glia interactions.
In advanced experimental paradigms, several probes can be combined to obtain information about different events within the cells. Fluorescence microscopy can record images with enhanced contrast of specific molecules, if an appropriate fluorescent label is used. Fluo-4 was chosen because it possesses a large dynamic range. Sufficient incubation time is vital when using the AM dyes in ENS. Dye concentration and loading method may need to be adjusted to achieve best results. Ideal preparations should be loaded with sufficient dye to visualize changes in fluorescence but not so much so that the dye chelates the target ions and interferes with intracellular signaling. Exposure to fluorescent light should be limited to prevent phototoxicity in cells and photobleaching of dyes.
Investigators must be careful with several steps of this experiment, especially solution and tissue preparation. Particular care has to be taken during processing and dissection of ENS tissue in order to maintain cellular functions. The GI tract contains several layers and tissue varieties, which pose challenges for dissection and imaging quality in these whole-mount preparations 27. Furthermore, the interconnecting fiber tracts of the MP are wider and ganglia are larger than those of the SMP 2. The neuronal density of the myenteric plexus is higher compared to that of the submucosal plexus 28. Slow and imprecise dissections will have detrimental effects on the quality of the plexus preparations and thus the overall success of the experiments. Therefore, clean/undamaged tools, practice and manual dexterity are critical to this procedure.
In whole-mount tissue preparations, careful consideration should be taken when drawing the regions of interest (ROI) to correctly assess the kinetics and degree of observed change in fluorescence intensity of the desired cell type. As the ganglia are located on a contractile muscle layer, motion artifacts caused by gut motility are a primary concern during in situ imaging. Thus, suppressing these motion disturbances through re-pinning tissue preparations after incubation with enzymes and the addition of pharmacological inhibition (nicardipine/scopolamine) to buffers permits clear and reliable image acquisition. Aside from pharmacology and mechanical approaches to prevent tissue movement, recent studies illustrate the application of advanced software methodologies and cell type response characteristics to correct for residual tissue movement in the recordings and improve the accuracy of analysis 29. Barring these technical hurdles, this method provides physiologically relevant conditions to assess morphologic and quantitative characteristics of neurons and enteric glia in the ENS.
Раскрытие информации
The authors have nothing to disclose.
Благодарности
This work was supported by grants from the Pharmaceutical Research and Manufacturers Association of America (PhRMA) Foundation (to B. Gulbransen), National Institutes of Health (Building Interdisciplinary Research Careers in Women’s Health) grant K12 HD065879 (B. Gulbransen) and start-up funds from Michigan State University (B. Gulbransen).
Материалы
| Name | Company | Catalog Number | Comments |
| BubbleStop Syringe Heater | AutoMate Scientific | 10-4-35-G | |
| CaCl2 | Sigma | C3306 | |
| Collagenase, Type II, powder | Gibco | 17101-015 | |
| Dispase | Sigma-Aldrich | 42613-33-2 | |
| Dissection tools | Roboz | ||
| DMSO | Sigma-Aldrich | D5879 | |
| Fixed-stage microscope | Olympus | BX51WI | |
| Fluo-4 AM dye | Invitrogen | F-14201 | |
| Glucose | Sigma | G8270 | |
| Insect pins | Fine Science Tools | Minutien Pins | |
| iQ Live Cell Imaging Software | Andor | Andor iQ3 | |
| KCl | Sigma | P3911 | |
| MgCl2 | Sigma | M9272 | |
| NaCl | Sigma | S9888 | |
| NaH2PO4 | Sigma | S8282 | |
| NaHCO3 | Sigma | S6014 | |
| Neo sCMOS camera | Andor | Neo 5.5 sCMOS | |
| Nicardipine | Sigma | N7510 | |
| Perfusion chamber | Custom | ||
| Peristaltic pump | Harvard Apparatus | Model 720 | |
| Pluronic F-127 | Invitrogen | P3000MP | |
| Probenecid | Molecular Probes | P36400 | |
| Scopolamine | Sigma | S1013 | |
| Sutter Lambda DG-4 | Sutter | DG-4 | |
| Sylgard | Dow Corning | 184 | |
| Temperature Controller | Warner Instruments | TC-344C |
Ссылки
- Furness, J. B. Types of neurons in the enteric nervous system. Journal of the Autonomic Nervous System. 81 (1-3), 87-96 (2000).
- Furness, J. B. The organization of the autonomic nervous system: peripheral connections. Neuroscience. 130 (1-2), 1-5 (2006).
- Pham, T. D., Gershon, M. D., Rothman, T. P. Time of origin of neurons in the murine enteric nervous system: sequence in relation to phenotype. Journal of Comparative Neurology. 314 (4), 789-798 (1991).
- Nasser, Y., et al. Role of enteric glia in intestinal physiology: effects of the gliotoxin fluorocitrate on motor and secretory function. Am J Physiol Gastrointest Liver Physiol. 291, G912-927 (2006).
- . Glial cells in the gut. Neurogastroenterology & Motility. 17 (6), 777-790 (2005).
- Broadhead, M. J., Bayguinov, P. O., Okamoto, T., Heredia, D. J., Smith, T. K. Ca2+ transients in myenteric glial cells during the colonic migrating motor complex in the isolated murine large intestine. J. Physiol. 590, 335-350 (2012).
- Gulbransen, B. D., Bains, J. S., Sharkey, K. A. Enteric glia are targets of the sympathetic innervation of the myenteric plexus in the guinea pig distal colon. J. Neurosci. 30, 6801-6809 (2010).
- McClain, J. L., et al. Ca2+ Responses in Enteric Glia Are Mediated by Connexin-43 Hemichannels and Modulate Colonic Transit in Mice. Gastroenterology. 146 (2), 497-507 (2014).
- Chandrasekharan, B., et al. Colonic motor dysfunction in human diabetes is associated with enteric neuronal loss and increased oxidative stress. Neurogastroenterology & Motility. 23 (2), e131-e126 (2011).
- Abdo, H., et al. Enteric glial cells protect neurons from oxidative stress in part via reduced glutathione. FASEB J. 24, 1082-1092 (2010).
- Aube, A. C., et al. Changes in enteric neurone phenotype and intestinal functions in a transgenic mouse model of enteric glia disruption. Gut. 55, 630-637 (2006).
- Berridge, M. J., Lipp, P., Bootman, M. D. The versatility and universality of calcium signalling. Nature Reviews Molecular cell biology. 1 (1), 11-21 (2000).
- Gulbransen, B. D., et al. Activation of neuronal P2X7 receptor-pannexin-1 mediates death of enteric neurons during colitis. Nat Med. 18, 600-604 (2012).
- Bayguinov, P. O., Hennig, G. W., Smith, T. K. Calcium activity in different classes of myenteric neurons underlying the migrating motor complex in the murine colon. J Physiol. 588, 399-421 (2010).
- Okamoto, T., Bayguinov, P. O., Broadhead, M. J., Smith, T. K. Ca(2+) transients in submucous neurons during the colonic migrating motor complex in the isolated murine large intestine. Neurogastroenterol Motil. 24 (8), 769-778 (2012).
- Kunze, W. A., Clerc, N., Furness, J. B., Gola, M. The soma and neurites of primary afferent neurons in the guinea-pig intestine respond differentially to deformation. J Physiol. 526, 375-385 (2000).
- Schemann, M., Michel, K., Peters, S., Bischoff, S. C., Neunlist, M. Imaging and the gastrointestinal tract: mapping the human enteric nervous system. Am J Physiol. 282, G919-G925 (2002).
- Hennig, G. W., et al. Visualization of spread of pacemaker activity in through ICC in guinea-pig antrum. Neurogastro Motil. 14, 575 (2001).
- Stevens, R. J., Publicover, N. G., Smith, T. K. Induction and organization of Ca2+ waves by enteric neural reflexes. Nature. 399, 62-66 (1999).
- Stevens, R. J., Publicover, N. G., Smith, T. K. Propagation and neural regulation of calcium waves in longitudinal and circular muscle layers of guinea-pig small intestine. Gastroenterology. 118, 982-984 (2000).
- Jessen, K. R., et al. Astrocyte-like glia in the peripheral nervous system: an immunohistochemical study of enteric glia. Journal of Neuroscience. 3 (11), 2206-2218 (1983).
- Gulbransen, B. D., Sharkey, K. A. Novel functional roles for enteric glia in the gastrointestinal tract. Nat Rev Gastroenterol Hepatol. 9, 625-632 (2012).
- Gomes, P., et al. ATP-dependent paracrine communication between enteric neurons and glia in a primary cell culture derived from embryonic mice. Neurogastroenterology & Motility. 21 (8), e870-e862 (2009).
- Gulbransen, B. D., Sharkey, K. A. Purinergic neuron-to-glia signaling in the enteric nervous system. Gastroenterology. 136, 1349-1358 (2009).
- Ren, J., Bertrand, P. P. Purinergic receptors and synaptic transmission in enteric neurons. Purinergic Signal. 4, 255-266 (2008).
- Takahashi, A., Camacho, P., Lechleiter, J. D., Herman, B. Measurement of intracellular calcium. Physiol Rev. 79, 1089-1125 (1999).
- Dongcheng, Z., et al. Neural crest regionalisation for enteric nervous system formation: implications for Hirschsprung's disease and stem cell therapy. Developmental Biology. 339 (2), 280-294 (2010).
- Gershon, M. D. Behind an enteric neuron there may lie a glial cell. J Clin Invest. 121, 3386-3389 (2011).
- Boesmans, W., et al. Imaging neuron-glia interactions in the enteric nervous system. Frontiers in Cellular Neuroscience. 7, (2013).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены