Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Концентрические Гель Система по изучению биофизических роли матриксных микроокружения на 3D миграции клеток
В этой статье
Резюме
Механические свойства и микроструктура внеклеточного матрикса сильно влияют 3D миграцию клеток. Метод в пробирке для изучения пространственно-временной миграционного поведения клеток в биофизически переменных среды, на численности населения и индивидуальном уровнях клеток, описывается.
Аннотация
Способность клеток к миграции имеет решающее значение в самых разнообразных клеточных функций на протяжении всей жизни из эмбрионального развития и заживления ран в опухоли и метастазов рака. Несмотря на интенсивные усилия научно-исследовательских, основные биохимические и биофизические принципы миграции клеток до сих пор до конца не изучен, особенно в физиологически соответствующих трехмерных (3D) микросреды. Здесь мы опишем анализа в пробирке разработана, чтобы позволить количественное изучение 3D миграции клеток поведения. Метод основан на использовании способности mechanosensing ячейки и склонность к миграции в ранее не заселенных внеклеточного матрикса (ЕСМ). Мы используем вторжение высоко инвазивных клеток рака молочной железы, MDA-MB-231, в коллагеновых гелях в качестве модельной системы. Распространение популяции клеток и динамика миграции отдельных клеток в течение нескольких недель культуры можно контролировать с помощью визуализации живых клеток и проанализированы, чтобы извлечь spatiotemporally разрешенных данных. Кроме того, Метод легко адаптируется для различных внеклеточного матрикса, тем самым предлагая простой, но эффективный способ изучения роли биофизических факторов в микросреде по миграции клеток.
Введение
Миграция клеток играет ключевую роль в различных физиологических реакций, таких как эмбриональное развитие, гемостаз, и иммунного ответа, а также в патологических процессах, таких как сосудистых заболеваний, воспаления, рака и 1. Пройдя биохимические и биофизические факторы, лежащие в основе миграции клеток, следовательно, принципиально важно не только понять основные принципы клеточных функций, но и для продвижения различных биомедицинских приложений, таких как в тканевой инженерии, анти-метастазирования и противовоспалительное разработки лекарственных препаратов. Так наблюдение в естественных условиях является технически сложным, много усилий было сосредоточено на повторении в пробирке миграции клеток.
В способах пробирке для изучения миграции клеток были в значительной степени предназначены для анализов на двумерных (2D) поверхности, что особенно царапины или заживления ран анализа 2. Такие анализы предложить простой экспериментальной установки, легко Live-ячейки изображения, а также обеспечить полезную информацию в различные биохимические механизмы, лежащие в основе миграции клеток. Тем не менее, эти анализы не учитывают внеклеточного матрикса (ЕСМ) архитектуры и реконструкции, которые представляют собой критические аспекты в понимании в естественных условиях миграции. Недавно было более понятно, что 3D модель культуры, часто в коллагеновых матриц на основе 3, обеспечивает платформу, которая лучше, напоминает в естественных условиях ситуацию. Действительно, клетки обладают миграционные динамику, которые отличаются от тех, на 2D поверхностях, особенно в связи с различной размерностью окружающей среды 4. Кроме того, биофизические и механические свойства матрицы чувствительно влияет клеточную миграцию 5, в том числе в контексте опухолевых клеток вторжения 6.
Здесь мы представляем метод для изучения 3D миграционного поведения клеток в ECM с биофизических свойств, которые могут легко изменяться с условиями подготовки. Клеткивысевают в "внутренней гель" и позволили бежать в вторгаются первоначально ацеллюлярную "внешнюю гель". Метод основан на способности клеток распознавать присутствие, и склонность к миграции в, бесклеточными регионов во внешней гель, который тесно связан с клеточной mechanosensing 7. В этом исследовании мы используем коллагена сетей, как ЕСМ вторглись высоко инвазивных клеток рака молочной железы, MD-MBA-231. Механические свойства и микроструктура обоих внутренних и наружных гелей могут быть настроены 8 и 9 характеризуются достичь физиологически соответствующие условия. Реконструкция и анализ клеточных треков разрешить детальную количественную экспертизу пространственно-временной миграционного поведения на обоих популяционном уровне и на индивидуальном уровне клеток. Важно отметить, что установка системы концентрических гель имитирует естественных условиях ткани топологию в которой сталкиваются мигрирующих клеток, особенно вторжение раковых клеток, таким образом предлагая важную информацию вна физические механизмы миграции клеток и метастазирования.
протокол
1. Сотовый Сбор
- Получить MD-MBA-231 клеток из 37 ° C, 5% СО 2 инкубатора. Отделить клетки от культуры ткани пластины, используя 0,5% раствор трипсина-ЭДТА. Используйте 1 мл раствора трипсина-EDTA для сотовых культивировали в Т25 колбы.
- Гранул клетки в 15 мл коническую пробирку центрифугированием при 200 х г в течение 4 мин, супернатант аспирации и ресуспендирования клеток в 5 мл культуральной среды.
- Количество плотности клеток, ρ, с помощью гемоцитометра.
Примечание: Чтобы подготовить внутренний гелевый семенами, клеточную суспензию будет позже быть разбавлен 10 × достичь конечной плотности посева клеток. Таким образом, 10 × концентрированной суспензии клеток требуется. - Рассчитайте объем среды, необходимой для достижения концентрации 10 × сотовый:
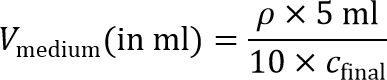
Примечание: конечной плотности посева клеток, с окончательным, в размере около 215; 10 6 клеток / мл рекомендуется для MD-MBA-231 клеток и используется в данном протоколе. Другие посева плотности также могут быть изучены для других типов клеток. - Пелле клетки более одного раза в 15 мл коническую трубку с помощью центрифугирования при 200 × г в течение 4 мин и аспирации супернатант.
- Ресуспендируют клеток в необходимом количестве (V среды, вычисленное на этапе 1.3) бессывороточной среде для культивирования клеток тщательно, чтобы свести к минимуму образование комков клеток.
Примечание: Фенол красный авто-люминесцентные, и может помешать флуоресцентной томографии / отражения. Использование без фенолового красного среде можно рассматривать для достижения наилучшего качества изображения.
2. Подготовка растворов коллагена
- Получить фондового раствора коллагена, 10 × PBS буфер, Milli-Q H 2 O, 0,1 М NaOH, и несколько микроцентрифужных пробирок. Хранить все на льду, чтобы предотвратить преждевременное коллагена полимеризации, и поддерживать стерильных условиях.
- Равновесие стерильный стеклоНижняя блюдо с предварительно согрейте его в 37 ° C инкубатора.
Примечание: Все тома в этом протоколе были оптимизированы для стеклянным дном блюдо с 12 мм а. Если используется другой тип блюда, отрегулировать громкость соответственно. - Рассчитать необходимый объем, необходимый для подготовки 50 мкл 2,4 мг / мл раствора коллагена для внутреннего геля (раствор I) на основе концентрации коллагена акций.
Примечание: Другие концентрации коллагена для внутреннего геля также могут быть использованы. - В стерильных условиях (как правило, капот биобезопасности), медленно добавляют 5 мкл 10 × PBS буфера с требуемым количеством раствора коллагена (в расчете на этапе 2.3) при осторожном закрученной. Будьте осторожны, чтобы избежать образования пузырьков воздуха.
- Доводят рН смеси до 7,4 с помощью 0,1 М NaOH с помощью калиброванного рН-метр. Ориентировочно, использовать около 5 мкл довести рН близко к 7,4 (количество варьируется в зависимости от концентрации и рН фондовой).
Примечание: Обратите внимание, что объемы участие в этомшаг слишком мал для использования стандартного рН-метра. Используйте один из следующих трюков:- Подготовка растворов коллагена для нескольких образцов. Отрегулируйте рН в объеме с использованием стандартных рН-метр и распространять коллагеновые решения по образцов.
- Кроме того, отрегулируйте рН раствора коллагена в большем объеме (т. Е., Объем, который позволяет использовать стандартный рН-метра). Обратите внимание на количество NaOH, необходимое для доведения рН до конечного рН. Уменьшите объемы и использовать соответствующее количество NaOH для эксперимента. Подтвердите значение рН с помощью лакмусовой бумаги.
- В противном случае, использование микро электрода рН, чтобы более точно регулировать рН небольших количествах.
- Доведите раствор до объема 45 мкл с использованием H 2 O. Выполните все шаги на льду, чтобы предотвратить преждевременное коллагена полимеризации.
3. Формирование концентрических гель культуры
- Возьмите подогретым со стеклянным дном блюдо (см шаг 2,2) из-йе-инкубатор.
- Добавить 5 мкл 10 × концентрированной суспензии клеток (полученного на стадии 1.5) к раствору I. ресуспендируют тщательно. Будьте осторожны, чтобы избежать образования пузырьков воздуха. Смесь теперь имеет объем 50 мкл и содержит конечной концентрации коллагена (2,4 мг / мл) и плотность клеток (в конечном = 2 × 10 6 клеток / мл).
- Добавить 20 мкл клеточной раствора, содержащего я медленно к центру и, таким образом, что он образует куполообразную капель (фиг.1А). Будьте осторожны, чтобы избежать образования пузырьков на этом этапе. Если мыльный пузырь формах, осторожно, но быстро попробовать либо разрыв его или сосать его с помощью пипетки. Аккуратно блюдо обратно в инкубатор, чтобы внутренний гель полимеризации в течение 45 мин.
- Получают раствор O (для наружного, бесклеточной коллагенового геля) около 15 мин до конца этой стадии инкубации.
Примечание: состояние наружной гель может быть изменена с точки зрения концентрации коллагена и полимеризации рН дополучить сетей с различной микроструктурой 10. В этом протоколе, сосредоточиться на 1,5 - 4,0 мг / мл коллагенового геля полимеризуют при рН 7,4.- На основании концентрации коллагена штока, рассчитать необходимый объем, необходимый для подготовки 200 мкл раствора коллагена O в конечной концентрации.
- Добавить 20 мкл 10 × PBS буфера медленно необходимого количества коллагена маточного раствора (в расчете на этапе 3.4) при осторожном закрученной. Доводят рН смеси до конечного рН с использованием 0,1 М NaOH с использованием калиброванного рН-метра. Смотри примечание к пункту 2.5 в отношении регулирования рН.
- Доведите раствор до конечного объема 200 мкл с использованием H 2 O. Выполните все шаги на льду, чтобы предотвратить преждевременное коллагена полимеризации.
- Возьмем блюдо из инкубатора через 45 мин полимеризации внутренней гель (см шаг 3,3). Осторожно добавьте 180 мкл раствора O в верхней части внутренней гель, так что раствор полностью покрывает внутреннийгель и заполняет скважину (рис 1б).
- Выполните этот шаг тщательно без перемешивания раствора, что может привести к неравномерной ориентацией волокон в наружном геля. Позаботьтесь, чтобы не касаться внутренней гель с наконечником пипетки, и, чтобы избежать образования пузырьков или воздушных карманов. Если мыльный пузырь формах, осторожно, но быстро попробовать либо разрыв его или сосать его с помощью пипетки. Аккуратно поместите блюдо обратно в инкубатор, чтобы внешний гель полимеризуется.
- Возьмите блюдо из инкубатора после 45 мин полимеризации. Гель должен быть уже достаточно затвердевшим в этой точке, хотя он все еще может отделить от нижней поверхности, если обрабатываются примерно.
- Осторожно залить 2 мл подогретой клеточной культуральной среды в чашке (фиг 1С). Убедитесь, что гель полностью погружен в среду. Обновление среду каждые 2 - 3 дней в течение всего периода культуры.
4, Live-ячейки изображения
- Выполните визуализацию с использованием инвертированного конфокальной микроскопии, оснащенный долгосрочных технологических возможностей визуализации живых клеток. Включить встроенный инкубационной камере при температуре (37 ° C) и СО 2 (5%) управления. Включите микроскопа и прогрейте на сцену, по крайней мере 1 час до начала эксперимента.
Примечание: Использование объектива с большим рабочим расстоянием для оптимизации наблюдения и локализации клеток в 3D-гелей. - Инкубируйте геля в среде, содержащей 5 мкл флуоресцентного красителя клетки следящей в течение 30 мин, чтобы позволить точную локализацию клеток в системе 3D. Впоследствии удаления несвязанного красителя путем промывки три раза 1 х PBS. После добавления клеточную культуральную среду в чашке.
- Возьмите блюдо из инкубатора и поместить его на столик микроскопа (рис 1D).
Примечание: изображений живых клеток может начаться в принципе сразу после полимеризации внешней геле. Однако на данный момент, клетки ян внутренние гель еще не распространился. Для изучения миграции из первых клеток, которые вторглись наружный гель, изображений живых клеток может начать 24 ч (в зависимости от типа клеток) после начала культивирования. Ориентировочно, около 12 - 14 дней культуры необходимы для большинства клеток во внутреннем геля для ввода внешнего гель. - Выберите тома зрения (VoV х) в регионах во внешней геля, окружающего внутреннюю гель. После 24 ч инкубации клеточной популяции будет распространяться, пересек интерфейс между внутренним и наружным гелей, и начал проникать в наружный гель.
- Для VoV годов, следует отнести регионы гель в непосредственной близости к границе геля, промежуточных областях, и областях, близких к окраине внешней геля 7. Исключить регионы ближе, чем 50 мкм от дна и боковых поверхностей, а также из верхней части геля, чтобы избежать возможных последствий краю. Каждый VoV обычно измеряет 647 × 647 × 100 мкм 3 (в х, у, г направления, соответственно), с интервалом 5 мкм в г -stack.
- Обеспечить режимов съемки, каналы / фильтры, время экспозиции, и резолюции изображения выбраны правильно. Для этикеток без изображения коллагена сети, используйте конфокальной отражения микроскопии одновременно во время покадровой съемки живых клеток.
- Возьмите примеры изображений, построить гистограммы интенсивности, и отрегулируйте прибыли и смещения наблюдать устойчивый сигнал и избежать насыщения, гарантируя, что гистограмма находится между нулем и максимальной интенсивности. Не изменить эти параметры больше в течение всего периода эксперимента.
- Возьмите покадровой изображения с выбранной Львов-х годов, с интервалом времени, Δ т, 10 мин в течение 8 часов (или дольше, если необходимо).
5. Отслеживать сотового и анализ данных
- Провести количественный изображения пост-обработки от г -stack изображений с помощью appropria TE программное обеспечение для обработки изображений.
- Сегменте покадровой изображения для автоматического выбора позиции 3D клеток в (х, Y, Z, T).
- Для каждого кадра, вручную проверить точность локализации и удаления ложных срабатываний из-за мусора клеток и клеточных выступов, которые, возможно, были ошибочно приняты за клетки. Удалить пролиферативных клеток из анализа и сплит перекрывающихся или связанных клеток в различных объектах.
- Создание 3D покадровой клеток дорожки из координат ячейки (X, Y, Z, T), полученных на предыдущем этапе, связывая расположение каждого элемента в последовательности времени.
- Исключите случайное и уровень шумов в системе путем удаления треков короче длины порог дорожки (обычно 20 мин).
- Исправьте для образца дрейфа путем вычитания общая чистая перемещения по трекам, если это необходимо.
- Рассчитать смещение клеток,Иль / ftp_upload / 52735 / 52735eq2.jpg "ширина =" 80 "/> и миграцию клеток расстояние,
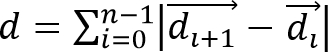 Из наблюдаемых траекторий клеток, где представляет собой вектор, представляющий 3D расположение ячейки во время и общее количество временных точках.
Из наблюдаемых траекторий клеток, где представляет собой вектор, представляющий 3D расположение ячейки во время и общее количество временных точках. - Рассчитать скорость клеток, как S = D / (N • Δ Т), где Δ Т интервал времени между кадрами. Рассчитать миграции клеток направленности (или сохранение), используя P = Δd / D. Эта простая мера упорства следует, что для Р = 0 нетто объем равен нулю, а для P = 1 траектория прямо направленная линия.
Результаты
Концентрические гель анализа, представленные здесь проводили с использованием высоко инвазивных клеток рака молочной железы, MDA-MB-231, 2,4 мг / мл внутренней коллагенового геля и плотности посева клеток из = 2 × 10 6 клеток / мл, в качестве примера. Как показано на рисунке 2, как п...
Обсуждение
In this protocol we describe an in vitro assay to study the 3D migrational behavior of cells in matrix environments that topologically resemble ECMs encountered in vivo. There are three main strengths of this assay as compared to other currently available methods. First, this assay allows one to simultaneously examine the cell migration mechanisms at both population level and individual cell level. This opens up possibilities of studying collective cell migration13, which has to date been lar...
Раскрытие информации
Авторы не имеют ничего раскрывать.
Благодарности
Авторы выражают благодарность В. ВС и К. Янсен для критических дискуссий и благодарят за поддержку со стороны Nano Биомеханика лаборатории в Национальном университете Сингапура. НАК подтверждает поддержку со стороны Марии Кюри IIF общения.
Материалы
| Name | Company | Catalog Number | Comments |
| Cell culture incubator | Fisher Scientific Pte Ltd | Model: 371, S/No 318854-6055 | |
| Confocal microscope | Nikon A1R | Inverted confocal laser scanning microscope equipped with incubator chamber | |
| Dulbecco's Modified Eagle's Medium (DMEM) | Life Technologies | 11965-092 | |
| Fetal Bovine Serum (FBS) | Life Technologies | 10082-147 | |
| Fluorescent CellTracker dye CMTMR | Life Technologies | C2927 | |
| Glass-bottom dish | IWAKI Cell Biology | 3931-035 | 35 mm diameter dish with 12 mm diameter glass-bottom well |
| Hemocytometer | iN CYTO | DHC-N01 (Neubauer Improved) | |
| Microprocessor pH meter | Hanna Instruments | pH 211 | |
| Nutragen Collagen | Advanced BioMatrix | #5010-D | Acid-solubilized bovine collagen type I (stock pH ~ 2) |
| Objective lens | Nikon | CFI Super Plan Fluor ELWD ADM 20XC, W.D. 8.2-6.9mm, NA 0.45. | |
| Penicillin-Streptomycin | Life Technologies | 15140-122 | |
| pH meter | Sartorius | S/No 29153352 | Basic pH Meter PB-11 |
| Trypsin-EDTA | Life Technologies | 15400-054 |
Ссылки
- Horwitz, R., Webb, D. Cell migration. Curr Biol. 13 (19), R756-R759 (2003).
- Liang, C. C., Park, A. Y., Guan, J. L. In vitro scratch assay: a convenient and inexpensive method for analysis of cell migration in vitro. Nat. Protoc. 2 (2), 329-333 (2007).
- Provenzano, P. P., Eliceiri, K. W., Inman, D. R., Keely, P. J. Engineering three-dimensional collagen matrices to provide contact guidance during 3D cell migration. Curr. Prot. Cell Biol. 10, 10-17 (2010).
- Friedl, P., Sahai, E., Weiss, S., Yamada, K. M. New dimensions in cell migration. Nat. Rev. Mol. Cell Biol. 13 (11), 743-747 (2012).
- Grinnell, F., Petroll, W. M. Cell motility and mechanics in three-dimensional collagen matrices. Annu. Rev. Cell. Dev. Biol. 26, 335-361 (2010).
- Wirtz, D., Konstantopoulos, K., Searson, P. C. The physics of cancer: the role of physical interactions and mechanical forces in metastasis. Nat. Rev. Cancer. 11 (7), 512-522 (2011).
- Sun, W., Kurniawan, N. A., Kumar, A. P., Rajagopalan, R., Lim, C. T. Effects of migrating cell-induced matrix reorganization on 3D cancer cell migration. Cell. Mol. Bioeng. 7 (2), 205-217 (2014).
- Achilli, M., Mantovani, D. Tailoring mechanical properties of collagen-based scaffolds for vascular tissue engineering: the effects of pH, temperature and ionic strength on gelation. Polymers. 2 (4), 664-680 (2010).
- Kurniawan, N. A., Wong, L. H., Rajagopalan, R. Early stiffening and softening of collagen: interplay of deformation mechanisms in biopolymer networks. Biomacromolecules. 13 (3), 691-698 (2012).
- Sun, W., Lim, C. T., Kurniawan, N. A. Mechanistic adaptability of cancer cells strongly affects anti-migratory drug efficacy. J. R. Soc. Interface. 11 (99), 20140638 (2014).
- Guzman, A., Ziperstein, M. J., Kaufman, L. J. The effect of fibrillar matrix architecture on tumor cell invasion of physically challenging environments. Biomaterials. 35 (25), 6954-6963 (2014).
- Wolf, K., et al. Physical limits of cell migration: control by ECM space and nuclear deformation and tuning by proteolysis and traction force. J. Cell Biol. 201 (7), 1069-1084 (2013).
- Friedl, P., Gilmour, D. Collective cell migration in morphogenesis, regeneration and cancer. Nat. Rev. Mol. Cell Biol. 10 (7), 445-457 (2009).
- Vedula, S. R. K., Ravasio, A., Lim, C. T., Ladoux, B. Collective cell migration: a mechanistic perspective. Physiology. 28 (6), 370-379 (2013).
- Petrie, R. J., Doyle, A. D., Yamada, K. M. Random versus directionally persistent cell migration. Nat. Rev. Mol. Cell Biol. 10 (8), 538-549 (2009).
- Miron-Mendoza, M., Seemann, J., Grinnell, F. The differential regulation of cell motile activity through matrix stiffness and porosity in three dimensional collagen matrices. Biomaterials. 31 (25), 6425-6435 (2010).
- Mouw, J. K., et al. Tissue mechanics modulate microRNA-dependent PTEN expression to regulate malignant progression. Nat. Med. 20 (4), 360-367 (2014).
- Wolf, K., et al. Collagen-based cell migration models in vitro and in vivo. Semin. Cell Dev. Biol. 20 (8), 931-941 (2009).
- Wong, L. H., Kurniawan, N. A., Too, H. -. P., Rajagopalan, R. Spatially resolved microrheology of heterogeneous biopolymer hydrogels using covalently bound microspheres. Biomech. Model. Mechanobiol. 13 (4), 839-849 (2014).
- Gupton, S. L., Waterman-Storer, C. M. Spatiotemporal feedback between actomyosin and focal-adhesion systems optimizes rapid cell migration. Cell. 125 (7), 1361-1374 (2006).
- Provenzano, P. P., Inman, D. R., Eliceiri, K. W., Trier, S. M., Keely, P. J. Contact guidance mediated three-dimensional cell migration is regulated by Rho/ROCK-dependent matrix reorganization. Biophys. J. 95 (11), 5374-5384 (2008).
- Wolf, K., et al. Multi-step pericellular proteolysis controls the transition from individual to collective cancer cell invasion. Nat. Cell Biol. 9 (8), 893-904 (2007).
- Jansen, K. A., Bacabac, R. G., Piechocka, I. K., Koenderink, G. H. Cells actively stiffen fibrin networks by generating contractile stress. Biophys. J. 105 (10), 2240-2251 (2013).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены